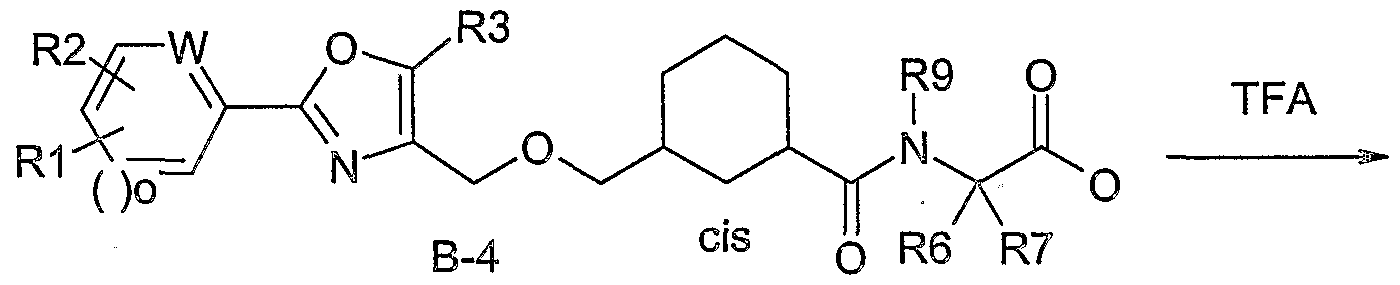
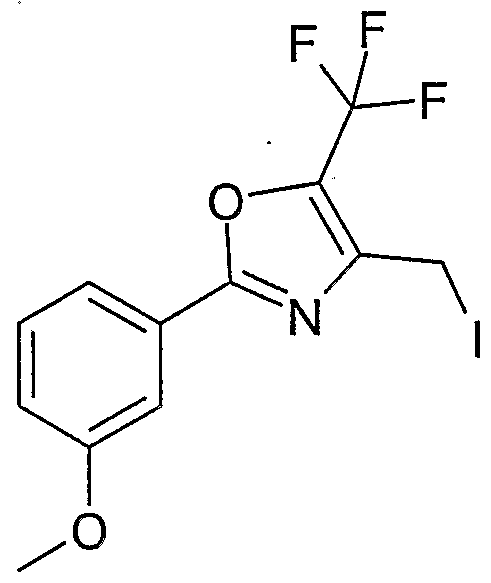
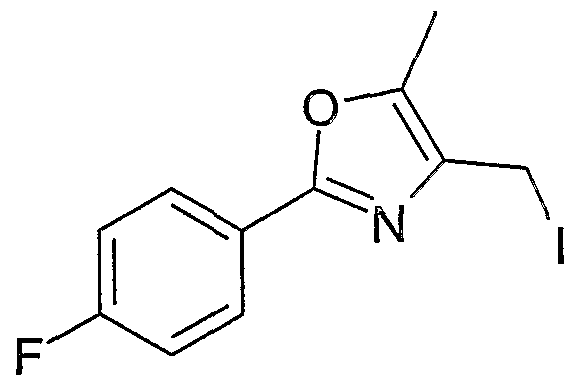
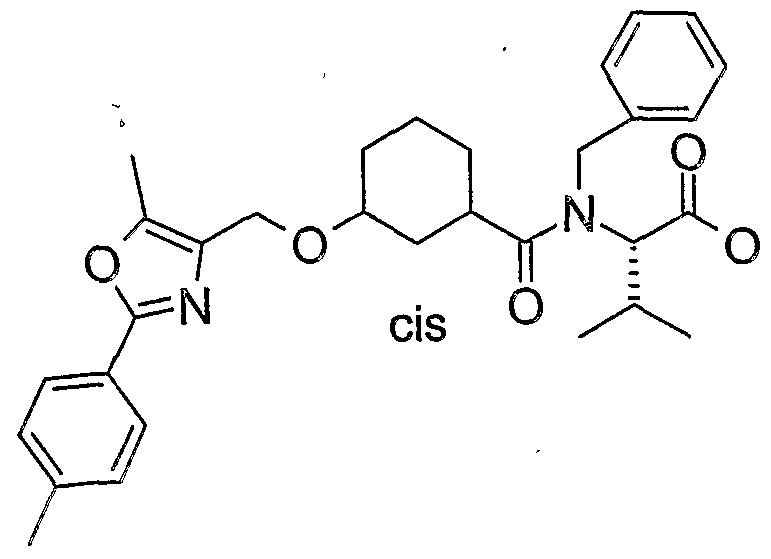
WO2004076426A1 - 3-methyl-2- (3- (2-phenyl-oxazol-4-ylmethoxy)-cyclohexancarbonyl-amino)-buttersäurederivate und verwandte verbindungen als ppar modulatoren zur behandlung von typ 2 diabetes und atherosklerose - Google Patents
3-methyl-2- (3- (2-phenyl-oxazol-4-ylmethoxy)-cyclohexancarbonyl-amino)-buttersäurederivate und verwandte verbindungen als ppar modulatoren zur behandlung von typ 2 diabetes und atherosklerose Download PDFInfo
- Publication number
- WO2004076426A1 WO2004076426A1 PCT/EP2004/001578 EP2004001578W WO2004076426A1 WO 2004076426 A1 WO2004076426 A1 WO 2004076426A1 EP 2004001578 W EP2004001578 W EP 2004001578W WO 2004076426 A1 WO2004076426 A1 WO 2004076426A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- methyl
- alkyl
- phenyl
- amino
- compounds
- Prior art date
Links
- 150000001875 compounds Chemical class 0.000 title claims abstract description 142
- 208000001072 type 2 diabetes mellitus Diseases 0.000 title claims abstract description 10
- 238000011282 treatment Methods 0.000 title claims description 21
- 201000001320 Atherosclerosis Diseases 0.000 title description 7
- LVYPISCMQWAFQB-UHFFFAOYSA-N 2-amino-2-[3-[(2-phenyl-1,3-oxazol-4-yl)methoxy]cyclohexanecarbonyl]butanoic acid Chemical class C1(=CC=CC=C1)C=1OC=C(N1)COC1CC(CCC1)C(=O)C(C(=O)O)(CC)N LVYPISCMQWAFQB-UHFFFAOYSA-N 0.000 title 1
- 101150014691 PPARA gene Proteins 0.000 title 1
- 238000000034 method Methods 0.000 claims abstract description 18
- 150000003839 salts Chemical class 0.000 claims abstract description 15
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 claims abstract description 5
- 206010022489 Insulin Resistance Diseases 0.000 claims abstract description 5
- 239000008103 glucose Substances 0.000 claims abstract description 5
- 230000004129 fatty acid metabolism Effects 0.000 claims abstract description 4
- -1 hydroxy, phenyl Chemical group 0.000 claims description 138
- 239000000203 mixture Substances 0.000 claims description 84
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims description 46
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 18
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 17
- 239000004480 active ingredient Substances 0.000 claims description 16
- 239000003814 drug Substances 0.000 claims description 16
- 230000002265 prevention Effects 0.000 claims description 14
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical group C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 claims description 13
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 claims description 12
- 239000008194 pharmaceutical composition Substances 0.000 claims description 12
- 125000004432 carbon atom Chemical group C* 0.000 claims description 11
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims description 9
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 claims description 9
- 229910052739 hydrogen Inorganic materials 0.000 claims description 8
- 125000004430 oxygen atom Chemical group O* 0.000 claims description 8
- 238000002360 preparation method Methods 0.000 claims description 8
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 claims description 7
- 125000004429 atom Chemical group 0.000 claims description 6
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 6
- 229910052799 carbon Inorganic materials 0.000 claims description 6
- 125000000217 alkyl group Chemical group 0.000 claims description 5
- 230000003178 anti-diabetic effect Effects 0.000 claims description 5
- 125000001072 heteroaryl group Chemical group 0.000 claims description 5
- 150000002632 lipids Chemical class 0.000 claims description 5
- 208000030159 metabolic disease Diseases 0.000 claims description 5
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 claims description 4
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 claims description 4
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 claims description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 claims description 4
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 claims description 4
- 239000013543 active substance Substances 0.000 claims description 4
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 4
- 230000008569 process Effects 0.000 claims description 4
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 claims description 3
- 208000032928 Dyslipidaemia Diseases 0.000 claims description 3
- 125000003118 aryl group Chemical group 0.000 claims description 3
- 206010012601 diabetes mellitus Diseases 0.000 claims description 3
- 125000001624 naphthyl group Chemical group 0.000 claims description 3
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 claims description 2
- 125000000041 C6-C10 aryl group Chemical group 0.000 claims description 2
- 208000001145 Metabolic Syndrome Diseases 0.000 claims description 2
- 101001043818 Mus musculus Interleukin-31 receptor subunit alpha Proteins 0.000 claims description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 claims description 2
- 201000000690 abdominal obesity-metabolic syndrome Diseases 0.000 claims description 2
- 230000009286 beneficial effect Effects 0.000 claims description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 claims description 2
- 208000037921 secondary disease Diseases 0.000 claims description 2
- 229930192474 thiophene Natural products 0.000 claims description 2
- 150000003862 amino acid derivatives Chemical class 0.000 abstract description 2
- 238000004519 manufacturing process Methods 0.000 abstract description 2
- 230000001771 impaired effect Effects 0.000 abstract 1
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 75
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 39
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 39
- 210000004027 cell Anatomy 0.000 description 38
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 36
- 230000015572 biosynthetic process Effects 0.000 description 33
- 238000003786 synthesis reaction Methods 0.000 description 33
- 102000003728 Peroxisome Proliferator-Activated Receptors Human genes 0.000 description 28
- 108090000029 Peroxisome Proliferator-Activated Receptors Proteins 0.000 description 28
- 125000004207 3-methoxyphenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(OC([H])([H])[H])=C1[H] 0.000 description 27
- 239000002904 solvent Substances 0.000 description 27
- BNCNAQNTIYCMGB-UHFFFAOYSA-N 4-(iodomethyl)-2-(4-methylphenyl)-5-phenyl-1,3-oxazole Chemical compound C1=CC(C)=CC=C1C1=NC(CI)=C(C=2C=CC=CC=2)O1 BNCNAQNTIYCMGB-UHFFFAOYSA-N 0.000 description 26
- 102000023984 PPAR alpha Human genes 0.000 description 25
- 239000000556 agonist Substances 0.000 description 25
- 108091008725 peroxisome proliferator-activated receptors alpha Proteins 0.000 description 25
- 239000000243 solution Substances 0.000 description 25
- AFWFEVZPOGORJH-RBUKOAKNSA-N (1s,3r)-3-[tert-butyl(diphenyl)silyl]oxycyclohexane-1-carboxylic acid Chemical compound C=1C=CC=CC=1[Si](C=1C=CC=CC=1)(C(C)(C)C)O[C@@H]1CCC[C@H](C(O)=O)C1 AFWFEVZPOGORJH-RBUKOAKNSA-N 0.000 description 24
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 24
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 22
- 239000013612 plasmid Substances 0.000 description 22
- 238000012360 testing method Methods 0.000 description 22
- 108060001084 Luciferase Proteins 0.000 description 21
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 18
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 18
- 235000019341 magnesium sulphate Nutrition 0.000 description 18
- 239000002609 medium Substances 0.000 description 18
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 17
- 239000005089 Luciferase Substances 0.000 description 17
- 108010016731 PPAR gamma Proteins 0.000 description 16
- 102100038825 Peroxisome proliferator-activated receptor gamma Human genes 0.000 description 16
- 239000007787 solid Substances 0.000 description 16
- AUIVQIHTTVPKFS-FJXQXJEOSA-N tert-butyl (2s)-2-amino-3-methylbutanoate;hydrochloride Chemical compound Cl.CC(C)[C@H](N)C(=O)OC(C)(C)C AUIVQIHTTVPKFS-FJXQXJEOSA-N 0.000 description 16
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 16
- 239000012074 organic phase Substances 0.000 description 15
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 14
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 14
- 239000011541 reaction mixture Substances 0.000 description 14
- 229940079593 drug Drugs 0.000 description 13
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 13
- AONKVWHDUVHQSZ-UHFFFAOYSA-N 4-(iodomethyl)-5-methyl-2-(4-methylphenyl)-1,3-oxazole Chemical compound ICC1=C(C)OC(C=2C=CC(C)=CC=2)=N1 AONKVWHDUVHQSZ-UHFFFAOYSA-N 0.000 description 12
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Natural products CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 12
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 12
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 12
- 230000000694 effects Effects 0.000 description 12
- 239000000126 substance Substances 0.000 description 12
- 239000002253 acid Substances 0.000 description 11
- 238000004296 chiral HPLC Methods 0.000 description 11
- FSEUPUDHEBLWJY-HWKANZROSA-N diacetylmonoxime Chemical compound CC(=O)C(\C)=N\O FSEUPUDHEBLWJY-HWKANZROSA-N 0.000 description 11
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical class N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 11
- VBWJPSYCWGSKND-UHFFFAOYSA-N 3-oxabicyclo[3.3.1]nonane-2,4-dione Chemical compound C1CCC2C(=O)OC(=O)C1C2 VBWJPSYCWGSKND-UHFFFAOYSA-N 0.000 description 10
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 10
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 10
- 239000003112 inhibitor Substances 0.000 description 10
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical compound ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 10
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 9
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 9
- 102100039556 Galectin-4 Human genes 0.000 description 9
- 101000608765 Homo sapiens Galectin-4 Proteins 0.000 description 9
- 201000010099 disease Diseases 0.000 description 9
- OPUJUITUYWGUEP-UHFFFAOYSA-N methyl 1-aminocyclopentane-1-carboxylate;hydrochloride Chemical compound Cl.COC(=O)C1(N)CCCC1 OPUJUITUYWGUEP-UHFFFAOYSA-N 0.000 description 9
- 239000000047 product Substances 0.000 description 9
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 9
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 8
- JBDSSBMEKXHSJF-UHFFFAOYSA-N cyclopentane carboxylic acid Natural products OC(=O)C1CCCC1 JBDSSBMEKXHSJF-UHFFFAOYSA-N 0.000 description 8
- 108020001507 fusion proteins Proteins 0.000 description 8
- 102000037865 fusion proteins Human genes 0.000 description 8
- 239000003921 oil Substances 0.000 description 8
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 8
- 102000004877 Insulin Human genes 0.000 description 7
- 108090001061 Insulin Proteins 0.000 description 7
- 239000005557 antagonist Substances 0.000 description 7
- 239000003446 ligand Substances 0.000 description 7
- 239000000741 silica gel Substances 0.000 description 7
- 229910002027 silica gel Inorganic materials 0.000 description 7
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 229940024606 amino acid Drugs 0.000 description 6
- 235000001014 amino acid Nutrition 0.000 description 6
- 150000001413 amino acids Chemical class 0.000 description 6
- 239000003480 eluent Substances 0.000 description 6
- 239000013613 expression plasmid Substances 0.000 description 6
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 6
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 6
- FVAUCKIRQBBSSJ-UHFFFAOYSA-M sodium iodide Chemical compound [Na+].[I-] FVAUCKIRQBBSSJ-UHFFFAOYSA-M 0.000 description 6
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 6
- ZVJBPHMCBRHVEV-UHFFFAOYSA-N 2-hydroxyiminopentan-3-one Chemical compound CCC(=O)C(C)=NO ZVJBPHMCBRHVEV-UHFFFAOYSA-N 0.000 description 5
- DQFNFCZJCTWYGP-UHFFFAOYSA-N 4-(iodomethyl)-2-(4-methylphenyl)-5-propan-2-yl-1,3-oxazole Chemical compound ICC1=C(C(C)C)OC(C=2C=CC(C)=CC=2)=N1 DQFNFCZJCTWYGP-UHFFFAOYSA-N 0.000 description 5
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 5
- 206010028980 Neoplasm Diseases 0.000 description 5
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 5
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical class [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 5
- 102000040945 Transcription factor Human genes 0.000 description 5
- 108091023040 Transcription factor Proteins 0.000 description 5
- 230000027455 binding Effects 0.000 description 5
- 229910002091 carbon monoxide Inorganic materials 0.000 description 5
- 238000004113 cell culture Methods 0.000 description 5
- 230000001413 cellular effect Effects 0.000 description 5
- 239000012230 colorless oil Substances 0.000 description 5
- 239000002299 complementary DNA Substances 0.000 description 5
- NKLCHDQGUHMCGL-UHFFFAOYSA-N cyclohexylidenemethanone Chemical group O=C=C1CCCCC1 NKLCHDQGUHMCGL-UHFFFAOYSA-N 0.000 description 5
- 229940125396 insulin Drugs 0.000 description 5
- 108090000623 proteins and genes Proteins 0.000 description 5
- 238000011160 research Methods 0.000 description 5
- 239000012312 sodium hydride Substances 0.000 description 5
- 229910000104 sodium hydride Inorganic materials 0.000 description 5
- 239000000725 suspension Substances 0.000 description 5
- 239000003826 tablet Substances 0.000 description 5
- XJKVVHCZKAADFP-UHFFFAOYSA-N 4-(iodomethyl)-2-(3-methoxyphenyl)-5-methyl-1,3-oxazole Chemical compound COC1=CC=CC(C=2OC(C)=C(CI)N=2)=C1 XJKVVHCZKAADFP-UHFFFAOYSA-N 0.000 description 4
- 125000004861 4-isopropyl phenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- 108090000331 Firefly luciferases Proteins 0.000 description 4
- 229930182816 L-glutamine Natural products 0.000 description 4
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 4
- YASAKCUCGLMORW-UHFFFAOYSA-N Rosiglitazone Chemical compound C=1C=CC=NC=1N(C)CCOC(C=C1)=CC=C1CC1SC(=O)NC1=O YASAKCUCGLMORW-UHFFFAOYSA-N 0.000 description 4
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 4
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 4
- 229960000583 acetic acid Drugs 0.000 description 4
- 230000033228 biological regulation Effects 0.000 description 4
- WTWBUQJHJGUZCY-UHFFFAOYSA-N cuminaldehyde Chemical compound CC(C)C1=CC=C(C=O)C=C1 WTWBUQJHJGUZCY-UHFFFAOYSA-N 0.000 description 4
- 230000001419 dependent effect Effects 0.000 description 4
- XWKOSAYDZJXYQO-UHFFFAOYSA-N ethyl 2-(4-methylphenyl)-5-propan-2-yl-1,3-oxazole-4-carboxylate Chemical compound O1C(C(C)C)=C(C(=O)OCC)N=C1C1=CC=C(C)C=C1 XWKOSAYDZJXYQO-UHFFFAOYSA-N 0.000 description 4
- 238000009472 formulation Methods 0.000 description 4
- 239000001257 hydrogen Substances 0.000 description 4
- 239000004615 ingredient Substances 0.000 description 4
- 230000037356 lipid metabolism Effects 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- XZWYZXLIPXDOLR-UHFFFAOYSA-N metformin Chemical compound CN(C)C(=N)NC(N)=N XZWYZXLIPXDOLR-UHFFFAOYSA-N 0.000 description 4
- 229960003105 metformin Drugs 0.000 description 4
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 4
- 238000002156 mixing Methods 0.000 description 4
- FXLOVSHXALFLKQ-UHFFFAOYSA-N p-tolualdehyde Chemical compound CC1=CC=C(C=O)C=C1 FXLOVSHXALFLKQ-UHFFFAOYSA-N 0.000 description 4
- HYAFETHFCAUJAY-UHFFFAOYSA-N pioglitazone Chemical compound N1=CC(CC)=CC=C1CCOC(C=C1)=CC=C1CC1C(=O)NC(=O)S1 HYAFETHFCAUJAY-UHFFFAOYSA-N 0.000 description 4
- 230000002829 reductive effect Effects 0.000 description 4
- 238000012163 sequencing technique Methods 0.000 description 4
- 238000003756 stirring Methods 0.000 description 4
- YROXIXLRRCOBKF-UHFFFAOYSA-N sulfonylurea Chemical class OC(=N)N=S(=O)=O YROXIXLRRCOBKF-UHFFFAOYSA-N 0.000 description 4
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 4
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 4
- WEWPHAAWLKAJKC-UHFFFAOYSA-N 4-(chloromethyl)-2-(4-methylphenyl)-5-phenyl-1,3-oxazole Chemical compound C1=CC(C)=CC=C1C1=NC(CCl)=C(C=2C=CC=CC=2)O1 WEWPHAAWLKAJKC-UHFFFAOYSA-N 0.000 description 3
- UUOZIINDOMFDBE-UHFFFAOYSA-N 4-(iodomethyl)-2-(3-methoxyphenyl)-5-propan-2-yl-1,3-oxazole Chemical compound COC1=CC=CC(C=2OC(=C(CI)N=2)C(C)C)=C1 UUOZIINDOMFDBE-UHFFFAOYSA-N 0.000 description 3
- QGKGLJHQIRRWES-UHFFFAOYSA-N 4-(iodomethyl)-5-methyl-2-(4-propan-2-ylphenyl)-1,3-oxazole Chemical compound C1=CC(C(C)C)=CC=C1C1=NC(CI)=C(C)O1 QGKGLJHQIRRWES-UHFFFAOYSA-N 0.000 description 3
- 125000004199 4-trifluoromethylphenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C(F)(F)F 0.000 description 3
- PBFCTVPSJFFZSU-UHFFFAOYSA-N 5-ethyl-4-(iodomethyl)-2-(4-propan-2-ylphenyl)-1,3-oxazole Chemical compound ICC1=C(CC)OC(C=2C=CC(=CC=2)C(C)C)=N1 PBFCTVPSJFFZSU-UHFFFAOYSA-N 0.000 description 3
- ZRYHGLASDJZBMP-OJRHAOMCSA-N CC(C)C(NC(=O)[C@@H]1CCC[C@@H](C1)C(O)=O)C(=O)OC(C)(C)C Chemical compound CC(C)C(NC(=O)[C@@H]1CCC[C@@H](C1)C(O)=O)C(=O)OC(C)(C)C ZRYHGLASDJZBMP-OJRHAOMCSA-N 0.000 description 3
- 201000009030 Carcinoma Diseases 0.000 description 3
- 240000008886 Ceratonia siliqua Species 0.000 description 3
- 235000013912 Ceratonia siliqua Nutrition 0.000 description 3
- 201000004624 Dermatitis Diseases 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- FAEKWTJYAYMJKF-QHCPKHFHSA-N GlucoNorm Chemical compound C1=C(C(O)=O)C(OCC)=CC(CC(=O)N[C@@H](CC(C)C)C=2C(=CC=CC=2)N2CCCCC2)=C1 FAEKWTJYAYMJKF-QHCPKHFHSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 3
- 206010020772 Hypertension Diseases 0.000 description 3
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 3
- 208000001126 Keratosis Diseases 0.000 description 3
- 102000016267 Leptin Human genes 0.000 description 3
- 108010092277 Leptin Proteins 0.000 description 3
- 241000713333 Mouse mammary tumor virus Species 0.000 description 3
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 3
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 3
- 239000005662 Paraffin oil Substances 0.000 description 3
- 241000254064 Photinus pyralis Species 0.000 description 3
- XBDQKXXYIPTUBI-UHFFFAOYSA-N Propionic acid Substances CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 3
- 108010052090 Renilla Luciferases Proteins 0.000 description 3
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 3
- GWYFCOCPABKNJV-UHFFFAOYSA-N beta-methyl-butyric acid Natural products CC(C)CC(O)=O GWYFCOCPABKNJV-UHFFFAOYSA-N 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 230000023852 carbohydrate metabolic process Effects 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- 238000010367 cloning Methods 0.000 description 3
- 238000001816 cooling Methods 0.000 description 3
- 235000014113 dietary fatty acids Nutrition 0.000 description 3
- 238000010790 dilution Methods 0.000 description 3
- 239000012895 dilution Substances 0.000 description 3
- 208000035475 disorder Diseases 0.000 description 3
- 150000002148 esters Chemical class 0.000 description 3
- STXQYTGSIQCKFA-UHFFFAOYSA-N ethyl 2-amino-4-methyl-3-oxopentanoate;hydrochloride Chemical compound Cl.CCOC(=O)C(N)C(=O)C(C)C STXQYTGSIQCKFA-UHFFFAOYSA-N 0.000 description 3
- HDTDHYKMFULBIB-UHFFFAOYSA-N ethyl 4-methyl-2-[(4-methylbenzoyl)amino]-3-oxopentanoate Chemical compound CCOC(=O)C(C(=O)C(C)C)NC(=O)C1=CC=C(C)C=C1 HDTDHYKMFULBIB-UHFFFAOYSA-N 0.000 description 3
- 229930195729 fatty acid Natural products 0.000 description 3
- 239000000194 fatty acid Substances 0.000 description 3
- 150000004665 fatty acids Chemical class 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- BRZYSWJRSDMWLG-CAXSIQPQSA-N geneticin Natural products O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](C(C)O)O2)N)[C@@H](N)C[C@H]1N BRZYSWJRSDMWLG-CAXSIQPQSA-N 0.000 description 3
- 239000008187 granular material Substances 0.000 description 3
- 230000006872 improvement Effects 0.000 description 3
- 238000011534 incubation Methods 0.000 description 3
- NRYBAZVQPHGZNS-ZSOCWYAHSA-N leptin Chemical compound O=C([C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CC(C)C)CCSC)N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](CS)C(O)=O NRYBAZVQPHGZNS-ZSOCWYAHSA-N 0.000 description 3
- 229940039781 leptin Drugs 0.000 description 3
- 108020001756 ligand binding domains Proteins 0.000 description 3
- 239000012280 lithium aluminium hydride Substances 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 239000007937 lozenge Substances 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- 238000010369 molecular cloning Methods 0.000 description 3
- PSHKMPUSSFXUIA-UHFFFAOYSA-N n,n-dimethylpyridin-2-amine Chemical compound CN(C)C1=CC=CC=N1 PSHKMPUSSFXUIA-UHFFFAOYSA-N 0.000 description 3
- 239000012071 phase Substances 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 239000000651 prodrug Substances 0.000 description 3
- 229940002612 prodrug Drugs 0.000 description 3
- 150000003254 radicals Chemical class 0.000 description 3
- 238000010992 reflux Methods 0.000 description 3
- 229960002354 repaglinide Drugs 0.000 description 3
- 238000004007 reversed phase HPLC Methods 0.000 description 3
- 208000017520 skin disease Diseases 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- CXGTZJYQWSUFET-IBGZPJMESA-N tesaglitazar Chemical compound C1=CC(C[C@H](OCC)C(O)=O)=CC=C1OCCC1=CC=C(OS(C)(=O)=O)C=C1 CXGTZJYQWSUFET-IBGZPJMESA-N 0.000 description 3
- 238000001890 transfection Methods 0.000 description 3
- XUFXOAAUWZOOIT-SXARVLRPSA-N (2R,3R,4R,5S,6R)-5-[[(2R,3R,4R,5S,6R)-5-[[(2R,3R,4S,5S,6R)-3,4-dihydroxy-6-methyl-5-[[(1S,4R,5S,6S)-4,5,6-trihydroxy-3-(hydroxymethyl)-1-cyclohex-2-enyl]amino]-2-oxanyl]oxy]-3,4-dihydroxy-6-(hydroxymethyl)-2-oxanyl]oxy]-6-(hydroxymethyl)oxane-2,3,4-triol Chemical compound O([C@H]1O[C@H](CO)[C@H]([C@@H]([C@H]1O)O)O[C@H]1O[C@@H]([C@H]([C@H](O)[C@H]1O)N[C@@H]1[C@@H]([C@@H](O)[C@H](O)C(CO)=C1)O)C)[C@@H]1[C@@H](CO)O[C@@H](O)[C@H](O)[C@H]1O XUFXOAAUWZOOIT-SXARVLRPSA-N 0.000 description 2
- JRSKDYYEXBWWDD-AGHHOFFYSA-N (2s)-2-[[(1r,3s)-3-[[2-(3-methoxyphenyl)-5-propan-2-yl-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]-3-methylbutanoic acid Chemical compound COC1=CC=CC(C=2OC(=C(CO[C@@H]3C[C@@H](CCC3)C(=O)N[C@@H](C(C)C)C(O)=O)N=2)C(C)C)=C1 JRSKDYYEXBWWDD-AGHHOFFYSA-N 0.000 description 2
- JLNWJFUPLRVTSE-PBXXJUDPSA-N (2s)-2-[[(1r,3s)-3-[[5-cyclohexyl-2-(3-methoxyphenyl)-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]-3-methylbutanoic acid Chemical compound COC1=CC=CC(C=2OC(=C(CO[C@@H]3C[C@@H](CCC3)C(=O)N[C@@H](C(C)C)C(O)=O)N=2)C2CCCCC2)=C1 JLNWJFUPLRVTSE-PBXXJUDPSA-N 0.000 description 2
- HFZUAMHOGVMZII-CUYJMHBOSA-N (2s)-2-[[(1r,3s)-3-[[5-cyclohexyl-2-(4-methylphenyl)-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]-3-methylbutanoic acid Chemical compound C1[C@H](C(=O)N[C@@H](C(C)C)C(O)=O)CCC[C@@H]1OCC1=C(C2CCCCC2)OC(C=2C=CC(C)=CC=2)=N1 HFZUAMHOGVMZII-CUYJMHBOSA-N 0.000 description 2
- KFZXFLPVXXDCIW-WVBUVRCRSA-N (2s)-2-[[(1r,3s)-3-[[5-ethyl-2-(3-methoxyphenyl)-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]-3-methylbutanoic acid Chemical compound CCC=1OC(C=2C=C(OC)C=CC=2)=NC=1CO[C@H]1CCC[C@@H](C(=O)N[C@@H](C(C)C)C(O)=O)C1 KFZXFLPVXXDCIW-WVBUVRCRSA-N 0.000 description 2
- CZWGJSOOLZAGGX-DXIQSLLYSA-N (2s)-2-[[(1r,3s)-3-[[5-ethyl-2-(4-methylphenyl)-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]-3-methylbutanoic acid Chemical compound CCC=1OC(C=2C=CC(C)=CC=2)=NC=1CO[C@H]1CCC[C@@H](C(=O)N[C@@H](C(C)C)C(O)=O)C1 CZWGJSOOLZAGGX-DXIQSLLYSA-N 0.000 description 2
- CEQRESQRXSEHTE-YJLNNSPDSA-N (2s)-2-[[(1s,3r)-3-[[2-(3-methoxyphenyl)-5-(trifluoromethyl)-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]-3-methylbutanoic acid Chemical compound COC1=CC=CC(C=2OC(=C(CO[C@H]3C[C@H](CCC3)C(=O)N[C@@H](C(C)C)C(O)=O)N=2)C(F)(F)F)=C1 CEQRESQRXSEHTE-YJLNNSPDSA-N 0.000 description 2
- JRSKDYYEXBWWDD-WEYGHZABSA-N (2s)-2-[[(1s,3r)-3-[[2-(3-methoxyphenyl)-5-propan-2-yl-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]-3-methylbutanoic acid Chemical compound COC1=CC=CC(C=2OC(=C(CO[C@H]3C[C@H](CCC3)C(=O)N[C@@H](C(C)C)C(O)=O)N=2)C(C)C)=C1 JRSKDYYEXBWWDD-WEYGHZABSA-N 0.000 description 2
- JLNWJFUPLRVTSE-ZWSUVBHBSA-N (2s)-2-[[(1s,3r)-3-[[5-cyclohexyl-2-(3-methoxyphenyl)-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]-3-methylbutanoic acid Chemical compound COC1=CC=CC(C=2OC(=C(CO[C@H]3C[C@H](CCC3)C(=O)N[C@@H](C(C)C)C(O)=O)N=2)C2CCCCC2)=C1 JLNWJFUPLRVTSE-ZWSUVBHBSA-N 0.000 description 2
- HFZUAMHOGVMZII-ARNLJNQMSA-N (2s)-2-[[(1s,3r)-3-[[5-cyclohexyl-2-(4-methylphenyl)-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]-3-methylbutanoic acid Chemical compound C1[C@@H](C(=O)N[C@@H](C(C)C)C(O)=O)CCC[C@H]1OCC1=C(C2CCCCC2)OC(C=2C=CC(C)=CC=2)=N1 HFZUAMHOGVMZII-ARNLJNQMSA-N 0.000 description 2
- KFZXFLPVXXDCIW-NBCNXNJRSA-N (2s)-2-[[(1s,3r)-3-[[5-ethyl-2-(3-methoxyphenyl)-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]-3-methylbutanoic acid Chemical compound CCC=1OC(C=2C=C(OC)C=CC=2)=NC=1CO[C@@H]1CCC[C@H](C(=O)N[C@@H](C(C)C)C(O)=O)C1 KFZXFLPVXXDCIW-NBCNXNJRSA-N 0.000 description 2
- ZBNDNZULMSKJDP-AOIWGVFYSA-N (2s)-3-methyl-2-[[(1r,3s)-3-[[2-(4-methylphenyl)-5-(trifluoromethyl)-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]butanoic acid Chemical compound C1[C@H](C(=O)N[C@@H](C(C)C)C(O)=O)CCC[C@@H]1OCC1=C(C(F)(F)F)OC(C=2C=CC(C)=CC=2)=N1 ZBNDNZULMSKJDP-AOIWGVFYSA-N 0.000 description 2
- YPAZKIQQBZQBFA-CUYJMHBOSA-N (2s)-3-methyl-2-[[(1r,3s)-3-[[2-(4-methylphenyl)-5-phenyl-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]butanoic acid Chemical compound C1[C@H](C(=O)N[C@@H](C(C)C)C(O)=O)CCC[C@@H]1OCC1=C(C=2C=CC=CC=2)OC(C=2C=CC(C)=CC=2)=N1 YPAZKIQQBZQBFA-CUYJMHBOSA-N 0.000 description 2
- YPAZKIQQBZQBFA-ARNLJNQMSA-N (2s)-3-methyl-2-[[(1s,3r)-3-[[2-(4-methylphenyl)-5-phenyl-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]butanoic acid Chemical compound C1[C@@H](C(=O)N[C@@H](C(C)C)C(O)=O)CCC[C@H]1OCC1=C(C=2C=CC=CC=2)OC(C=2C=CC(C)=CC=2)=N1 YPAZKIQQBZQBFA-ARNLJNQMSA-N 0.000 description 2
- IQYVUHVGUMWONP-VWPQPMDRSA-N (2s)-3-methyl-2-[[(1s,3r)-3-[[2-(4-methylphenyl)-5-propan-2-yl-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]butanoic acid Chemical compound C1[C@@H](C(=O)N[C@@H](C(C)C)C(O)=O)CCC[C@H]1OCC1=C(C(C)C)OC(C=2C=CC(C)=CC=2)=N1 IQYVUHVGUMWONP-VWPQPMDRSA-N 0.000 description 2
- LIWSUCVQKCZLMK-XCRHUMRWSA-N (2s)-3-methyl-2-[[(1s,3r)-3-[[5-(trifluoromethyl)-2-[3-(trifluoromethyl)phenyl]-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]butanoic acid Chemical compound C1[C@@H](C(=O)N[C@@H](C(C)C)C(O)=O)CCC[C@H]1OCC1=C(C(F)(F)F)OC(C=2C=C(C=CC=2)C(F)(F)F)=N1 LIWSUCVQKCZLMK-XCRHUMRWSA-N 0.000 description 2
- AOYAUPLEHKFKHJ-ZVDOUQERSA-N (2s)-3-methyl-2-[[(1s,3r)-3-[[5-methyl-2-(4-methylphenyl)-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]butanoic acid Chemical compound C1[C@@H](C(=O)N[C@@H](C(C)C)C(O)=O)CCC[C@H]1OCC1=C(C)OC(C=2C=CC(C)=CC=2)=N1 AOYAUPLEHKFKHJ-ZVDOUQERSA-N 0.000 description 2
- HSINOMROUCMIEA-FGVHQWLLSA-N (2s,4r)-4-[(3r,5s,6r,7r,8s,9s,10s,13r,14s,17r)-6-ethyl-3,7-dihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]-2-methylpentanoic acid Chemical compound C([C@@]12C)C[C@@H](O)C[C@H]1[C@@H](CC)[C@@H](O)[C@@H]1[C@@H]2CC[C@]2(C)[C@@H]([C@H](C)C[C@H](C)C(O)=O)CC[C@H]21 HSINOMROUCMIEA-FGVHQWLLSA-N 0.000 description 2
- AKMNUCBQGHFICM-UHFFFAOYSA-N 1-(2-methyl-1,3-benzoxazol-6-yl)-3-(1,5-naphthyridin-4-yl)urea Chemical compound C1=CN=C2C(NC(=O)NC3=CC=C4N=C(OC4=C3)C)=CC=NC2=C1 AKMNUCBQGHFICM-UHFFFAOYSA-N 0.000 description 2
- AZUYLZMQTIKGSC-UHFFFAOYSA-N 1-[6-[4-(5-chloro-6-methyl-1H-indazol-4-yl)-5-methyl-3-(1-methylindazol-5-yl)pyrazol-1-yl]-2-azaspiro[3.3]heptan-2-yl]prop-2-en-1-one Chemical compound ClC=1C(=C2C=NNC2=CC=1C)C=1C(=NN(C=1C)C1CC2(CN(C2)C(C=C)=O)C1)C=1C=C2C=NN(C2=CC=1)C AZUYLZMQTIKGSC-UHFFFAOYSA-N 0.000 description 2
- YKNAKDFZAWQEEO-IBGZPJMESA-N 1-[7-(3,4-dimethoxyphenyl)-9-[[(3s)-1-methylpiperidin-3-yl]methoxy]-3,5-dihydro-2h-1,4-benzoxazepin-4-yl]propan-1-one Chemical compound C1N(C(=O)CC)CCOC2=C1C=C(C=1C=C(OC)C(OC)=CC=1)C=C2OC[C@H]1CCCN(C)C1 YKNAKDFZAWQEEO-IBGZPJMESA-N 0.000 description 2
- GIYZJSLQVOWCAR-UHFFFAOYSA-N 1-cyclohexyl-2-hydroxyiminopropan-1-one Chemical compound ON=C(C)C(=O)C1CCCCC1 GIYZJSLQVOWCAR-UHFFFAOYSA-N 0.000 description 2
- FTJREIAOAPABHN-UHFFFAOYSA-N 2-(3,4-dimethylphenyl)-4-(iodomethyl)-5-propan-2-yl-1,3-oxazole Chemical compound ICC1=C(C(C)C)OC(C=2C=C(C)C(C)=CC=2)=N1 FTJREIAOAPABHN-UHFFFAOYSA-N 0.000 description 2
- SNAKZQGNQQFDCV-UHFFFAOYSA-N 2-hydroxyimino-4-methylpentan-3-one Chemical compound CC(C)C(=O)C(C)=NO SNAKZQGNQQFDCV-UHFFFAOYSA-N 0.000 description 2
- YOETUEMZNOLGDB-UHFFFAOYSA-N 2-methylpropyl carbonochloridate Chemical compound CC(C)COC(Cl)=O YOETUEMZNOLGDB-UHFFFAOYSA-N 0.000 description 2
- JMTMSDXUXJISAY-UHFFFAOYSA-N 2H-benzotriazol-4-ol Chemical compound OC1=CC=CC2=C1N=NN2 JMTMSDXUXJISAY-UHFFFAOYSA-N 0.000 description 2
- NMTUHPSKJJYGML-UHFFFAOYSA-N 3-(trifluoromethyl)benzaldehyde Chemical compound FC(F)(F)C1=CC=CC(C=O)=C1 NMTUHPSKJJYGML-UHFFFAOYSA-N 0.000 description 2
- 125000006275 3-bromophenyl group Chemical group [H]C1=C([H])C(Br)=C([H])C(*)=C1[H] 0.000 description 2
- WMPDAIZRQDCGFH-UHFFFAOYSA-N 3-methoxybenzaldehyde Chemical compound COC1=CC=CC(C=O)=C1 WMPDAIZRQDCGFH-UHFFFAOYSA-N 0.000 description 2
- RUQIUASLAXJZIE-UHFFFAOYSA-N 3-methoxybenzoyl chloride Chemical compound COC1=CC=CC(C(Cl)=O)=C1 RUQIUASLAXJZIE-UHFFFAOYSA-N 0.000 description 2
- ZCGHXCCBOMXYNH-UHFFFAOYSA-N 3-methyl-2-[[3-[[5-methyl-2-(4-propan-2-ylphenyl)-1,3-oxazol-4-yl]methoxymethyl]cyclohexanecarbonyl]amino]butanoic acid Chemical compound C1C(C(=O)NC(C(C)C)C(O)=O)CCCC1COCC1=C(C)OC(C=2C=CC(=CC=2)C(C)C)=N1 ZCGHXCCBOMXYNH-UHFFFAOYSA-N 0.000 description 2
- CUPROPFTDOKVRM-UHFFFAOYSA-N 4-(iodomethyl)-2-(4-methoxyphenyl)-5-methyl-1,3-oxazole Chemical compound C1=CC(OC)=CC=C1C1=NC(CI)=C(C)O1 CUPROPFTDOKVRM-UHFFFAOYSA-N 0.000 description 2
- LAKXJTRDJPBSAS-UHFFFAOYSA-N 4-(iodomethyl)-5-methyl-2-[3-(trifluoromethyl)phenyl]-1,3-oxazole Chemical compound ICC1=C(C)OC(C=2C=C(C=CC=2)C(F)(F)F)=N1 LAKXJTRDJPBSAS-UHFFFAOYSA-N 0.000 description 2
- SWLAMJPTOQZTAE-UHFFFAOYSA-N 4-[2-[(5-chloro-2-methoxybenzoyl)amino]ethyl]benzoic acid Chemical class COC1=CC=C(Cl)C=C1C(=O)NCCC1=CC=C(C(O)=O)C=C1 SWLAMJPTOQZTAE-UHFFFAOYSA-N 0.000 description 2
- VBTCDGHIPOUPHM-UHFFFAOYSA-N 4-iodo-5-methyl-2-[2-methyl-3-(trifluoromethyl)phenyl]-1,3-oxazole 3-(trifluoromethyl)benzaldehyde Chemical compound IC=1N=C(OC1C)C1=C(C(=CC=C1)C(F)(F)F)C.FC(C=1C=C(C=O)C=CC1)(F)F VBTCDGHIPOUPHM-UHFFFAOYSA-N 0.000 description 2
- NIVGNNIVMXYXFG-UHFFFAOYSA-N 4-methyl-2-(4-methylphenyl)-3-oxido-5-phenyl-1,3-oxazol-3-ium Chemical compound [O-][N+]=1C(C)=C(C=2C=CC=CC=2)OC=1C1=CC=C(C)C=C1 NIVGNNIVMXYXFG-UHFFFAOYSA-N 0.000 description 2
- NQUVCRCCRXRJCK-UHFFFAOYSA-N 4-methylbenzoyl chloride Chemical compound CC1=CC=C(C(Cl)=O)C=C1 NQUVCRCCRXRJCK-UHFFFAOYSA-N 0.000 description 2
- KBIHBGYYYFRDEA-UHFFFAOYSA-N 5-ethyl-4-(iodomethyl)-2-(4-methylphenyl)-1,3-oxazole Chemical compound ICC1=C(CC)OC(C=2C=CC(C)=CC=2)=N1 KBIHBGYYYFRDEA-UHFFFAOYSA-N 0.000 description 2
- HJXQCOMHBGRGHO-UHFFFAOYSA-N 5-ethyl-4-(iodomethyl)-2-[3-(trifluoromethyl)phenyl]-1,3-oxazole Chemical compound ICC1=C(CC)OC(C=2C=C(C=CC=2)C(F)(F)F)=N1 HJXQCOMHBGRGHO-UHFFFAOYSA-N 0.000 description 2
- OUDFNZMQXZILJD-UHFFFAOYSA-N 5-methyl-2-furaldehyde Chemical compound CC1=CC=C(C=O)O1 OUDFNZMQXZILJD-UHFFFAOYSA-N 0.000 description 2
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 2
- 244000215068 Acacia senegal Species 0.000 description 2
- 206010001052 Acute respiratory distress syndrome Diseases 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 241000701022 Cytomegalovirus Species 0.000 description 2
- 230000004568 DNA-binding Effects 0.000 description 2
- QSJXEFYPDANLFS-UHFFFAOYSA-N Diacetyl Chemical group CC(=O)C(C)=O QSJXEFYPDANLFS-UHFFFAOYSA-N 0.000 description 2
- 102100025012 Dipeptidyl peptidase 4 Human genes 0.000 description 2
- 102000004366 Glucosidases Human genes 0.000 description 2
- 108010056771 Glucosidases Proteins 0.000 description 2
- 102000018997 Growth Hormone Human genes 0.000 description 2
- 108010051696 Growth Hormone Proteins 0.000 description 2
- 229920000084 Gum arabic Polymers 0.000 description 2
- 206010019280 Heart failures Diseases 0.000 description 2
- 101000741788 Homo sapiens Peroxisome proliferator-activated receptor alpha Proteins 0.000 description 2
- 208000002260 Keloid Diseases 0.000 description 2
- 238000008214 LDL Cholesterol Methods 0.000 description 2
- 229940086609 Lipase inhibitor Drugs 0.000 description 2
- 239000000637 Melanocyte-Stimulating Hormone Substances 0.000 description 2
- 108010007013 Melanocyte-Stimulating Hormones Proteins 0.000 description 2
- PCZOHLXUXFIOCF-UHFFFAOYSA-N Monacolin X Natural products C12C(OC(=O)C(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 PCZOHLXUXFIOCF-UHFFFAOYSA-N 0.000 description 2
- IRLWJILLXJGJTD-UHFFFAOYSA-N Muraglitazar Chemical compound C1=CC(OC)=CC=C1OC(=O)N(CC(O)=O)CC(C=C1)=CC=C1OCCC1=C(C)OC(C=2C=CC=CC=2)=N1 IRLWJILLXJGJTD-UHFFFAOYSA-N 0.000 description 2
- UULIGRNKXHCLQN-UHFFFAOYSA-N N-[[4-[[(4-amino-2-quinazolinyl)amino]methyl]cyclohexyl]methyl]-1-naphthalenesulfonamide Chemical compound C1=CC=C2C(N)=NC(NCC3CCC(CNS(=O)(=O)C=4C5=CC=CC=C5C=CC=4)CC3)=NC2=C1 UULIGRNKXHCLQN-UHFFFAOYSA-N 0.000 description 2
- 208000008589 Obesity Diseases 0.000 description 2
- 108010015181 PPAR delta Proteins 0.000 description 2
- 229940080774 Peroxisome proliferator-activated receptor gamma agonist Drugs 0.000 description 2
- 206010036049 Polycystic ovaries Diseases 0.000 description 2
- 102000004257 Potassium Channel Human genes 0.000 description 2
- 201000004681 Psoriasis Diseases 0.000 description 2
- 108700008625 Reporter Genes Proteins 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 2
- 229940123464 Thiazolidinedione Drugs 0.000 description 2
- 208000007536 Thrombosis Diseases 0.000 description 2
- 102000006601 Thymidine Kinase Human genes 0.000 description 2
- 108020004440 Thymidine kinase Proteins 0.000 description 2
- JLRGJRBPOGGCBT-UHFFFAOYSA-N Tolbutamide Chemical compound CCCCNC(=O)NS(=O)(=O)C1=CC=C(C)C=C1 JLRGJRBPOGGCBT-UHFFFAOYSA-N 0.000 description 2
- 108090000631 Trypsin Proteins 0.000 description 2
- 102000004142 Trypsin Human genes 0.000 description 2
- 102000005630 Urocortins Human genes 0.000 description 2
- 108010059705 Urocortins Proteins 0.000 description 2
- 108010084455 Zeocin Proteins 0.000 description 2
- 239000000205 acacia gum Substances 0.000 description 2
- 235000010489 acacia gum Nutrition 0.000 description 2
- 229960002632 acarbose Drugs 0.000 description 2
- XUFXOAAUWZOOIT-UHFFFAOYSA-N acarviostatin I01 Natural products OC1C(O)C(NC2C(C(O)C(O)C(CO)=C2)O)C(C)OC1OC(C(C1O)O)C(CO)OC1OC1C(CO)OC(O)C(O)C1O XUFXOAAUWZOOIT-UHFFFAOYSA-N 0.000 description 2
- 208000009621 actinic keratosis Diseases 0.000 description 2
- 150000001351 alkyl iodides Chemical class 0.000 description 2
- 229940124277 aminobutyric acid Drugs 0.000 description 2
- 229910021529 ammonia Inorganic materials 0.000 description 2
- 229940025084 amphetamine Drugs 0.000 description 2
- 150000001450 anions Chemical class 0.000 description 2
- 229940124599 anti-inflammatory drug Drugs 0.000 description 2
- 239000003472 antidiabetic agent Substances 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- 239000002585 base Substances 0.000 description 2
- 210000000227 basophil cell of anterior lobe of hypophysis Anatomy 0.000 description 2
- 239000003613 bile acid Substances 0.000 description 2
- 238000009835 boiling Methods 0.000 description 2
- 239000004067 bulking agent Substances 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 235000021256 carbohydrate metabolism Nutrition 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 230000024245 cell differentiation Effects 0.000 description 2
- 239000006285 cell suspension Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 238000010276 construction Methods 0.000 description 2
- 231100000433 cytotoxic Toxicity 0.000 description 2
- 230000001472 cytotoxic effect Effects 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- SMAOVIHJZYGLNT-UHFFFAOYSA-N ethyl 2-hydroxyimino-4-methyl-3-oxopentanoate Chemical compound CCOC(=O)C(=NO)C(=O)C(C)C SMAOVIHJZYGLNT-UHFFFAOYSA-N 0.000 description 2
- OCJKUQIPRNZDTK-UHFFFAOYSA-N ethyl 4,4,4-trifluoro-3-oxobutanoate Chemical compound CCOC(=O)CC(=O)C(F)(F)F OCJKUQIPRNZDTK-UHFFFAOYSA-N 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 239000012894 fetal calf serum Substances 0.000 description 2
- 229940125753 fibrate Drugs 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 238000004108 freeze drying Methods 0.000 description 2
- 239000012362 glacial acetic acid Substances 0.000 description 2
- 229960004580 glibenclamide Drugs 0.000 description 2
- 229960004346 glimepiride Drugs 0.000 description 2
- WIGIZIANZCJQQY-RUCARUNLSA-N glimepiride Chemical compound O=C1C(CC)=C(C)CN1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)N[C@@H]2CC[C@@H](C)CC2)C=C1 WIGIZIANZCJQQY-RUCARUNLSA-N 0.000 description 2
- 229960001381 glipizide Drugs 0.000 description 2
- ZJJXGWJIGJFDTL-UHFFFAOYSA-N glipizide Chemical compound C1=NC(C)=CN=C1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)NC2CCCCC2)C=C1 ZJJXGWJIGJFDTL-UHFFFAOYSA-N 0.000 description 2
- ZNNLBTZKUZBEKO-UHFFFAOYSA-N glyburide Chemical compound COC1=CC=C(Cl)C=C1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)NC2CCCCC2)C=C1 ZNNLBTZKUZBEKO-UHFFFAOYSA-N 0.000 description 2
- 239000000122 growth hormone Substances 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 102000054223 human PPARA Human genes 0.000 description 2
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 2
- 239000004026 insulin derivative Substances 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 239000011630 iodine Substances 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 210000001117 keloid Anatomy 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 229940060975 lantus Drugs 0.000 description 2
- 229960004844 lovastatin Drugs 0.000 description 2
- PCZOHLXUXFIOCF-BXMDZJJMSA-N lovastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 PCZOHLXUXFIOCF-BXMDZJJMSA-N 0.000 description 2
- QLJODMDSTUBWDW-UHFFFAOYSA-N lovastatin hydroxy acid Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(C)C=C21 QLJODMDSTUBWDW-UHFFFAOYSA-N 0.000 description 2
- 238000003670 luciferase enzyme activity assay Methods 0.000 description 2
- 206010025135 lupus erythematosus Diseases 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 229950004994 meglitinide Drugs 0.000 description 2
- 208000010125 myocardial infarction Diseases 0.000 description 2
- 235000001968 nicotinic acid Nutrition 0.000 description 2
- 229960003512 nicotinic acid Drugs 0.000 description 2
- 239000011664 nicotinic acid Substances 0.000 description 2
- 235000020824 obesity Nutrition 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- ZRSNZINYAWTAHE-UHFFFAOYSA-N p-methoxybenzaldehyde Chemical compound COC1=CC=C(C=O)C=C1 ZRSNZINYAWTAHE-UHFFFAOYSA-N 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- DHHVAGZRUROJKS-UHFFFAOYSA-N phentermine Chemical compound CC(C)(N)CC1=CC=CC=C1 DHHVAGZRUROJKS-UHFFFAOYSA-N 0.000 description 2
- CWCMIVBLVUHDHK-ZSNHEYEWSA-N phleomycin D1 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC[C@@H](N=1)C=1SC=C(N=1)C(=O)NCCCCNC(N)=N)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C CWCMIVBLVUHDHK-ZSNHEYEWSA-N 0.000 description 2
- 230000035790 physiological processes and functions Effects 0.000 description 2
- 229960005095 pioglitazone Drugs 0.000 description 2
- 239000004033 plastic Substances 0.000 description 2
- 229920003023 plastic Polymers 0.000 description 2
- 201000010065 polycystic ovary syndrome Diseases 0.000 description 2
- 108020001213 potassium channel Proteins 0.000 description 2
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 238000011321 prophylaxis Methods 0.000 description 2
- 125000006239 protecting group Chemical group 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 2
- 229960004586 rosiglitazone Drugs 0.000 description 2
- DCKVNWZUADLDEH-UHFFFAOYSA-N sec-butyl acetate Chemical compound CCC(C)OC(C)=O DCKVNWZUADLDEH-UHFFFAOYSA-N 0.000 description 2
- 238000007493 shaping process Methods 0.000 description 2
- 201000010153 skin papilloma Diseases 0.000 description 2
- 239000012279 sodium borohydride Substances 0.000 description 2
- 229910000033 sodium borohydride Inorganic materials 0.000 description 2
- 235000009518 sodium iodide Nutrition 0.000 description 2
- LPXPTNMVRIOKMN-UHFFFAOYSA-M sodium nitrite Chemical compound [Na+].[O-]N=O LPXPTNMVRIOKMN-UHFFFAOYSA-M 0.000 description 2
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical class [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 2
- 239000011550 stock solution Substances 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- IUUYANMOEMBTBV-FJXQXJEOSA-N tert-butyl (2s)-pyrrolidine-2-carboxylate;hydron;chloride Chemical compound Cl.CC(C)(C)OC(=O)[C@@H]1CCCN1 IUUYANMOEMBTBV-FJXQXJEOSA-N 0.000 description 2
- MHYGQXWCZAYSLJ-UHFFFAOYSA-N tert-butyl-chloro-diphenylsilane Chemical compound C=1C=CC=CC=1[Si](Cl)(C(C)(C)C)C1=CC=CC=C1 MHYGQXWCZAYSLJ-UHFFFAOYSA-N 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 229960005371 tolbutamide Drugs 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- 239000012588 trypsin Substances 0.000 description 2
- 239000000777 urocortin Substances 0.000 description 2
- DBGIVFWFUFKIQN-VIFPVBQESA-N (+)-Fenfluramine Chemical compound CCN[C@@H](C)CC1=CC=CC(C(F)(F)F)=C1 DBGIVFWFUFKIQN-VIFPVBQESA-N 0.000 description 1
- DBGIVFWFUFKIQN-UHFFFAOYSA-N (+-)-Fenfluramine Chemical group CCNC(C)CC1=CC=CC(C(F)(F)F)=C1 DBGIVFWFUFKIQN-UHFFFAOYSA-N 0.000 description 1
- YPINLRNGSGGJJT-JXMROGBWSA-N (2e)-2-hydroxyimino-1-phenylpropan-1-one Chemical compound O\N=C(/C)C(=O)C1=CC=CC=C1 YPINLRNGSGGJJT-JXMROGBWSA-N 0.000 description 1
- ZVJBPHMCBRHVEV-GQCTYLIASA-N (2e)-2-hydroxyiminopentan-3-one Chemical compound CCC(=O)C(\C)=N\O ZVJBPHMCBRHVEV-GQCTYLIASA-N 0.000 description 1
- AMNXBQPRODZJQR-DITALETJSA-N (2s)-2-cyclopentyl-2-[3-[(2,4-dimethylpyrido[2,3-b]indol-9-yl)methyl]phenyl]-n-[(1r)-2-hydroxy-1-phenylethyl]acetamide Chemical compound C1([C@@H](C=2C=CC=C(C=2)CN2C3=CC=CC=C3C3=C(C)C=C(N=C32)C)C(=O)N[C@@H](CO)C=2C=CC=CC=2)CCCC1 AMNXBQPRODZJQR-DITALETJSA-N 0.000 description 1
- IQYVUHVGUMWONP-URVUXULASA-N (2s)-3-methyl-2-[[(1r,3s)-3-[[2-(4-methylphenyl)-5-propan-2-yl-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]butanoic acid Chemical compound C1[C@H](C(=O)N[C@@H](C(C)C)C(O)=O)CCC[C@@H]1OCC1=C(C(C)C)OC(C=2C=CC(C)=CC=2)=N1 IQYVUHVGUMWONP-URVUXULASA-N 0.000 description 1
- AOYAUPLEHKFKHJ-DYXWJJEUSA-N (2s)-3-methyl-2-[[(1r,3s)-3-[[5-methyl-2-(4-methylphenyl)-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]butanoic acid Chemical compound C1[C@H](C(=O)N[C@@H](C(C)C)C(O)=O)CCC[C@@H]1OCC1=C(C)OC(C=2C=CC(C)=CC=2)=N1 AOYAUPLEHKFKHJ-DYXWJJEUSA-N 0.000 description 1
- ZBNDNZULMSKJDP-SCTDSRPQSA-N (2s)-3-methyl-2-[[(1s,3r)-3-[[2-(4-methylphenyl)-5-(trifluoromethyl)-1,3-oxazol-4-yl]methoxy]cyclohexanecarbonyl]amino]butanoic acid Chemical compound C1[C@@H](C(=O)N[C@@H](C(C)C)C(O)=O)CCC[C@H]1OCC1=C(C(F)(F)F)OC(C=2C=CC(C)=CC=2)=N1 ZBNDNZULMSKJDP-SCTDSRPQSA-N 0.000 description 1
- ALSCEGDXFJIYES-YFKPBYRVSA-N (2s)-pyrrolidine-2-carbonitrile Chemical compound N#C[C@@H]1CCCN1 ALSCEGDXFJIYES-YFKPBYRVSA-N 0.000 description 1
- ZGGHKIMDNBDHJB-NRFPMOEYSA-M (3R,5S)-fluvastatin sodium Chemical compound [Na+].C12=CC=CC=C2N(C(C)C)C(\C=C\[C@@H](O)C[C@@H](O)CC([O-])=O)=C1C1=CC=C(F)C=C1 ZGGHKIMDNBDHJB-NRFPMOEYSA-M 0.000 description 1
- 125000006704 (C5-C6) cycloalkyl group Chemical group 0.000 description 1
- KWTSXDURSIMDCE-QMMMGPOBSA-N (S)-amphetamine Chemical compound C[C@H](N)CC1=CC=CC=C1 KWTSXDURSIMDCE-QMMMGPOBSA-N 0.000 description 1
- ZOBPZXTWZATXDG-UHFFFAOYSA-N 1,3-thiazolidine-2,4-dione Chemical compound O=C1CSC(=O)N1 ZOBPZXTWZATXDG-UHFFFAOYSA-N 0.000 description 1
- OMXRTIUYSHDUTH-UHFFFAOYSA-N 1-(3-ethyl-1-benzofuran-7-yl)piperazine;oxalic acid Chemical compound OC(=O)C(O)=O.C1=CC=C2C(CC)=COC2=C1N1CCNCC1 OMXRTIUYSHDUTH-UHFFFAOYSA-N 0.000 description 1
- AWNXKZVIZARMME-UHFFFAOYSA-N 1-[[5-[2-[(2-chloropyridin-4-yl)amino]pyrimidin-4-yl]-4-(cyclopropylmethyl)pyrimidin-2-yl]amino]-2-methylpropan-2-ol Chemical compound N=1C(NCC(C)(O)C)=NC=C(C=2N=C(NC=3C=C(Cl)N=CC=3)N=CC=2)C=1CC1CC1 AWNXKZVIZARMME-UHFFFAOYSA-N 0.000 description 1
- BBMCTIGTTCKYKF-UHFFFAOYSA-N 1-heptanol Chemical compound CCCCCCCO BBMCTIGTTCKYKF-UHFFFAOYSA-N 0.000 description 1
- GUSVHVVOABZHAH-OPZWKQDFSA-N 1aw8p77hkj Chemical compound O([C@@H]1[C@@H](CO)O[C@H]([C@@H]([C@H]1O)O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4C[C@H]5[C@@H]([C@]4(CC[C@@H]3[C@@]2(C)CC1)C)[C@@H]([C@]1(OC[C@H](C)CC1)O5)C)[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O GUSVHVVOABZHAH-OPZWKQDFSA-N 0.000 description 1
- MOGDMEKTOJGFTN-UHFFFAOYSA-N 2-(3,4-dimethylphenyl)-5-ethyl-4-(iodomethyl)-1,3-oxazole Chemical compound ICC1=C(CC)OC(C=2C=C(C)C(C)=CC=2)=N1 MOGDMEKTOJGFTN-UHFFFAOYSA-N 0.000 description 1
- XMIZYEHKNZQYHX-UHFFFAOYSA-N 2-(3,5-dimethoxyphenyl)-4-(iodomethyl)-5-methyl-1,3-oxazole Chemical compound COC1=CC(OC)=CC(C=2OC(C)=C(CI)N=2)=C1 XMIZYEHKNZQYHX-UHFFFAOYSA-N 0.000 description 1
- OPKUFKQWFHXKKC-UHFFFAOYSA-N 2-(3-bromophenyl)-4-(iodomethyl)-5-methyl-1,3-oxazole Chemical compound ICC1=C(C)OC(C=2C=C(Br)C=CC=2)=N1 OPKUFKQWFHXKKC-UHFFFAOYSA-N 0.000 description 1
- UEJHHKGNCWUBHD-UHFFFAOYSA-N 2-(4-fluorophenyl)-4-(iodomethyl)-5-methyl-1,3-oxazole Chemical compound ICC1=C(C)OC(C=2C=CC(F)=CC=2)=N1 UEJHHKGNCWUBHD-UHFFFAOYSA-N 0.000 description 1
- WHELBNUVILHIHT-UHFFFAOYSA-N 2-(4-methylphenyl)-1,3-oxazole Chemical compound C1=CC(C)=CC=C1C1=NC=CO1 WHELBNUVILHIHT-UHFFFAOYSA-N 0.000 description 1
- VTAKZNRDSPNOAU-UHFFFAOYSA-M 2-(chloromethyl)oxirane;hydron;prop-2-en-1-amine;n-prop-2-enyldecan-1-amine;trimethyl-[6-(prop-2-enylamino)hexyl]azanium;dichloride Chemical compound Cl.[Cl-].NCC=C.ClCC1CO1.CCCCCCCCCCNCC=C.C[N+](C)(C)CCCCCCNCC=C VTAKZNRDSPNOAU-UHFFFAOYSA-M 0.000 description 1
- PTTYSGQPCQXILV-UHFFFAOYSA-N 2-[3-(trifluoromethyl)phenyl]-1,3-oxazole Chemical compound FC(F)(F)C1=CC=CC(C=2OC=CN=2)=C1 PTTYSGQPCQXILV-UHFFFAOYSA-N 0.000 description 1
- YPINLRNGSGGJJT-UHFFFAOYSA-N 2-hydroxyimino-1-phenylpropan-1-one Chemical compound ON=C(C)C(=O)C1=CC=CC=C1 YPINLRNGSGGJJT-UHFFFAOYSA-N 0.000 description 1
- YCOXJFAUNLRWPU-UHFFFAOYSA-N 2-methyl-n,n-dipropyl-9-(2,4,6-trimethylphenyl)pyrimido[4,5-b]indol-4-amine Chemical compound C12=CC=CC=C2C=2C(N(CCC)CCC)=NC(C)=NC=2N1C1=C(C)C=C(C)C=C1C YCOXJFAUNLRWPU-UHFFFAOYSA-N 0.000 description 1
- PJKVFARRVXDXAD-UHFFFAOYSA-N 2-naphthaldehyde Chemical compound C1=CC=CC2=CC(C=O)=CC=C21 PJKVFARRVXDXAD-UHFFFAOYSA-N 0.000 description 1
- FQEVHRCPXFKJHF-UHFFFAOYSA-N 3-(trifluoromethoxy)benzaldehyde Chemical compound FC(F)(F)OC1=CC=CC(C=O)=C1 FQEVHRCPXFKJHF-UHFFFAOYSA-N 0.000 description 1
- SUISZCALMBHJQX-UHFFFAOYSA-N 3-bromobenzaldehyde Chemical compound BrC1=CC=CC(C=O)=C1 SUISZCALMBHJQX-UHFFFAOYSA-N 0.000 description 1
- TWJQZBXURHWBPV-UHFFFAOYSA-N 3-cyclohexyl-1-(4,4-dimethyl-6,7-dihydro-1h-imidazo[4,5-c]pyridin-5-yl)propan-1-one;oxalic acid Chemical compound OC(=O)C(O)=O.C1CC=2NC=NC=2C(C)(C)N1C(=O)CCC1CCCCC1 TWJQZBXURHWBPV-UHFFFAOYSA-N 0.000 description 1
- XMIIGOLPHOKFCH-UHFFFAOYSA-N 3-phenylpropionic acid Chemical compound OC(=O)CCC1=CC=CC=C1 XMIIGOLPHOKFCH-UHFFFAOYSA-N 0.000 description 1
- QXZBMSIDSOZZHK-DOPDSADYSA-N 31362-50-2 Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(N)=O)NC(=O)CNC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H]1NC(=O)CC1)C(C)C)C1=CNC=N1 QXZBMSIDSOZZHK-DOPDSADYSA-N 0.000 description 1
- OKHGLMQXLUEZMI-UHFFFAOYSA-N 4-(iodomethyl)-2-(3-methoxyphenyl)-5-phenyl-1,3-oxazole Chemical compound COC1=CC=CC(C=2OC(=C(CI)N=2)C=2C=CC=CC=2)=C1 OKHGLMQXLUEZMI-UHFFFAOYSA-N 0.000 description 1
- QKSYAXASYDZMFY-UHFFFAOYSA-N 4-(iodomethyl)-5-(trifluoromethyl)-2-[3-(trifluoromethyl)phenyl]-1,3-oxazole Chemical compound ICC1=C(C(F)(F)F)OC(C=2C=C(C=CC=2)C(F)(F)F)=N1 QKSYAXASYDZMFY-UHFFFAOYSA-N 0.000 description 1
- XWACKBMPGJMLFJ-UHFFFAOYSA-N 4-(iodomethyl)-5-methyl-2-(3-methylphenyl)-1,3-oxazole Chemical compound ICC1=C(C)OC(C=2C=C(C)C=CC=2)=N1 XWACKBMPGJMLFJ-UHFFFAOYSA-N 0.000 description 1
- SOINZDZUVFPFLV-UHFFFAOYSA-N 4-(iodomethyl)-5-methyl-2-(5-methylfuran-2-yl)-1,3-oxazole Chemical compound O1C(C)=CC=C1C1=NC(CI)=C(C)O1 SOINZDZUVFPFLV-UHFFFAOYSA-N 0.000 description 1
- OJSUKGKXAPQITL-UHFFFAOYSA-N 4-(iodomethyl)-5-methyl-2-[3-(trifluoromethoxy)phenyl]-1,3-oxazole Chemical compound ICC1=C(C)OC(C=2C=C(OC(F)(F)F)C=CC=2)=N1 OJSUKGKXAPQITL-UHFFFAOYSA-N 0.000 description 1
- SLYIGTWFTNDINH-UHFFFAOYSA-N 4-(iodomethyl)-5-methyl-2-[4-(trifluoromethyl)phenyl]-1,3-oxazole Chemical compound ICC1=C(C)OC(C=2C=CC(=CC=2)C(F)(F)F)=N1 SLYIGTWFTNDINH-UHFFFAOYSA-N 0.000 description 1
- URSQQDZMMODUMK-UHFFFAOYSA-N 4-(iodomethyl)-5-methyl-2-thiophen-2-yl-1,3-oxazole Chemical compound ICC1=C(C)OC(C=2SC=CC=2)=N1 URSQQDZMMODUMK-UHFFFAOYSA-N 0.000 description 1
- ZMZAAMFIVHGMBP-UHFFFAOYSA-N 4-(iodomethyl)-5-propan-2-yl-2-[3-(trifluoromethyl)phenyl]-1,3-oxazole Chemical compound ICC1=C(C(C)C)OC(C=2C=C(C=CC=2)C(F)(F)F)=N1 ZMZAAMFIVHGMBP-UHFFFAOYSA-N 0.000 description 1
- LAZDGPNLQILXLE-UHFFFAOYSA-N 4-(iodomethyl)-5-propan-2-yl-2-[4-(trifluoromethyl)phenyl]-1,3-oxazole Chemical compound ICC1=C(C(C)C)OC(C=2C=CC(=CC=2)C(F)(F)F)=N1 LAZDGPNLQILXLE-UHFFFAOYSA-N 0.000 description 1
- BEOBZEOPTQQELP-UHFFFAOYSA-N 4-(trifluoromethyl)benzaldehyde Chemical compound FC(F)(F)C1=CC=C(C=O)C=C1 BEOBZEOPTQQELP-UHFFFAOYSA-N 0.000 description 1
- UOQXIWFBQSVDPP-UHFFFAOYSA-N 4-fluorobenzaldehyde Chemical compound FC1=CC=C(C=O)C=C1 UOQXIWFBQSVDPP-UHFFFAOYSA-N 0.000 description 1
- FEXFOJWILSEGPI-UHFFFAOYSA-N 4-hydroxyiminohexan-3-one Chemical compound CCC(=O)C(CC)=NO FEXFOJWILSEGPI-UHFFFAOYSA-N 0.000 description 1
- CCDHUQHOTFWAQJ-UHFFFAOYSA-N 4-methyl-2-[(4-methylbenzoyl)amino]-3-oxopentanoic acid Chemical compound CC(C(C(C(=O)O)NC(C1=CC=C(C=C1)C)=O)=O)C CCDHUQHOTFWAQJ-UHFFFAOYSA-N 0.000 description 1
- HFKMMKOEOOHUFA-UHFFFAOYSA-N 5-cyclohexyl-4-(iodomethyl)-2-(4-methylphenyl)-1,3-oxazole Chemical compound C1=CC(C)=CC=C1C1=NC(CI)=C(C2CCCCC2)O1 HFKMMKOEOOHUFA-UHFFFAOYSA-N 0.000 description 1
- WZOMSQRBEXCMRP-UHFFFAOYSA-N 5-ethyl-4-(iodomethyl)-2-(3-methoxyphenyl)-1,3-oxazole Chemical compound ICC1=C(CC)OC(C=2C=C(OC)C=CC=2)=N1 WZOMSQRBEXCMRP-UHFFFAOYSA-N 0.000 description 1
- NAAYFNGDSPPEQE-UHFFFAOYSA-N 5-ethyl-4-(iodomethyl)-2-[4-(trifluoromethyl)phenyl]-1,3-oxazole Chemical compound ICC1=C(CC)OC(C=2C=CC(=CC=2)C(F)(F)F)=N1 NAAYFNGDSPPEQE-UHFFFAOYSA-N 0.000 description 1
- SZDOYVPWMLPFBK-UHFFFAOYSA-N 5-ethyl-4-(iodomethyl)-2-naphthalen-2-yl-1,3-oxazole Chemical compound ICC1=C(CC)OC(C=2C=C3C=CC=CC3=CC=2)=N1 SZDOYVPWMLPFBK-UHFFFAOYSA-N 0.000 description 1
- KKVBULDFFNFYHJ-UHFFFAOYSA-N 6-oxabicyclo[3.2.1]octan-7-one Chemical compound C1C2C(=O)OC1CCC2 KKVBULDFFNFYHJ-UHFFFAOYSA-N 0.000 description 1
- PZASAAIJIFDWSB-CKPDSHCKSA-N 8-[(1S)-1-[8-(trifluoromethyl)-7-[4-(trifluoromethyl)cyclohexyl]oxynaphthalen-2-yl]ethyl]-8-azabicyclo[3.2.1]octane-3-carboxylic acid Chemical compound FC(F)(F)C=1C2=CC([C@@H](N3C4CCC3CC(C4)C(O)=O)C)=CC=C2C=CC=1OC1CCC(C(F)(F)F)CC1 PZASAAIJIFDWSB-CKPDSHCKSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- KBMGLVFFJUCSBR-UHFFFAOYSA-N 8-hydroxy-4-methoxy-1-methyl-3-(3-methylbut-2-enyl)quinolin-2-one Chemical compound C1=CC=C2C(OC)=C(CC=C(C)C)C(=O)N(C)C2=C1O KBMGLVFFJUCSBR-UHFFFAOYSA-N 0.000 description 1
- 239000005541 ACE inhibitor Substances 0.000 description 1
- 102000004146 ATP citrate synthases Human genes 0.000 description 1
- 108090000662 ATP citrate synthases Proteins 0.000 description 1
- 208000004611 Abdominal Obesity Diseases 0.000 description 1
- 208000002874 Acne Vulgaris Diseases 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- 206010002383 Angina Pectoris Diseases 0.000 description 1
- 206010059313 Anogenital warts Diseases 0.000 description 1
- 208000019901 Anxiety disease Diseases 0.000 description 1
- 102000018619 Apolipoproteins A Human genes 0.000 description 1
- 108010027004 Apolipoproteins A Proteins 0.000 description 1
- 102000018616 Apolipoproteins B Human genes 0.000 description 1
- 108010027006 Apolipoproteins B Proteins 0.000 description 1
- 206010003210 Arteriosclerosis Diseases 0.000 description 1
- 206010003211 Arteriosclerosis coronary artery Diseases 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- XUKUURHRXDUEBC-KAYWLYCHSA-N Atorvastatin Chemical compound C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CC[C@@H](O)C[C@@H](O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-KAYWLYCHSA-N 0.000 description 1
- XUKUURHRXDUEBC-UHFFFAOYSA-N Atorvastatin Natural products C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CCC(O)CC(O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-UHFFFAOYSA-N 0.000 description 1
- 210000002237 B-cell of pancreatic islet Anatomy 0.000 description 1
- 206010004146 Basal cell carcinoma Diseases 0.000 description 1
- 229940123208 Biguanide Drugs 0.000 description 1
- XNCOSPRUTUOJCJ-UHFFFAOYSA-N Biguanide Chemical compound NC(N)=NC(N)=N XNCOSPRUTUOJCJ-UHFFFAOYSA-N 0.000 description 1
- 102000013585 Bombesin Human genes 0.000 description 1
- 108010051479 Bombesin Proteins 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- FYEFOCWJZPOIHL-FXAWDEMLSA-N C(C)(C)C1=C(N=C(O1)C1=CC(=CC=C1)C(F)(F)F)CO[C@H]1C[C@H](CCC1)C(=O)NC1(CCCC1)C(=O)O Chemical compound C(C)(C)C1=C(N=C(O1)C1=CC(=CC=C1)C(F)(F)F)CO[C@H]1C[C@H](CCC1)C(=O)NC1(CCCC1)C(=O)O FYEFOCWJZPOIHL-FXAWDEMLSA-N 0.000 description 1
- PQYDWBUNTLKHTQ-FCHUYYIVSA-N C(C)(C)C1=CC=C(C=C1)C=1OC(=C(N=1)CO[C@H]1C[C@H](CCC1)C(=O)NC1(CCCC1)C(=O)O)C Chemical compound C(C)(C)C1=CC=C(C=C1)C=1OC(=C(N=1)CO[C@H]1C[C@H](CCC1)C(=O)NC1(CCCC1)C(=O)O)C PQYDWBUNTLKHTQ-FCHUYYIVSA-N 0.000 description 1
- PNUHYNRZOOFTQZ-FXAWDEMLSA-N C(C)C1=C(N=C(O1)C1=CC(=CC=C1)OC)CO[C@H]1C[C@H](CCC1)C(=O)NC1(CCCC1)C(=O)O Chemical compound C(C)C1=C(N=C(O1)C1=CC(=CC=C1)OC)CO[C@H]1C[C@H](CCC1)C(=O)NC1(CCCC1)C(=O)O PNUHYNRZOOFTQZ-FXAWDEMLSA-N 0.000 description 1
- IDHPKCAYJAIMGN-JTHBVZDNSA-N C(C)C1=C(N=C(O1)C1=CC2=CC=CC=C2C=C1)CO[C@H]1C[C@H](CCC1)C(=O)NC1(CCCC1)C(=O)O Chemical compound C(C)C1=C(N=C(O1)C1=CC2=CC=CC=C2C=C1)CO[C@H]1C[C@H](CCC1)C(=O)NC1(CCCC1)C(=O)O IDHPKCAYJAIMGN-JTHBVZDNSA-N 0.000 description 1
- KTUJCIGCWRTAKZ-UHFFFAOYSA-N C1(CCCCC1)C1=C(N=C(O1)C1=C(C(=CC=C1)OC)C)I Chemical compound C1(CCCCC1)C1=C(N=C(O1)C1=C(C(=CC=C1)OC)C)I KTUJCIGCWRTAKZ-UHFFFAOYSA-N 0.000 description 1
- DKGPCEZNOWENDG-UHFFFAOYSA-N C=CC(c1c(CI)nc(-c2cc(C(F)(F)F)ccc2)[o]1)(F)F Chemical compound C=CC(c1c(CI)nc(-c2cc(C(F)(F)F)ccc2)[o]1)(F)F DKGPCEZNOWENDG-UHFFFAOYSA-N 0.000 description 1
- XMRDAVGXWAREJF-UHFFFAOYSA-N CC=1C=C(C=CC1C)C1(OC(=C(N1)I)C(C)C)C.CC=1C=C(C=O)C=CC1C Chemical compound CC=1C=C(C=CC1C)C1(OC(=C(N1)I)C(C)C)C.CC=1C=C(C=O)C=CC1C XMRDAVGXWAREJF-UHFFFAOYSA-N 0.000 description 1
- SSACIHNUQIOYQE-UHFFFAOYSA-N CC=1C=C(C=CC1C)C1(OC(=C(N1)I)CC)C.CC=1C=C(C=O)C=CC1C Chemical compound CC=1C=C(C=CC1C)C1(OC(=C(N1)I)CC)C.CC=1C=C(C=O)C=CC1C SSACIHNUQIOYQE-UHFFFAOYSA-N 0.000 description 1
- HRGZOXLSPNKNFN-AZUAARDMSA-N COC1=CC=C(C=C1)C=1OC(=C(N=1)CO[C@H]1C[C@H](CCC1)C(=O)NC1(CCCC1)C(=O)O)C Chemical compound COC1=CC=C(C=C1)C=1OC(=C(N=1)CO[C@H]1C[C@H](CCC1)C(=O)NC1(CCCC1)C(=O)O)C HRGZOXLSPNKNFN-AZUAARDMSA-N 0.000 description 1
- 206010006895 Cachexia Diseases 0.000 description 1
- 229940127291 Calcium channel antagonist Drugs 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- BTOCMKDGIQYOGY-UHFFFAOYSA-N Cc1c(COC(C2)CC=CC2C(NC2(CCCCC2)C(OC)=O)=O)nc(-c2ccc(C)cc2)[o]1 Chemical compound Cc1c(COC(C2)CC=CC2C(NC2(CCCCC2)C(OC)=O)=O)nc(-c2ccc(C)cc2)[o]1 BTOCMKDGIQYOGY-UHFFFAOYSA-N 0.000 description 1
- NUVBVUVRQQJJFK-UHFFFAOYSA-N Cc1c(COC(CCC2)CC2C(NC2(CCCCC2)C(O)=O)=O)nc(-c2ccc(C)cc2)[o]1 Chemical compound Cc1c(COC(CCC2)CC2C(NC2(CCCCC2)C(O)=O)=O)nc(-c2ccc(C)cc2)[o]1 NUVBVUVRQQJJFK-UHFFFAOYSA-N 0.000 description 1
- JRUQWXIOLKJHJR-VHYCJAOWSA-N Cc1c(COC(CCC2)CC2C(N[C@@H](Cc2ccccc2)C(O)=O)=O)nc(-c2ccc(C)cc2)[o]1 Chemical compound Cc1c(COC(CCC2)CC2C(N[C@@H](Cc2ccccc2)C(O)=O)=O)nc(-c2ccc(C)cc2)[o]1 JRUQWXIOLKJHJR-VHYCJAOWSA-N 0.000 description 1
- 229920000623 Cellulose acetate phthalate Polymers 0.000 description 1
- 206010065941 Central obesity Diseases 0.000 description 1
- 208000010445 Chilblains Diseases 0.000 description 1
- 206010008528 Chillblains Diseases 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- XJUZRXYOEPSWMB-UHFFFAOYSA-N Chloromethyl methyl ether Chemical compound COCCl XJUZRXYOEPSWMB-UHFFFAOYSA-N 0.000 description 1
- 229920001268 Cholestyramine Polymers 0.000 description 1
- 229920002905 Colesevelam Polymers 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- 208000000907 Condylomata Acuminata Diseases 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- 208000002506 Darier Disease Diseases 0.000 description 1
- 206010012438 Dermatitis atopic Diseases 0.000 description 1
- 208000002249 Diabetes Complications Diseases 0.000 description 1
- 108010067722 Dipeptidyl Peptidase 4 Proteins 0.000 description 1
- 208000001976 Endocrine Gland Neoplasms Diseases 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 101710198884 GATA-type zinc finger protein 1 Proteins 0.000 description 1
- 102000019432 Galanin Human genes 0.000 description 1
- 101800002068 Galanin Proteins 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- HEMJJKBWTPKOJG-UHFFFAOYSA-N Gemfibrozil Chemical compound CC1=CC=C(C)C(OCCCC(C)(C)C(O)=O)=C1 HEMJJKBWTPKOJG-UHFFFAOYSA-N 0.000 description 1
- 102000051325 Glucagon Human genes 0.000 description 1
- 108060003199 Glucagon Proteins 0.000 description 1
- 102000007446 Glucagon-Like Peptide-1 Receptor Human genes 0.000 description 1
- 108010086246 Glucagon-Like Peptide-1 Receptor Proteins 0.000 description 1
- DTHNMHAUYICORS-KTKZVXAJSA-N Glucagon-like peptide 1 Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(N)=O)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC=1N=CNC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=CC=C1 DTHNMHAUYICORS-KTKZVXAJSA-N 0.000 description 1
- 108090000079 Glucocorticoid Receptors Proteins 0.000 description 1
- 102100033417 Glucocorticoid receptor Human genes 0.000 description 1
- 102000007390 Glycogen Phosphorylase Human genes 0.000 description 1
- 108010046163 Glycogen Phosphorylase Proteins 0.000 description 1
- 201000005569 Gout Diseases 0.000 description 1
- 108010023302 HDL Cholesterol Proteins 0.000 description 1
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 description 1
- 101000741790 Homo sapiens Peroxisome proliferator-activated receptor gamma Proteins 0.000 description 1
- 101000684208 Homo sapiens Prolyl endopeptidase FAP Proteins 0.000 description 1
- 102000002265 Human Growth Hormone Human genes 0.000 description 1
- 108010000521 Human Growth Hormone Proteins 0.000 description 1
- 239000000854 Human Growth Hormone Substances 0.000 description 1
- 208000035150 Hypercholesterolemia Diseases 0.000 description 1
- 206010020649 Hyperkeratosis Diseases 0.000 description 1
- 208000031226 Hyperlipidaemia Diseases 0.000 description 1
- 206010058222 Hypertensive cardiomyopathy Diseases 0.000 description 1
- NFAHUPQGMDFOIP-UHFFFAOYSA-N IC=1N=C(OC1CC)C1=C(C(=CC=C1)OC)C.C(C1=CC(=CC=C1)OC)=O Chemical compound IC=1N=C(OC1CC)C1=C(C(=CC=C1)OC)C.C(C1=CC(=CC=C1)OC)=O NFAHUPQGMDFOIP-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- MADRVGBADLFHMO-UHFFFAOYSA-N Indeloxazine Chemical compound C=1C=CC=2C=CCC=2C=1OCC1CNCCO1 MADRVGBADLFHMO-UHFFFAOYSA-N 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 1
- 108010057186 Insulin Glargine Proteins 0.000 description 1
- COCFEDIXXNGUNL-RFKWWTKHSA-N Insulin glargine Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@H]1CSSC[C@H]2C(=O)N[C@H](C(=O)N[C@@H](CO)C(=O)N[C@H](C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3C=CC(O)=CC=3)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3NC=NC=3)NC(=O)[C@H](CO)NC(=O)CNC1=O)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(=O)NCC(O)=O)=O)CSSC[C@@H](C(N2)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](NC(=O)CN)[C@@H](C)CC)[C@@H](C)CC)[C@@H](C)O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CC=1C=CC=CC=1)C(C)C)C1=CN=CN1 COCFEDIXXNGUNL-RFKWWTKHSA-N 0.000 description 1
- 229940122355 Insulin sensitizer Drugs 0.000 description 1
- 206010023330 Keloid scar Diseases 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- 102000000853 LDL receptors Human genes 0.000 description 1
- 108010001831 LDL receptors Proteins 0.000 description 1
- 241000254158 Lampyridae Species 0.000 description 1
- 239000004166 Lanolin Substances 0.000 description 1
- 229910010084 LiAlH4 Inorganic materials 0.000 description 1
- 102000004882 Lipase Human genes 0.000 description 1
- 108090001060 Lipase Proteins 0.000 description 1
- 239000004367 Lipase Substances 0.000 description 1
- 108010013563 Lipoprotein Lipase Proteins 0.000 description 1
- 102100022119 Lipoprotein lipase Human genes 0.000 description 1
- 108010033266 Lipoprotein(a) Proteins 0.000 description 1
- 102000057248 Lipoprotein(a) Human genes 0.000 description 1
- 229940122014 Lyase inhibitor Drugs 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 229940124757 MC-4 agonist Drugs 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- ZPXSCAKFGYXMGA-UHFFFAOYSA-N Mazindol Chemical compound N12CCN=C2C2=CC=CC=C2C1(O)C1=CC=C(Cl)C=C1 ZPXSCAKFGYXMGA-UHFFFAOYSA-N 0.000 description 1
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical compound CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 description 1
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 1
- 102100031545 Microsomal triglyceride transfer protein large subunit Human genes 0.000 description 1
- IBAQFPQHRJAVAV-ULAWRXDQSA-N Miglitol Chemical compound OCCN1C[C@H](O)[C@@H](O)[C@H](O)[C@H]1CO IBAQFPQHRJAVAV-ULAWRXDQSA-N 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 208000007256 Nevus Diseases 0.000 description 1
- 102000007399 Nuclear hormone receptor Human genes 0.000 description 1
- 108020005497 Nuclear hormone receptor Proteins 0.000 description 1
- ZQDDZUHDMZILMU-UHFFFAOYSA-N ON=C(C(=O)O)C(C(C)C)=O Chemical compound ON=C(C(=O)O)C(C(C)C)=O ZQDDZUHDMZILMU-UHFFFAOYSA-N 0.000 description 1
- 102000002512 Orexin Human genes 0.000 description 1
- 229940124754 PPAR-alpha/gamma agonist Drugs 0.000 description 1
- 206010033645 Pancreatitis Diseases 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 102100038824 Peroxisome proliferator-activated receptor delta Human genes 0.000 description 1
- 229940127315 Potassium Channel Openers Drugs 0.000 description 1
- TUZYXOIXSAXUGO-UHFFFAOYSA-N Pravastatin Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(O)C=C21 TUZYXOIXSAXUGO-UHFFFAOYSA-N 0.000 description 1
- 102100040918 Pro-glucagon Human genes 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 102000009572 RNA Polymerase II Human genes 0.000 description 1
- 108010009460 RNA Polymerase II Proteins 0.000 description 1
- 208000013616 Respiratory Distress Syndrome Diseases 0.000 description 1
- 208000017442 Retinal disease Diseases 0.000 description 1
- 206010038923 Retinopathy Diseases 0.000 description 1
- 208000025747 Rheumatic disease Diseases 0.000 description 1
- RYMZZMVNJRMUDD-UHFFFAOYSA-N SJ000286063 Natural products C12C(OC(=O)C(C)(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 RYMZZMVNJRMUDD-UHFFFAOYSA-N 0.000 description 1
- 206010039793 Seborrhoeic dermatitis Diseases 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical class [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 1
- 229940123495 Squalene synthetase inhibitor Drugs 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 229940100389 Sulfonylurea Drugs 0.000 description 1
- 208000031673 T-Cell Cutaneous Lymphoma Diseases 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric Acid Chemical class [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- DTQVDTLACAAQTR-UHFFFAOYSA-M Trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-M 0.000 description 1
- 201000006704 Ulcerative Colitis Diseases 0.000 description 1
- 206010047115 Vasculitis Diseases 0.000 description 1
- 208000000260 Warts Diseases 0.000 description 1
- 229910021536 Zeolite Inorganic materials 0.000 description 1
- WIQIWPPQGWGVHD-JEDNCBNOSA-N [(2s)-1-[(2-methylpropan-2-yl)oxy]-1-oxopropan-2-yl]azanium;chloride Chemical compound Cl.C[C@H](N)C(=O)OC(C)(C)C WIQIWPPQGWGVHD-JEDNCBNOSA-N 0.000 description 1
- FPQVGDGSRVMNMR-JCTPKUEWSA-N [[(z)-(1-cyano-2-ethoxy-2-oxoethylidene)amino]oxy-(dimethylamino)methylidene]-dimethylazanium;tetrafluoroborate Chemical compound F[B-](F)(F)F.CCOC(=O)C(\C#N)=N/OC(N(C)C)=[N+](C)C FPQVGDGSRVMNMR-JCTPKUEWSA-N 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 206010000496 acne Diseases 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 210000001789 adipocyte Anatomy 0.000 description 1
- 201000000028 adult respiratory distress syndrome Diseases 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 230000001270 agonistic effect Effects 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001447 alkali salts Chemical class 0.000 description 1
- BHELZAPQIKSEDF-UHFFFAOYSA-N allyl bromide Chemical compound BrCC=C BHELZAPQIKSEDF-UHFFFAOYSA-N 0.000 description 1
- 150000001370 alpha-amino acid derivatives Chemical class 0.000 description 1
- 235000008206 alpha-amino acids Nutrition 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 239000003392 amylase inhibitor Substances 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 229940044094 angiotensin-converting-enzyme inhibitor Drugs 0.000 description 1
- 229920006318 anionic polymer Polymers 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000879 anti-atherosclerotic effect Effects 0.000 description 1
- 230000003579 anti-obesity Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 229940053200 antiepileptics fatty acid derivative Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 229940127217 antithrombotic drug Drugs 0.000 description 1
- 230000036506 anxiety Effects 0.000 description 1
- RCHHVVGSTHAVPF-ZPHPLDECSA-N apidra Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@H]1CSSC[C@H]2C(=O)N[C@H](C(=O)N[C@@H](CO)C(=O)N[C@H](C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3C=CC(O)=CC=3)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3N=CNC=3)NC(=O)[C@H](CO)NC(=O)CNC1=O)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O)=O)CSSC[C@@H](C(N2)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](NC(=O)CN)[C@@H](C)CC)[C@@H](C)CC)[C@@H](C)O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@@H](N)CC=1C=CC=CC=1)C(C)C)C1=CNC=N1 RCHHVVGSTHAVPF-ZPHPLDECSA-N 0.000 description 1
- 229940112930 apidra Drugs 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 208000011775 arteriosclerosis disease Diseases 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 201000008937 atopic dermatitis Diseases 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 229960005370 atorvastatin Drugs 0.000 description 1
- 235000015173 baked goods and baking mixes Nutrition 0.000 description 1
- 150000007514 bases Chemical class 0.000 description 1
- BMWITAUNXBHIPO-OZZZDHQUSA-N benzenesulfonic acid;(2s,4s)-4-fluoro-1-[2-[(1-hydroxy-2-methylpropan-2-yl)amino]acetyl]pyrrolidine-2-carbonitrile Chemical compound OS(=O)(=O)C1=CC=CC=C1.OCC(C)(C)NCC(=O)N1C[C@@H](F)C[C@H]1C#N BMWITAUNXBHIPO-OZZZDHQUSA-N 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid group Chemical group C(C1=CC=CC=C1)(=O)O WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- AGEZXYOZHKGVCM-UHFFFAOYSA-N benzyl bromide Chemical compound BrCC1=CC=CC=C1 AGEZXYOZHKGVCM-UHFFFAOYSA-N 0.000 description 1
- 239000002876 beta blocker Substances 0.000 description 1
- 229940097320 beta blocking agent Drugs 0.000 description 1
- 229960000516 bezafibrate Drugs 0.000 description 1
- IIBYAHWJQTYFKB-UHFFFAOYSA-N bezafibrate Chemical compound C1=CC(OC(C)(C)C(O)=O)=CC=C1CCNC(=O)C1=CC=C(Cl)C=C1 IIBYAHWJQTYFKB-UHFFFAOYSA-N 0.000 description 1
- 125000002619 bicyclic group Chemical group 0.000 description 1
- 210000003445 biliary tract Anatomy 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- OZVBMTJYIDMWIL-AYFBDAFISA-N bromocriptine Chemical compound C1=CC(C=2[C@H](N(C)C[C@@H](C=2)C(=O)N[C@]2(C(=O)N3[C@H](C(N4CCC[C@H]4[C@]3(O)O2)=O)CC(C)C)C(C)C)C2)=C3C2=C(Br)NC3=C1 OZVBMTJYIDMWIL-AYFBDAFISA-N 0.000 description 1
- 229960002802 bromocriptine Drugs 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 229940081734 cellulose acetate phthalate Drugs 0.000 description 1
- 208000026106 cerebrovascular disease Diseases 0.000 description 1
- 239000003610 charcoal Substances 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 239000003354 cholesterol ester transfer protein inhibitor Substances 0.000 description 1
- 229940125881 cholesteryl ester transfer protein inhibitor Drugs 0.000 description 1
- YZFWTZACSRHJQD-UHFFFAOYSA-N ciglitazone Chemical compound C=1C=C(CC2C(NC(=O)S2)=O)C=CC=1OCC1(C)CCCCC1 YZFWTZACSRHJQD-UHFFFAOYSA-N 0.000 description 1
- 229950009226 ciglitazone Drugs 0.000 description 1
- 229960001214 clofibrate Drugs 0.000 description 1
- KNHUKKLJHYUCFP-UHFFFAOYSA-N clofibrate Chemical compound CCOC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 KNHUKKLJHYUCFP-UHFFFAOYSA-N 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 229960001152 colesevelam Drugs 0.000 description 1
- 208000029078 coronary artery disease Diseases 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 125000004093 cyano group Chemical group *C#N 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 229960004597 dexfenfluramine Drugs 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- HNPSIPDUKPIQMN-UHFFFAOYSA-N dioxosilane;oxo(oxoalumanyloxy)alumane Chemical compound O=[Si]=O.O=[Al]O[Al]=O HNPSIPDUKPIQMN-UHFFFAOYSA-N 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 230000002526 effect on cardiovascular system Effects 0.000 description 1
- 201000011523 endocrine gland cancer Diseases 0.000 description 1
- 230000037149 energy metabolism Effects 0.000 description 1
- 239000002702 enteric coating Substances 0.000 description 1
- 238000009505 enteric coating Methods 0.000 description 1
- 210000002615 epidermis Anatomy 0.000 description 1
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 1
- XCLDSQRVMMXWMS-UHFFFAOYSA-N ethyl 4-methyl-3-oxopentanoate Chemical compound CCOC(=O)CC(=O)C(C)C XCLDSQRVMMXWMS-UHFFFAOYSA-N 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- OLNTVTPDXPETLC-XPWALMASSA-N ezetimibe Chemical compound N1([C@@H]([C@H](C1=O)CC[C@H](O)C=1C=CC(F)=CC=1)C=1C=CC(O)=CC=1)C1=CC=C(F)C=C1 OLNTVTPDXPETLC-XPWALMASSA-N 0.000 description 1
- 229960000815 ezetimibe Drugs 0.000 description 1
- 235000019197 fats Nutrition 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 229960001582 fenfluramine Drugs 0.000 description 1
- 229960002297 fenofibrate Drugs 0.000 description 1
- YMTINGFKWWXKFG-UHFFFAOYSA-N fenofibrate Chemical compound C1=CC(OC(C)(C)C(=O)OC(C)C)=CC=C1C(=O)C1=CC=C(Cl)C=C1 YMTINGFKWWXKFG-UHFFFAOYSA-N 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 229960003765 fluvastatin Drugs 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 235000012041 food component Nutrition 0.000 description 1
- 239000005417 food ingredient Substances 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 235000012631 food intake Nutrition 0.000 description 1
- CNUDBTRUORMMPA-UHFFFAOYSA-N formylthiophene Chemical compound O=CC1=CC=CS1 CNUDBTRUORMMPA-UHFFFAOYSA-N 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- BTCSSZJGUNDROE-UHFFFAOYSA-N gamma-aminobutyric acid Chemical compound NCCCC(O)=O BTCSSZJGUNDROE-UHFFFAOYSA-N 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 230000030136 gastric emptying Effects 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 229960003627 gemfibrozil Drugs 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 210000004392 genitalia Anatomy 0.000 description 1
- MASNOZXLGMXCHN-ZLPAWPGGSA-N glucagon Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O)C(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)[C@@H](C)O)C1=CC=CC=C1 MASNOZXLGMXCHN-ZLPAWPGGSA-N 0.000 description 1
- 229960004666 glucagon Drugs 0.000 description 1
- 230000009229 glucose formation Effects 0.000 description 1
- 230000004190 glucose uptake Effects 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 230000004116 glycogenolysis Effects 0.000 description 1
- 235000014168 granola/muesli bars Nutrition 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 238000005984 hydrogenation reaction Methods 0.000 description 1
- 239000002471 hydroxymethylglutaryl coenzyme A reductase inhibitor Substances 0.000 description 1
- 229940031704 hydroxypropyl methylcellulose phthalate Drugs 0.000 description 1
- 229920003132 hydroxypropyl methylcellulose phthalate Polymers 0.000 description 1
- 201000001421 hyperglycemia Diseases 0.000 description 1
- 208000015210 hypertensive heart disease Diseases 0.000 description 1
- 229940126904 hypoglycaemic agent Drugs 0.000 description 1
- 229950005809 implitapide Drugs 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000004968 inflammatory condition Effects 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000003978 infusion fluid Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 108700039926 insulin glulisine Proteins 0.000 description 1
- 239000000543 intermediate Substances 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 1
- 208000028867 ischemia Diseases 0.000 description 1
- 206010023332 keratitis Diseases 0.000 description 1
- 201000004607 keratosis follicularis Diseases 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 229940039717 lanolin Drugs 0.000 description 1
- 235000019388 lanolin Nutrition 0.000 description 1
- 208000002741 leukoplakia Diseases 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 235000019421 lipase Nutrition 0.000 description 1
- 230000008604 lipoprotein metabolism Effects 0.000 description 1
- 206010024627 liposarcoma Diseases 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 239000002697 lyase inhibitor Substances 0.000 description 1
- OVWYEQOVUDKZNU-UHFFFAOYSA-N m-tolualdehyde Chemical compound CC1=CC=CC(C=O)=C1 OVWYEQOVUDKZNU-UHFFFAOYSA-N 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 210000001161 mammalian embryo Anatomy 0.000 description 1
- 229960000299 mazindol Drugs 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 description 1
- NMMZEZFSJLGLHB-VQTJNVASSA-N methyl (1s,3r)-3-[tert-butyl(diphenyl)silyl]oxycyclohexane-1-carboxylate Chemical compound C1[C@@H](C(=O)OC)CCC[C@H]1O[Si](C(C)(C)C)(C=1C=CC=CC=1)C1=CC=CC=C1 NMMZEZFSJLGLHB-VQTJNVASSA-N 0.000 description 1
- MTPXRXOMKRLUMU-UHFFFAOYSA-N methyl 1-aminocyclohexane-1-carboxylate;hydrochloride Chemical compound Cl.COC(=O)C1(N)CCCCC1 MTPXRXOMKRLUMU-UHFFFAOYSA-N 0.000 description 1
- 150000004702 methyl esters Chemical class 0.000 description 1
- 229960001110 miglitol Drugs 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 239000007932 molded tablet Substances 0.000 description 1
- 208000008588 molluscum contagiosum Diseases 0.000 description 1
- SLZIZIJTGAYEKK-CIJSCKBQSA-N molport-023-220-247 Chemical compound C([C@@H](C(=O)N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1N=CNC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1N=CNC=1)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(N)=O)NC(=O)[C@H]1N(CCC1)C(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)CN)[C@@H](C)O)C1=CNC=N1 SLZIZIJTGAYEKK-CIJSCKBQSA-N 0.000 description 1
- 125000002950 monocyclic group Chemical group 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- OJMDJGREWFCSIH-UHFFFAOYSA-N n,n-dibutyl-7,7-dimethyl-2-oxo-1,8-dioxaspiro[4.5]decane-4-carboxamide Chemical compound CCCCN(CCCC)C(=O)C1CC(=O)OC11CC(C)(C)OCC1 OJMDJGREWFCSIH-UHFFFAOYSA-N 0.000 description 1
- JMIISYUBDOEMLT-UHFFFAOYSA-N n-[1-[2-(3,4-dimethoxyphenyl)ethyl]-6,6-dimethyl-2,4-dioxo-3-(trifluoromethyl)-5,7-dihydroindol-3-yl]-2,2-dimethylpropanamide Chemical compound C1=C(OC)C(OC)=CC=C1CCN1C(CC(C)(C)CC2=O)=C2C(NC(=O)C(C)(C)C)(C(F)(F)F)C1=O JMIISYUBDOEMLT-UHFFFAOYSA-N 0.000 description 1
- LXEDKSZTPGCEPU-UHFFFAOYSA-N n-[2-(3a-benzyl-2-methyl-3-oxo-6,7-dihydro-4h-pyrazolo[4,3-c]pyridin-5-yl)-1-(4-chlorophenyl)-2-oxoethyl]-1-amino-1,2,3,4-tetrahydronaphthalene-2-carboxamide Chemical compound O=C1N(C)N=C2CCN(C(=O)C(NC(=O)C3C(C4=CC=CC=C4CC3)N)C=3C=CC(Cl)=CC=3)CC21CC1=CC=CC=C1 LXEDKSZTPGCEPU-UHFFFAOYSA-N 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 230000002474 noradrenergic effect Effects 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- 230000035764 nutrition Effects 0.000 description 1
- 239000007764 o/w emulsion Substances 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 108060005714 orexin Proteins 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- AHLBNYSZXLDEJQ-FWEHEUNISA-N orlistat Chemical compound CCCCCCCCCCC[C@H](OC(=O)[C@H](CC(C)C)NC=O)C[C@@H]1OC(=O)[C@H]1CCCCCC AHLBNYSZXLDEJQ-FWEHEUNISA-N 0.000 description 1
- 229960001243 orlistat Drugs 0.000 description 1
- 201000008482 osteoarthritis Diseases 0.000 description 1
- YDCVQGAUCOROHB-UHFFFAOYSA-N oxadiazolidine-4,5-dione Chemical class O=C1NNOC1=O YDCVQGAUCOROHB-UHFFFAOYSA-N 0.000 description 1
- 150000002923 oximes Chemical class 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- VWMZIGBYZQUQOA-QEEMJVPDSA-N pamaqueside Chemical compound O([C@@H]1[C@@H](CO)O[C@H]([C@@H]([C@H]1O)O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4C[C@H]5[C@@H]([C@]4(CC(=O)[C@@H]3[C@@]2(C)CC1)C)[C@@H]([C@]1(OC[C@H](C)CC1)O5)C)[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O VWMZIGBYZQUQOA-QEEMJVPDSA-N 0.000 description 1
- 229950005482 pamaqueside Drugs 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 208000003154 papilloma Diseases 0.000 description 1
- 230000002023 papillomaviral effect Effects 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 230000007310 pathophysiology Effects 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 239000003614 peroxisome proliferator Substances 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 229960003562 phentermine Drugs 0.000 description 1
- 230000001766 physiological effect Effects 0.000 description 1
- 229960002797 pitavastatin Drugs 0.000 description 1
- VGYFMXBACGZSIL-MCBHFWOFSA-N pitavastatin Chemical compound OC(=O)C[C@H](O)C[C@H](O)\C=C\C1=C(C2CC2)N=C2C=CC=CC2=C1C1=CC=C(F)C=C1 VGYFMXBACGZSIL-MCBHFWOFSA-N 0.000 description 1
- 238000013492 plasmid preparation Methods 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229940068917 polyethylene glycols Drugs 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 229940100467 polyvinyl acetate phthalate Drugs 0.000 description 1
- 230000008092 positive effect Effects 0.000 description 1
- 230000018656 positive regulation of gluconeogenesis Effects 0.000 description 1
- 230000000291 postprandial effect Effects 0.000 description 1
- 159000000001 potassium salts Chemical class 0.000 description 1
- 229960002965 pravastatin Drugs 0.000 description 1
- TUZYXOIXSAXUGO-PZAWKZKUSA-N pravastatin Chemical compound C1=C[C@H](C)[C@H](CC[C@@H](O)C[C@@H](O)CC(O)=O)[C@H]2[C@@H](OC(=O)[C@@H](C)CC)C[C@H](O)C=C21 TUZYXOIXSAXUGO-PZAWKZKUSA-N 0.000 description 1
- 238000002953 preparative HPLC Methods 0.000 description 1
- 201000001514 prostate carcinoma Diseases 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- HDACQVRGBOVJII-JBDAPHQKSA-N ramipril Chemical compound C([C@@H](C(=O)OCC)N[C@@H](C)C(=O)N1[C@@H](C[C@@H]2CCC[C@@H]21)C(O)=O)CC1=CC=CC=C1 HDACQVRGBOVJII-JBDAPHQKSA-N 0.000 description 1
- 229960003401 ramipril Drugs 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000009877 rendering Methods 0.000 description 1
- 230000010410 reperfusion Effects 0.000 description 1
- 208000037803 restenosis Diseases 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 229960000672 rosuvastatin Drugs 0.000 description 1
- BPRHUIZQVSMCRT-VEUZHWNKSA-N rosuvastatin Chemical compound CC(C)C1=NC(N(C)S(C)(=O)=O)=NC(C=2C=CC(F)=CC=2)=C1\C=C\[C@@H](O)C[C@@H](O)CC(O)=O BPRHUIZQVSMCRT-VEUZHWNKSA-N 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 208000008742 seborrheic dermatitis Diseases 0.000 description 1
- 201000003385 seborrheic keratosis Diseases 0.000 description 1
- 239000000952 serotonin receptor agonist Substances 0.000 description 1
- 239000003772 serotonin uptake inhibitor Substances 0.000 description 1
- 229960004425 sibutramine Drugs 0.000 description 1
- UNAANXDKBXWMLN-UHFFFAOYSA-N sibutramine Chemical compound C=1C=C(Cl)C=CC=1C1(C(N(C)C)CC(C)C)CCC1 UNAANXDKBXWMLN-UHFFFAOYSA-N 0.000 description 1
- 229960002855 simvastatin Drugs 0.000 description 1
- RYMZZMVNJRMUDD-HGQWONQESA-N simvastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)C(C)(C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 RYMZZMVNJRMUDD-HGQWONQESA-N 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 108091008012 small dense LDL Proteins 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 235000010288 sodium nitrite Nutrition 0.000 description 1
- 239000012453 solvate Substances 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 239000004059 squalene synthase inhibitor Substances 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- RFUWRXIYTQGFGA-QRPNPIFTSA-N tert-butyl (2s)-2-amino-4-methylpentanoate;hydron;chloride Chemical compound Cl.CC(C)C[C@H](N)C(=O)OC(C)(C)C RFUWRXIYTQGFGA-QRPNPIFTSA-N 0.000 description 1
- ZAOPBCHLHBOUPR-UHFFFAOYSA-N tert-butyl 1-[2-[di(propan-2-yl)amino]ethylcarbamoyl]-6-phenylmethoxy-3,4-dihydro-1h-isoquinoline-2-carboxylate Chemical compound C=1C=C2C(C(=O)NCCN(C(C)C)C(C)C)N(C(=O)OC(C)(C)C)CCC2=CC=1OCC1=CC=CC=C1 ZAOPBCHLHBOUPR-UHFFFAOYSA-N 0.000 description 1
- YZKDXIFGPWUKTI-UHFFFAOYSA-N tert-butyl 2-amino-2-methylpropanoate;hydrochloride Chemical compound Cl.CC(C)(C)OC(=O)C(C)(C)N YZKDXIFGPWUKTI-UHFFFAOYSA-N 0.000 description 1
- 229950004704 tesaglitazar Drugs 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 150000001467 thiazolidinediones Chemical class 0.000 description 1
- 201000005665 thrombophilia Diseases 0.000 description 1
- 229950004437 tiqueside Drugs 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- CMSGWTNRGKRWGS-NQIIRXRSSA-N torcetrapib Chemical compound COC(=O)N([C@H]1C[C@@H](CC)N(C2=CC=C(C=C21)C(F)(F)F)C(=O)OCC)CC1=CC(C(F)(F)F)=CC(C(F)(F)F)=C1 CMSGWTNRGKRWGS-NQIIRXRSSA-N 0.000 description 1
- 229950004514 torcetrapib Drugs 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 239000012096 transfection reagent Substances 0.000 description 1
- 238000003146 transient transfection Methods 0.000 description 1
- GXPHKUHSUJUWKP-UHFFFAOYSA-N troglitazone Chemical compound C1CC=2C(C)=C(O)C(C)=C(C)C=2OC1(C)COC(C=C1)=CC=C1CC1SC(=O)NC1=O GXPHKUHSUJUWKP-UHFFFAOYSA-N 0.000 description 1
- 229960001641 troglitazone Drugs 0.000 description 1
- GXPHKUHSUJUWKP-NTKDMRAZSA-N troglitazone Natural products C([C@@]1(OC=2C(C)=C(C(=C(C)C=2CC1)O)C)C)OC(C=C1)=CC=C1C[C@H]1SC(=O)NC1=O GXPHKUHSUJUWKP-NTKDMRAZSA-N 0.000 description 1
- 229960000281 trometamol Drugs 0.000 description 1
- 210000001635 urinary tract Anatomy 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 229940099259 vaseline Drugs 0.000 description 1
- SYOKIDBDQMKNDQ-XWTIBIIYSA-N vildagliptin Chemical compound C1C(O)(C2)CC(C3)CC1CC32NCC(=O)N1CCC[C@H]1C#N SYOKIDBDQMKNDQ-XWTIBIIYSA-N 0.000 description 1
- 239000007762 w/o emulsion Substances 0.000 description 1
- 238000010626 work up procedure Methods 0.000 description 1
- 239000010457 zeolite Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D263/00—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings
- C07D263/02—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings
- C07D263/30—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D263/32—Heterocyclic compounds containing 1,3-oxazole or hydrogenated 1,3-oxazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/48—Drugs for disorders of the endocrine system of the pancreatic hormones
- A61P5/50—Drugs for disorders of the endocrine system of the pancreatic hormones for increasing or potentiating the activity of insulin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/12—Antidiuretics, e.g. drugs for diabetes insipidus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
Abstract
Description
Claims
Priority Applications (13)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2006501885A JP2006519193A (ja) | 2003-02-27 | 2004-02-19 | 2型糖尿病およびアテローム性動脈硬化症の治療のためのpparモジュレーターとしての3−メチル−2−(3−(2−フェニル−オキサゾール−4−イルメトキシ)−シクロヘキサンカルボニル−アミノ酪酸誘導体および関連化合物 |
| AT04712494T ATE430738T1 (de) | 2003-02-27 | 2004-02-19 | 3-methyl-2- (3- (2-phenyl-oxazol-4-ylmethoxy)- cyclohexancarbonyl-amino)-buttersäurederivate und verwandte verbindungen als ppar modulatoren zur behandlung von typ 2 diabetes und atherosklerose |
| DK04712494T DK1599453T3 (da) | 2003-02-27 | 2004-02-19 | 3-Methyl-2-(3-(2-phenyloxazol-4-ylmethyoxy)cyclohexancarbonylamino)smörsyrederivater og beslægtede forbindelser som PPAR modulatorer til behandling af type 2 diabetes og atherosklerose |
| EP04712494A EP1599453B1 (de) | 2003-02-27 | 2004-02-19 | 3-methyl-2- (3- (2-phenyl-oxazol-4-ylmethoxy)-cyclohexancarbonyl-amino)-buttersäurederivate und verwandte verbindungen als ppar modulatoren zur behandlung von typ 2 diabetes und atherosklerose |
| YUP-2005/0594A RS20050594A (en) | 2003-02-27 | 2004-02-19 | 3-methyl-2-(3-(2-phenyl-oxazol-4- ylmethoxy)- cyclohexanecarbonyl- amino butyric acid derivatives and related compounds as ppar modulators for the treatment of type 2 diabetes and atherosclerosis |
| DE502004009453T DE502004009453D1 (de) | 2003-02-27 | 2004-02-19 | 3-methyl-2- (3- (2-phenyl-oxazol-4-ylmethoxy)-cyclohexancarbonyl-amino)-buttersäurederivate und verwandte verbindungen als ppar modulatoren zur behandlung von typ 2 diabetes und atherosklerose |
| AU2004215672A AU2004215672B2 (en) | 2003-02-27 | 2004-02-19 | 3-methyl-2- (3- (2-phenyl-oxazol-4-ylmethoxy)-cyclohexanecarbonyl-amino butyric acid derivatives and related compounds as PPAR modulators for the treatment of type 2 diabetes and atherosclerosis |
| CA002516620A CA2516620A1 (en) | 2003-02-27 | 2004-02-19 | 3-methyl-2- (3- (2-phenyl-oxazol-4-ylmethoxy)-cyclohexanecarbonyl-amino butyric acid derivatives and related compounds as ppar modulators for the treatment of type 2 diabetes and atherosclerosis |
| BRPI0407814-4A BRPI0407814A (pt) | 2003-02-27 | 2004-02-19 | derivados de ácido 3-metil-2-(3-(2-fenil-oxazol-4-ilmetoxi)-ciclohexonaca rbonil-amino)-butìrico e compostos afins como moduladores ppar para o tratamento do diabetes tipo 2 e aterosclerose |
| MXPA05008951A MXPA05008951A (es) | 2003-02-27 | 2004-02-19 | Derivados de acido 3-metil -2-(3- (2-fenil -oxazol-4 -ilmetoxi) -ciclohexanocarbonil -aminobutirico y compuestos relacionados como moduladores de ppar para el tratamiento de diabetes de tipo 2 y aterosclerosis. |
| TNP2005000206A TNSN05206A1 (en) | 2003-02-27 | 2005-08-26 | 3-methyl-2-(3- (2-phenyl-oxazol-4-ylmethoxy)-cyclohexanecarbonyl-amino butyric acid derivatives and related compounds as ppar modulators for the treatment of type 2 diabetes and atherosclerosis |
| HR20050742A HRP20050742A2 (en) | 2003-02-27 | 2005-08-26 | 3-methyl-2-(3-(2-phenyl-oxazol-4-ylmethoxy)-cyclohexanecarbonyl-amino butyric acid derivatives and related compounds as ppar modulators for the treatment of type 2 diabetes and atherosclerosis |
| NO20054396A NO20054396L (no) | 2003-02-27 | 2005-09-22 | 3-metyl-2-(3-(2-fenyl-oksazol-4-ylmetoksy)-cykloheksankarbonyl-amino)-smorsyrederivater og lignende forbindelser som PPAR-modulatorer til behandling av type 2 diabetes og aterosklerose |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE10308355A DE10308355A1 (de) | 2003-02-27 | 2003-02-27 | Aryl-cycloalkyl substituierte Alkansäurederivate, Verfahren zu ihrer Herstellung und ihre Anwendung als Arzneimittel |
| DE10308355.3 | 2003-02-27 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2004076426A1 true WO2004076426A1 (de) | 2004-09-10 |
Family
ID=32920629
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/EP2004/001579 WO2004076427A1 (de) | 2003-02-27 | 2004-02-19 | 3-(2-phenyl-oxazol-4- ylmethoxy)-cyclohexylmethoxy -essigsäure derivate und verwandte verbindungen als ppar modulatoren zur behandlung von typ 2 diabetes und atherosklerose |
| PCT/EP2004/001586 WO2004076428A1 (de) | 2003-02-27 | 2004-02-19 | 4-(3- (2-phenyl-oxazol-4-ylmethoxy)-cyclohexyloxy)-butansäure derivate und verwandte verbindungen als ppar modulatoren zur behandlung von typ 2 diabetes und atherosklerose |
| PCT/EP2004/001578 WO2004076426A1 (de) | 2003-02-27 | 2004-02-19 | 3-methyl-2- (3- (2-phenyl-oxazol-4-ylmethoxy)-cyclohexancarbonyl-amino)-buttersäurederivate und verwandte verbindungen als ppar modulatoren zur behandlung von typ 2 diabetes und atherosklerose |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/EP2004/001579 WO2004076427A1 (de) | 2003-02-27 | 2004-02-19 | 3-(2-phenyl-oxazol-4- ylmethoxy)-cyclohexylmethoxy -essigsäure derivate und verwandte verbindungen als ppar modulatoren zur behandlung von typ 2 diabetes und atherosklerose |
| PCT/EP2004/001586 WO2004076428A1 (de) | 2003-02-27 | 2004-02-19 | 4-(3- (2-phenyl-oxazol-4-ylmethoxy)-cyclohexyloxy)-butansäure derivate und verwandte verbindungen als ppar modulatoren zur behandlung von typ 2 diabetes und atherosklerose |
Country Status (34)
| Country | Link |
|---|---|
| US (5) | US7259177B2 (de) |
| EP (3) | EP1599452B1 (de) |
| JP (3) | JP2006519194A (de) |
| KR (3) | KR20050105492A (de) |
| CN (3) | CN100439347C (de) |
| AR (3) | AR043432A1 (de) |
| AT (3) | ATE430738T1 (de) |
| AU (3) | AU2004215672B2 (de) |
| BR (3) | BRPI0407907A (de) |
| CA (3) | CA2517386A1 (de) |
| CL (2) | CL2004000391A1 (de) |
| CO (2) | CO5690578A2 (de) |
| DE (4) | DE10308355A1 (de) |
| DK (3) | DK1599455T3 (de) |
| EC (2) | ECSP055986A (de) |
| ES (3) | ES2326418T3 (de) |
| HR (3) | HRP20050743A2 (de) |
| IL (2) | IL170314A (de) |
| MA (3) | MA27736A1 (de) |
| MX (3) | MXPA05008988A (de) |
| NO (3) | NO20054408L (de) |
| OA (2) | OA13035A (de) |
| PA (1) | PA8596801A1 (de) |
| PE (3) | PE20040959A1 (de) |
| PL (3) | PL378437A1 (de) |
| PT (3) | PT1599453E (de) |
| RS (1) | RS20050594A (de) |
| RU (3) | RU2005130002A (de) |
| SA (1) | SA04250153A (de) |
| TN (2) | TNSN05204A1 (de) |
| TW (3) | TW200510352A (de) |
| UY (2) | UY28209A1 (de) |
| WO (3) | WO2004076427A1 (de) |
| ZA (2) | ZA200505765B (de) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006015716A2 (de) * | 2004-08-07 | 2006-02-16 | Sanofi-Aventis Deutschland Gmbh | Verfahren zur herstellung der enantiomeren formen von cis-konfigurierten 3-hydroxycyclohexancarbonsäure-derivaten unter verwendung von hydrolasen |
| WO2006066694A1 (de) * | 2004-12-15 | 2006-06-29 | Sanofi-Aventis Deutschland Gmbh | VERFAHREN ZUR HERSTELLUNG VON OXAZOLEN DURCH KONDENSATION VON AROMATISCHEN ALDEHYDEN MIT α-KETOXIMEN ZU N-OXIDEN UND NACHFOLGENDE REAKTION MIT AKTIVIERTEN SÄUREDERIVATEN |
| WO2007039177A2 (en) | 2005-09-29 | 2007-04-12 | Sanofi-Aventis | Phenyl- and pyridinyl- 1, 2 , 4 - oxadiazolone derivatives, processes for their preparation and their use as pharmaceuticals |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7576131B2 (en) | 1999-06-04 | 2009-08-18 | Metabolex, Inc. | Use of (-) (3-trihalomethylphenoxy) (4-halophenyl) acetic acid derivatives for treatment of insulin resistance, type 2 diabetes, hyperlipidemia and hyperuricemia |
| US6262118B1 (en) * | 1999-06-04 | 2001-07-17 | Metabolex, Inc. | Use of (-) (3-trihalomethylphenoxy) (4-halophenyl) acetic acid derivatives for treatment of insulin resistance, type 2 diabetes and hyperlipidemia |
| US7399777B2 (en) * | 2001-08-31 | 2008-07-15 | Sanofi-Aventis Deutschland Gmbh | Diarylcycloalkyl derivatives, processes for their preparation and their use as pharmceuticals |
| DE10308353A1 (de) * | 2003-02-27 | 2004-12-02 | Aventis Pharma Deutschland Gmbh | Diarylcycloalkylderivate, Verfahren zu ihrer Herstellung und ihre Verwendung als Arzneimittel |
| DE102004039532B4 (de) * | 2004-08-14 | 2006-09-21 | Sanofi-Aventis Deutschland Gmbh | Cyclohexyl-methyloxy substituierte Essigsäurederivate, Verfahren zu ihrer Herstellung und ihre Anwendung als Arzneimittel |
| DE102004039509B4 (de) * | 2004-08-14 | 2006-09-21 | Sanofi-Aventis Deutschland Gmbh | Aryl-cycloalkyl substituierte Alkansäurederivate, Verfahren zu ihrer Herstellung und ihre Verwendung als Arzneimittel |
| DE102004039533B4 (de) * | 2004-08-14 | 2006-09-28 | Sanofi-Aventis Deutschland Gmbh | Essigsäurederivate mit Cyclohexylmethoxy-Substituenten, Verfahren zu ihrer Herstellung und ihre Anwendung als Arzneimittel |
| GT200600218A (es) * | 2005-06-10 | 2007-03-28 | Formulación y proceso de compresión directa | |
| US8128969B2 (en) | 2006-08-10 | 2012-03-06 | Mimozax Co., Ltd. | Hypoglycemic composition containing acacia bark derivative |
| CN101801906A (zh) | 2007-08-16 | 2010-08-11 | 索尔维公司 | 制备4-氟取代的3-氧代-烷酸酯的方法 |
| CN101959875B (zh) * | 2008-02-29 | 2013-10-16 | 日产化学工业株式会社 | 噻吩化合物及其中间体的制造方法 |
| US7615661B2 (en) * | 2008-03-12 | 2009-11-10 | International Flavors & Fragrances Inc. | Thioester compounds and their use in fragrance or flavor applications |
| KR102450783B1 (ko) | 2017-12-13 | 2022-10-06 | 캐논 가부시끼가이샤 | 카트리지 |
| CN109810071B (zh) * | 2019-03-28 | 2023-04-21 | 中国科学院成都生物研究所 | 一种miRNA生物合成抑制剂 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000064876A1 (en) * | 1999-04-28 | 2000-11-02 | Aventis Pharma Deutschland Gmbh | Tri-aryl acid derivatives as ppar receptor ligands |
| WO2002100403A1 (en) * | 2001-06-07 | 2002-12-19 | Eli Lilly And Company | Modulators of peroxisome proliferator activated receptors (ppar) |
Family Cites Families (62)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2663336B1 (fr) | 1990-06-18 | 1992-09-04 | Adir | Nouveaux derives peptidiques, leur procede de preparation et les compositions pharmaceutiques qui les contiennent. |
| FR2663464B1 (fr) * | 1990-06-19 | 1992-09-11 | Commissariat Energie Atomique | Circuit integre en technologie silicium sur isolant comportant un transistor a effet de champ et son procede de fabrication. |
| IL108634A0 (en) | 1993-02-15 | 1994-05-30 | Wellcome Found | Hypolipidaemic heterocyclic compounds, their prepatation and pharmaceutical compositions containing them |
| ZA941003B (en) | 1993-02-15 | 1995-08-14 | Wellcome Found | Hypolipidaemic compounds |
| JP3144624B2 (ja) | 1995-06-02 | 2001-03-12 | 杏林製薬株式会社 | N−ベンジルジオキソチアゾリジルベンズアミド誘導体及びその製造法 |
| KR19990077319A (ko) | 1996-01-17 | 1999-10-25 | 한센 핀 베네드, 안네 제헤르 | 축합된 1,2,4-티아디아진 및 축합된 1,4-티아진 유도체, 그것의제조방법 및 사용 |
| UA72181C2 (uk) | 1996-08-30 | 2005-02-15 | Ново Нордіск А/С | Похідна глюкагоноподібного пептиду-1 (варіанти), фармацевтична композиція та спосіб одержання лікувального засобу (варіанти), спосіб лікування діабету (варіанти) і ожиріння |
| TW492957B (en) | 1996-11-07 | 2002-07-01 | Novartis Ag | N-substituted 2-cyanopyrrolidnes |
| JP4339402B2 (ja) | 1996-12-31 | 2009-10-07 | ドクター・レディーズ・ラボラトリーズ・リミテッド | 新規なヘテロ環化合物、これらの製造方法及びこれらを含有する薬学的組成物、並びに糖尿病及び関連疾患の治療におけるこれらの使用 |
| DE19726167B4 (de) | 1997-06-20 | 2008-01-24 | Sanofi-Aventis Deutschland Gmbh | Insulin, Verfahren zu seiner Herstellung und es enthaltende pharmazeutische Zubereitung |
| WO1999003861A1 (en) | 1997-07-16 | 1999-01-28 | Novo Nordisk A/S | Fused 1,2,4-thiadiazine derivatives, their preparation and use |
| CO4970713A1 (es) | 1997-09-19 | 2000-11-07 | Sanofi Synthelabo | Derivados de carboxamidotiazoles, su preparacion, composiciones farmaceuticas que los contienen |
| EP1067109B1 (de) * | 1998-03-10 | 2009-12-09 | Ono Pharmaceutical Co., Ltd. | Carbonsäurederivate und medikamente die diese als aktiven wirkstoff enthalten |
| DE19823831A1 (de) | 1998-05-28 | 1999-12-02 | Probiodrug Ges Fuer Arzneim | Neue pharmazeutische Verwendung von Isoleucyl Thiazolidid und seinen Salzen |
| SE9801992D0 (sv) | 1998-06-04 | 1998-06-04 | Astra Ab | New 3-aryl-2-hydroxypropionic acid derivative I |
| MA26634A1 (fr) | 1998-06-04 | 2004-12-20 | Astra Ab | Nouveaux derives de l'acide 3-aryl propionique et analogues |
| US6221897B1 (en) | 1998-06-10 | 2001-04-24 | Aventis Pharma Deutschland Gmbh | Benzothiepine 1,1-dioxide derivatives, a process for their preparation, pharmaceuticals comprising these compounds, and their use |
| DE19828113A1 (de) | 1998-06-24 | 2000-01-05 | Probiodrug Ges Fuer Arzneim | Prodrugs von Inhibitoren der Dipeptidyl Peptidase IV |
| DE19828114A1 (de) | 1998-06-24 | 2000-01-27 | Probiodrug Ges Fuer Arzneim | Produgs instabiler Inhibitoren der Dipeptidyl Peptidase IV |
| AU5443499A (en) * | 1998-08-27 | 2000-03-21 | Ono Pharmaceutical Co. Ltd. | Carboxylic acid derivatives and drugs containing the same as the active ingredient |
| DE19845405C2 (de) * | 1998-10-02 | 2000-07-13 | Aventis Pharma Gmbh | Arylsubstituierte Propanolaminderivate und deren Verwendung |
| GB9900416D0 (en) | 1999-01-08 | 1999-02-24 | Alizyme Therapeutics Ltd | Inhibitors |
| DE19916108C1 (de) | 1999-04-09 | 2001-01-11 | Aventis Pharma Gmbh | Mit Zuckerresten substituierte 1,4-Benzothiazepin-1,1-dioxidderivate, Verfahren zu deren Herstellung und deren Verwendung |
| EP1173438A1 (de) | 1999-04-16 | 2002-01-23 | Novo Nordisk A/S | Substituierte imidazole, ihre herstellung und ihre verwendung |
| US6908926B1 (en) * | 1999-04-16 | 2005-06-21 | Novo Nordisk A/S | Substituted imidazoles, their preparation and use |
| EE200100556A (et) | 1999-04-28 | 2003-02-17 | Aventis Pharma Deutschland Gmbh | Diarüülhappe derivaat, seda sisaldav farmatseutiline kompositsioon ja ühendi kasutamine ravimite valmistamiseks |
| EP1175421A1 (de) | 1999-04-30 | 2002-01-30 | Neurogen Corporation | 9h-pyrimido[4,5-b]indolderivate: crf1 spezifische liganden |
| GB9911863D0 (en) | 1999-05-21 | 1999-07-21 | Knoll Ag | Therapeutic agents |
| AU773505B2 (en) | 1999-06-18 | 2004-05-27 | Merck & Co., Inc. | Arylthiazolidinedione and aryloxazolidinedione derivatives |
| EP1196610A2 (de) | 1999-07-09 | 2002-04-17 | Cohesion Technologies, Inc. | Ecarin polypeptide, dafür kodierende polynukleotide und vefahren zur verwendung davon |
| US6967201B1 (en) | 1999-07-29 | 2005-11-22 | Eli Lilly And Company | Benzofurylpiperazines and benzofurylhomopiperazines: serotonin agonists |
| WO2001016094A1 (de) * | 1999-09-01 | 2001-03-08 | Aventis Pharma Deutschland Gmbh | Sulfonylcarboxamidderivate, verfahren zu ihrer herstellung und ihre verwendung als arzneimittel |
| TW200528436A (en) | 1999-09-22 | 2005-09-01 | Bristol Myers Squibb Co | Substituted acid derivatives useful as antiodiabetic and antiobesity agents and method |
| SE9904413D0 (sv) | 1999-12-03 | 1999-12-03 | Astra Ab | Comminuted form |
| CA2392038A1 (en) | 1999-12-03 | 2001-06-07 | Astrazeneca Ab | Crystalline form of (s)-2 ethoxy-3-[4-(2-{4-methanesulfonyloxyphenyl} ethoxy) phenyl] propanoic acid |
| DK2055302T3 (da) | 2000-03-31 | 2014-10-27 | Royalty Pharma Collection Trust | Fremgangsmåde til forbedring af signalering af øceller ved diabetes mellitus og til forebyggelse deraf |
| CA2407349A1 (en) | 2000-04-25 | 2002-10-24 | Kyorin Pharmaceutical Co., Ltd. | Novel stable crystal of thiazolidinedione derivative and process for producing the same |
| KR100502876B1 (ko) | 2000-04-28 | 2005-07-21 | 아사히 가세이 파마 가부시키가이샤 | 신규 이환성 화합물 |
| ES2252230T3 (es) | 2000-05-11 | 2006-05-16 | Bristol-Myers Squibb Company | Analogos de tetrahidroisoquinolina utiles como secretores de la hormona del crecimiento. |
| AU6497701A (en) | 2000-05-30 | 2001-12-11 | Merck & Co Inc | Melanocortin receptor agonists |
| DE50102147D1 (de) | 2000-06-09 | 2004-06-03 | Aventis Pharma Gmbh | Acylphenylharnstoffderivate, verfahren zu ihrer herstellung und ihre verwendung als arzneimittel |
| DE10038709A1 (de) | 2000-08-09 | 2002-02-28 | Aventis Pharma Gmbh | Substituierte und unsubstituierte Benzooxathiazole sowie daraus abgeleitete Verbindungen |
| EP1182251A1 (de) * | 2000-08-11 | 2002-02-27 | Yissum Research Development Company of the Hebrew University of Jerusalem | Verfahren zum Identifizieren von Verbindungen, die die Ubiquitin vermittelte Proteolyse von IkB inhibieren |
| EP1313715B1 (de) | 2000-08-23 | 2007-08-01 | Eli Lilly And Company | Oxazolylaryloxyessigsäure derivate und ihre verwendung als ppar agonisten |
| PL360744A1 (en) * | 2000-08-23 | 2004-09-20 | Eli Lilly And Company | Oxazolyl-arylpropionic acid derivatives and their use as ppar agonists |
| TWI243162B (en) | 2000-11-10 | 2005-11-11 | Taisho Pharmaceutical Co Ltd | Cyanopyrrolidine derivatives |
| WO2002046146A1 (fr) | 2000-12-05 | 2002-06-13 | Kyorin Pharmaceutical Co., Ltd. | Derives d'acide carboxylique substitues |
| GB0031103D0 (en) * | 2000-12-20 | 2001-01-31 | Glaxo Group Ltd | Chemical compounds |
| SK7822003A3 (en) | 2000-12-21 | 2003-12-02 | Aventis Pharma Gmbh | Novel 1,2-diphenzylazetidinones, method for producing the same, medicaments containing said compounds, and the use thereof for treating disorders of the lipid metabolism |
| HUP0303636A3 (en) * | 2000-12-25 | 2006-02-28 | Ono Pharmaceutical Co | Dihydronaphthalenederivative compounds and pharmaceutical compositions containing them as active ingredient |
| CA2438551A1 (en) * | 2001-02-15 | 2002-08-22 | Pfizer Products Inc. | Ppar agonists |
| PE20021091A1 (es) | 2001-05-25 | 2003-02-04 | Aventis Pharma Gmbh | Derivados de fenilurea sustituidos con carbonamida y procedimiento para su preparacion |
| DE10154689A1 (de) | 2001-11-09 | 2003-05-22 | Probiodrug Ag | Substituierte Aminoketonverbindungen |
| WO2003004458A1 (en) | 2001-07-03 | 2003-01-16 | Biovitrum Ab | New compounds |
| FR2827859B1 (fr) | 2001-07-30 | 2005-09-23 | Lipha | Derives 4-(arylthio) - ou 4-(heteroarylthio) -butyrique dans la preparation de medicaments destines au traitement du diabete |
| RS50889B (sr) | 2001-08-31 | 2010-08-31 | Sanofi-Aventis Deutschland Gmbh. | Derivati diaril-cikloalkila, postupak za njihovu proizvodnju i njihova primena u svojstvu ppar aktivatora |
| ATE433440T1 (de) | 2002-02-05 | 2009-06-15 | Lilly Co Eli | Harnstoff-linker verbindungen und ihre verwendung als ppar regulatoren |
| IL164249A0 (en) | 2002-04-11 | 2005-12-18 | Aventis Pharma Gmbh | Acyl-3-carboxphenylurea derivatives, processes forpreparing them and their use |
| DE10215908B4 (de) | 2002-04-11 | 2005-08-18 | Aventis Pharma Deutschland Gmbh | Acyl-3-carboxyphenyl-harnstoffderivate und deren Verwendung als Arzneimittel |
| DE10225635C1 (de) | 2002-06-07 | 2003-12-24 | Aventis Pharma Gmbh | N-Benzoylureido-Zimtsäurederivate, Verfahren zu deren Herstellung und deren Verwendung |
| WO2004004665A2 (en) | 2002-07-09 | 2004-01-15 | Bristol-Myers Squibb Company | Substituted heterocyclic derivatives useful as antidiabetic and antiobesity agents and method |
| US7148246B2 (en) * | 2003-02-27 | 2006-12-12 | Sanofi-Aventis Deutschland Gmbh | Cycloalkyl derivatives having bioisosteric carboxylic acid groups, processes for their preparation and their use as pharmaceuticals |
-
2003
- 2003-02-27 DE DE10308355A patent/DE10308355A1/de not_active Withdrawn
-
2004
- 2004-02-19 KR KR1020057015851A patent/KR20050105492A/ko not_active Application Discontinuation
- 2004-02-19 RU RU2005130002/04A patent/RU2005130002A/ru not_active Application Discontinuation
- 2004-02-19 JP JP2006501886A patent/JP2006519194A/ja active Pending
- 2004-02-19 WO PCT/EP2004/001579 patent/WO2004076427A1/de active IP Right Grant
- 2004-02-19 EP EP04712490A patent/EP1599452B1/de not_active Expired - Lifetime
- 2004-02-19 ES ES04712494T patent/ES2326418T3/es not_active Expired - Lifetime
- 2004-02-19 PT PT04712494T patent/PT1599453E/pt unknown
- 2004-02-19 MX MXPA05008988A patent/MXPA05008988A/es active IP Right Grant
- 2004-02-19 DK DK04712503T patent/DK1599455T3/da active
- 2004-02-19 DE DE502004009690T patent/DE502004009690D1/de not_active Expired - Lifetime
- 2004-02-19 PT PT04712503T patent/PT1599455E/pt unknown
- 2004-02-19 BR BRPI0407907-8A patent/BRPI0407907A/pt not_active IP Right Cessation
- 2004-02-19 PL PL378437A patent/PL378437A1/pl not_active Application Discontinuation
- 2004-02-19 CN CNB2004800054769A patent/CN100439347C/zh not_active Expired - Fee Related
- 2004-02-19 DK DK04712494T patent/DK1599453T3/da active
- 2004-02-19 JP JP2006501892A patent/JP2006519199A/ja active Pending
- 2004-02-19 WO PCT/EP2004/001586 patent/WO2004076428A1/de active Application Filing
- 2004-02-19 KR KR1020057015995A patent/KR20050106461A/ko not_active Application Discontinuation
- 2004-02-19 AT AT04712494T patent/ATE430738T1/de not_active IP Right Cessation
- 2004-02-19 PT PT04712490T patent/PT1599452E/pt unknown
- 2004-02-19 EP EP04712494A patent/EP1599453B1/de not_active Expired - Lifetime
- 2004-02-19 BR BRPI0407758-0A patent/BRPI0407758A/pt not_active IP Right Cessation
- 2004-02-19 JP JP2006501885A patent/JP2006519193A/ja active Pending
- 2004-02-19 WO PCT/EP2004/001578 patent/WO2004076426A1/de active Application Filing
- 2004-02-19 DK DK04712490T patent/DK1599452T3/da active
- 2004-02-19 AU AU2004215672A patent/AU2004215672B2/en not_active Ceased
- 2004-02-19 MX MXPA05008995A patent/MXPA05008995A/es active IP Right Grant
- 2004-02-19 RU RU2005129995/04A patent/RU2005129995A/ru not_active Application Discontinuation
- 2004-02-19 CN CNB2004800054379A patent/CN100439345C/zh not_active Expired - Fee Related
- 2004-02-19 RS YUP-2005/0594A patent/RS20050594A/sr unknown
- 2004-02-19 DE DE502004009453T patent/DE502004009453D1/de not_active Expired - Lifetime
- 2004-02-19 AT AT04712490T patent/ATE365159T1/de not_active IP Right Cessation
- 2004-02-19 PL PL377735A patent/PL377735A1/pl not_active Application Discontinuation
- 2004-02-19 CA CA002517386A patent/CA2517386A1/en not_active Abandoned
- 2004-02-19 PL PL378130A patent/PL378130A1/pl not_active Application Discontinuation
- 2004-02-19 ES ES04712490T patent/ES2287700T3/es not_active Expired - Lifetime
- 2004-02-19 MX MXPA05008951A patent/MXPA05008951A/es active IP Right Grant
- 2004-02-19 RU RU2005129992/04A patent/RU2005129992A/ru not_active Application Discontinuation
- 2004-02-19 AT AT04712503T patent/ATE435217T1/de not_active IP Right Cessation
- 2004-02-19 AU AU2004215677A patent/AU2004215677B2/en not_active Ceased
- 2004-02-19 EP EP04712503A patent/EP1599455B1/de not_active Expired - Lifetime
- 2004-02-19 OA OA1200500248A patent/OA13035A/en unknown
- 2004-02-19 CA CA002517381A patent/CA2517381A1/en not_active Abandoned
- 2004-02-19 DE DE502004004139T patent/DE502004004139D1/de not_active Expired - Lifetime
- 2004-02-19 AU AU2004215673A patent/AU2004215673B2/en not_active Ceased
- 2004-02-19 BR BRPI0407814-4A patent/BRPI0407814A/pt not_active IP Right Cessation
- 2004-02-19 CA CA002516620A patent/CA2516620A1/en not_active Abandoned
- 2004-02-19 ES ES04712503T patent/ES2329366T3/es not_active Expired - Lifetime
- 2004-02-19 KR KR1020057016023A patent/KR20050106462A/ko not_active Application Discontinuation
- 2004-02-19 OA OA1200500247A patent/OA13034A/en unknown
- 2004-02-19 CN CNB2004800054985A patent/CN100398526C/zh not_active Expired - Fee Related
- 2004-02-25 TW TW093104705A patent/TW200510352A/zh unknown
- 2004-02-25 TW TW093104704A patent/TW200500349A/zh unknown
- 2004-02-25 TW TW093104697A patent/TW200508210A/zh unknown
- 2004-02-27 US US10/788,996 patent/US7259177B2/en active Active
- 2004-02-27 PE PE2004000206A patent/PE20040959A1/es not_active Application Discontinuation
- 2004-02-27 US US10/789,017 patent/US7335671B2/en active Active
- 2004-02-27 CL CL200400391A patent/CL2004000391A1/es unknown
- 2004-02-27 US US10/788,997 patent/US7365084B2/en not_active Expired - Fee Related
- 2004-02-27 PE PE2004000205A patent/PE20050293A1/es not_active Application Discontinuation
- 2004-02-27 UY UY28209A patent/UY28209A1/es unknown
- 2004-02-27 PE PE2004000203A patent/PE20050292A1/es not_active Application Discontinuation
- 2004-02-27 AR ARP040100635A patent/AR043432A1/es not_active Application Discontinuation
- 2004-02-27 UY UY28210A patent/UY28210A1/es unknown
- 2004-02-27 PA PA20048596801A patent/PA8596801A1/es unknown
- 2004-02-27 AR ARP040100636A patent/AR043433A1/es not_active Application Discontinuation
- 2004-02-27 AR ARP040100629A patent/AR043427A1/es not_active Application Discontinuation
- 2004-02-27 CL CL200400392A patent/CL2004000392A1/es unknown
- 2004-06-09 SA SA04250153A patent/SA04250153A/ar unknown
-
2005
- 2005-07-19 ZA ZA200505765A patent/ZA200505765B/en unknown
- 2005-07-19 ZA ZA200505768A patent/ZA200505768B/en unknown
- 2005-08-16 IL IL170314A patent/IL170314A/en not_active IP Right Cessation
- 2005-08-16 IL IL170316A patent/IL170316A/en not_active IP Right Cessation
- 2005-08-26 MA MA28459A patent/MA27736A1/fr unknown
- 2005-08-26 EC EC2005005986A patent/ECSP055986A/es unknown
- 2005-08-26 TN TNP2005000204A patent/TNSN05204A1/en unknown
- 2005-08-26 MA MA28465A patent/MA27742A1/fr unknown
- 2005-08-26 TN TNP2005000206A patent/TNSN05206A1/en unknown
- 2005-08-26 MA MA28460A patent/MA27737A1/fr unknown
- 2005-08-26 HR HR20050743A patent/HRP20050743A2/xx not_active Application Discontinuation
- 2005-08-26 CO CO05085499A patent/CO5690578A2/es not_active Application Discontinuation
- 2005-08-26 HR HR20050742A patent/HRP20050742A2/xx not_active Application Discontinuation
- 2005-08-26 HR HR20050744A patent/HRP20050744A2/xx not_active Application Discontinuation
- 2005-08-26 EC EC2005005985A patent/ECSP055985A/es unknown
- 2005-08-26 CO CO05085508A patent/CO5690580A2/es not_active Application Discontinuation
- 2005-09-22 NO NO20054408A patent/NO20054408L/no unknown
- 2005-09-22 NO NO20054396A patent/NO20054396L/no unknown
- 2005-09-22 NO NO20054398A patent/NO20054398L/no unknown
-
2007
- 2007-08-16 US US11/839,950 patent/US20080015238A1/en not_active Abandoned
-
2008
- 2008-01-14 US US12/013,806 patent/US7872034B2/en not_active Expired - Fee Related
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000064876A1 (en) * | 1999-04-28 | 2000-11-02 | Aventis Pharma Deutschland Gmbh | Tri-aryl acid derivatives as ppar receptor ligands |
| WO2002100403A1 (en) * | 2001-06-07 | 2002-12-19 | Eli Lilly And Company | Modulators of peroxisome proliferator activated receptors (ppar) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006015716A2 (de) * | 2004-08-07 | 2006-02-16 | Sanofi-Aventis Deutschland Gmbh | Verfahren zur herstellung der enantiomeren formen von cis-konfigurierten 3-hydroxycyclohexancarbonsäure-derivaten unter verwendung von hydrolasen |
| WO2006015716A3 (de) * | 2004-08-07 | 2006-06-22 | Sanofi Aventis Deutschland | Verfahren zur herstellung der enantiomeren formen von cis-konfigurierten 3-hydroxycyclohexancarbonsäure-derivaten unter verwendung von hydrolasen |
| WO2006066694A1 (de) * | 2004-12-15 | 2006-06-29 | Sanofi-Aventis Deutschland Gmbh | VERFAHREN ZUR HERSTELLUNG VON OXAZOLEN DURCH KONDENSATION VON AROMATISCHEN ALDEHYDEN MIT α-KETOXIMEN ZU N-OXIDEN UND NACHFOLGENDE REAKTION MIT AKTIVIERTEN SÄUREDERIVATEN |
| US7544809B2 (en) | 2004-12-15 | 2009-06-09 | Sanofi-Aventis Deutschland Gmbh | Method for the preparation of oxazoles by condensing aromatic aldehydes with α-ketoximes to form n-oxides and reacting same with activated acid derivatives |
| US7825144B2 (en) | 2004-12-15 | 2010-11-02 | Sanofi-Aventis Deutschland Gmbh | Method for the production of oxazoles by condensing aromatic aldehydes with α-ketoximes to N-oxides and then reacting the same with activated acid derivatives |
| WO2007039177A2 (en) | 2005-09-29 | 2007-04-12 | Sanofi-Aventis | Phenyl- and pyridinyl- 1, 2 , 4 - oxadiazolone derivatives, processes for their preparation and their use as pharmaceuticals |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1789403B1 (de) | N-(phenyl-oxazol-4-ylmethoxymethyl)-cyclohexyl-bernsteinsäureamid derivate und verwandte verbindungen als ppar-liganden (peroxisomen-proliferatoren-aktivierte rezeptoren) zur behandlung von hyperlipidämie und diabetes | |
| EP1599453B1 (de) | 3-methyl-2- (3- (2-phenyl-oxazol-4-ylmethoxy)-cyclohexancarbonyl-amino)-buttersäurederivate und verwandte verbindungen als ppar modulatoren zur behandlung von typ 2 diabetes und atherosklerose | |
| EP1599454B1 (de) | Diarylcycloalkylderivate, verfahren zu ihrer herstellung und ihre verwendung als arzneimittel | |
| EP1599203B1 (de) | 1,3-substituierte cycloalkylderivate mit sauren, meist heterocyclischen gruppen; verfahren zu ihrer herstellung und ihre verwendung als arzneimittel | |
| AU2004215675B2 (en) | Arylcycloalkyl derivatives with branched side chains as PPAR receptor modulators, method for their production and their use as medicaments | |
| EP1599443B1 (de) | Cycloalkyl substituierte alkansaürederivate, verfahren zu ihrer herstellung und ihre anwendung als arzneimittel | |
| DE102005029382B3 (de) | Alkoxymethylyl-substituierte Benzoesäurederivate, Verfahren zu ihrer Herstellung und ihre Anwendung als Arzneimittel | |
| EP1789402B1 (de) | 2-{-3-¬2-(phenyl)-oxazol-4-ylmethoxymethyl -cyclohexylmethoxy}-propionsäure derivate als ppar-liganden (peroxisomen-proliferatoren-aktivierte rezeptoren) zur behandlung von hyperlipidämie und diabetes | |
| EP1601671B1 (de) | Cycloalkylderivate mit bioisosteren carbonsäure - gruppen, verfahren zu ihrer herstellung und ihre verwendung als arzneimittel | |
| EP1778655B1 (de) | 2-{-3-'2-(phenyl)-oxazol-4-ylmethoxy!-cyclohexylmethoxy}-propionsäure derivate als ppar-liganden (peroxisomen-proliferatoren-aktivierte rezeptoren) zur behandlung von hyperlipidämie und diabetes |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WWE | Wipo information: entry into national phase |
Ref document number: P-2005/0594 Country of ref document: YU |
|
| AK | Designated states |
Kind code of ref document: A1 Designated state(s): AE AG AL AM AT AU AZ BA BB BG BR BW BY BZ CA CH CN CO CR CU CZ DE DK DM DZ EC EE EG ES FI GB GD GE GH GM HR HU ID IL IN IS JP KE KG KP KR KZ LC LK LR LS LT LU LV MA MD MG MK MN MW MX MZ NA NI NO NZ OM PG PH PL PT RO RU SC SD SE SG SK SL SY TJ TM TN TR TT TZ UA UG US UZ VC VN YU ZA ZM ZW |
|
| AL | Designated countries for regional patents |
Kind code of ref document: A1 Designated state(s): BW GH GM KE LS MW MZ SD SL SZ TZ UG ZM ZW AM AZ BY KG KZ MD RU TJ TM AT BE BG CH CY CZ DE DK EE ES FI FR GB GR HU IE IT LU MC NL PT RO SE SI SK TR BF BJ CF CG CI CM GA GN GQ GW ML MR NE SN TD TG |
|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application | ||
| DPEN | Request for preliminary examination filed prior to expiration of 19th month from priority date (pct application filed from 20040101) | ||
| WWE | Wipo information: entry into national phase |
Ref document number: 200505767 Country of ref document: ZA |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 1-2005-501338 Country of ref document: PH |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 170162 Country of ref document: IL |
|
| WWE | Wipo information: entry into national phase |
Ref document number: KE |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2004712494 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2516620 Country of ref document: CA |
|
| WWE | Wipo information: entry into national phase |
Ref document number: PA/a/2005/008951 Country of ref document: MX Ref document number: CR2005-007957 Country of ref document: CR |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 542030 Country of ref document: NZ Ref document number: 2043/CHENP/2005 Country of ref document: IN |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 378437 Country of ref document: PL Ref document number: 2006501885 Country of ref document: JP Ref document number: 1020057016023 Country of ref document: KR Ref document number: 2004215672 Country of ref document: AU Ref document number: 05085511 Country of ref document: CO Ref document number: P20050742A Country of ref document: HR |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 20048054985 Country of ref document: CN |
|
| ENP | Entry into the national phase |
Ref document number: 2004215672 Country of ref document: AU Date of ref document: 20040219 Kind code of ref document: A |
|
| WWP | Wipo information: published in national office |
Ref document number: 2004215672 Country of ref document: AU |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 1200501408 Country of ref document: VN |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2005130002 Country of ref document: RU |
|
| WWP | Wipo information: published in national office |
Ref document number: 1020057016023 Country of ref document: KR |
|
| WWP | Wipo information: published in national office |
Ref document number: 2004712494 Country of ref document: EP |
|
| ENP | Entry into the national phase |
Ref document number: PI0407814 Country of ref document: BR |