EP0349935B1 - Wässrige Lösungen von Polyamidoamin-Epichlorhyrin-Harzen, Verfahren zu ihrer Herstellung und ihre Verwendung - Google Patents
Wässrige Lösungen von Polyamidoamin-Epichlorhyrin-Harzen, Verfahren zu ihrer Herstellung und ihre Verwendung Download PDFInfo
- Publication number
- EP0349935B1 EP0349935B1 EP89112049A EP89112049A EP0349935B1 EP 0349935 B1 EP0349935 B1 EP 0349935B1 EP 89112049 A EP89112049 A EP 89112049A EP 89112049 A EP89112049 A EP 89112049A EP 0349935 B1 EP0349935 B1 EP 0349935B1
- Authority
- EP
- European Patent Office
- Prior art keywords
- resin
- acid
- epichlorohydrin
- polyamidoamine
- reaction
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Classifications
-
- D—TEXTILES; PAPER
- D21—PAPER-MAKING; PRODUCTION OF CELLULOSE
- D21H—PULP COMPOSITIONS; PREPARATION THEREOF NOT COVERED BY SUBCLASSES D21C OR D21D; IMPREGNATING OR COATING OF PAPER; TREATMENT OF FINISHED PAPER NOT COVERED BY CLASS B31 OR SUBCLASS D21G; PAPER NOT OTHERWISE PROVIDED FOR
- D21H17/00—Non-fibrous material added to the pulp, characterised by its constitution; Paper-impregnating material characterised by its constitution
- D21H17/20—Macromolecular organic compounds
- D21H17/33—Synthetic macromolecular compounds
- D21H17/46—Synthetic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds
- D21H17/54—Synthetic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds obtained by reactions forming in the main chain of the macromolecule a linkage containing nitrogen
- D21H17/55—Polyamides; Polyaminoamides; Polyester-amides
-
- D—TEXTILES; PAPER
- D21—PAPER-MAKING; PRODUCTION OF CELLULOSE
- D21H—PULP COMPOSITIONS; PREPARATION THEREOF NOT COVERED BY SUBCLASSES D21C OR D21D; IMPREGNATING OR COATING OF PAPER; TREATMENT OF FINISHED PAPER NOT COVERED BY CLASS B31 OR SUBCLASS D21G; PAPER NOT OTHERWISE PROVIDED FOR
- D21H21/00—Non-fibrous material added to the pulp, characterised by its function, form or properties; Paper-impregnating or coating material, characterised by its function, form or properties
- D21H21/14—Non-fibrous material added to the pulp, characterised by its function, form or properties; Paper-impregnating or coating material, characterised by its function, form or properties characterised by function or properties in or on the paper
- D21H21/18—Reinforcing agents
- D21H21/20—Wet strength agents
Definitions
- US Pat. No. 3,352,833 describes, inter alia, an alkaline aftertreatment of polyamidoamine-epichlorohydrin resins for reactivating the wet strength activity.
- the acidified resin solutions are then reacted with 0.25 to 2.5 equivalents of base per equivalent of acid in aqueous solution.
- the base is added before using the resin for papermaking, and the resin solution is left to age for four hours and then used immediately.
- the reworking of the alkaline aftertreatment specified in this US patent shows that this does not result in resin solutions which are sufficiently stable in storage and / or low in chlorine (cf. the comparative experiments which follow below).
- reaction products from epihalohydrin and polyamidoamines are already known from EP-A-0 131 200, the polyamidoamines being reaction products from dicarboxylic acids, aliphatic polyamines and monoalkanolamines. An alkaline aftertreatment of these reaction products is not mentioned.
- the present invention now relates to a storage-stable, aqueous solution of a water-dilutable polyamidoamine-epichlorohydrin resin (A) obtained by converting a water-dilutable, basic polyamidoamine (B), consisting of an acid component (B1), and an amine component (B2), with epichlorohydrin (C), in an aqueous system and in a ratio of 0.6 to 2 moles per mole of basic (with (C) reactive) amino groups of the polyamidoamine (B), addition of a base (D) at 25 to 95 ° C, optionally after prior acidification of the reaction system that the pH is above 8, and subsequent addition of acid to one pH value of at most 7, the content of organically bound chlorine in the resin (A) being at most 4% by weight and the component (B2) consisting of a mixture of one or more polyamines and alkanolamines.
- A water-dilutable polyamidoamine-epichlorohydrin resin
- the invention relates to a process for the preparation of these resin solutions and their use.
- stable in storage is intended here to mean that no noticeable gelation or precipitation occurs during storage for at least three months at room temperature (or for at least 10 days at 50 ° C.).
- solution is also intended to include a colloidal solution.
- the pH of the resin solution according to the invention is preferably between 1.5 and 5.
- the viscosity of a 12.5% solution at 25 ° C. is generally about 10 to 200, preferably 15 to 80 mPa.s.
- the content of resin (A) in the solution according to the invention is generally between 8 and 25% by weight, preferably 10 and 15% by weight, based on the solution.
- this resin solution contains small amounts of inorganic substances (from the base treatment and the subsequent neutralization) and optionally up to 0.5% by weight, preferably 0.05 to 0.2% by weight, of antifungal agents, such as sorbic acid or Potassium sorbate and optionally other additives, such as, for example Defoaming agent.
- antifungal agents such as sorbic acid or Potassium sorbate
- other additives such as, for example Defoaming agent.
- the resin (A) generally has an average molecular weight M n of at least 500, preferably of at least 1000 and in particular of 1000 to 500,000.
- the content of organically bound chlorine is generally between 0.1 and 4, preferably between 1 and 4 and in particular between 1 and 3% by weight. In a 12.5% resin solution, this chlorine content does not exceed 0.5% by weight and is generally between 0.0125 and 0.5, preferably between 0.125 and 0.5 and in particular between 0.125 to 0.375% by weight, based on the solution.
- the amount of units in (A) derived from the epichlorohydrin is generally 20 to 50% by weight, preferably 30 to 40% by weight, based on (A).
- the process according to the invention for the preparation of the resin solutions described above is characterized in that water-soluble, basic polyamidoamines (B) are reacted with epichlorohydrin (C) in a ratio of 0.6 to 2 moles per mole of basic amino groups of the polyamidoamine (B) in an aqueous system brings, and then, optionally after prior acidification of the reaction system, with as much a base (D), generally 0.1 to 1.0 mol, preferably 0.1 to 0.6 mol per mol of epichlorohydrin used, at 25 to 95 ° C converts that the pH is greater than 8, then adjusts the pH to at most 7 by adding acid.
- a base generally 0.1 to 1.0 mol, preferably 0.1 to 0.6 mol per mol of epichlorohydrin used, at 25 to 95 ° C converts that the pH is greater than 8, then adjusts the pH to at most 7 by adding acid.
- the water-soluble polyamidoamine (B) generally has an average molecular weight M n (determined via the carboxyl end groups) of at least 500, preferably at least 1000 and in particular 2000 to 20,000; the amine number is usually between 200 and 400, preferably between 250 and 350 mg KOH / g and the acid number between 0 and 50, preferably 10 and 30 mg KOH / g.
- Polyamidoamines (B) which meet the conditions according to the invention are, for example, in DE-AS 1,777,824, GB-PS 865,727, US-PS 4,075,177 and 4,336,835, DE-OS 3,323,732 and EP -OS 31 899 described, to which reference is made here.
- the corresponding products according to DE-OS 3,323,732 are preferred insofar as they come under the present framework.
- polyamidoamines (B) are obtained by reacting the acid component (B1), such as dicarboxylic acids or their functional derivatives, and ⁇ -aminocarboxylic acids or their lactams with the amine component (B2), such as polyamines, these being present in a mixture with alkanolmonoamines if ( B1) meets the conditions mentioned above.
- These polyamines contain at least two primary amino groups and preferably at least one secondary and / or tertiary amino group.
- the quantity ratio of the components is to be chosen so that in the resulting polyamidoamine (B) there is still a sufficient number of basic (ie reactive with epichlorohydrin (C)) amino groups, no gelation occurs during the reaction and the molecular weight of (A) in the specified range.
- Reaction products of type 1) using diethylene triamine, triethylene tetramine and tetraethylene pentamine as polyamine and 2-aminoethanol as alkanol monoamine are particularly preferred.
- polyamines b1) are called methyl bis (3-aminopropyl) amine, ethyl bis (3-aminopropyl) amine, N- (3-aminopropyl) tetramethylene diamine, N, N'-bis (3-aminopropyl) tetramethylene diamine, Polyalkylene polyamines such as di-propylene- (1,2) -triamine, bis- (3-aminopropyl) -amine, tripropylene- (1,2) -tetramine and especially diethylene triamine, triethylene tetramine and tetraethylene pentamine.
- Polyamines c1) are, for example: ethylenediamine, propylenediamine, 1-amino-3-methylamino-propane, 2-methylpentamethylene diamine, pentane methylene diamine, hexamethylene diamine, trimethyl hexamethylene diamine, neopentyl diamine, octamethylene diamine, dioxadodecane diamine, cyclialiphatic diamines such as 1,2-, 1,3- or 1,4-cyclohexane diamine; 4,4'-methylene-bis-cyclohexylamine, isophoronediamine, menthandiamine, 4,4'-diamino-3,3'-dimethyl-di-cyclohexylmethane, 3-aminomethyl-1- (3-aminopropyl-1-methyl) -4 -methylcyclohexane, N-methylethylenediamine, N-aminoethylpiperazine, 1,3-bis
- alkanol monoamines are those of the formula H2N-R1-OH (II) suitable in which R1 has the above meaning, such as 2-aminoethanol, 1-amino-2-propanol, 3-amino-1-propanol, 2-amino-1-butanol, 4-amino-1-butanol, 5-amino -1-pentanol, 6-amino-1-hexanol and their isomers, the hydrocarbon radical of which is branched or which carry the amino group and / or the hydroxyl group on a primary or secondary carbon atom; furthermore those which are derived from cyclic hydrocarbon radicals, preferably having 5-7 carbon atoms.
- the molar amount of dicarboxylic acid or its functional derivatives to polyamine / alkanol monoamine is such that the ratio of carboxyl groups to the sum of primary NH2 groups 1: (0.8-1.4), preferably 1: (0, 95-1.1).
- the ratio of their molar amounts is 0.6: 0.4 to 0.99: 0.01, preferably 0.8: 0.2 to 0.95: 0.05.
- the polyamidoamines (B) can be prepared in the customary manner, for example by heating the for several hours corresponding components with the exclusion of oxygen at temperatures of 125 to 250 ° C, preferably from 140 to 180 ° C, first under ordinary pressure and then under reduced pressure, with a small amount of hydrazine hydrate or hydrazides can be added to avoid the darkening of the polyamides.
- the reaction time depends on the temperatures and pressures used and is generally between 4 and 10 hours.
- dichlorohydrin (1,3-dichloro-2-hydroxypropane) can optionally also be used.
- Bases (D) which can be used include: alkali metal hydroxides, preferably sodium and potassium hydroxide, carbonates, bicarbonates, alkaline earth metal hydroxides, such as calcium hydroxide, furthermore benzyltrimethylammonium hydroxide, tetramethylammonium hydroxide, tetraethylammonium hydroxide or corresponding mixtures.
- the reaction products can be prepared by the process according to the invention in such a way that the polyamidoamines (B) and epichlorohydrin (C) are in a first reaction step at a concentration of the reactants of about 25 to 50%, preferably 35 to 45% and at one Temperature between 25 and 95 ° C, preferably 40 to 70 ° C, until it can react until the viscosity of a 40% solution (determined at 25 ° C) is about 100 to 600, preferably 200 to 400 mPa.s.
- This solution is then set in a second reaction step with an aqueous solution of a base (D) which is used in an amount of generally 0.1 to 1.0, preferably 0.1 to 0.6, mol per mol of epichlorohydrin (C) is contained, at a concentration of the reactants of 10 to 40%, preferably 15 to 25%, and a temperature between 25 to 95 ° C, preferably 40 to 70 ° C, until the viscosity a 12.5% solution (determined at 25 ° C.) is 10-200 mPa.s, preferably 15 to 80 mPa.s.
- the pH in this second reaction step is greater than 8, preferably between 9 and 12.
- the mixture is expediently added to the mixture in order to terminate the action and to stabilize the self-crosslinking reaction products, so much acid or acid derivatives that the pH the aqueous solution is 1 to 7, preferably between 1.5 and 5, and adjusts the solids content of the reaction solution to 8 to 25% by weight by dilution with water.
- acid can be added to the solution during or after the reaction of polyamidoamine (B) and epichlorohydrin (C) and the pH can be adjusted to less than 7, preferably 1.5 and 5.
- Sufficient base (D) is then added to this acidic reaction mixture such that the pH is greater than 8, preferably between 9 and 12, and this system is then used for a period of 0.5 to 8 hours, preferably 1 to 4 hours at a temperature of 25 to 95 ° C, preferably 40 to 70 ° C.
- Halogen-free acids such as sulfuric, phosphoric or acetic acid are particularly suitable as acids and corresponding anhydrides or acidic salts as acid derivatives.
- the amount of epichlorohydrin (C) is generally 0.6 to 2 mol, preferably 1.0 to 1.4 mol, per mol of basic amino groups (primary, secondary or tertiary) in the polyamidoamine (B) and the amount of base (D) 0.1 to 1.0 mol, preferably 0.1 to 0.6 mol, per mol of epichlorohydrin used.
- the resins or resin solutions according to the invention have a considerably lower level than the previously known reaction products of polyamidoamine and epichlorohydrin organically bound chlorine content and are therefore ideally suited to significantly reduce the organic chlorine content of wastewater, including paper mills.
- the reaction products which have hitherto been used to improve the wet strength effectiveness of paper do not possess this valuable property to the same extent. Due to the high storage stability of the resin solutions according to the invention, their wet strength effectiveness remains constant even after months of storage.
- the wet strength of paper - including paper made from unbleached cellulose - can be outstandingly improved. In some cases, depending on the type of paper or as desired, it is also possible to increase the absorbency. It is noteworthy that the reaction products practically do not affect the whiteness of paper made from bleached pulp. It should also be mentioned that the speed at which the reaction products to be used according to the invention crosslink on the paper or in the pulp is high and that the reaction products are also used as retention aids for fillers used in papermaking, drainage aids to improve the papermaking speed and flocculants to remove fine particles Particles from dirty water, for example industrial waste water, can be used.
- the resins in question in the form of aqueous solutions to the aqueous suspension of the paper raw material before processing into paper.
- the amounts of resin required to achieve the desired wet strength can be determined by Determine preliminary tests without difficulty.
- the polyamidoamine was diluted with 570 g of water.
- the solution had a solids content of 59.8% (1 g, 1 hour, 125 ° C.) and a viscosity at 25 ° C. of 1174 mPa.s.
Description
- Aus der DE-Auslegeschrift 1.177.824 ist es bekannt, Polyamine mit mindestens drei Aminogruppen mit C₃- C₁₀-Dicarbonsäuren umzusetzen und die so erhaltenen Polyamide mit Epichlorhydrin in wasserlösliche Kondensationsprodukte zu überführen. Dabei kann das Epichlorhydrin in einem Molverhältnis zu den sekundären Aminogruppen des Polyamids von etwa (0,5 bis 1,8) : 1 verwendet werden. Die gewonnenen Produkte können zur Verbesserung der Naßfestigkeit von Papier eingesetzt werden.
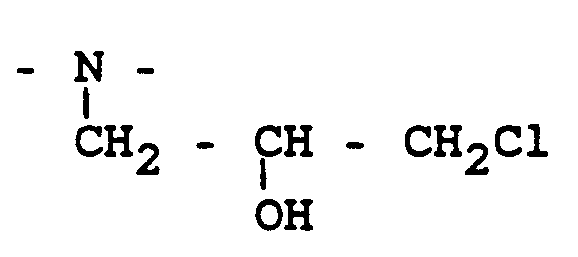
- Weiterhin ist bekannt (z.B. aus der britischen Patentschrift 865.727), daß solche wäßrigen Kondensationsprodukte, hergestellt aus Polyamidoaminen und Epichlorhydrin, unter anderem Chlorhydrin-Struktureinheiten der Formel
enthalten. Demzufolge können Polyamidoamin-Epichlorhydrin-Harze einen erheblichen Anteil an organisch gebundenem Chlor aufweisen. Durch Umweltschutzauflagen ist es nunmehr aber erforderlich, Produkte mit einem möglichst niedrigen organisch gebundenem Chlorgehalt bereitzustellen. - In der US-Patentschrift 3.352.833 wird unter anderem auch eine alkalische Nachbehandlung von Polyamidoamin-Epichlorhydrin-Harzen zur Reaktivierung der Naßfestwirksamkeit beschrieben. Danach werden die sauer eingestellten Harzlösungen mit 0,25 bis 2,5 Equivalent Base pro Equivalent Säure in wäßriger Lösung zur Reaktion gebracht. Nach Beispiel 10 der US-Patentschrift 3.352.833 wird die Base vor der Verwendung des Harzes zur Papierherstellung zugegeben, und die Harzlösung vier Stunden altern gelassen und dann sofort verwendet.
Angaben über den Abbau des organisch gebundenen Chlors finden sich in diesen Druckschriften nicht. Die Nacharbeitung der in dieser US-Patentschrift angegebenen alkalischen Nachbehandlung zeigt jedoch, daß dabei keine ausreichend lagerstabilen und/oder ausreichend chlorarmen Harzlösungen entstehen (vgl. die weiter unten folgenden Vergleichsversuche). Ein weiterer Nachteil dieser Alkali-Aktivierung vor der Verarbeitung, beispielsweise in der Papiemasse, sind die zusätzlichen betrieblichen Einrichtungen wie Behälter, Rührwerke und Dosiereinrichtungen, die diese Methode erfordert. Zur optimalen Verwendung der alkalisch zu aktivierenden Polyamidoamin-Epichlorhydrin-Harze ist es außerdem nötig, die Alkalizugaben genau zu dosieren, bestimmte Standzeiten einzuhalten und wegen einer eintretenden Lagerstabilitätsverminderung der alkalischen Lösung diese innerhalb eines bestimmten Zeitraumes zu verbrauchen. - Aus EP-A-0 131 200 sind bereits Reaktionsprodukte aus Epihalogenhydrin und Polyamidoaminen bekannt, wobei die Polyamidoamine Umsetzungsprodukte sind aus Dicarbonsäuren, aliphatischen Polyaminen und Monoalkanolaminen. Eine alkalische Nachbehandlung dieser Reaktionsprodukte ist nicht erwähnt.
- Das nicht-vorveröffentlichte Dokument EP-A-0 282 862 beschreibt Reaktionsprodukte der gleichen Art einschließlich der alkalischen Nachbehandlung. Die hier beschriebenen Reaktionsprodukte sind jedoch nicht durch Einbau von Monoalkanolaminen modifiziert.
- Die vorliegende Erfindung betrifft nunmehr eine lagerstabile, wäßrige Lösung eines wasserverdünnbaren Polyamidoamin-Epichlorhydrin-Harzes (A), erhalten durch Umsatz eines wasserverdünnbaren, basischen Polyamidoamins (B), bestehend aus einer Säurekomponente (B₁), und einer Aminkomponente (B₂), mit Epichlorhydrin (C), in einem wäßrigen System und in einem Verhältnis von 0,6 bis 2 Mol pro Mol basischer (mit (C) reaktiver) Aminogruppen des Polyamidoamins (B), Zugabe einer Base (D) bei 25 bis 95 °C, gegebenenfalls nach vorheriger Ansäuerung des Reaktionssystems, daß der pH-Wert oberhalb 8 liegt, und anschließende Zugabe von Säure auf einen pH-Wert von höchstens 7, wobei der Gehalt an organisch gebundenem Chlor in dem Harz (A) höchstens 4 Gew.-% beträgt und wobei die Komponente (B₂) aus einem Gemisch aus einem oder mehreren Polyaminen und Alkanolaminen besteht.
- Weiterhin bezieht sich die Erfindung auf ein Verfahren zur Herstellung dieser Harz-Lösungen sowie deren Verwendung.
- Das Merkmal "lagerstabil" soll hierbei bedeuten, daß während einer Lagerung von mindestens drei Monaten bei Raumtemperatur (oder von mindestens 10 Tagen bei 50°C) keine merkliche Gelierung oder Ausfällung eintritt.
- Der Begriff "Lösung" soll hier auch eine kolloidale Lösung miteinschließen.
- Der pH-Wert des erfindungsgemäßen Harzlösung liegt vorzugsweise zwischen 1,5 und 5. Die Viskosität einer 12,5-%igen Lösung beträgt bei 25°C im allgemeinen etwa 10 bis 200, vorzugsweise 15 bis 80 mPa.s.
- Der Gehalt an Harz (A) in der erfindungsgemäßen Lösung liegt im allgemeinen zwischen 8 und 25 Gew.-%, vorzugsweise 10 und 15 Gew.-%, bezogen auf die Lösung.
- Daneben enthält diese Harzlösung geringe Mengen an anorganischen Stoffen (von der Basenbehandlung und der anschließenden Neutralisation) sowie gegebenenfalls bis 0,5 Gew.-%, vorzugsweise 0,05 bis 0,2 Gew.-%, an antifungizid wirkenden Mitteln, wie Sorbinsäure bzw. Kaliumsorbat sowie gegebenenfalls weitere Additive, wie z.B. Entschäumungsmittel.
- Das Harz (A) besitzt im allgemeinen ein mittleres Molekulargewicht
M n von mindestens 500, vorzugsweise von mindestens 1000 und insbesondere von 1000 bis 500 000. Der Gehalt an organisch gebundenem Chlor liegt im allgemeinen zwischen 0,1 und 4, vorzugsweise zwischen 1 und 4 und insbesondere zwischen 1 und 3 Gew.-%. In einer 12,5 %igen Harzlösung übersteigt dieser Chlorgehalt nicht Werte von 0,5 Gew.-% und liegt im allgemeinen zwischen 0,0125 und 0,5, vorzugsweise zwischen 0,125 und 0,5 und insbesondere zwischen 0,125 bis 0,375 Gew.-%, bezogen auf die Lösung. - Die Menge an Einheiten in (A), die sich von dem Epichlorhydrin ableiten, beträgt im allgemeinen 20 bis 50 Gew.-%, vorzugsweise 30 bis 40 Gew.-%, bezogen auf (A).
- Das erfindungsgemäße Verfahren zur Herstellung vorstehend beschriebener Harzlösungen ist dadurch gekennzeichnet, daß man wasserlösliche, basische Polyamidoamine (B) mit Epichlorhydrin (C) in einem Verhältnis von 0,6 bis 2 Mol pro Mol basischer Aminogruppen des Polyamidoamins (B) in wäßrigem System zur Reaktion bringt, und dann, gegebenenfalls nach vorheriger Ansäuerung des Reaktionssystems, mit soviel einer Base (D), im allgemeinen 0,1 bis 1,0 Mol, vorzugsweise 0,1 bis 0,6 Mol pro Mol eingesetztes Epichlorhydrin, bei 25 bis 95°C umsetzt, daß der pH-Wert bei größer als 8 liegt, anschließend den pH-Wert durch Zugabe von Säure auf höchstens 7 einstellt.
- Das wasserlösliche Polyamidoamin (B) besitzt im allgemeinen ein mittleres Molekulargewicht
M n (bestimmt über die Carboxylendgruppen) von mindestens 500, vorzugsweise mindestens 1000 und insbesondere 2000 bis 20000; die Aminzahl liegt zumeist zwischen 200 und 400, vorzugsweise zwischen 250 und 350 mg KOH/g und die Säurezahl zwischen 0 und 50, vorzugsweise 10 und 30 mg KOH/g. - Polyamidoamine (B), welche die erfindungsgemäßen Bedingungen erfüllen, sind beispielsweise in der DE-AS 1.777.824, der GB-PS 865.727, den US-PSen 4.075.177 und 4.336.835, der DE-OS 3.323.732 und der EP-OS 31 899 beschrieben, auf die hier Bezug genommen wird.
Bevorzugt sind dabei die entsprechenden Produkte gemäß der DE-OS 3.323.732, soweit sie unter den vorliegenden Rahmen fallen. - Generell werden derartige Polyamidoamine (B) durch Umsetzung der Säurekomponente (B₁), wie Dicarbonsäuren oder deren funktionellen Derivaten sowie von ω-Aminocarbonsäuren oder deren Lactamen mit der Aminkomponente (B₂), wie Polyamine erhalten, wobei diese im Gemisch mit Alkanolmonoaminen vorliegen, falls (B₁) die weiter oben genannten Bedingungen erfüllt. Diese Polyamine enthalten dabei mindestens zwei primäre Aminogruppen und vorzugsweise mindestens eine sekundäre und/oder tertiäre Aminogruppe. Das Mengenverhältnis der Komponenten ist dabei so zu wählen, daß im resultierenden Polyamidoamin (B) noch eine genügende Zahl an basischen (d.h. mit Epichlorhydrin (C) reaktiven) Aminogruppen vorhanden ist, keine Gelierung bei der Reaktion eintritt und das Molekulargewicht von (A) in dem angegebenen Bereich liegt.
- Bei den Polyamidoaminen (B) handelt es sich beispielsweise um Umsetzungsprodukte von
- a) gesättigten oder olefinisch-ungesättigten aliphatischen C₃-C₁₀-Dicarbonsäuren oder deren funktionellen Derivaten bzw. mindestens 3 C-Atome enthaltenden ω-Aminocarbonsäuren oder deren Lactamen mit
- b1) aliphatischen Polyaminen, die mindestens zwei primäre und mindestens eine weitere, und zwar sekundäre und/oder tertiäre Aminogruppe enthalten, oder
- b2) einem Gemisch der Polyamine b1) mit
- c1) Polyaminen, die mindestens eine primäre und gegebenenfalls mindestens eine sekundäre Aminogruppe enthalten und nicht unter die Definition b1) fallen, wobei die zusätzlichen Polyamine in solchen Mengen verwendet werden können, daß deren Anteil an primären Aminogruppen, bezogen auf die Gesamtmenge der primären Aminogruppen, 70 %, vorzugsweise 50 % und insbesondere 30 % nicht übersteigt, und
- b3) Alkanolmonoaminen mit 2 bis 20 C-Atomen, vorzugsweise 2 bis 6 C-Atomen und 1 bis 3, vorzugsweise 1 oder 2 OH-Gruppen und insbesondere mit einer OH-Gruppe. Vorzugsweise besitzen diese Alkanolmonoamine die weiter unten angegebene Formel (II).
- Als wasserlösliche Polyamidoamine (B) kommen insbesondere in Betracht:
- 1. Umsetzungsprodukte von a) gesättigten aliphatischen C₃-C₁₀-Dicarbonsäuren, wie Bernsteinsäure, Glutarsäure, Adipinsäure, Sebazinsäure, Malonsäure oder deren funktionellen Derivaten, wie Anhydriden und Estern, wobei die drei erstgenannten Säuren bevorzugt sind, mit den vorstehend unter b) genannten Gemischen von Polyaminen mit Alkanolmonoaminen.
- 2. Umsetzungsprodukte von solchen gesättigten modifizierten Dicarbonsäuren bzw. deren Derivaten, die durch Anlagerung von aliphatischen, cycloaliphatischen, araliphatischen oder heterocyclischen Polyaminen, die mindestens zwei Aminogruppen, und zwar primäre und/oder sekundäre, enthalten, an α,β-olefinisch-ungesättigte Carbonsäureester, deren Alkoholrest 1 bis 8, vorzugsweise 1 bis 3 C-Atome hat, wie Acrylsäureethylester und Methacrylsäuremethylester, erhalten und dann mit den vorstehend unter b₁)/c₁) genannten Polyaminen bzw. deren Gemischen, gegebenenfalls in Abmischung mit Alkanolmonoaminen, umgesetzt werden.
- 3. Umsetzungsprodukte von mindestens drei Kohlenstoffatome enthaltenden ω-Aminocarbonsäuren oder deren Lactamen, z.B. 6-Aminocapronsäure und 8-Aminocaprylsäure bzw. 6-Caprolactam und 8-Capryllactam, mit den vorstehend unter b) genannten Gemischen von Polyaminen mit Alkanolmonoaminen.
- 4. Umsetzungsprodukte von olefinisch ungesättigten Dicarbonsäuren, wie Maleinsäure oder Fumarsäure bzw. deren funktionellen Derivaten, wie Anhydriden oder Estern, mit den vorstehend unter b₁)/c₁) genannten Polyaminen bzw. deren Gemischen, gegebenenfalls in Abmischung mit Alkanolmonoaminen.
- 5. Solche Umsetzungsprodukte, denen außer den unter 1. genannten gesättigten, aliphatischen C₃-C₁₀-Dicarbonsäuren und den unter 4. genannten ungesättigten Dicarbonsäuren noch ω-Aminocarbonsäuren oder deren Lactame des unter 3. angeführten Typs und außerdem unter b1) angeführten Polyaminen noch mindestens eine primäre und gegebenenfalls eine sekundäre Aminogruppe, also z.B. eine primäre oder eine sekundäre Aminogruppe, enthaltende aliphatische, cycloaliphatische, araliphatische oder heterocyclische Polyamine und Alkanolamine zugrunde liegen. Hierbei sind diejenigen Polyamidoamine zu bevorzugen, denen außer den vorstehend unter b₁)/c₁) genannten Polyaminen bzw. deren Gemischen, gegebenenfalls in Abmischung mit Alkanolmonoaminen und außer den gesättigten C₃-C₁₀-Dicarbonsäuren noch ω-Aminocarbonsäuren oder deren Lactame des unter 3. angeführten Typs zugrunde liegen.
- Umsetzungsprodukte vom Typ 1) unter Verwendung von Diethylentriamin, Triethylentetramin und Tetraethylenpentamin als Polyamin und 2-Aminoethanol als Alkanolmonoamin sind besonders bevorzugt.
-
- p
- Null oder eine ganze Zahl von 1 bis 6, vorzugsweise 1 bis 4 ist,
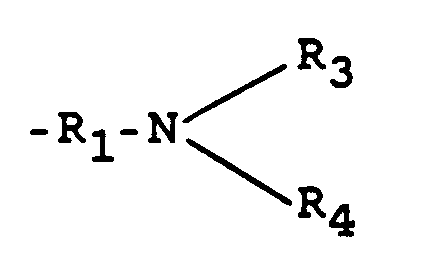
- R₁
- einen zweiwertigen, vorzugsweise nichtaromatischen Kohlenwasserstoffrest mit 2 bis 18 C-Atomen, vorzugsweise einen verzweigten oder unverzweigten Alkylenrest mit 2 bis 10 C-Atomen, insbesondere mit 2 bis 6 C-Atomen, oder einen Cycloalykylenrest mit 5 bis 12 C-Atomen, vorzugsweise 6 bis 10 C-Atomen, oder einen Aralkylenrest mit 7 bis 12 C-Atomen, vorzugsweise 8 bis 10 C-Atomen darstellt und
- R₂, R₂,
- unabhängig voneinander für H oder einer der beiden Reste für
- R₃, R₄
- entweder unabhängig voneinander für H, (C₁-C₂₀)Alkyl, vorzugsweise (C₁-C₆)Alkyl, stehen, wobei diese Alkylreste auch Hydroxygruppen tragen können.
- Als Polyamine b1) seien z.B. genannt Methyl-bis-(3-aminopropyl)-amin, Ethyl-bis-(3-aminopropyl)-amin, N-(3-Aminopropyl)-tetramethylendiamin, N,N'-Bis-(3-aminopropyl)-tetramethylendiamin, Polyalkylenpolyamine, wie Di-propylen-(1,2)-triamin, Bis-(3-amino-propyl)-amin, Tripropylen-(1,2)-tetramin und vor allem Diethylentriamin, Triethylentetramin und Tetraethylenpentamin.
- Polyamine c1) sind beispielsweise: Ethylendiamin, Propylendiamin, 1-Amino-3-methylamino-propan, 2-Methylpentamethylendiamin, Pentanethylendiamin, Hexamethylendiamin, Trimethylhexamethylendiamin, Neopentyldiamin, Octamethylendiamin, Dioxadodecandiamin, cyclialiphatische Diamine wie 1,2-, 1,3- oder 1,4-Cyclohexandiamin; 4,4'-Methylen-bis-cyclohexylamin, Isophorondiamin, Menthandiamin, 4,4'-Diamino-3,3'-dimethyl-di-cyclohexylmethan, 3-Aminomethyl-1-(3-aminopropyl-1-methyl)-4-methylcyclohexan, N-Methylethylendiamin, N-Aminoethylpiperazin, 1,3-Bis-aminomethylbenzol.
- Als Alkanolmonoamine sind z.B. solche der Formel
H₂N-R₁-OH (II)
geeignet, in der R₁ die obige Bedeutung hat, wie 2-Aminoethanol, 1-Amino-2-propanol, 3-Amino-1-propanol, 2-Amino-1-butanol, 4-Amino-1-butanol, 5-Amino-1-pentanol, 6-Amino-1-hexanol und deren Isomere, deren Kohlenwasserstoffrest verzweigt ist oder die die Aminogruppe und/oder die Hydroxylgruppe an einen primären oder sekundären C-Atom tragen; ferner solche, die sich von cyclischen Kohlenwasserstoffresten, vorzugsweise mit 5-7 C-Atomen, ableiten. - Die zur Erzielung wasserlöslicher Polyamidoamine (B) mit optimalen Eigenschaften einzuhaltenden Mengenverhältnisse der in Betracht kommenden Komponenten lassen sich durch Vorversuche leicht ermitteln. Im allgemeinen ist die Mol-Menge an Dicarbonsäure oder deren funktionelle Derivate zu Polyamin/Alkanolmonoamin so, daß das Verhältnis von Carboxylgruppen zu der Summe von primären NH₂-Gruppen 1: (0,8-1,4), vorzugsweise 1: (0,95-1,1) beträgt. Im Falle von Mischungen von Polyaminen und Alkanolmonoaminen liegt das Verhältnis ihrer Molmengen bei 0,6:0,4 bis 0,99:0,01, vorzugsweise 0,8:0,2 bis 0,95:0,05.
- Die Herstellung der Polyamidoamine (B) kann in üblicher Weise erfolgen, z.B. durch mehrstündiges Erhitzen der entsprechenden Komponenten unter Ausschluß von Sauerstoff auf Temperaturen von 125 bis 250°C, vorzugsweise von 140 bis 180°C, zunächst unter gewöhnlichem Druck und dann unter vermindertem Druck, wobei zur Vermeidung der Dunkelfärbung der Polyamide geringe Menge an Hydrazinhydrat oder Hydraziden zugesetzt werden können. Die Reaktionszeit hängt von den angewendeten Temperaturen und Drucken ab und liegt im allgemeinen zwischen 4 und 10 Stunden.
- Anstelle des Epichlorhydrins (B) kann gegebenenfalls auch das Dichlorhydrin (1,3-Dichlor-2-hydroxypropan) eingesetzt werden.
- Als Basen (D) können unter anderem eingesetzt werden: Alkalihydroxide, bevorzugt Natrium- und Kaliumhydroxid, Carbonate, Bicarbonate, Erdalkalihydroxide, wie Calciumhydroxid, weiterhin Benzyltrimethylammoniumhydroxid, Tetramethylammoniumhydroxid, Tetraethylammoniumhydroxid oder entsprechende Gemische.
- Die Herstellung der Reaktionsprodukte nach dem erfindungsgemäßen Verfahren kann in der Weise erfolgen, daß man die Polyamidoamine (B) und Epichlorhydrin (C) in einem ersten Reaktionsschritt bei einer Konzentration der Reaktionsteilnehmer von etwa 25 bis 50 %, vorzugsweise 35 bis 45 % und bei einer Temperatur zwischen 25 und 95°C, vorzugsweise 40 bis 70°C, solange reagieren läßt, bis die Viskosität einer 40 %igen Lösung (bestimmt bei 25°C) etwa 100 bis 600, vorzugsweise 200 bis 400 mPa.s beträgt. Anschließend setzt man diese Lösung in einem zweiten Reaktionsschritt mit einer wäßrigen Lösung einer Base (D), die in einer Menge von im allgemeinen 0,1 bis 1,0, vorzugsweise 0,1 bis 0,6 Mol pro Mol eingesetztes Epichlorhydrin (C) enthalten ist, bei einer Konzentration der Reaktionsteilnehmer von 10 bis 40 %, vorzugsweise 15 bis 25 %, und einer Temperatur zwischen 25 bis 95°C, vorzugsweise 40 bis 70°C, solange um, bis die Viskosität einer 12,5 %igen Lösung (bestimmt bei 25°C) 10-200 mPa.s, vorzugsweise 15 bis 80 mPa.s beträgt. Der pH-Wert in diesem zweiten Reaktionsschritt liegt bei größer als 8, vorzugsweise zwischen 9 und 12. Danach gibt man der Mischung zur Beendigung der Einwirkung und zur Stabilisierung der an sich selbstvernetzenden Reaktionsprodukte zweckmäßig so viel Säure oder Säurederivate zu, daß der pH-Wert der wäßrigen Lösung bei 1 bis 7, vorzugsweise zwischen 1,5 und 5 liegt, und stellt den Feststoffgehalt der Reaktionslösung durch Verdünnen mit Wasser auf 8 bis 25 Gew.-% ein.
- In einer anderen, weniger bevorzugten Ausführungsform kann man während oder nach der Umsetzung von Polyamidoamin (B) und Epichlorhydrin (C) der Lösung zunächst Säure zugeben und den pH-Wert auf kleiner als 7, vorzugsweise 1,5 und 5 einstellen. Diese saure Reaktionsmischung wird dann mit soviel an Base (D) versetzt, daß der pH-Wert bei größer als 8, vorzugsweise zwischen 9 und 12 liegt, und dieses System wird dann für eine Zeitdauer von 0,5 bis 8 Stunden, vorzugsweise 1 bis 4 Stunden bei einer Temperatur von 25 bis 95°C, vorzugsweise 40 bis 70°C gehalten.
- Als Säuren kommen vor allem halogenfreie Säuren, wie Schwefel-, Phosphor- oder Essigsäure in Betracht und als Säurederivate entsprechende Anhydride oder saure Salze.
- Die Menge an Epichlorhydrin (C) beträgt im allgemeinen 0,6 bis 2 Mol, vorzugsweise 1,0 bis 1,4 Mol pro Mol basischer Aminogruppen (primär, sekundär oder tertiär) im Polyamidoamin (B) und die Menge an Base (D) 0,1 bis 1,0 Mol, vorzugsweise 0,1 bis 0,6 Mol pro Mol eingesetztes Epichlorhydrin.
- Die erfindungsgemäßen Harze bzw. Harzlösungen weisen gegenüber den bisher bekannten Reaktionsprodukten aus Polyamidoamin und Epichlorhydrin einen erheblich geringeren organisch gebundenen Chlorgehalt auf und eignen sich deshalb in hervorragender Weise dazu, den organischen Chlorgehalt von Abwässern, u.a. von Papierfabriken, erheblich zu senken. Diese wertvolle Eigenschaft besitzen die Reaktionsprodukte, die bisher zur Verbesserung der Naßfestwirksamkeit von Papier verwendet worden sind, nicht in gleichem Umfang. Aufgrund der hohen Lagerstabiliät der erfindungsgemäßen Harzlösungen bleibt deren Naßfestwirksamkeit auch nach monatelanger Lagerung konstant.
- Mit Hilfe der nach dem erfindungsgemäßen Verfahren hergestellten Reaktionsprodukte gelingt es, die Naßfestigkeit von Papier - auch von Papier aus ungebleichtem Zellstoff - hervorragend zu verbessern. In manchen Fällen ist es - je nach Art des Papiers bzw. nach Wunsch - auch möglich, die Saugfähigkeit zu erhöhen. Bemerkenswert ist, daß die Reaktionsprodukte den Weißgrad von Papier, das aus gebleichtem Zellstoff hergestellt ist, praktisch nicht beeinträchtigen. Erwähnt sei ferner, daß die Geschwindigkeit, mit der die erfindungsgemäß zu verwendenden Reaktionsprodukte auf dem Papier bzw. im Zellstoff vernetzen, hoch ist und daß die Reaktionsprodukte auch als Retentionshilfsmittel für bei der Papierherstellung verwendete Füllstoffe, Drainagehilfsstoffe zur Verbesserung der Papierherstellungsgeschwindigkeit und Flockungsmittel zur Entfernung feiner Teilchen aus Schmutzwasser, zum Beispiel industriellem Abwasser, verwendet werden können.
- Um die Naßfestigkeit von Papier gemäß der vorliegenden Erfindung zu erhöhen, kann man beispielsweise so vorgehen, daß man die in Betracht kommenden Harze in Form wäßriger Lösungen bereits der wäßrigen Suspension des Papierrohstoffes vor der Verarbeitung zu Papier zusetzt. Die Mengen an Harz, die zur Erzielung der gewünschten Naßfestigkeit erforderlich sind, lassen sich durch Vorversuche ohne Schwierigkeiten ermitteln. Im allgemeinen empfiehlt es sich, 0,05 bis 2, vorzugsweise 0,1 bis 1,6 Gew.-Teile Festharz auf 100 Gew.-Teile Papierrohstoff einzusetzen, zweckmäßig in Form einer wäßrigen Lösung, deren Gehalt an Reaktionsprodukten 8 bis 25, vorzugsweise 10 bis 15 Gew.-% beträgt.
- Die folgenden Beispiele sollen die Erfindung näher veranschaulichen. Sofern nicht anders angegeben, bedeutet Prozent Gewichtsprozente. Der organische Chlorgehalt wurde aus der Differenz des nach der Verbrennungsmethode von Wickbold (Bezugsvorschriften: DIN 53 188, Abs. 13 und DIN 53 474, Abs. 5.5; 6.3) ermittelten Chlorgehaltes und dem ionischen Chlorgehalt bestimmt.
- 392 g Diethylentriamin (3,8 Mol) und 24,4 g (0,4 Mol) 2-Amino-ethanol wurden in einen Vierhalskolben, der mit Rührer, Thermometer und Destillationsapparatur versehen war, gefüllt und innerhalb von 30 Minuten 584 g Adipinsäure (4 Mol) portionsweise zugegeben, so daß die Temperatur nicht über 100°C stieg. Dann wurde unter Stickstoff in 3 Stunden auf 150°C geheizt, eine Stunde bei dieser Temperatur gehalten und weiter auf 170°C erwärmt, wobei das gebildete Wasser gleichmäßig herausdestillierte. Nach einer Haltezeit von etwa 2 Stunden hatte das Kondensat eine Säurezahl von 20 mgKOH/g und eine Aminzahl von 251 mgKOH/g. Nach Entfernen der Heizung wurde das Polyamidoamin mit 570 g Wasser verdünnt. Die Lösung hatte einen Festkörpergehalt von 59,8 % (1 g, 1 Stunde, 125°C) und eine Viskosität bei 25°C von 1174 mPa.s.
-
- a) 322 g der Polyamidoamin-Vorproduktlösung aus Beispiel 1 (entsprechend 0,857 Val NH) und 321 g Wasser wurden in einem Dreihalskolben mit Rührer, Thermometer und Kühler gegeben und unter Rühren 111 g Epichlorhydrin (1,20 Mol) zugesetzt. In 30 Minuten wurde auf 55 bis 60°C erwärmt und bei dieser Temperatur gehalten. Nach 6 Stunden betrug die Gardner-Viskosität I.
- b) Es wurden 352 g Wasser zugegeben, auf 60 bis 65°C erwärmt und bei dieser Temperatur gehalten. Nach 3 Stunden betrug die Gardner-Viskosität F. Dann wurden 1295 g Wasser, in denen 2,5 g Kaliumsorbat gelöst waren, zugegeben und gekühlt. Danach wurde mit 14 g 48 %iger Schwefelsäure auf pH 3,70 eingestellt. Die Harzlösung hatte einen Festkörpergehalt von 12,6 % (1 g, 1 Stunde, 100°C) und eine Viskosität bei 25°C von 21 mPa.s.
-
- a) 207 g der Polyamidoamin-Vorproduktlösung aus Beispiel 1 (entsprechend 0,552 Val NH) und 207 g Wasser wurden in einen Dreihalskolben mit Rührer, Thermometer und Kühler gegeben und unter Rühren 66,5 g Epichlorhydrin (0,72 Mol) zugesetzt. In 60 Minuten wurde auf 60°C erwärmt und bei dieser Temperatur gehalten. Nach 3 Stunden betrug die Gardner-Viskosität M.
- b) Es wurden 578 g Wasser zugegeben, auf 65°C erwärmt und bei dieser Temperatur gehalten. Nach 4 Stunden betrug die Gardner-Viskosität F-G. Dann wurden 442 g Wasser, in denen 1,5 g Kaliumsorbat gelöst waren, zugegeben und gekühlt. Danach wurde mit 9,2 g 48 %iger Schwefelsäure auf pH 3,9 eingestellt. Die Harzlösung hatte einen Festkörpergehalt von 12,6 % (1 g , 1 Stunde, 100°C) und eine Viskosität bei 25°C von 47 mPa.s.
-
a) Es wurde zunächst wie in Beispiel 2a)/b) verfahren; die Wasserverdünnung in der Stufe b) erfolgte jedoch auf ca. 20 %. Die resultierende Harzlösung hatte folgende Daten:FK (1 g, 1 h, 100°C) 19,7 % pH 4,01 Viskosität 25°C 46,5 mPa.s. Stabilität 50°C >10 Tage Chlor gesamt ber. 2,84 % Chlor ionisch gef. 1,67 % 14,7 g Epichlorhydrin 158,9 mVal 0,793 g H₂SO₄ 100 % 16,2 mVal
b) In Anlehnung an die Lehre von Anspruch 11 oder US-PS 3.352.833 wurden 200 ml der Harzlösung gemäß a) bei Raumtemperatur mit 4,1 ml 10 n NaOH (entsprechend 2,5 Equivalenten NaOH pro Equivalent H₂SO₄) während 4 Stunden umgesetzt. Die Ergebnisse zeigt die Tabelle 2.
c) Die Laugenbehandlung erfolgte analog Abschnitt b), jedoch wurde die Lauge in einer Menge entsprechend Beispiel 10 der US-PS 3.352.833 eingesetzt, nämlich 17,5 ml 10 n NaOH pro 200 g Harzlösung (= Equivalent der Summe der Menge an Epichlorhydrin und H₂SO₄). Bezüglich der Ergebnisse siehe wiederum die Tabelle 2. -
a) Es wurde zunächst wie im Beispiel 3a)/b) verfahren; die resultierende Harzlösung hatte folgende Daten:FK (1 g, 1 h, 100°C) 12,4 % pH 3,99 Viskosität 25°C 33,9 mPa.s. Stabilität 50°C > 10 Tage Chlor gesamt ber. 1,69 % Chlor ionisch gef. 1,07 % 8,81 g Epichlorhydrin 95,2 mVal 0,557 g H₂SO₄ 100 % 11,4 mVal
b) Analog wie bei 4b) wurden 200 g der vorstehenden Harzlösung mit 2,85 ml 10 n NaOH (2,5 Equivalente/Equivalent H₂SO₄) während 4 Stunden bei Raumtemperatur umgesetzt. Ergebnisse siehe Tabelle 2.
c) Analog Beispiel 4c) wurden 200 g der vorstehenden Harzlösung mit 10,7 ml 10 n NaOH umgesetzt (= Equivalent der Summe der Menge an Epichlorhydrin und H₂SO₄). Bezüglich der Ergebnisse siehe die Tabelle 2. -
- a) 207 g der Polyamidoamin-Vorproduktlösung aus Beispiel 1 (entsprechend 0,552 Val NH) und 207 g Wasser wurden in einen Dreihalskolben mit Rührer, Thermometer und Kühler gegeben und unter Rühren 66,5 g Epichlorhydrin (0,72 Mol) zugesetzt. In 45 Minuten wurde auf 60°C erwärmt und bei dieser Temperatur gehalten. Nach 3,5 Stunden betrug die Gardner-Viskosität N.
- b) Es wurden 578 g 1 %ige Natronlauge zugegeben, auf 65°C erwärmt und bei dieser Temperatur gehalten. Nach 3 Stunden betrug die Gardner-Viskosität E-F. Dann wurden 442 g Wasser, in denen 1,5 g Kaliumsorbat gelöst waren, zugegeben, gekühlt und anschließend mit 11,7 g 48 %iger Schwefelsäure auf pH 3,9 eingestellt. Die Harzlösung hatte einen Festkörpergehalt von 12,7 % (1 g, 1 Stunde, 100°C) und eine Viskosität bei 25°C von 39 mPa.s.
- Nach der Arbeitsweise analog Beispiel 6, aber mit unterschiedlichen Mengen Natriumhydroxid, wurden folgende weitere Produkte hergestellt:
- 7. Im Reaktionsschritt b) wurden 578 g 1,5 %ige Natronlauge zugegeben.
Das Ansäuern erfolgte mit 24,9 g 48 %iger Schwefelsäure auf pH 1,75. Die erhaltene Harzlösung hatte einen Festkörpergehalt von 13,3 % (1 g, 1 Stunde, 100°C) und eine Viskosität bei 25°C von 34 mPa.s. - 8. Im Reaktionsschritt b) wurden 578 g 2,0 %ige Natronlauge zugegeben.
Das Ansäuern erfolgte mit 37,5 g 48 %iger Schwefelsäure auf pH 1,75. Die erhaltene Harzlösung hatte einen Festkörpergehalt von 13,5 % (1 g, 1 Stunde, 100°C) und eine Viskosität bei 25°C von 40 mPa.s. - Zu 2 kg einer Suspension von 10 g gebleichtem Sulfitzellstoff mit einem Mahlgrad von 42 bis 43°C Schopper-Riegler wurde unter starkem Rühren die 12,5 %igen, wäßrigen Harzlösungen von Beispiel 2, 3, 6, 7 und 8 in einer Menge von 1 % Festharz auf Zellstoff gegeben.
- Nach einer Aufziehzeit von mindestens 2 Minuten wurden in einem Blattbildner nach Schopper zwei Papierblätter von ca. 320 m² Fläche mit einem Flächengewicht von 100 g/m² gebildet, auf dem Trockenzylinder 5 Minuten bei 100°C erwärmt und 10 Minuten bei 120°C im Trockenschrank nachgehärtet. Nach einer Klimatisierungszeit von 24 Stunden bei 20°C und 65 % relativer Luftfeuchtigkeit wurden von Probestreifen des Papiers die Naßfestigkeiten in Newton (N) nach der Prüfvorschrift des Zelluloseinstituts der Technischen Hochschule Darmstadt gemessen. Das auf diese Weise erhaltene Papier wies eine Naßfestigkeit auf, die erheblich höher lag als die eines Papiers, das aus dem gleichen gebleichten Sulfitzellstoff ohne Zusatz der wäßrigen Lösungen der erfindungsgemäß verwendeten Produkte unter gleichen Versuchsbedingungen hergestellt wurde.
-
- Aus dieser Tabelle 1 ist zu ersehen, daß gegenüber den Vergleichsbeispielen 2 und 3 der Gehalt an organisch gebundenem Chlor in den Beispielen 6 bis 8 deutlich erniedrigt ist, wobei in dem Beispiel 8 der Wert nur noch ca. 20 % des Vergleichsbeispiels 3 beträgt. Darüber hinaus weisen die nach dem erfindungsgemäßen Verfahren hergestellten Reaktionsprodukte ausgezeichnete Naßfestwirksamkeiten und gute Lagerstabilitäten auf.
Tabelle 2 4b) 4c) 5b) 5c) Harz 4a) 4a) 5a) 5a) Harzlösung (g) 200 200 200 200 Gesamtchlor (%) 2,84 2,84 1,69 1,69 Cl⁻ (%) 1,67 1,67 1,07 1,07 10 n NaOH ml 4,1 17,5 2,85 10,7 pH 9,9 12,7 10,5 12,5 Cl⁻ nach 1 h (%) 1,97 2,23 1,24 1,41 Cl⁻ nach 4 h (%) 1,97 2,31 1,26 1,43 Cl⁻ nach 24 h (%) 1,97 geliert 1,27 geliert Gehalt an organ. geb. Chlor (%) bez. auf Lösung* 0,87 - 0,42 Lagerstabilität bei 50°C >10 Tage 1,5 h >10 Tage 3 h * nach 24 h - Aus dieser Tabelle ist ersichtlich, daß die nach 4c/5c erhaltenen Produkte zu einer Abnahme des organisch gebundenen Chlorgehaltes (Zunahme an Cl⁻) führen, aber keine ausreichende Lagerstabilität aufweisen (nach 24 h Gel).
- Demgegenüber sind die nach 4b/5b erhaltenen Produkte noch nach 10 Tagen (50°C) stabil. Die Erhöhung des Cl⁻Gehaltes bleibt aber deutlich hinter den erfindungsgemäßen Harzen zurück. Im Fall von Harz 5b) errechnet sich ein Wert von organisch gebundenem Chlor von 0,42 %; bei den erfindungsgemäßen Beispielen 6, 7 und 8 wird dieser Wert unterschritten.
- Aus diesen Versuchen ist zu ersehen, daß nach dem in der US-Patentschrift 3.352.833 angegebenen Verfahren keine stabilen, an organ. gebundenem Chlor armen Produkte erhalten werden können, wie sie das erfindungsgemäße Verfahren liefert. Dies bestätigt, was aus der Technik bekannt ist. Die Verarbeitung alkal. aktivierter Harze muß bei genauer Alkalidosierung innerhalb einer bestimmten Zeit erfolgen, was in der Praxis als ein großer Nachteil empfunden wird.
Claims (13)
- Wäßrige Lösung eines wasserverdünnbaren Polyamidoamin-Epichlorhydrin-Harzes (A), erhalten durch Umsatz eines wasserverdünnbaren, basischen Polyamidoamins (B), bestehend aus einer Säurekomponenten (B₁), und einer Aminkomponente (B₂), mit Epichlorhydrin (C), in einem wäßrigen System und in einem Verhältnis von 0,6 bis 2 Mol pro Mol basischer (mit (C) reaktiver) Aminogruppen des Polyamidoamins (B), Zugabe einer Base (D) bei 25 bis 95 °C, gegebenenfalls nach vorheriger Ansäuerung des Reaktionssystems, daß der pH-Wert oberhalb 8 liegt, und anschließende Zugabe von Säure auf einen pH-Wert von höchstens 7, wobei der Gehalt an organisch gebundenem Chlor in dem Harz (A) höchstens 4 Gew.-% beträgt und wobei die Komponenten (B₂) aus einem Gemisch aus einem oder mehreren Polyaminen und Alkanolaminen besteht.
- Harzlösung nach Anspruch 1, dadurch gekennzeichnet, daß der pH-Wert zwischen 1,5 und 5 liegt.
- Harzlösung nach Anspruch 1 und/oder 2, dadurch gekennzeichnet, daß das Harz (A) ein mittleres Molekulargewicht
M n von mindestens 1000 aufweist. - Harzlösung nach mindestens einem der Ansprüche 1 bis 3, dadurch gekennzeichnet, daß der Gehalt an organisch gebundenem Chlor in dem Harz (A) 1 bis 4 Gew.-% beträgt.
- Harzlösung nach mindestens einem der Ansprüche 1 bis 4, dadurch gekennzeichnet, daß der Gehalt an Harz (A) zwischen 8 und 25 Gew.-% liegt.
- Harzlösung nach mindestens einem der Ansprüche 1 bis 5, dadurch gekennzeichnet, daß das Epichlorhydrin (C) in einer Menge von 0,6 bis 2,0 Mol pro Mol basischer Aminogruppen des Polyamidoamins (B) eingesetzt wird.
- Verfahren zur Herstellung der Harzlösungen gemäß mindestens einem der Ansprüche 1 bis 6, dadurch gekennzeichnet, daß man wasserlösliche, basische Polyamidoamine (B) mit Epichlorhydrin (C) in einem Verhältnis von 0,6 bis 2 Mol pro Mol basischer (mit (C) reaktiver) Aminogruppen des Polyamidoamins (B) in wäßrigem System zur Reaktion bringt und dann, gegebenenfalls nach vorheriger Ansäuerung des Reaktionssystems mit soviel einer Base (D) bei 25 bis 95°C umsetzt, daß der pH-Wert bei größer als 8 liegt, und anschließend dann den pH-Wert durch Zugabe von Säure auf höchstens 7 eingestellt.
- Verfahren nach Anspruch 7, dadurch gekennzeichnet, daß die Menge an Base (D) 0,1 bis 0,6 Mol pro Mol eingesetztes Epichlorhydrin beträgt.
- Verfahren nach Anspruch 7 und/oder 8, dadurch gekennzeichnet, daß als Base Natrium- oder Kaliumhydroxid eingesetzt werden.
- Verfahren nach mindestens einem der Ansprüche 7 bis 9, dadurch gekennzeichnet, daß das anfallende Reaktionsprodukt mit einer Säure auf einen pH-Wert von 1,5 bis 5 eingestellt wird.
- Verfahren nach Anspruch 10, dadurch gekennzeichnet, daß als Säuren Schwefelsäure, Salzsäure, Essigsäure oder Ameisensäure eingesetzt werden.
- Verfahren nach mindestens einem der Ansprüche 7 bis 11, dadurch gekennzeichnet, daß die Umsetzung mit der Base (D) bei 40 bis 70°C erfolgt.
- Verwendung der wäßrigen Harzlösung nach mindestens einem der Ansprüche 1 bis 6 als Hilfsmittel in der Papierindustrie, insbesondere zur Erhöhung der Naßfestigkeit von Papier.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AT89112049T ATE90405T1 (de) | 1988-07-02 | 1989-07-01 | Waessrige loesungen von polyamidoamin-epichlorhyrin-harzen, verfahren zu ihrer herstellung und ihre verwendung. |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE3822490A DE3822490A1 (de) | 1988-07-02 | 1988-07-02 | Waessrige loesungen von polyamidoamin-epichlorhyrin-harzen, verfahren zu ihrer herstellung und ihre verwendung |
| DE3822490 | 1988-07-02 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| EP0349935A2 EP0349935A2 (de) | 1990-01-10 |
| EP0349935A3 EP0349935A3 (de) | 1991-05-08 |
| EP0349935B1 true EP0349935B1 (de) | 1993-06-09 |
Family
ID=6357862
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP89112049A Expired - Lifetime EP0349935B1 (de) | 1988-07-02 | 1989-07-01 | Wässrige Lösungen von Polyamidoamin-Epichlorhyrin-Harzen, Verfahren zu ihrer Herstellung und ihre Verwendung |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US5019606A (de) |
| EP (1) | EP0349935B1 (de) |
| AT (1) | ATE90405T1 (de) |
| DE (2) | DE3822490A1 (de) |
| ES (1) | ES2058408T3 (de) |
Families Citing this family (61)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5171795A (en) * | 1990-08-01 | 1992-12-15 | Hercules Incorporated | Process for the production of improved polyaminopolyamide epichlorohydrin resins |
| US5239047A (en) * | 1990-08-24 | 1993-08-24 | Henkel Corporation | Wet strength resin composition and method of making same |
| US5364927A (en) * | 1990-08-24 | 1994-11-15 | Henkel Corporation | Wet strength resin composition and method of making same |
| US5714552A (en) * | 1990-11-30 | 1998-02-03 | Hercules Incorporated | Process for making epichlorohydrin resins |
| CA2066378C (en) * | 1991-04-24 | 2000-09-19 | David J. Hardman | Dehalogenation of organohalogen-containing compounds |
| DE4114657A1 (de) * | 1991-05-06 | 1992-11-12 | Hoechst Ag | Waessrige loesungen von kationischen polyamidoamin-harzen |
| ATE169943T1 (de) * | 1991-06-19 | 1998-09-15 | Akzo Nobel Nv | Verfahren zur herstellung von harze auf der basis von epihalohydrin mit verringertem halogengehalt |
| DE4136289A1 (de) * | 1991-11-04 | 1993-05-06 | Bayer Ag, 5090 Leverkusen, De | Verfahren zur herstellung von polykondensaten |
| US5256727A (en) * | 1992-04-30 | 1993-10-26 | Georgia-Pacific Resins, Inc. | Resins with reduced epichlorohydrin hydrolyzates |
| DE4240110A1 (de) * | 1992-11-28 | 1994-06-01 | Basf Ag | Kondensationsprodukte von Polyalkylenpolyaminen, Verfahren zu ihrer Herstellung und ihre Verwendung bei der Herstellung von Papier |
| USH1613H (en) * | 1993-07-26 | 1996-11-05 | Hercules Incorporated | Polyamide-epichlorohydrin wet-strength resins with reduced content of epichlorohydrin-derived by-products in-situ solvent extraction |
| DE4426008A1 (de) | 1994-07-22 | 1996-01-25 | Cassella Ag | Hydrophile, hochquellfähige Hydrogele |
| US5567798A (en) * | 1994-09-12 | 1996-10-22 | Georgia-Pacific Resins, Inc. | Repulpable wet strength resins for paper and paperboard |
| US5614597A (en) | 1994-12-14 | 1997-03-25 | Hercules Incorporated | Wet strength resins having reduced levels of organic halogen by-products |
| JPH08302006A (ja) * | 1995-05-09 | 1996-11-19 | Mitsubishi Gas Chem Co Inc | 低塩素変性ポリアミンおよび水系エポキシ樹脂硬化剤 |
| US5972691A (en) * | 1995-06-07 | 1999-10-26 | Hercules Incorporated | Dehalogenation of polyamine, neutral curing wet strength resins |
| US5773507A (en) * | 1995-08-25 | 1998-06-30 | Henkel Corporation | Anti-static composition and process for making same |
| US5786429A (en) * | 1996-04-18 | 1998-07-28 | Hercules Incorporated | Highly branched polyamidoamines and their preparation |
| DE19722340A1 (de) * | 1997-05-28 | 1998-12-03 | Clariant Gmbh | Wasserquellbare, hydrophile Polymerzusammensetzungen |
| DE19728789A1 (de) | 1997-07-05 | 1999-01-07 | Bayer Ag | Naßfestmittel mit niedrigem DCP-Gehalt |
| US6294645B1 (en) * | 1997-07-25 | 2001-09-25 | Hercules Incorporated | Dry-strength system |
| US6222006B1 (en) * | 1997-08-13 | 2001-04-24 | Fort James Corporation | Wet strength thermosetting resin formulations and polyaminamide polymers suitable for use in the manufacture of paper products |
| US5942085A (en) * | 1997-12-22 | 1999-08-24 | The Procter & Gamble Company | Process for producing creped paper products |
| US6429267B1 (en) | 1997-12-31 | 2002-08-06 | Hercules Incorporated | Process to reduce the AOX level of wet strength resins by treatment with base |
| DE19807502B4 (de) | 1998-02-21 | 2004-04-08 | Basf Ag | Verfahren zur Nachvernetzung von Hydrogelen mit 2-Oxazolidinonen, daraus hergestellte Hydrogele und deren Verwendung |
| US6503979B1 (en) | 1998-02-26 | 2003-01-07 | Basf Aktiengesellschaft | Method for cross-linking hydrogels with bis- and poly-2-oxazolidinones |
| US6291023B1 (en) | 1998-04-22 | 2001-09-18 | Sri International | Method and composition for textile printing |
| DE19854574A1 (de) | 1998-11-26 | 2000-05-31 | Basf Ag | Verfahren zur Nachvernetzung von Hydrogelen mit N-Acyl-2-Oxazolidinonen |
| DE19854573A1 (de) | 1998-11-26 | 2000-05-31 | Basf Ag | Verfahren zur Nachvernetzung von Hydrogelen mit 2-Oxo-tetrahydro-1,3-oxazinen |
| ES2384726T3 (es) * | 1999-06-11 | 2012-07-11 | Hercules Incorporated | Proceso para preparar resinas de poliamina-epihalohidrina con un contenido reducido de subproductos |
| US20030070783A1 (en) * | 2000-12-09 | 2003-04-17 | Riehle Richard James | Reduced byproduct high solids polyamine-epihalohydrin compositions |
| AU3066402A (en) * | 2000-12-09 | 2002-07-01 | Hercules Inc | Reduced byproduct high solids polyamine-epihalohydrin compositions |
| KR20040040487A (ko) * | 2001-10-05 | 2004-05-12 | 바스프 악티엔게젤샤프트 | 모르폴린 2,3-디온에 의한 하이드로겔의 가교결합 방법 |
| US7081512B2 (en) * | 2003-05-21 | 2006-07-25 | Hercules Incorporated | Treatment of resins to lower levels of CPD-producing species and improve gelation stability |
| DE102004038015A1 (de) * | 2004-08-04 | 2006-03-16 | Basf Ag | Verfahren zur Nachvernetzung wasserabsorbierender Polymere mit zyklischen Carba-maten und/oder zyklischen Harnstoffen |
| DE102004057868A1 (de) * | 2004-11-30 | 2006-06-01 | Basf Ag | Unlösliche Metallsulfate in wasserabsorbierenden Polymerpartikeln |
| US20060142432A1 (en) * | 2004-12-29 | 2006-06-29 | Harrington John C | Retention and drainage in the manufacture of paper |
| US7589153B2 (en) * | 2005-05-25 | 2009-09-15 | Georgia-Pacific Chemicals Llc | Glyoxalated inter-copolymers with high and adjustable charge density |
| US7576162B2 (en) * | 2005-06-30 | 2009-08-18 | Akzo Nobel N.V. | Chemical process |
| US20070053934A1 (en) * | 2005-08-26 | 2007-03-08 | Neville Kallenbach | Polyvalent multimeric composition containing active polypeptides, pharmaceutical compositions and methods of using the same |
| CN101558101B (zh) * | 2006-08-24 | 2013-02-06 | 赫尔克里士公司 | 低分子量聚胺聚酰胺-表氯醇(pae)树脂和蛋白质的粘合剂组合物 |
| US7932349B2 (en) * | 2006-09-18 | 2011-04-26 | Hercules Incorporated | Membrane separation process for removing residuals polyamine-epihalohydrin resins |
| US20080292886A1 (en) * | 2007-03-23 | 2008-11-27 | Hercules Inc. | Adhesive formulations containing urea additives, methods of forming plywood therewith, and plywood products made thereby |
| US7868071B2 (en) * | 2007-07-30 | 2011-01-11 | Georgia-Pacific Chemicals Llc | Method of stabilizing aqueous cationic polymers |
| CA2701918C (en) * | 2007-10-09 | 2014-08-05 | Hercules Incorporated | Crosslinkercontaining adhesive compositions |
| EP2148003A1 (de) * | 2008-07-22 | 2010-01-27 | Mühle Rüningen GmbH & Co. KG | Verfahren zur Herstellung eines modifizierten stärkehaltigen Produkts, in diesem Verfahren erzeugbares modifiziertes stärkehaltiges Produkt und seine Verwendung bei der Papierherstellung |
| US20120115992A1 (en) | 2009-07-20 | 2012-05-10 | Akzo Nobel Coatings International B.V. | Adhesive system and method of producting a wood based product |
| WO2011009811A1 (en) | 2009-07-20 | 2011-01-27 | Akzo Nobel Coatings International B.V. | Adhesive system and method of producing a wood based product |
| WO2012076566A2 (en) | 2010-12-10 | 2012-06-14 | Akzo Nobel Coatings International B.V. | Aqueous composition |
| US20120247697A1 (en) | 2011-03-29 | 2012-10-04 | Kemira Oyj | Polyamine Polyamidoamine Epihaloohydrin Compositions and Processes for Preparing and Using the Same |
| BR112013026913B1 (pt) | 2011-04-21 | 2020-05-26 | Ecolab Usa Inc. | Processo para produzir uma composição de resina de poliamidoamina-epialoidrina |
| ES2633188T3 (es) | 2011-09-30 | 2017-09-19 | Kemira Oyj | Papel y procedimiento de fabricación de papel |
| US9777434B2 (en) | 2011-12-22 | 2017-10-03 | Kemira Dyj | Compositions and methods of making paper products |
| KR20150064078A (ko) | 2012-09-26 | 2015-06-10 | 케미라 오와이제이 | 흡수성 물질, 흡수성 물질을 포함하는 산물, 조성물, 및 흡수성 물질을 제조하는 방법 |
| PT2929087T (pt) | 2012-12-06 | 2017-03-23 | Kemira Oyj | Composições utilizadas em papel e métodos de fabrico de papel |
| US9562326B2 (en) | 2013-03-14 | 2017-02-07 | Kemira Oyj | Compositions and methods of making paper products |
| CA2958133C (en) | 2014-08-13 | 2021-01-26 | Solenis Technologies, L.P. | Process to improve performance of wet-strength resins through base activation |
| CN105348524A (zh) * | 2015-12-14 | 2016-02-24 | 广东省造纸研究所 | 一种环境友好型pae造纸湿强剂的制备方法 |
| CN106589420A (zh) * | 2015-12-15 | 2017-04-26 | 广东省造纸研究所 | 一种低氯丙醇pae造纸湿强剂的制备方法 |
| WO2020181092A1 (en) * | 2019-03-05 | 2020-09-10 | Kemira Oyj | Compositions and methods comprising wet strengthening resins |
| CN111203197A (zh) * | 2020-01-14 | 2020-05-29 | 吉首大学 | 基于环氧和氨基交联的吸附材料及其制备方法 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0282862A2 (de) * | 1987-03-17 | 1988-09-21 | Bayer Ag | Stickstoffhaltige, wasserlösliche Verbindungen |
| EP0332967A2 (de) * | 1988-03-16 | 1989-09-20 | Bayer Ag | Polyamidamin-Harze |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL231136A (de) * | 1957-09-05 | |||
| US3240761A (en) * | 1962-07-10 | 1966-03-15 | Hercules Powder Co Ltd | Cationic thermosetting quaternized polyamide-epichlorohydrin resins and method of preparing same |
| US3352833A (en) * | 1963-12-31 | 1967-11-14 | Hercules Inc | Acid stabilization and base reactivation of water-soluble wet-strength resins |
| US3332901A (en) * | 1966-06-16 | 1967-07-25 | Hercules Inc | Cationic water-soluble polyamide-epichlorohydrin resins and method of preparing same |
| US3647763A (en) * | 1970-04-13 | 1972-03-07 | Nat Starch Chem Corp | Chain extended polyamine resin compositions |
| DE2434816C3 (de) * | 1974-07-19 | 1981-01-22 | Basf Ag, 6700 Ludwigshafen | Verfahren zur Herstellung von stickstoffhaltigen Kondensationsprodukten und deren Verwendung als Retentionsmittel, Flockungsmittel und Entwässerungsbeschleuniger bei der Papierherstellung |
| FR2292729A1 (fr) * | 1974-11-29 | 1976-06-25 | Protex Manuf Prod Chimiq | Procede de preparation de resines cathioniques thermodurcissables, resines obtenues suivant ce procede et leurs applications, notamment pour l'amelioration de la resistance a l'etat humide du papier |
| JPS54159496A (en) * | 1978-06-07 | 1979-12-17 | Sumitomo Chem Co Ltd | Preparation of aqueous solution of cationic thermosetting resin |
| DE2949870A1 (de) * | 1979-12-12 | 1981-06-19 | Hoechst Ag, 6230 Frankfurt | Kondensationsprodukte zur erhoehung der nassfestigkeit von papier |
| DE3003648A1 (de) * | 1980-02-01 | 1981-08-06 | Basf Ag, 6700 Ludwigshafen | Verfahren zur zerstellung von wasserloeslichen, stickstoffhaltigen kondensationsprodukten und deren verwendung bei der papierherstellung |
| DE3135830A1 (de) * | 1981-09-10 | 1983-03-24 | Basf Ag, 6700 Ludwigshafen | Verfahren zur herstellung von wasserloeslichen, stickstoffhaltigen kondensationsprodukten und deren verwendung bei der papierherstellung |
| DE3323732A1 (de) * | 1983-07-01 | 1985-01-17 | Hoechst Ag, 6230 Frankfurt | Wasserloesliche, von esterbindungen weitgehend freie reaktionsprodukte aus epihalogenhydrin in wasserloeslichen basischen polyamidoaminen, verfahren zu ihrer herstellung und ihre verwendung |
| DD218276A1 (de) * | 1983-07-21 | 1985-02-06 | Univ Leipzig | Verfahren zum herstellen monoklonaler antikoerper fuer ein t-zell-antigen |
| DD223456A1 (de) * | 1984-01-18 | 1985-06-12 | Leuna Werke Veb | Verfahren zur herstellung von epoxidharzen mit niedrigem chlorgehalt |
| US4579667A (en) * | 1984-11-07 | 1986-04-01 | Hercules Incorporated | Gelled aqueous compositions |
| GB8613652D0 (en) * | 1986-06-05 | 1986-07-09 | Grace W R Ab | Compositions for sizing paper |
| US4870119A (en) * | 1986-11-24 | 1989-09-26 | Sandoz Ltd. | Water-soluble polyamides containing aromatic groups |
-
1988
- 1988-07-02 DE DE3822490A patent/DE3822490A1/de not_active Withdrawn
-
1989
- 1989-06-30 US US07/374,467 patent/US5019606A/en not_active Expired - Fee Related
- 1989-07-01 AT AT89112049T patent/ATE90405T1/de not_active IP Right Cessation
- 1989-07-01 DE DE8989112049T patent/DE58904602D1/de not_active Expired - Fee Related
- 1989-07-01 ES ES89112049T patent/ES2058408T3/es not_active Expired - Lifetime
- 1989-07-01 EP EP89112049A patent/EP0349935B1/de not_active Expired - Lifetime
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0282862A2 (de) * | 1987-03-17 | 1988-09-21 | Bayer Ag | Stickstoffhaltige, wasserlösliche Verbindungen |
| EP0332967A2 (de) * | 1988-03-16 | 1989-09-20 | Bayer Ag | Polyamidamin-Harze |
Also Published As
| Publication number | Publication date |
|---|---|
| EP0349935A2 (de) | 1990-01-10 |
| EP0349935A3 (de) | 1991-05-08 |
| ES2058408T3 (es) | 1994-11-01 |
| US5019606A (en) | 1991-05-28 |
| ATE90405T1 (de) | 1993-06-15 |
| DE3822490A1 (de) | 1990-01-04 |
| DE58904602D1 (de) | 1993-07-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0349935B1 (de) | Wässrige Lösungen von Polyamidoamin-Epichlorhyrin-Harzen, Verfahren zu ihrer Herstellung und ihre Verwendung | |
| EP0002474B2 (de) | Amidgruppenhaltige Polyamine und ihre Verwendung bei der Papierherstellung | |
| DE2616220C2 (de) | Kationische wasserlösliche Amin- Epichlorhydrin-Polykondensate, Verfahren zu deren Herstellung und deren Verwendung | |
| EP0332967B1 (de) | Polyamidamin-Harze | |
| DE1795392C3 (de) | Verfahren zur Herstellung von kationaktiven Polyamiden und deren Verwendung als Hilfsmittel bei der Papierherstellung | |
| EP0670858B1 (de) | Kondensationsprodukte von polyalkylenpolyaminen, und ihre verwendung bei der herstellung von papier | |
| DE69233403T2 (de) | Harze auf der Basis von Epihalohydrin mit verringertem Halogengehalt | |
| DE2434816C3 (de) | Verfahren zur Herstellung von stickstoffhaltigen Kondensationsprodukten und deren Verwendung als Retentionsmittel, Flockungsmittel und Entwässerungsbeschleuniger bei der Papierherstellung | |
| DE1906450C3 (de) | Selbstvernetzende wasserlösliche Produkte und deren Verwendung als Naßfestmittel für Papier | |
| EP0074558B1 (de) | Verfahren zur Herstellung von wasserlöslichen, stickstoffhaltigen Kondensationsprodukten und deren Verwendung bei der Papierherstellung | |
| DE1802435B2 (de) | Verfahren zur Herstellung von vernetzten Harzen auf der Basis von basischen Polyamidoaminen und deren Verwendung als Entwässerungs-, Retentions- und Flockungsmittel bei der Papierherstellung | |
| EP0512423B1 (de) | Wässrige Lösungen von kationischen Polyamidoamin-Harzen | |
| EP0131200B1 (de) | Wasserlösliche, von Esterbindungen weitgehend freie Reaktionsprodukte aus Epihalogenhydrin und wasserlöslichen basischen Polyamidoaminen, Verfahren zu ihrer Herstellung und ihre Verwendung | |
| EP0335157A1 (de) | Stickstoffhaltige, wasserlösliche polymere Verbindungen | |
| WO2000040639A1 (de) | Nassfestmittel mit niedrigem dcp-gehalt | |
| EP0031899B1 (de) | Selbstvernetzende wasserlösliche Reaktionsprodukte, Verfahren zur Herstellung von Bindemitteln aus solchen Produkten und Verwendung der Produkte zur Erhöhung der Nassfestigkeit von Papier | |
| EP0540943B1 (de) | Verfahren zur Herstellung von Polykondensaten | |
| EP0000714B1 (de) | Hilfsmittel zur Verbesserung der Retention, Entwässerung und Aufbereitung, insbesondere bei der Papierherstellung | |
| DE19607641A1 (de) | Wasserlösliche Kondensationsprodukte aus Aminogruppen enthaltenden Verbindungen und halogenfreien Vernetzern, Verfahren zu ihrer Herstellung und ihre Verwendung | |
| EP0335158A1 (de) | Stickstoffhaltige polymere Verbindungen | |
| EP0707113A1 (de) | Verfahren zur Herstellung trockenfest und/oder nassfest ausgerüsteter cellulosehaltiger Flächengebilde | |
| CH642385A5 (en) | Process for the preparation of novel cationic, water-soluble, polymeric reaction products | |
| EP0005201A1 (de) | Leimungsmittel für Papier | |
| EP1151029B1 (de) | Nassfestmittel mit niedrigem dcp-gehalt | |
| DE2925567A1 (de) | Harnstoffgruppenhaltige polyamine, sowie deren herstellung und verwendung als retentionsmittel |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| AK | Designated contracting states |
Kind code of ref document: A2 Designated state(s): AT BE CH DE ES FR GB GR IT LI NL SE |
|
| 17P | Request for examination filed |
Effective date: 19901117 |
|
| PUAL | Search report despatched |
Free format text: ORIGINAL CODE: 0009013 |
|
| AK | Designated contracting states |
Kind code of ref document: A3 Designated state(s): AT BE CH DE ES FR GB GR IT LI NL SE |
|
| RHK1 | Main classification (correction) |
Ipc: D21H 17/55 |
|
| 17Q | First examination report despatched |
Effective date: 19911218 |
|
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Kind code of ref document: B1 Designated state(s): AT BE CH DE ES FR GB GR IT LI NL SE |
|
| REF | Corresponds to: |
Ref document number: 90405 Country of ref document: AT Date of ref document: 19930615 Kind code of ref document: T |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: GB Payment date: 19930628 Year of fee payment: 5 Ref country code: FR Payment date: 19930628 Year of fee payment: 5 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: CH Payment date: 19930629 Year of fee payment: 5 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: SE Payment date: 19930701 Year of fee payment: 5 |
|
| ITF | It: translation for a ep patent filed |
Owner name: ING. C. GREGORJ S.P.A. |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: AT Payment date: 19930708 Year of fee payment: 5 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: ES Payment date: 19930715 Year of fee payment: 5 |
|
| REF | Corresponds to: |
Ref document number: 58904602 Country of ref document: DE Date of ref document: 19930715 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: GR Payment date: 19930723 Year of fee payment: 5 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: NL Payment date: 19930731 Year of fee payment: 5 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: BE Payment date: 19930810 Year of fee payment: 5 |
|
| REG | Reference to a national code |
Ref country code: GR Ref legal event code: FG4A Free format text: 3008148 |
|
| ET | Fr: translation filed | ||
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DE Payment date: 19930929 Year of fee payment: 5 |
|
| GBT | Gb: translation of ep patent filed (gb section 77(6)(a)/1977) |
Effective date: 19930907 |
|
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |
|
| 26N | No opposition filed | ||
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GB Effective date: 19940701 Ref country code: AT Effective date: 19940701 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: SE Effective date: 19940702 Ref country code: ES Free format text: LAPSE BECAUSE OF THE APPLICANT RENOUNCES Effective date: 19940702 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LI Effective date: 19940731 Ref country code: CH Effective date: 19940731 Ref country code: BE Effective date: 19940731 |
|
| REG | Reference to a national code |
Ref country code: ES Ref legal event code: FG2A Ref document number: 2058408 Country of ref document: ES Kind code of ref document: T3 |
|
| BERE | Be: lapsed |
Owner name: HOECHST A.G. Effective date: 19940731 |
|
| EUG | Se: european patent has lapsed |
Ref document number: 89112049.5 Effective date: 19950210 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GR Free format text: THE PATENT HAS BEEN ANNULLED BY A DECISION OF A NATIONAL AUTHORITY Effective date: 19950131 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: NL Effective date: 19950201 |
|
| GBPC | Gb: european patent ceased through non-payment of renewal fee |
Effective date: 19940701 |
|
| NLV4 | Nl: lapsed or anulled due to non-payment of the annual fee | ||
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: FR Effective date: 19950331 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PL |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DE Effective date: 19950401 |
|
| EUG | Se: european patent has lapsed |
Ref document number: 89112049.5 |
|
| REG | Reference to a national code |
Ref country code: GR Ref legal event code: MM2A Free format text: 3008148 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: ST |
|
| REG | Reference to a national code |
Ref country code: ES Ref legal event code: FD2A Effective date: 19991007 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: IT Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20050701 |