DE69918159T2 - Verfahren und vorrichtung zur steuerung der gewebeimplantat-interaktionen - Google Patents
Verfahren und vorrichtung zur steuerung der gewebeimplantat-interaktionen Download PDFInfo
- Publication number
- DE69918159T2 DE69918159T2 DE69918159T DE69918159T DE69918159T2 DE 69918159 T2 DE69918159 T2 DE 69918159T2 DE 69918159 T DE69918159 T DE 69918159T DE 69918159 T DE69918159 T DE 69918159T DE 69918159 T2 DE69918159 T2 DE 69918159T2
- Authority
- DE
- Germany
- Prior art keywords
- implant according
- polymer layer
- implant
- tissue
- tissue reaction
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/54—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/0002—Remote monitoring of patients using telemetry, e.g. transmission of vital signals via a communication network
- A61B5/0031—Implanted circuitry
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/145—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue
- A61B5/14532—Measuring characteristics of blood in vivo, e.g. gas concentration, pH value; Measuring characteristics of body fluids or tissues, e.g. interstitial fluid, cerebral tissue for measuring glucose, e.g. by tissue impedance measurement
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/08—Materials for coatings
- A61L31/10—Macromolecular materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/14—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/14—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L31/16—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
Description
- Hintergrund der Erfindung
- 1. Gebiet der Erfindung
- Die Erfindung betrifft im allgemeinen das Gebiet der Implantate für menschliche und tierische Körper. Insbesondere betrifft die Erfindung Vorrichtungen und Methoden zur Kontrolle der Gewebs-/Implantat-Interaktionen, wobei eine bessere Integration, Funktionalität und erhöhte Lebensdauer der Implantate im Körper erreicht wird.
- 2. Beschreibung des Standes der Technik
- Implantierbare künstliche Materialien und Vorrichtungen wie z. B. Arzneiversorgungssysteme, Herzschrittmacher, künstliche Gelenke und Organe spielen eine wichtige Rolle in der heutigen Gesundheitsfürsorge. Zusätzlich zu diesen Vorrichtungen besitzen implantierbare Beobachtungssysteme oder „Biosensoren" ein großes Potential zur Verbesserung sowohl der Pflegequalität als auch der Lebensqualität von Patienten und Tieren. Eine beispielhafte Beobachtungsvorrichtung, die die Lebensqualität von Diabetespatienten und Tieren deutlich erhöhen würde, ist beispielsweise ein implantierbarer Glukosemonitor zur schmerzfreien, kontinuierlichen, sicheren Bestimmung des Blutglukosespiegels. Diabetespatienten bestimmen heutzutage ihren eigenen Glukoseblutspielgel durch Aufnahme von Kapillarblutproben aus wiederholten Fingereinstichen. Da diese Tests schmerzvoll, zeitaufwendig und mehrmals an einem Tag wiederholt werden müssen, führen Diabetespatienten oftmals keine ausreichende Zahl an täglichen Tests durch. Die mangelnde Einhaltung erschwert die intrinsisch bedingte diskontinuierliche Natur der Beobachtung und führt letztendlich zu extensiven pathologischen Auswirkungen bei Diabetespatienten.
- Eins der größten Probleme in Verbindung mit allen Typen von Implantaten ist die Biokompatibilität des Implantats mit dem Körper und insbesondere mit der Gewebe, das mit dem Implantat in Kontakt tritt. Siehe auch Mercacto und Moussy (1998) in Biosensors & Bioelectronics, Vol. 13, Nr. 2, 133–145. Trotz intensiver Bemühungen zur Entwicklung von beispielsweise implantierbaren Biosensoren zur Glukosebestimmung und Bestimmung anderer Funktionen ermöglicht keine Entwicklung heutzutage eine schmerzfreie, zuverlässige und kontinuierliche Beobachtung. Ein Grund hierfür ist, daß die momentan implantierbaren Sensoren unter einem progressiven Verlust an Funktionalität nach einer relativ kurzen Zeit in vivo leiden. Dieser Verlust an Funktionalität beruht auf unterschiedlichen Faktoren, wobei einige der wichtigsten die Proteinabsorption, Entzündungsbildung und die Fibrose (Einkapselung) hervorgehend aus dem Gewebstrauma um das Implantat sind. Diese Fibrose führt zu einem Verlust an Blutgefäßen in der Implantatsumgebung und somit zu einem behinderten Zugang zum Blutglukosespiegel. Dieser Faktor kann ebenfalls mit der Funktionalität anderer Implantate und implantierbarer Vorrichtungen wie z. B. Insulinpumpen, Herzschrittmachern, künstlichen Gelenken und künstlichen Organen in Verbindung gebracht werden.
- Ein Ansatz zur Kontrolle der durch das Gewebstrauma an der Implantationsstelle hervorgerufenen Entzündung und Fibrose war die Verwendung von inerten Materialien wie beispielsweise Titan oder monokristallinem Aluminium, wie veröffentlicht in US Patent Nr. 4,122,605 von Hirabayashi et al. Obwohl geeignet für Knochen und Zahnimplantate ist dieser Ansatz nicht hilfreich bei komplexeren prothetischen Bauteilen oder Biosensoren, welche die Verwendung einer Vielzahl von Materialien benötigen. Ein weiterer Ansatz war die Verwendung von porösen äußeren Ummantelungen aus DACRON oder TEFLON, wie veröffentlicht in US Patent Nr. 4,648,880 von Brauman et al., oder mit Polytetrafluorethylen, wie veröffentlicht in US Patent Nr. 5,779,734. Obwohl geeignet für Prothesen wie z. B. Brustimplantate, sind solche Beschichtungen nicht praktikabel für prothetische Vorrichtungen und Biosensoren mit komplexeren Geometrien. Der häufigst genutzte Ansatz zur Kontrolle der Gewebsreaktionen, insbesondere der Entzündung, war die systematische Verabreichung von Arzneimitteln wie Corticosteroide. Diese systematische Verabreichung kann zu Nebenwirkungen wie einer allgemeinen Immunsuppression, Blutungen und psychischen Problemen, insbesondere über lange Zeit, führen. Dementsprechend besteht ein Bedarf an Vorrichtungen und Methoden zur Kontrolle der Gewebs/Implantat-Interaktionen, insbesondere für implantierbare Materialien, Prothesen und Vorrichtungen wie Biosensoren.
- Zusammenfassung der Erfindung
- Die oben diskutierten und anderen Nachteile und Defizite des Standes der Technik werden überwunden oder geschwächt durch eine verbesserte Gewebe/Implantatschnittstelle, aufweisend ein Implantat mit einer äußeren Oberfläche und einer bioaktiven Polymerschicht angrenzend an zumindest einem Teil der äußeren Oberfläche des Implantats. In einem bevorzugten Ausführungsbeispiel weist die Polymerschicht mindestens einen Gewebereaktionsmodifikator auf, welcher kovalent an die Polymerschicht gebunden ist oder in der Polymerschicht eingebunden ist, in einer zur Kontrolle der Gewebsreaktion an der Implantationsstelle effektiven Menge. Die bioaktive Polymerschicht kann ein synthetisches organisches Polymer wie beispielsweise ein Hydrogel oder ein natürliches Polymer wie beispielsweise ein Protein sein. Das Polymer kann gleichfalls selbst aufbauend sein. Vorzugsweise kontrolliert der mindestens eine Gewebsreaktionsmodifikator die Entzündungsbildung, Fibrose, Zellmigration, Zellproliferation, Leukozytenaktivierung, Leukozytenanhaftung, Lymphozytenaktivierung, Lymphozytenanhaftung, Makrophagenaktivierung, Makrophagenanhaftung, den Zelltod und/oder die Neovaskularisation. Beispielhafte Gewebereaktionsmodifikatoren können unter anderem ein steroidales oder nicht-steroidales entzündungshemmendes Reagenz, ein antifibrotisches Reagenz, ein Antiproliferationsreagenz, ein Cytokin, ein Cytokininhibitor, neutralisierte Antikörper, anhaftende Liganden, Metabolite oder metabolische Zwischenstufen, DNA, RNA, cytotoxische Reagenzien und Kombinationen dieser sein. Der Gewebereaktionsmodifikator kann kovalent an die Polymerschicht gebunden oder in der Polymerschicht eingeschlossen sein.
- In einem weiteren Ausführungsbeispiel ist der Gewebereaktionsmodifikator kovalent an den Polymerfilm gebunden oder in einer langsam freisetzenden Form in dem Polymerfilm eingeschlossen, wie beispielsweise in Form von biologisch abbaubaren Polymeren, Nanopartikeln, Liposomen, Emulsionen und Mikrosphären zur Bereitstellung der Langzeitversorgung des Gewebereaktionsmodifikators an der Implantationsstelle.
- Die Verbindung der unterschiedlichen Kombinationen von Gewebereaktionsmodifikatoren mit bioaktiven Polymeren stellt ein extrem einfaches, flexibles und effektives Mittel zur Kontrolle der Implantat/Gewebe-Interphasen zur Verfügung, welches die Lebenszeit des Implantats und dessen Funktion verbessert. Die oben diskutierten und anderen Merkmale und Vorteile können vom Fachmann aus den folgenden detaillierten Beschreibungen und Zeichnungen entnommen werden.
- Kurze Beschreibung der Zeichnungen
- Bezugnehmend auf die Zeichnungen sind die einzelnen Elemente durchnummeriert, wie in den unterschiedlichen Figuren gezeigt:
-
1 ist eine schematische Darstellung eines Implantats und einer Gewebswechselwirkungsmodifizierungs-Hydrogelkombination. -
2 ist eine schematische Darstellung eines Implantats und einer Gewebswechselwirkungsmodifizierungs-MAP-poly(anion/polycation) Kombination. -
3 ist eine schematische Darstellung eines hydrogenperoxidbasierenden amperometrischen Sensors zur Beobachtung des subkutanen Glukosespiegels und einer bioaktiven Schichtenschnittstelle. -
4 ist ein Detail aus3 . -
5 ist eine Grafik, welche die Glukosepermeabilitätsdaten als Funktion einer sukzessiven NAFIONTM/Fe3+ selbstaufbauenden Monoschicht auf einer 0,1 μm Glasfibermembran zeigt. -
6 zeigt quartzkristalline Mikrobalance (QCM) Frequenzshifts (welche in direkter Relation zu der Massenabscheidung auf dem QCM-Sensor stehen) gegen den Dipkreislauf für Huminsäure/Fe3+ Anordnungen, als Funktion des pH-Wertes und der Ionenstärke der Huminsäurelösung. -
7 ist eine grafische Darstellung der ellipsometrischen Bestimmung der Dicke versus dem Tauchzyklus für Huminsäure/Fe3+ Anordnungen, als Funktion des pH-Wertes und der Ionenstärke der Huminsäurelösung. - Ausführliche Beschreibung der bevorzugten Ausführungsbeispiele
- Wie hierin verwendet, bezieht sich der Begriff „Implantat" weitestgehend auf jedes Material oder jede Vorrichtung, welche invasiv in den Körper eines Wirbeltieres wie z. B. eines Vogels, eines Reptils, einer Amphibie oder eines Menschen eingebracht wird. Die verbesserte Gewebe/Implantatschnittstelle der vorliegenden Erfindung weist in einem ersten Ausführungsbeispiel ein Implantat auf, welches eine äußere Oberfläche und eine bioaktive Polymerschicht anhaftend an zumindestens einem Teil der äußeren Oberfläche des Implantates aufweist, wobei die Polymerschicht mindestens einen Gewebereaktionsmodifikator kovalent an die Polymerschicht oder in der Polymerschicht eingeschlossen aufweist, in einer Quantität, welche effektiv zur Kontrolle der Gewebereaktions an der Implantationsstelle ist. Der mindestens Gewebereaktionsmodifikator dient zur Modifizierung der Gewebereaktion gegenüber dem Implantat an der Implantationsstelle durch Steuerung oder Verhinderung der Gewebereaktion, welche zu einer Implantatsabstoßung, Beeinträchtigung oder zum Verlust der Funktion führt.
- „Gewebereaktionsmodifikatoren" wie hierin verwendet, sind Faktoren, die die Reaktion des Gewebes an der Implantationsstelle kontrollieren. Ein Aspekt dieser Reaktion kann weitestgehend in einem Zweischrittprozeß unterteilt werden, die Entzündung und die Wundheilung. Eine unkontrollierte Entzündungsreaktion (akut oder chronisch) resultiert in einer extensiven Gewebszerstörung und letztendlich in einer Gewebsfribrose. Wundheilung schließt die Regeneration des verletzten Gewebes, die Reparatur (Fibrose) und das Einwachsen von neuen Blutgefäßen (Neovaskularisation und Angiogenesis) ein. Für die Fibrose verwendet der Körper Kollagen aus den aktivierten Fibroblasten zum „Stopfen und Füllen" der noch nicht regenerierten Bereiche, die aus einem Trauma oder einer Entzündung resultieren. Das Einwachsen der neuen Blutgefäße ist kritisch und letztendlich das Ergebnis der Wundheilung. Eine Anzahl anderer Wechselwirkungen sind gleichfalls in diese Kategorie eingeschlossen, wie z. B. die Fibroblastbildung und Funktion, die Leukozytenaktivierung, die Leukozytenanhaftung, die Lymphozytenaktivierung, die Lymphozytenanhaftung, die Makrophagenaktivierung, die Makrophagenanhaftung, die Thrombose, die Zellmigration, die Zellproliferation einschließlich des unkontrollierten Wachstums, Neoplasie und Zellverletzung und Zelltod. Nachteilige Gewebsreaktionen auf Implantationen können auch aus genetischer Funktionsstörung, Immunerkrankungen, infektiösen Störungen, umweltbedingte Toxinaufnahmen, Ernährungsstörungen und Störungen im Baby- oder Kindesalter hervorgerufen werden.
- Gewebereaktionsmodifikatoren sind daher eine breite Kategorie von organischen und inorganischen, synthetischen und natürlichen Materialien und Derivaten dieser, welche die oben genannten Gewebereaktionen durch Verletzungen aufgrund von Implantationen beeinflussen. Solche Materialien schließen nicht abschließend mit ein synthetische organische Verbindungen (Arzneimittel), Peptide, Polypeptide, Proteine, Lipide, Zucker, Kohlenhydrate, bestimmte RNA und DNA und Fettsäuren, sowie Metaboliten und Derivate dieser. Gewebereaktionsmodifikatoren können auch die Form von genetischem Material, Viren, prokaryotischen oder eukaryotischen Zellen haben oder von diesen abgeleitet sein. Die Gewebereaktionsmodifikatoren können auch in unterschiedlichen Formen wie z. B. ungeladenen Molekülen, Teilen von molekularen Komplexen von pharmakologisch akzeptablen Salzen oder simplen Derivaten wie Estern, Ethern oder Amiden sein. Gewebereaktionsmodifikatoren können viral, mikrobiotisch, durch Pilzpflanzen, Insekten, Fische oder andere Wirbeltierquellen hergestellt werden.
- Beispiele für Gewebereaktionsmodifikatoren schließen nicht abschließend ein, entzündungshemmende Reagenzien wie steroidale Medikamente wie z. B. corticosteroide wie Dexamethason, ein wirksames Breitbandsteroidal entzündungshemmendes Mittel und antifibrotische Medikamente mit bekannter Effizienz in diabetischen Rattenmodellen, und Methyl Prednisone, Triamcinolone, Hydrokortison und Analoge davon; und nicht steroidale Medikamente wie beispielsweise Ketoprofen, Cyclosporin, Naproxen und Ibuprofin.
- Andere beispielhafte Gewebereaktionsmodifikatoren schließen Neovaskularisationsreagenzien wie Cytokine ein. Cytokine sind Wachstumsfaktoren wie beispielsweise der Transformierungswachstumsfaktor Alpha (TGFA), der epidermale Wachstumsfaktor (EGF), der Vaskularendothelialwachstumsfaktor (VEGF) und der Antitransformationswachstumsfaktor Beta (TGFB). TGFA unterdrückt die Kollagensynthese und stimuliert die Angiogenesis. Es konnte gezeigt werden, daß der epidermale Wachstumsfaktor angebunden an ein festes Substrat signifikant Mobilität und die aktive Konformation beibehält. VEGF stimuliert die Angiogenesis und ist vorteilhaft, da es selektiv die Proliferation der Endothelialzellen und nicht der Fibroblasten oder die Kollagensynthese unterstützt, im Gegensatz zu anderen angiogenen Faktoren. Zusätzlich zur Unterstützung der Wundheilung unterstützt der verbesserte Blutfluß, hervorgerufen durch die Anwesenheit von Neovaskularisationsreagenzien, die Genauigkeit der Sensormessungen.
- Ein anderer Typ der Gewebereaktionsmodifikatoren sind neutralisierte Antikörper einschließlich beispielsweise der Antitransformierungswachstumsfaktor Beta Antikörper (Anti-TGFB); Anti-TGFB Rezeptor Antikörper; und Anti-Fibroblastantikörper (Anti-CD44). Anti-TGFB Antikörper zeigten eine Unterdrückung der Fibroblastproliferation und unterdrückten somit die Fibrose. Aufgrund der Wichtigkeit des TGFB in der Fibrose unterbinden Anti-TGFB Rezeptorantikörper die Fibrose durch Blockierung der TGFB Aktivierung der Fibroblasten. Einige Studien haben gezeigt, daß Anti-CD44 Antikörper den programmierten Zelltod (Apoptosis) in Fibroblasten in vitro induzieren. Daher ist die Verwendung von Anti-CD44 Antikörpern ein neuer Ansatz zur Unterdrückung der Fibroblastenbildung und somit der Fibrose. Ein anderes Antiproliferationsreagenz schließt Mitomicyin C ein, welches die Fibroblastproliferation unter bestimmten Umständen, wie z. B. nach Auftreten der Vaskularisation, unterdrückt.
- Anbindende Liganden („bindende Molekülteile") können gleichfalls als Gewebereaktionsmodifikatoren genutzt werden, wobei die adhesiven Liganden in die Polymerschicht eingearbeitet werden, um direkt die Anhaftung von Endothelialzellen an die implantierte Oberfläche zu ermöglichen. Eine solche Anhaftung unterstützt die Neovaskularisation an der Implantat/Gewebeschnittstelle. Hierbei hat die Oberflächendichte des bindenden Molekülteils einen Einfluß auf die Zellreaktion und die Variation der Dichte der Bindungsstellen erlaubt die Kontrolle der Reaktion. Beispielhafte anlagernde Liganden sind nicht abschließend Arginin-Glycin-Asparaginsäure (RGD) Molekülteile und Arginin-Glutaminsäure-Asparaginsäure-Valin-Molekülteile (REDV), ein Fibronoinpolypeptid. Der REDV Ligand zeigte eine selektive Bindung an menschliche Endothelialzellen, aber keine Bindung an weiche Muskelzellen, Fibroblasten oder Blutplättchen, wenn in geeigneten Mengen eingesetzt.
- Der mindestens eine Gewebereaktionsmodifikator ist kovalent an eine bioaktive Polymerschicht gebunden oder in dieser eingeschlossen. Wie hierin verwendet, bedeutet eine „bioaktive" Polymerschicht eine, welche die Gewebereaktion gegenüber implantierten Materialien kontrollieren kann (verstärken oder unterdrücken).
- Bioaktive Polymere sind allgemein biologisch verträglich, das heißt physiologisch tolerierbar und führen nicht zu einer gegensätzlichen lokalen oder systematischen Reaktion. Der Begriff „Schicht" wie hierin verwendet schließt Blöcke, Flicken, Halbkreise und andere Geometrien ohne Limitierung ein. Während synthetische Polymere wie Poly(tetrafluorethylen), Silikone, Poly(acrylate), Poly(methacrylat), Hydrogele und Derivate davon weitestgehend allgemein eingesetzt werden, werden natürliche Polymere wie Proteine und Kohlenhydrate gleichfalls im Bereich der vorliegenden Erfindung eingesetzt. Die bioaktiven Polymerschichtfunktionen dienen zum Schutz der Implantate und stellen dessen Funktion sicher, minimieren die Proteinabadsorption auf dem Implantat und dienen als eine Stelle zur Bereitstellung von Gewebereaktionsmodifikatoren oder Medikamentenverabreichungsvorrichtungen.
- In einem Ausführungsbeispiel ist der Gewebereaktionsmodifikator kovalent an ein Hydrogel gebunden oder in diesem eingeschlossen. Hydrogele werden durch Polymerisation von hydrophilen und hydrophoben Monomeren gebildet und formen ein Gel, wie beschrieben in US Patent Nr. 4,983,181 und Nr. 4,994,081. Sie bestehen weitestgehend aus Wasser und sind ggf. durch chemische oder physikalische Methoden kreuzvernetzt. Die chemische Verbindung ist durch die freien Radikale einschließlich der Kreuzvernetzung von Diänen wie beispielsweise Ethylenglykoldimethacrylat (EGDMA) und dergleichen verstärkt. Physikalische Kreuzvernetzungen werden durch Copolymerisation eines hydrophoben Co-Monomers mit einem wasserlöslichen Monomer gebildet und durch Kontaktierung des copolymerisierten Gels mit Wasser gebildet. Die physikalische Assoziation der hydrophoben Regionen des Gels resultiert in der Bildung von physikalischen Kreuzvernetzungen. Die Kontrolle der Rate von hydrophilen zu hydrophoben Monomeren erlaubt die Kontrolle der finalen Eigenschaften des Gels. Hoch wassergequollene Hydrogele sind bioaktiv und haben minimalen Einfluß auf die Diffusionsrate von kleinen Molekülen. Hydrogele sind gleichfalls intrinsisch mobil und haben deshalb einen minimalen Effekt auf die assoziierten Peptid Gewebereaktionsmodifikatoren.
- Hydrogele können durch Polymerisation von Monomeren wie 2-Hydroxyethylmethacrylat, 2-Hydroxyethylmethacrylat, fluorinierte Acrylate, Acrylsäure und Methacrylsäure und Kombinationen dieser gebildet werden. Bevorzugte Hydrogele sind Copolymere von 2-Hydroxyethylmethacrylat, wobei das Comonomer ausgewählt wird um die mechanische Festigkeit, die Hydrolysestabilität oder andere mechanische oder chemische Eigenschaften zu verbessern. Bevorzugte Comonomere schließen nicht abschließend 3-Hydroxypropylmethacrylat, N-Vinylpyrrolidon, 2-Hydroxyethylacrylat, Glycerinmethacrylat, n-Isopropylacrylamid, N,N-Dimethylacrylamid, Glycidylmethacrylat und Kombinationen dieser ein. Besonders bevorzugte Hydrogele sind Terpolymere von 2-Hydroxyethylmethacrylat (HEMA), N-Vinylpyrrolidon (NVP) und 2-N-Ethylperfluoroktansulfamidoethylacrylat (FOSA) mit angebundenem EGDMA zur Kontrolle der Kreuzvernetzung. HEMA ist hydrophil und quillt in der Gegenwart von Wasser. Die Hydroxylgruppe des HEMA bietet gleichzeitig eine potentielle Stelle zur kovalenten Anbindung von Gewebereaktionsmodifikatoren, langsamen Freisetzungssystemen und dergleichen. Acrylsäure, Methacrylsäure und andere funktionalisierte Vinylmonomere können gleichfalls eingesetzt werden, um diese Anbindungsseiten zur Verfügung zu stellen. NVP ist ampholytisch, wobei der Rückratring Hydrophobizität und die polare Amidgruppe Hydrophilizität liefert. Poly(vinylpyrrolidon) ist wasserlöslich, physiologisch inaktiv und bildet Komplexe mit einer Zahl von kleinen Molekülen wie Jod und Chlorhexidin. Die Verwendung von NVP verbessert die Festigkeit von polymerisierten HEMA und liefert eine verbesserte Löslichkeit der anderen Monomere unter Bulkpolymerisationsbedingungen.
- Im Stand der Technik bekannte Polymerisationsmethoden können in Abhängigkeit des Implantates genutzt werden. Demgemäß kann für Implantate, die höhere Temperaturen tolerieren, die Polymerisation ggf. durch Wärme in Anwesenheit eines Initiators wie z. B. Azoisobutyronitril (AIBN) initiiert werden. Photoinitiierung durch UV-Licht kann in Anwesentheit eines Initiators wie z. B. Benzoin oder Benzil oder durch sichtbares Licht in Anwesenheit von Initiatoren wie Eosin initiiert werden. Die Anbindung des Hydrogels an das Implantat kann durch mechanische Kraft geschehen, da die Schicht um das Implantat, die während der Herstellung des Hydrogels gebildet wird, deutlich durch die Polymerisation schrumpft.
- In einem weiteren bevorzugten Ausführungsbeispiel sind die Gewebereaktionsmodifikatoren mit einer bioaktiven Polymerschicht assoziiert, welche durch supramolekularen Selbstaufbau hergestellt wird. Die Herstellung von Materialien durch Selbstaufbau führte zu signifikanten Vorteilen in dem Bereich von dünnen Filmen, z. B. da wo die sequentielle Beschichtung von (Poly)kation/(Poly)anion die Einbindung von molekularen Farbstoffen, Nanokristallen, Mikrosphären, geladenen Proteinen und Zellwachstumsfaktoren in größere Strukturen erlaubte. Solch ein Schicht-nach-Schicht – Wachstum von kleinen und großen molekulargewichtigen Komponenten eröffnet einen hohen Grad an Flexibilität in der Herstellung dieser komplexeren Strukturen.
- Elektrostatische Selbstorganisation basiert auf der Wechselwirkung von gegensätzlich geladenen Spezies, die den „Komplex" unlöslich lassen werden gegenüber der Mutterlösung. Diese Technik bietet ein wirkungsvolles Werkzeug zur Herstellung einer Vielzahl von Schicht und Multischichtstrukturen aus Poly(anionen) und Poly(kationen). Diese „fuzzy" Nanoanordnungen zeigen eine signifikante Mischung der gegensätzlich geladenen Polyionenketten. Die starken Metalligandkräfte, die die Selbstorganisation stabilisieren, geben einen Hinweis auf physikalisch kreuzvernetzte Strukturen. Diese Systeme sind auch bei niedrigen pH-Werten und in polaren Lösungsmitteln sehr stabil, und eliminieren die Notwendigkeit der chemischen Kreuzvernetzung zur Erzeugung von räumlicher Stabilität. Die Anordnungen können direkt auf dem Implantat erzeugt werden oder an eine Hydrogelmembran angelagert werden, wodurch eine größere Zahl an Möglichkeiten zur Entwicklung der Membran und der interaktiven Oberflächenhydrogele ermöglicht wird. Die Schichtdicke und andere mikrostrukturellen Charakteristika dieser Anordnung hängen von dem Typ der geladenen Spezies ab, deren Konzentration, pH-Wert, Molekulargewicht, Ionenstärke und dergleichen.
- Ein Beispiel einer bioaktiven Schicht, die durch Selbstorganisation gebildet wurde, ist die Bildung von NAFIONTM/Fe3+ Multischichtfilmen. NAFIONTM ist ein perfluorierter Elektrolyt mit einer Sulphonsäurefunktionalität, welche bisher als semipermeable Membran für elektrochemische Sensoren genutzt wurde. Wie auch immer führt die starke Ionenaustauscheigenschaft von NAFIONTM zur Calcifikation in vitro und in vivo. Die Sulfon(R-SO3)-Gruppen in den hydrophilen Domänen der Membran dienen als Nukleierungspunkt zur Ablagerung von Calciumphosphat. Diese Kristalle scheinen den Metabolitentransport durch die Membran zu unterdrücken und die Membran zu verspröden, was zu rissen führt.
- Elektrostatische Verbindungen von NAFIONTM und Fe3+ aus verdünnten Lösungen von Eisencitrat bei einem pH-Wert in dem Bereich von ungefähr 2 bis ungefähr 6 kann zur Verhinderung der Calciumablagerung eingesetzt werden. Schicht nach Schichtaufbau erlaubt graduelle Spannungsrelaxation und die vollständige Substitution der NAFION-Protonen durch Fe3+, wodurch alle Kalzifikationsstellen deaktiviert werden. Die Verwendung von Eisencitratlösungen bei mildem pH (das heißt bei ungefähr 6) erlaubt die Bildung der Membranen ohne die Deaktivierung der Proteine, Enzyme oder anderen Gewebereaktionsmodifikatoren. Dementsprechend, durch Eintauchen in eine saure NAFIONTM-Lösung (pH ungefähr 3), werden die Substraghydroxalgruppen, das heißt Silanolgruppen (SiOH) partiell protoniert, wodurch starke elektrostatische Kräfte erzeugt werden, die negativ geladene NAFiONTM mit Zellen anziehen. Nach dem Spülen im Wasser zur Entfernung von lose gebundenen Spezies wird das Substrat in eine Eisenchloridlösung getaucht. Die Eisenionen, die durch die Sulfongruppen angezogen werden, kehren die Oberflächenladung um und stellen somit die ursprüngliche Oberflächenladung wieder her. Der ganze Prozeß wird so oft wiederholt, bis die gewünschte Dicke erhalten wird.
- Ein weiterer Polymer (Ligand), der zur Selbstorganisation geeignet ist, ist das Muschelanhaftungsprotein (MAP). Die Selbstorganisation von biologischen Materialien wie dem Muschelanhaftungsprotein erlaubt die Einarbeitung von Materialien, die die Implantatsbiokompatibilität erhöhen. MAP wird durch Blausiegelmuscheln (Mytilus edulis) produziert und weist allgemein 75 bis 85 dekamerische Einheiten mit einer primären Sequenz von KPSY-Hyp-Hyp-T-DOPA auf, wobei Hyp Hydroxyproline und DOPA 3,4-Dihydroxyphenylalanin sind. DOPA ist ein starkes Metallchelatisierungsreagenz, insbesondere mit Ca2+ und Fe3+ und die starke Selbstaggregation von DOPA in der Anwesenheit von Kationen führt zu einer supramolekularen Selbstorganisation. Demgemäß wird ein Substrat, welches Metallchelatisierungsgruppen aufweist, zum Beispiel freie Aminogruppen, hintereinander erst in eine Lösung mit Metallionen (das heißt Ca2+ und Fe3+) getaucht (gefolgt von einem optionalen Waschschritt in frischen Solvenz); und zweitens in eine Lösung aufweisend einen Poly(liganden) (das heißt das MAP-Protein) getaucht, (gefolgt von einem optionalen Waschschritt in frischen Solvent). Die Dicke der Membran ist direkt proportional zu der Zahl der aufeinander gefolgten Tauchzyklen. Die Organisation der Membran kann mit der variablen winkelspektroskopischen Ellipsometrie (VASE), der UV-VIS und der Quartzkristallmikrobalance bestimmt werden. Die starke Chelatisierung zwischen Ca2+ und DOPA in der MAP-Membran führt zu einer wesentlichen Abnahme der Porosität, wodurch kleinen Molekülen wie z. B. Glukose oder Sauerstoff die Permeation ermöglicht wird, wohingegen die Permeation größerer Moleküle unterdrückt wird. Zusätzlich kann die Einführung von geringen Mengen an Kreuzvernetzungen durch die Michael-Addition von benachbarten Lysineinheiten durch leichte Erhöhung des pH-Wertes über 8,5 zur weiteren Feinabstimmung der Permeabilität solcher Anordnungen dienen.
- Der Hauptvorteil von MAP ist, daß man davon ausgeht, daß dieses nicht kalziniert, wie sich am Mangel der starken ionischen Kräfte (das heißt die schwache Acidität der DOPA-Molekülteile) und von Nukleierungsoberflächen in diesen Anordnungen das Wachstum von Phosphatablagerungen in Seewasser verhindern, wodurch dem MAP ermöglicht wird, seine start adhesive Natur zu behalten (niedrige Glasübergangstemperatur). Zusätzlich trägt der Einsatz von Ca2+-Ionen in den Anordnungen des Muschelanhaftungsproteins zur Umkehr der Ca2+-Konzentrationsgradienten in der Implantat/Gewebeinterphase bei. Die Umkehr des Ca2+-Konzentrationsgradienten, gemeinsam mit der schwachen Acidität der DOPA-Molekülteile, sollen als weiteres Abwehrmittel für die Ca3(PO4)2 Bildung in der MAP-Membran dienen. Der Widerstand gegenüber der Calcifikation wurde in vitro (in DMEM Kulturmedium) und in vivo (subkutan in Ratten) evaluiert.
- Huminsäure kann gleichfalls polymerisiert oder selbstorganisierend bioaktive Schichten bilden. Huminsäure oder „Huminsubstanzen" sind heterogene, hoch molekulargewichtige organische Säuren mit einer großen Menge an DOPA und sind widerstandsfähig gegen mikrobischen Abbau. Die bekannte Eigenschaft der Huminsäure, Elektronen von einer Vielzahl von Metallen und organischen Molekülen aufzunehmen und abzugeben, erklärt die Eigenschaft Elektronen zwischen den Humin reduzierenden Mikroorganismen und den Fe(III)-Fe(II)-Oxiden zu transportieren. Es wird davon ausgegangen, daß Huminsäure am biologischen Elektronentransfer als Ergebnis der Elektronenaufnahmefähigkeit der Chinonmolekülteile teilnimmt, wenn diese zum Hydrochinon und zurück reduziert werden. Dies macht die Fe3+/Huminsäure aufgebauten Membranen zu einem attraktiven Bindemittel zur Anbindung von unterschiedlichen Arten von Zellen an die bioaktive Schicht.
- Supramolekulare Hydrogelarchitekturen hoher Ordnung können an der Spitze des MAP oder der Huminsäureschichten unter Verwendung der ausführlich studierten Poly(anionen)/Poly(kationen) Technologie gebunden werden. Geeignete Poly(anionen) schließen Salze der Poly(glutaminsäure) und deren Copolymere mit anderen Aminosäuren ein. Geeignete Poly(kationen) schließen Salze des Polylysin und deren Copolymere mit anderen Aminosäuren ein.
- In einem weiteren Ausführungsbeispiel weist die Gewebeimplantatschnittstelle mehr als eine bioaktive Polymerschicht auf. Beispielsweise wird zuerst eine Muschelanhaftungsproteinschicht selbstorganisierend auf der äußeren Oberfläche des Implantats aufgebracht, gefolgt von einem selbstorganisierten (Poly)anionen/(Poly)kationen-Film. Alternativ kann eine NAFIONTM Schicht zwischen dem Sensor und einem Hydrogel aufgebracht werden. NAFIONTM ist ein Polymer mit niedriger Oberflächenenergie und haftet allgemein nicht in wässriger Umgebung an anderen synthetischen organischen Polymeren. Standardverfahren zur Modifizierung der Oberfläche von Fluoropolymeren wie Poly(tetrafluorethylen) werden entsprechend eingesetzt, um eine funktionale NAFIONTM-Oberfläche zu erhalten, die kovalent andere Polymerschichten binden kann. Das bekannteste eingesetzte Modifizierungsreagenz ist Natrium (kommerziell erhältlich als Tetra-Etch), welches ungesättigte Kohlenwasserstoffketten auf der NAFIONTM-Oberfläche erzeugen. Tropfenfreie Radikalpolymerisation von ungesättigten funktionellen Gruppen mit Hydrogelmonomeren kann beispielsweise zur Adhäsion an NAFIONTM-Oberflächen führen.
- Andere Komponenten wie Poly(ethylenoxid) (PEG), können gleichfalls in die bioaktive Polymerschicht eingebracht werden, um die Proteinabsorption zu minimieren. Poly(ethylenoxid) ist meistens bereits im Hydrogel enthalten, beispielsweise durch Copolymerisation von Vinylmonomeren, welche Poly(ethylenoxid)-Seitenketten haben, wie z. B. Poly(ethylenglykol)methacrylat (welches kommerziell von der Firma Aldrich Chemical Co. bezogen werden kann), oder ein Divinyl-terminiertes Poly(ethylenglykol)makromonomer. Die Copolymerisation von HEMA und Poly(ethylenglykol)methacrylat in der Gegenwart von AIBN führt zu flexibleren, unhydrierten Copolymeren. Das optimale Molekulargewicht und der Gehalt an Poly(ethylenoxid) kann für jede Anwendung durch Proteinabsorptionsstudien bestimmt werden.
- Um weitere chemische Funktionalitäten auf den bioaktiven Polymerschichten bereitzustellen, insbesondere eine Hydrogelschicht, können sowohl Polyvinylalkohol oder Polyethylenimin als makromolekulare oberflächenaktive Substanzen eingesetzt werden. Wenn Hydroxylfunktionalitäten zur Verfügung stehen, wird die Verbindung durch Tresylation gefördert. Poly(ethylenoxid) kann auch an Hydroxylgruppen auf der Oberfläche der Polymerschicht durch Tresylationskupplung mit Jeff-Aminen, einem Amin terminierten Poly(ethylenoxid), welches kommerziell von Huntsmann zu beziehen ist, gegraftet werden.
- Ein weiteres Beispiel für die vorliegende Erfindung ist eine Gewebe/Implantatschnittstelle, die aus einem Implantat besteht, welches eine äußere Oberfläche und ein bioaktives Polymer, insbesondere eines der oben beschriebenen Hydrogele, MAP-Schichten, oder Poly(anionen)/Poly(kationen) Schichten auf der äußeren Oberfläche aufweist, wobei die Anwesentheit der bioaktiven Polymere eine effektive Veränderung der Gewebereaktion ohne Verwendung weiterer Gewebereaktionsmodifikatoren liefert. Insbesondere die Verwendung von einem oder mehrerer dieser Schichten scheint die Biokompatibilität dieser Schichten, die Lebenszeit und/oder die Funktion des Implantats zur erhöhen.
- Da, wo sie eingesetzt werden, können Verbindungen von Gewebereaktionsmodifikatoren mit bioaktiven Polymerschichten zum Beispiel durch physikalische Mittel, das heißt eingeschlossen in die Polymerschicht, oder durch kovalente Anbindung an die bioaktive Polymerschicht und/oder die Oberfläche der bioaktiven Polymerschicht gebunden werden. Einschließung tritt zum Zeitpunkt der Schichtbildung oder zu einem späteren Zeitpunkt, das heißt durch Absorption des Gewebereaktionsmodifikators in die gebildete Schicht, auf. Durch Einstellung des Grades der Kreuzvernetzung der Schicht kann die Diffusionsrate der Schicht zu der Stelle der Implantation kontrolliert werden.
- Kovalente Kupplung, z. B. an Hydrofunktionalitäten der HEMA-Monomere in dem Hydrogel oder der Hydroxylmolekülteile in dem MAP-Protein, kann vorteilhaft dahingehend sein, daß der Bindungsfaktor weiterhin an Zelloberflächenrezeptoren binden kann und so zur Signalübertragung beitragen kann, ohne aus dem Hydrogel auszutreten oder endozytisiert zu werden. Die Kupplung von Peptiden an Hydroxylfunktionalitäten kann durch die bekannten Methoden wie z. B. durch Aktivierung der Hydroxylgruppe im HEMA mit Tresylchlorid in der Gegenwart von Triethylamin, gefolgt durch eine Reaktion mit dem N-Ende eines Peptides, erfolgen. Für die Anhaftungsliganden REDV wird das GREDVY-Molekülteil (Glycin-Arginin-Glutaminsäure-Asparaginsäure-Valin-Tyrosin) verwendet. Der Glycinabschnitt dient als Abstandshalter, während der Tyrosinabschnitt die Anbindung von radioaktiven Jodproben zur Bestimmung der Kupplungseffizienz ermöglicht. Da die Quellraten der Hydrogele stark von dem eingesetzten Lösungsmittel abhängen, erlaubt die Wahl eines passenden Lösungsmittels die Kontrolle der räumlichen Verteilung der gekuppelten Faktoren. Die Verwendung von hoch quellenden Lösungsmitteln wie Dimethylsulfoxid erlaubt eine homogene Verteilung der Faktoren über das Hydrogel, wohingegen die Verwendung von niedrig quellenden Lösungsmitteln wie Dioxan dazu führen, daß die Faktoren weniger abgegrenzt an der Oberfläche des Hydrogels verteilt sind.
- In einem weiteren Ausführungsbeispiel ist der Gewebereaktionsmodifikator in der bioaktiven Polymerschicht als Teil eines kontrollierten Abgabesystems enthalten. Die Verwendung von kontrollierten Abgabesystemen erlaubt kontrollierte, ortsspezifische Bereitstellung von Gewebereaktionsmodifikatoren an der Implantationsstelle, wodurch der biologische Abbau limitiert und die systemischen Nebeneffekte reduziert oder eliminiert werden, und wodurch die therapeutische Reaktion erhöht wird. Die Dauer der Einwirkung und der Dosisspiegel können gleichfalls eingestellt werden, was wichtig zur Kontrolle von Entzündungen und Fibrosen ist. Niedrigere Dosisspiegel sind notwendig für zielgerichtete Bereitstellung (im Gegensatz zur systemischen Verabreichung), wodurch die Kosten der Behandlung verringert werden.
- Mittel zur kontrollierten Freisetzung sind im Stand der Technik bekannt und weisen allgemein biologisch abbaubare Verknüpfungen oder Formen auf, welche das aktive Reagenz durch Abbau an der Implantationsstelle freisetzen. Beispiele für Mittel zur kontrollierten Freisetzung schließen nicht abschließend bioabbaubare Polymere, Nanopartikel und kontrolliert freisetzende Vissikel wie Liposome und Mikrosphären ein. Da viele kontrolliert freisetzende Bereitstellungssysteme hergestellt werden können, um unterschiedliche Freisetzungsraten unter gleichen Bedingungen zu erhalten, kann in einem Beispiel ein einzelner Gewebereaktionsmodifikator mit unterschiedlichen Freisetzungsraten bereitgestellt werden, um ein spezifisches Freisetzungsprofil zu erhalten. In einem weiteren Ausführungsbeispiel wird die Zugängigkeit einer Vielzahl von Gewebereaktionsmodifikatoren durch unterschiedliche Freisetzungsraten der Bereitstellungssysteme reguliert.
- Mikrosphären sind besonders geeignet. Mikrosphären sind mikrometergroße sphärische Artikel, die typischerweise unter Verwendung von natürlichen oder synthetischen Polymeren hergestellt werden und eine effektive Freisetzung einer Vielzahl von Medikamenten einschließlich Dexamethason und einiger Proteine zeigten. Um die Kontrolle über die diversen und dynamischen Prozesse einschließlich der Entzündung, der Reparatur und der Neovaskularisation zu maximieren, können Mischungen von Mikrosphären, welche unterschiedliche Gewebereaktionsmodifikatoren aufweisen, in Kombination eingesetzt werden. Zusätzlich können die Mikrosphären so hergestellt werden, daß die unterschiedlichen Gewebereaktionsmodifikatoren unterschiedliche Freisetzungsraten zeigen, um die unterschiedlichen Phasen der Gewebereaktion zu kontrollieren. Mikrosphären mit einem Durchmesser größer 10 μm werden aktuell bevorzugt. Die Mikrosphären können kovalent an das Implantat oder das Hydrogel gebunden sein oder physikalisch in Hydrogel eingebracht sein. Die Kupplung der Mikrosphären an die interaktiven Hydrogele erfolgt durch Einbringung unterschiedlicher Funktionalitäten in die Oberfläche der Mikrosphären.
- Mikrosphärenbereitstellungssysteme können gekapselt sein, wobei das aktive Reagenz in der Mitte eingebracht ist oder das aktive Reagenz ist in der Polymermatrix dispergiert. Jede Mikrosphäre ist für die Herstellungsmethode, Freisetzungsrate und Dosis des spezifischen Gewebereaktionsmodifikators optimiert. Die Copolymerisationsraten, Partikelgrößen und Arzneimittelbeladungen werden variiert, um die gewünschte Freisetzungsrate des Gewebereaktionsmodifikators zu erhalten. Da kleine Mikrosphären gewöhnlich phagocytisiert und somit von der Einbringungsstelle entfernt werden, besitzen die bevorzugten Mikrosphären einen Durchmesser in der Größenordnung von ungefähr 10 bis ungefähr 100 μm. Die von M. Tsung und D. J. Burgess in J. Pharm., Vol 86, p. 603 (1997) beschriebenen Methoden zur Partikelgrößeneinstellung können eingesetzt werden. SEM, TEM und optische Mikroskopie können zur Bestimmung der Mikrosphärengröße, Schärfe, Oberflächencharakteristik und internen Struktur eingesetzt werden.
- Eine Anzahl von Polymeren zur Verwendung in langsam freisetzenden Mikrosphären schließen nicht abschließend Proteine, wie im US Patent Nr. 5,271,961 offenbart, Polyorthoester, Poly(Milchsäure), Poly(Glycolsäure) Polyanhydride, Polyphosphazene, Polycaprolactone, Polyhydroxybutyrate und Kombinationen dieser ein. Ein bevorzugtes Polymer ist Poly(Milchsäure-Glycolsäure) („PLGA"). PLGA ist bioaktiv, führt selbst nicht zu signifikanten Entzündungsreaktionen, kann mit unterschiedlichen Freisetzungsraten hergestellt werden und ist sowohl für wasserlösliche als auch wasserunlösliche Medikamente geeignet. PLGA Mikrosphärenpreparationen sind kommerziell unter dem Handelsnamen LUPRON-DEPOT® erhältlich und von der Federal Drug Administration (FDA) zur parenteralen Verabreichung freigegeben. Das Verhältnis der Glycolsäure zum Milchsäure, die Partikelgröße, das Molekulargewicht des Polymers und die Medikamentenbeladung können variiert werden, um die gewünschten Freisetzungsraten des Gewebereaktionsmodifikators zu erreichen.
- Modifikationen der PLGA Mikrosphärenoberfläche durch Tresylation erlauben die kovalente Anlagerung von Mikrosphären an Hydroxylgruppen der Hydrogele. Die Anlagerung von Polyethylenamin oder Polyvinylalkohol an die Mikrosphärenoberfläche erfolgt durch die Zugabe dieser Elemente während der Mikrosphärenherstellung. Diese Elemente erlauben die Anbindung an interaktive Oberflächen von Hydrogelen. Kopolymerisation von PLGA mit kleinen Mengen von Glutaminsäure (ungefähr 5%) erlaubt gleichfalls die Kupplung der Mikrosphären an die Hydrogele.
- Die Beschichtung oder Modifizierung der PLGA Mikrosphärenoberfläche erlaubt auch die Einstellung der Biokompatibilität, des biologischen Abbaus und der Freisetzungsrate. Glutaminsäure erzeugt eine negative Ladung auf der Oberfläche der Mikrosphären, wodurch eine Selbstorganisation der Polypeptide ermöglicht wird. Als eine Alternative können Polyethylenamin, Phosphatidsäure oder Phosphatidylinositol an der Oberflächen der Mikrosphären angebracht werden und positive und negative Ladungen hervorrufen. Diese Elemente können an die Mikrosphärenoberflächen durch Einbringung während der Mikrosphärenherstellung angelagert werden.
- Die Herstellung von wasserunlöslichen Gewebereaktionsmodifikatoren wie Dexamethason ist auf die Hydrophobicität dieser Moleküle angewiesen. Eine einfache Öl/Wasseremulsionstechnik wird angewendet, wobei beispielsweise Dexamethason in der internen Ölphase (PLGA/Methylenchlorid) der Emulsion eingeschlossen ist und daher auch nach dem nachfolgenden Abdampfen des Lösungsmittels in den Mikrosphären, wie bei C. Grandfils, et al., in J. Biomedical Materials Research, Vol. 26, p. 467 (1992) beschrieben, enthalten ist. In der Absicht, den Dexamethasongehalt in den Mikrosphären zu erhöhen, wird die Dexamethasonauftragung in die wässrige Phase durch den Wechsel der Ölphase zum Beispiel gegen eine Methylenchlorid/Acetonmischung anstelle des Methylenchlorides reduziert.
- Für hydrophile Gewebereaktionsmodifikatoren wie VEGF und andere Polypeptide wird eine Modifikation der Multiemulsionstechnik wie sie durch Toguchi et al. in J. Pharm. Sci., Vol. 83, p. 636 (1994) beschrieben wird, verwendet, da Polypeptide im allgemeinen wasserlöslich sind und daher in der internen Wasserphase der Wasser/Öl/Wasser-Emulsion eingeschlossen werden müssen. Diese Methode stellt den Polypeptideinschluß in den PLGA Mikrosphären nach anschließender Lösungsmittelentfernung sicher. Während des Einschlusses von VEGF führt die Zugabe von Phosphatidylcholin (PC) als oberflächenaktive Substanz und die Verringerung der Reaktionstemperatur auf 30°C zu einer erhöhten Emulsionsstabilität und führt zu höheren VEGF-Konzentrationen und Aktivität bei dem anschließenden Einschluß in die Mikrosphären. Sucralfat, ein Proteaseinhibitor, kann zur Sicherstellung der Polypeptidaktivität in vivo zugegeben werden. Rattenserum Albumin kann ebenfalls zur Erleichterung der Freisetzungsrate zugegeben werden.
- Zusätzlich zu den oben beschriebenen Methoden hängen allgemeine Methoden zur Herstellung der vorliegenden Gewebe/Implantatschnittstellen von der Natur des Implantats, der Natur der bioaktiven Polymerschichten und der Natur des Gewebereaktionsmodifikators ab. Der Teil des Implantats, der beschichtet werden soll, kann gegossen oder beschichtet werden, oder getränkt oder eingetaucht in eine Monomerlösung werden, gefolgt von der Polymerisation auf dem Implantat. Alternativ kann das Implantat durch Schmelzen, Eintauchen, Abgießen oder Beschichten mit einem polymerisierten Monomer, gefolgt von der Entfernung des Lösungsmittels (wenn anwesend), beschichtet werden. Selbstorganisierende Typen von Polymerbeschichtungen werden allgemein direkt auf der Oberfläche des Implantats ausgebaut. Die Monomer- oder Polymerlösung kann den Gewebereaktionsmodifikator enthalten; hierdurch wird der Modifikator während der Ablagerung eingebaut oder der Gewebereaktionsmodifikator kann von der Schicht nach Abscheidung adsorbiert werden. Die Menge des Gewebereaktionsmodifikators der in die Gewebereaktionsmodifikatorbereitstellungsvorrichtung eingebracht wird, variiert in Abhängigkeit des jeweiligen Gewebereaktionsmodifikators, dem gewünschten therapeutischen Effekt und der Zeitspanne, über welche der Gewebereaktionsmodifikator abgegeben werden soll. Da eine Vielzahl von Vorrichtungen in einer Vielzahl von Größen und Formen zur Kontrolle einer Vielzahl von Gewebereaktionen geeignet ist, hängt das obere und untere Limit von der Aktivität des Gewebereaktionsmodifikators und der Zeitspanne der Freisetzung aus der Vorrichtung in einer bestimmten Anwendung ab. Daher ist es nicht praktikabel, einen Bereich der therapeutisch effektiven Mengen an Gewebereaktionsmodifikatoren anzugeben. Während bioaktive Polymere nahezu alle Geometrien annehmen können, werden Schichten im allgemeinen bevorzugt, welche eine Schichtdicke von ungefähr 0,05 bis ungefähr 5 mm, bevorzugt von ungefähr 0,1 bis ungefähr 1 mm aufweisen.
- Die Bestimmung der präzisen Gewebe/Implantatkonfiguration und die Quantität und Form des Gewebereaktionsmodifikators zur effektiven Kontrolle der Gewebereaktion an der Implantationsstelle liegt im Bereich der Fähigkeiten eines Fachmanns auf dem Gebiet und hängt von der jeweiligen Implantationsstelle, der Zeit, die das Implantat im Körper verbringen soll und dem Implantat an sich ab. Beispielhafte Implantationsstellen umfassen nicht abschließend Teile unterschiedlicher Systeme wie den Gastrointestinaltrakt, einschließlich des Gallentrakts, des Harntrakts, des Genitaltrakts, des zentralen Nervensystems und des endokrinen Systems und Stellen wie Blutgefäße, Knochen und Gelenke, Sehnen, Nerven, Muskeln, den Kopf und Nacken und Organe wie das Herz, die Lunge, die Haut, die Leber, den Magen, Augen, Blut, Blutstammzellen und Knochenmark.
- Beispielhafte Implantate umfassen nicht abschließend Prothesen wie künstliche Gelenke, künstliche Sehnen und Bänder, Zahnimplantate, Blutgefäßprothesen, Herzklappen, Innenohrprothesen, intraokulare Linsen, Brustprothesen, Penis- und Hodenprothesen, und Tracheal-, Laryngeal- und Esophagealprothesen; künstliche Organe wie Herz, Leber, Magen, Niere und Nebenschilddrüsen; und Reparaturmaterialien und Vorrichtungen wie Knochenzement, Knochendefektreparaturen, Knochenplatten zur Fixierung von Frakturen, Herzklappen, Katheter, Nervenregenerationskanäle, Hornhautbandagen, Hautreparaturschablonen und Gerüste zur Gewebsreparatur und Regeneration; und Vorrichtungen wie Herzschrittmacher, implantierbare Medikamentenapplikationssysteme (z. B. für Medikamente, menschliche Wachstumshormone, Insulin, Knochenwachstumsfaktoren und andere Hormone) und Biosensoren. Implantierbare Medikamentenapplikationssysteme sind im US Patent Nr. 3,773,919, Nr. 4,155,992, Nr. 4,379,138, Nr. 4,130,639, Nr. 4,900,556, Nr. 4,186,189, Nr. 5,593,697 und Nr. 5,342,622 offenbart. Biosensoren zur Beobachtung von Werten wie dem Blut pH, der Ionenkonzentration, dem Metabolitenspiegel, klinisch-chemischer Analyte, der Sauerstoffkonzentration, der Kohlendioxidkonzentration, dem Druck und dem Glukosespiegel sind bekannt. Blutglukosespiegel können beispielsweise durch optische Sensoren und elektrochemische Sensoren bestimmt werden. Unterschiedliche UV, HPLC und proteinaktive Untersuchungen sind bekannt oder können zur Quantifizierung der Freisetzungsraten, Konzentration und Aktivitäten der Gewebereaktionsmodifikatoren in vitro und in vivo modifiziert werden.
- Die oben beschriebenen Ausführungsbeispiele allein oder in unterschiedlichen Kombinationen fallen alle in den Bereich der vorliegenden Erfindung. Ein schematisches Diagramm einer beispielhaften Gewebe/Implantatschnittstelle
10 weist ein Implanatat12 und ein Hydrogel14 , wie in1 gezeigt, auf. Der Gewebereaktionsmodifikator16 ist im Hydrogel14 eingeschlossen, wohingegen der Gewebereaktionsmodifikator18 kovalent an das Hydrogel14 gebunden ist. Die kovalente Anlagerung kann permanent oder hydrolisierbar sein. Der Gewebereaktionsmodifikator19 ist mit der Oberfläche des Hydrogels14 verbunden, z. B. durch ionische hydrophile oder hydrophobe Wechselwirkungen. Der Gewebereaktionsmodifikator20 ist in den Mikrosphären22 enthalten, welche im Hydrogel14 eingeschlossen sind; der Gewebereaktionsmodifikator24 ist in den Mikrosphären26 enthalten, welche kovalent an das Hydrogel14 gebunden sind; und der Gewebereaktionsmodifikator28 ist in den Mikrosphären30 enthalten, welche mit dem Hydrogel14 verbunden sind (durch ionische oder hydrophobe Wechselwirkungen). Der Gewebereaktionsmodifikator32 ist in den Nanopartikeln34 enthalten, welche im Hydrogel14 eingeschlossen sind. PEO-Ketten40 und PC-Ketten42 sind kovalent an die äußere Oberfläche des Hydrogels14 gebunden. Adhäsive Liganden44 sind kovalent an eine Vielzahl von PEO-Ketten40 gebunden. In einem weiteren Ausführungsbeispiel sind eine oder mehrere Membranschichten zwischen dem Implantat12 und dem Hydrogel14 (nicht gezeigt) eingebracht. Die Membranschichten können vorteilhafterweise semipermeabel sein und die Diffusion von ausgewählten Molekülen an die Implantatoberfläche zulassen. Der Einschluß anderer bioaktiver Reagenzien in die Gewebe/Implantatschnittstelle hat lokale oder systemische Effekte (z. B. Antibiotika, Sedative, Hormone, entzündungshemmende Mittel, Antimykoside, Analgetika, DNA, RNA und dergleichen) und liegen gleichfalls im Bereich der vorliegenden Erfindung. - Eine schematische Darstellung einer beispielhaften Gewebe/Implantatschnittstelle
100 weist ein Implantat110 , eine Muschelanhaftungsproteinschicht112 und einen abwechselnden Polykation-/Polyanionfilm114 , wie in2 gezeigt, auf. Der Der Polykation-/Polyanionfilm114 weist den Gewebereaktionsmodifikator116 eingeschlossen in Mikrosphären118 auf, welche im Film114 eingelagert sind. Der Gewebereaktionsmodifikator120 (z. B. VEGF) und die Anhaftungsliganden122 sind außerhalb des Polykation-/Polyanionfilms114 anwesend. PEO kann der Anordnung zur Kontrolle der Proteinadhäsion zugegeben werden (nicht gezeigt). - Eine exemplarische Anwendung der vorliegenden Erfindung ist ein Stent, welches zur Offenhaltung eines Blutgefäßes nach einer Ballonangioplastie benutzt wird, wobei zumindest ein Teil der äußeren Oberfläche des Stents eine bioaktive Polymerschicht aufweist, welche mikrosphärengekapselte Medikamente wie z. B. Dexamethason zur Verhinderung der Entzündungsreaktion und zur Verbesserung der Gewebsregeneration (Restinosis) aufweist. Wenn solche Mikrosphären intravenös verabreicht werden, würden sie durch den schnellen Blutfluß weggespült.
- Ein weiteres Beispiel für die Anwendung der oben beschriebenen Gewebs/Implantatschnittstellen weist einen implantierbaren elektrochemischen Blutglukosesensor auf. Vorzugsweise mißt der elektrochemisiche Sensor die Glukosekonzentration im subkutanen Gewebe unter Verwendung der wasserstoffperoxidbasierenden amperomerischen Bestimmung. Diese Sensoren sind hoch spezifisch für Glukose, haben eine kurze Antwortzeit und sind bereits miniaturisiert. Wie in
3 gezeigt, hat ein bevorzugter Sensor330 eine Glukose anzeigende (arbeitende) Elektrode332 , (die Glukose anzeigende Elektrode) und eine Referenzgegenelektrode336 . Die Arbeitselektrode332 kann einen ausgespulten Palladiumdraht334 und die Referenzelektrode336 einen aufgespulten Silber/Silberchloriddraht337 aufweisen. Die Glukoseoxidase ist in der Matrix338 immobilisiert und kann z. B. bovines Serum Albumin/Glutaraldehyd sein. In Anwesenheit von Sauerstoff wird die Glukose durch Enzyme oxidiert und produziert Wasserstoffperoxid (H2O2). Das Wasserstoffperoxid wird anschließend an der Oberfläche der Arbeitselektrode334 oxidiert und produziert einen meßbaren elektrischen Strom, wobei die Strommenge proportional zu der Menge an Glukose an der Elektrode ist. Der Sensor330 hat eine lineare Kennung von 0 bis mindestens 20 millimol (mM) Glukose in vitro mit einer hohen Empfindlichkeit. Sensor330 ist ungefähr 0,5 mm im Durchmesser und kann in Abhängigkeit der Anwendung größer oder kleiner sein. - Wie in
4 im Detail gezeigt, ist zumindest ein Teil des Sensors330 vor der Wechselwirkung mit dem umgebenden Gewebe durch eine selektiv permeable Membran geschützt. Der Platindraht334 beispielsweise ist zumindest mit einer selektiv permeablen Membran320 zum Schutz oder zur Minimierung der Gewebswechselwirkungen beschichtet. Eine beispielhafte selektiv permeable Membran ist ein elektroabgeschiedener Poly(o-phenyldiamin) (PPD) Film, welcher permeabel für Wasserstoffperoxid, jedoch undurchlässig für größere, wechselwirkende und/oder abbauende Moleküle wie Ascorbinsäure, Harnsäure, Proteine und dergleichen ist. - Der gesamte Sensor
330 weist des weiteren eine erste bioaktive Polymerschicht322 auf, welche den Sensor weiter vor wechselwirkenden und/oder beschädigenden Substanzen im Gewebe, wie z. B. Proteine schützt. Wie zuvor beschrieben, ist ein beispielhaftes Material eine perfluorierte ionomere Membran, beispielsweise NAFIONTM, welche vor der Kalzifikation und anderen unerwünschten Wechselwirkungen durch geeignete Modifizierung geschützt ist. Eine zweite bioaktive Polymerschicht344 , z. B. ein Hydrogel, ist direkt auf die Schicht322 aufgebracht. Der Gewebereaktionsmodifikator350 ist kovalent an diese permeable Membran320 , die erste Schicht322 und die zweite Schicht344 gebunden. Der Gewebereaktionsmodifikator352 ist gleichfalls mit der zweiten Schicht344 in einer langsam freisetzenden Form verbunden und ermöglicht eine Langzeitabgabe des Gewebereaktionsmodifikators an der Implantationsstelle. Weitere Glukosesensoren sind im US Patent Nr. 4,703,756 offenbart. - Die Erfindung ist des weiteren durch die nachfolgenden, nicht limitierten Beispiele beschrieben.
- Beispiele
- Beispiel 1 Hydrogelsynthese
- Hydrogele des HEMA, FOSA und NVP (mit unterschiedlichen Monomerverhältnissen) werden unter Verwendung von 0,1 mol AIBN als freier Radikalinitiator als Masse bei 70°C und in Wasser/Dioxan bei 60°C polymerisiert. Nach 12 bis 24 Stunden wird ein kreuzvernetztes Material erhalten, welches in Wasser, Aceton und einer Vielzahl anderer organischer Lösungsmittel unlöslich ist. Das zurückbleibende Monomer wurde durch Quellen in Wasser/Aceton gefolgt vom wiederholten Waschen entfernt. Der Grad der Quellung hängt von den relativen Gewichtsprozenten (Gew.-%) der einzelnen im Gel verwendeten Monomere ab. Die Auswirkung der Hydrogelzusammensetzung (Gew.-% basierend auf der Gesamtmenge an Monomeren) auf das Quellverhalten wurde bestimmt und ist in Tabelle 1 dargestellt.
- Diese Daten zeigen, daß schon ein Anteil von 5% von FOSA Monomer die Quellung in destilliertem Wasser um 10% erniedrigt. Die Zugabe von NVP Monomeren kann die Quellrate in Abhängigkeit des Ladungsverhältnisses des Monomers unterschiedlich stark erhöhen. Die Einbringung von PEG Acrylatmonomeren kann ebenfalls die Quelleigenschaften beeinflussen und gleichzeitig die potentielle Proteinadsorption verringern. Die Daten lassen darauf schließen, daß die vorgeschlagenen Materialien erfolgreich mit bis zu 4 Comonomeren hergestellt werden können und, daß die erhaltenen, gewünschten Hydrogeleigenschaften gut kontrolliert werden können. Diese Hydrogele enthalten gleichfalls restliche Hydroxyfunktionalitäten, die zur kovalenten Anbindung von Gewebereaktionsmodifikatoren und/oder langsame Applikationssysteme unter Verwendung bekannter Methoden dienen können.
- Beispiel 2 Herstellung von HEMA-FOSA Hydrogelen
- Zur Herstellung dieses Gels werden 2,45 g HEMA (Aldrich, eingesetzt wie erhalten), 15 g FOSA („FX-13" von 3M, 3 mal umkristallisiert in Methanol), 0,007 g AIBN (Aldrich, umkristallisiert in Methanol) unter Zugabe von 1,5 ml Dioxan (Aldrich, eingesetzt wie erhalten) gemischt. Die erhaltene Lösung wurde in eine Teflonform gegossen und anschließend bei 70°C für 12 Stunden in den Ofen gegeben. Das Gel wurde anschließend in Wasser und einer Wasser/Acetonmischung gequollen, um das nicht reagierte Monomer und lineare (nicht kreuzvernetzte) Polymere auszuwaschen. Das resultierende Gel quoll bis zum Gleichgewicht in deionisiertem Wasser und hatte eine Dicke von 1 mm. Für die Permeabilitätsmessung wurde ein Kreis von geeigneter Größe (1,5 cm Durchmesser) aus dem Gel ausgestampft.
- Beispiel 3 Bestimmung der Permeabilität von HEMA-FOSA Hydrogelen in vitro
- Zur Bestimmung der Permeabilität der neuen HEMA-FOSA Hydrogele gegenüber Glukose wurde ein freistehender Hydrogelfilm mit einer 1,5 cm großen Polycarbonatmembran mit 10 μm Porengröße unterstützt. Die Permeabilität der HEMA-FOSA Hydrogele gegenüber Glukose wurde unter Verwendung eines einseiten magnetischen Biodialysers (Sialomed Corp.) Diese Vorrichtung besteht aus einer Probenkammer mit einer Öffnung, welche mit dem gestützten HEMA-FOSA Hydrogel verschlossen wird. Wenn der Kammerdeckel aufgeschraubt ist, hält dieser die Membran an der Stelle ohne diese jedoch zu bedecken. Der komplette Apparat wird nun in ein Becherglas mit Dialysepuffer gegeben und es wird bei einer fixen Umdrehungszahl und Temperatur (37°C) gerührt. Über die Zeit diffundiert der Inhalt der Probenkammer in den Puffer. Der Innenraum der Kammer ist mit 1 ml 1 M/l Glukose in einer Phosphatpufferlösung (PBS) gefüllt, in PBS mit physiologisch relevanten Proteinen (Albumin, Alexin, Fibrogen, Fibrin und Fibronektin) in Zellkulturmedien, und in Zellkulturmedien mit Zellen (Vascularendothelialzellen und Fibroblasten). Der Dialysepuffer (B) besteht aus 50 ml derselben Lösung, jedoch ohne Glukose. Diese hohen Probe zu Puffer-Verhältnisse stellen sicher, daß die Änderung in der Glukosekonzentration im Dialysepuffer über die Zeit meßbar ist. Proben (50 μl) des Dialysepuffers werden alle 20 Minuten innerhalb von 2 Stunden gesammelt. Die Konzentration der Glukose in den Dialysepufferproben wird durch einen Beckman Glukoseanalysator II quantifiziert. Unter Verwendung dieses Protokolls werden die Permeabilität der Polycarbonatmembran (als Referenz) von NAFION und HEMA-FOSA Hydrogel bestimmt. Basierend auf diesen Daten sollte die Verwendung von Hydrogelen die Permeabilität gegenüber Glukose aufgrund des hohen Wassergehaltes des Materials nur geringfügig reduzieren.
- Beispiel 4 Herstellung von VEGF-Poly(HEMA)
- VEGF wurde in Hydrogele eingebracht, aufweisend Poly(HEMA) und Sucralfat (als Proteaseinhibitor), durch Inkubation des Hydrogels mit 0,075 μg/μl VEGF. Die Proben wurden für ungefähr 2 Stunden bei Raumtemperatur getrocknet.
- Eine ELISA Prüfung (R&D Systems, Minneapolis, MD) wurde zur Quantifizierung des VEGF während der Herstellung der bioaktiven Schicht oder des langsamen Applikationssystems eingesetzt. Zur Einsparung von VEGF (oder anderer teurer Gewebereaktionsmodifikatoren) wurden Freisetzungsstudien unter Verwendung einer miniaturisierten, Hochdurchflußmethode durchgeführt, wobei Gewebereaktionsmodifikator-Mikrosphärenproben in 12 Bohrlochplatten mit einem Phosphatpuffer (pH 7,4, 37°C) eingebracht wurden und die Volumina zur Aufrechterhaltung der Abgleitbedingungen eingestellt wurden. Zu geeigneten Zeitpunkten wurden die Proben entnommen und auf ihren Gewebereaktionsmodifikatorgehalt untersucht. Zusätzlich wurden die in vitro – Freisetzungsstudien unter Anwesenheit von 1. Protein und 2. Zellen (Leukozyten, vasculare Endothelialzellen und Fibroblasten) durchgeführt, in der Absicht, die in vivo-Umgebung an der Implantat/Gewebeschnittstelle nachzustellen. Die VEGF Aktivität wurde durch Zellproliferationsprüfung in vitro, wie von J. U. Muhlhauser et al., in Circulation Research, Vol. 77, p. 1077 (1995) beschrieben und durch Radioaktivitätsbeobachtung unter Verwendung von 125I-VEGF (New England Nuclear, Boston, MA) in vivo durchgeführt. Ultraviolett (UV) Analysen und Hochdruckflüssigkeitschromatographie (HPLC) Prüfungen sind für die Quantifizierung der Dexamethasonkonzentration in vitro und in vivo erhältlich. Teilkoeffizientendaten können gleichfalls zur Bestimmung der Verteilung des Gewebereaktionsmodifikators während der Herstellung eingesetzt werden.
- Beispiel 5 VEGF – induzierte Neovascularisation in Ratten
- Ein einfaches Hydrogelmodell der lokalen Medikamentenapplikation wurde zur Demonstration eingesetzt, daß die Anwesenheit von VEGF an der Implantat/Gewebeschnittstelle die Neovascularisation in Ratten induziert. Dementsprechend wurde das zuvor beschriebene VEGF-Poly(HEMA) mit Sucralfat subkutan in Sprague-Dawley-Ratten implantiert. Zur Kontrolle von nicht spezifischen Effekten wurden Hydrogele, welche Poly(HEMA) und Sucralfat (ohne VEGF) aufweisen, gleichfalls in Sprague-Dawley-Ratten implantiert. Zwei Wochen nach der Implantation wurden die Tiere getöten und die Implantationsstellen auf Neovascularisation untersucht. Ein Implantat, welches Poly(HEMA) und Sucralfat aufwies, jedoch kein VEGF, zeigte keine nachweisbare Induzierung der Vascularisation. Im Gegensatz dazu Implantate eines Hydrogels, aufweisend Poly(HEMA), Sucralfat und VEGF induzierte massive Neovascularisation im subkutanen Rattengewebe. Diese Daten zeigen klar, daß die Verwendung von angiogenen Faktoren die Vascularisation um das Implantat verbessern.
- Beispiel 6 Herstellung und Charakterisierung eines NAFIONTM-Fe3+ Selbstaufbaus
- NAFIONTM, ein perfluoriertes Ionenaustauschharz (5% w/v in niedrig aliphatischen Alkoholmischungen und Wasser; Gleichgewichtsgewicht von 1100 g Polymer pro Mol SO3H) und Eisenchloridhexahydrat (FeCl3*6H2O) und Eisencitrat wurden von Aldrich bezogen. A. C. S. zertifizierte KCl wurde von Fischer ohne weitere Reinigung bezogen. 28 bis 30 Gew.-% einer wässrigen NH4OH Lösung (Acros) und 35 bis 38% Salzsäure (J. T. Baker) wurden als 1%ige Verdünnung zur Einstellung des pH-Wertes genutzt. Millipor deionisiertes Wasser (Widerstand > 18 M Ω) wurde in allen Experimenten eingesetzt.
- Siliconwafer mit natürlichen Oxiden (100 Orientierung) und Mikroskopiergläser (Fischer) wurden als Substrate für den Selbstaufbau genutzt. Diese wurden in einer Piranha-Lösung (H2SO4/H2O2 (7 : 3)) gereinigt, mit deionisiertem Wasser und Methanol gespült und in deionisiertem Wasser über Nacht aufbewahrt bevor sie im selbstaufbauenden Wachstum ohne weitere Oberflächenmodifikation eingesetzt wurden. 1 mg/ml (9,09*10–4 M), basierend auf dem Molekulargewicht der Wiederholungseinheit NAFIONTM-Lösung wurden durch Verdünnung der erhaltenen Lösung in einer (9 : 1) Methanol/Wassermischung hergestellt und für alle Experimente genutzt. Der pH dieser Lösung wurde durch wässrige NH4OH Lösung eingestellt. Zusätzlich wurde die Ionenstärke der NAFIONTM mit KCl modifiziert. 0,5 g FeCl3*6H2O wurden in 100 ml Wasser gelöst, um eine 5 mg/ml (18,5 10–3 M) Lösung zu ergeben. Gleichzeitig wurde eine Eisencitratlösung hergestellt, wobei der pH dieser Lösung zwischen 2 und 6 durch langsames Zugeben von Base variiert wurde. Hierdurch wurden größtenteils die durch Fe3+ hervorgerufenen Schäden am Glukoseoxidaseenzym minimiert.
- Ein HMSTM Serie programmierbarer Slide Stainer (Carl Zeiss, Inc.) wurde für den Schicht nach Schicht Aufbau von NAFIONTM mit Fe3+ eingesetzt. Der Probenhalter in dem HMSTM Serien Slide Stainer wurde abgedeckt, um die Solvenzverdunstung zu reduzieren, die insbesondere an den Substratecken auftritt, um somit die Qualität des Films zu erhöhen. Jeder Tauchzyklus bestand aus 8 Schritten. Zuerst wurde das Substrat in die NAFIONTM Lösung 15 Minuten eingetaucht, gefolgt von 3 aufeinanderfolgenden Waschschritten, jeweils 1 Minute in Millipor deionisiertem Wasser. Anschließend wurde das Substrat in die Eisenchloridlösung 15 Minuten eingetaucht, wie zuvor gefolgt von 3 Waschschritten. 12 aufeinanderfolgende Tauchzyklen wurden in dieser Studie gewöhnlich eingesetzt. Das Substrat wurde kontinuierlich während des Eintauchzyklusses bewegt, um die Filmqualität zu erhöhen. Nach Beendigung der gewünschten Anzahl von Tauchzyklen wurde das Substrat entfernt und in Millipor Wasser und Methanol gewaschen und mit warmer Luft getrocknet.
- Löslichkeitsstudien in einer Reihe von Lösungsmitteln führten zu dem Schluß, daß abhängig von der dielektrischen Konstante des Lösungsmittels oder der Lösungsmittelmischung NAFIONTM entweder homogene Mischungen, Kolloide oder Ausfällungen bilden. Basierend auf dem 9/1 Methanol/Wasser Solventverhältnis in dieser Studie (ε~38), scheint NAFIONTM eine mizellare Konformation zu erreichen mit einem hydrophoben Fluorcarbonrückgrat auf der Innenseite und polaren Sulfonatgruppen auf der Oberfläche.
- Die alte
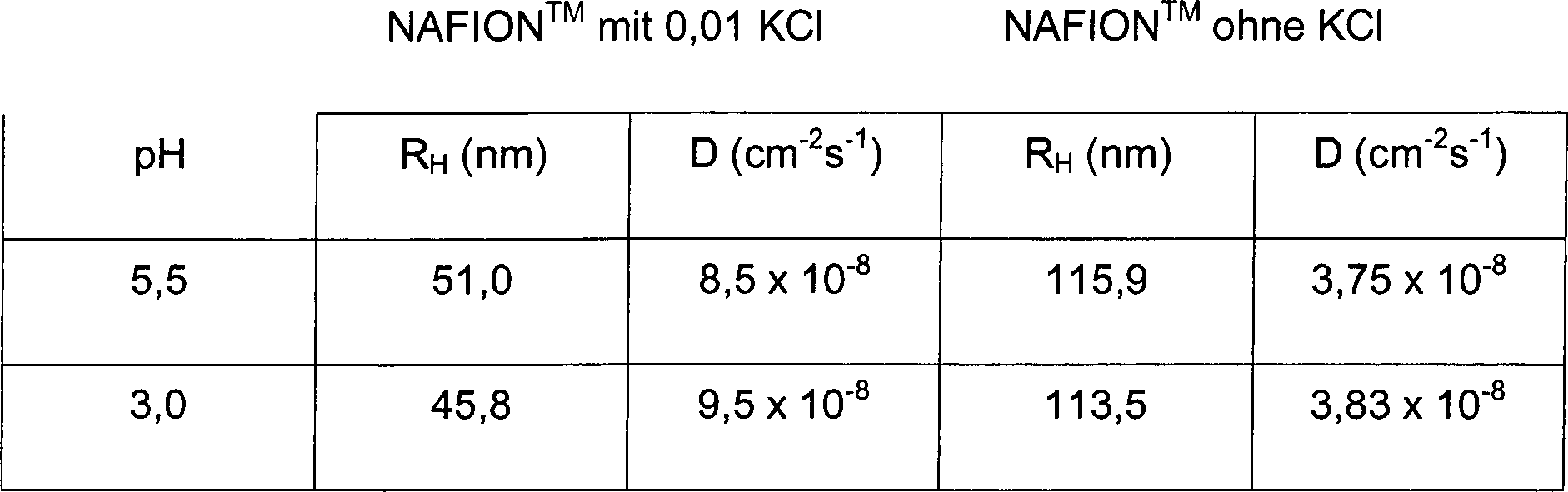
6 zeigt die ellipsometrisch bestimmte Filmdicke als Funktion der Anzahl der Tauchzyklen. Unter Beibehaltung des pH's der FeCl3 Lösung und der Waschlösung scheint der pH-Wert der NAFIONTM Lösung einen deutlichen Einfluß auf das Filmwachstum zu haben. Die schnellste Wachstumsrate wurde bei einem pH-Wert von 3 beobachtet, was ca. 40 nm pro Tauchzyklus entspricht. Ein abrupter Übergang im Filmwachstum wurde bei einem pH-Wert über 4 beobachtet, der zu einer signifikant niedrigeren Abscheidungsrate führte (d. h. 6,7 und 6,3 nm/Tauchzyklus für pH 4,5 bzw. 5,5). - Tabelle 2 zeigt den hydrodynamischen Radius RH und den Diffusionskoeffizienten DH von NAFIONTM Lösung bestimmt durch dynamic light scattering (DLS).
- Der Einfluß des pH auf den hydrodynamischen Radius von NAFIONTM scheint für einen pH von 3 und 5,5 vernachlässigbar. Dies steht im Widerspruch zum streng sauren Charakter der Sulfonatgruppen (die N-Acidität von 12 in Hammett Acidität des NAFIONsTM ist vergleichbar mit der von 100%iger Schwefelsäure) und implementiert einen nahezu vollständigen Ionisationsgrad sowohl für pH 3 als auch pH 5,5. Auf der anderen Seite beginnt die Tendenz von Eisenionen unlösliche Hydroxide zu bilden bei einem pH ≥ 4,3 basierend auf dem Löslichkeitsprodukt von Fe(OH)3(Kspungefähr 6 × 10–39). Diese Transformierung des absorbierten Fe3+ zu Fe(RSO3)x(OH)1–x führt zu einer Erhöhung der Basizität des Substrats. Auf Basis dieser Beobachtung kann der abrupte Übergang zu niedrigen Wachstumsraten der NAFIONTM/Fe3+ Aufbauten im Zusammenhang stehen mit neutralisationsinduzierter NAFIONTM Streuung.
- Die alte
7 zeigt die Filmdicke dieser Anordnungen als Funktions des pH und der Ionenstärke der NAFIONTM Lösung. Die Zugabe 0,01 M KCl zeigte einen deutlichen Einfluß auf die Filmwachstumsrate. Auch der Einfluß der Salzkonzentration auf die Dicke des abgeschiedenen Filmes wurde untersucht, wobei die oberen Werte als optimale Ionenstärke in Abhängigkeit der Filmqualität bestimmt wurden. Bei KCl-Konzentrationen, das heißt 0,1 M, wurde keine Filmabscheidung beobachtet und das Salz wurde vorwiegend auf der Oberfläche abgeschieden. - Der gut dokumentierte Ladungsabschirmungseffekt in Polyelektrolyten als Ergebnis der abnehmenden repulsiven Wechselwirkungen zwischen den negativ geladenen Sulfonatgruppen durch Zugabe von positiv geladenen Ionen (d. h. K+), erlaubt es dem NAFIONTM eine kompaktere Konformation einzunehmen. Dies führt zu einer nahezu 60%igen Reduktion des hydrodynamischen Volumens im Vergleich zur salzfreien Lösung (siehe Tabelle 2). Ein vergleichbarer Anstieg des Diffusionskoeffizienten der NAFIONTM Mizellen impliziert eine größere Diffusionsrate auf der Anordnungsoberfläche. Überraschenderweise korrespondiert die mittlere Wachstumsrate in
2a (pH 3, 0,01 M KCl), welche ca. 47 nm/Tauchzyklus beträgt, annähernd mit dem hydrodynamischen Radius in Tabelle 1. Dies impliziert, daß die Oberflächenadsorption einhergeht mit einer minimalen NAFIONTM Oberflächenverteilung, relativ gesehen zum Nichtsalzfall, wobei eine ungefähr 65%ige Verteilung zu einer Wachstumsrate von 40 nm/Tauchzyklus führt. Der Einfluß des Salzes scheint für unterschiedliche pH-Werte basierend auf der relativen Ionenstärke der oberflächeninduzierten Wechselwirkung, die die Mizellen abflachen und den Ladungsabschirmungskräften, die diese zusammen halten, äquivalent zu sein. Es scheint, daß bei einem pH von 3 der zweite der dominante Effekt zu sein scheint, wobei der Fall sich für ein pH von 4,5 umdreht, wenn die Basizität des Fe(RSO3)x(OH)1–x die Ladungsabschirmungskräfte überragt. Dieses thermodynamisch basierende Modul kann bestimmten kinetisch bedingten Restriktionen unter Berücksichtigung der Mizellenrate an der Oberfläche unterliegen, wie es durch die großen Diffusionskoeffizienten in der Gegenwart von Salz beeinflußt wird. EDAX oder selbstaufbauende NAFIONTM/Fe3+ Filme, behandelt mit einer DMEM Nährstoftlösung, zeigen eine um mehr als zwei Größenordnungen verringerte Intensität der Calciumlinie verglichen mit NAFIONTM, die durch Tauchbeschichtung abgeschieden wurden. - Die alte
8 zeigt die Glukosepermeabilitätsdaten, die mit diesen Anordnungen auf 0,1 μm Glasfasermembranen erhalten wurden. - Beispiel 7 Herstellung und Charakterisierung von Huminsäureselbstaufbauten
- Huminsäurelösungen (1 mg/mL Konzentration) wurden durch Lösung von 1 g Huminsäure (HA, eingesetzt wie erhalten), Natriumsalz (bezogen von Aldrich) in 1 l deionisiertem Wasser erstellt. Der pH-Wert der so erhaltenen Lösung betrug 9,3.
- Der pH-Wert der HA-Lösung kann durch Zugabe von Säure (z. B. HCl) variiert werden, was weitestgehend den Ionisationsgrad der Carboxylgruppe in HA beeinflußt und signifant die molekulare Konformation des Polymers in Lösung verändert. Die erhaltene Nettodicke der abgeschiedenen Filme stieg mit absteigendem pH aufgrund des natürlichen Aufspulens der polyionischen Moleküle als Grad der Ionisationsabnahme. Ein sehr ähnlicher Effekt wird in der Anwesentheit von Salz beobachtet. Salzinduzierte Ladungsabschirmungseffekte erlauben eine kompaktere Spulenkonformation bei gleichem pH und führen daher konsequenterweise zu dickeren Filmen. Quartzkristallmikrobalance/QCM) (
4 ) und ellipsometrische Daten (7 ) unterstützen diese Beobachtung. - Beispiel 8 In vitro Ansprechverhalten gegenüber einem Glukosesensor mit bioaktiver Schicht (voraussichtlich)
- Die Funktion eines Glukosesensors mit bioaktiver Schicht alleine wurde durch Inkubation des Sensors bei 37°C in PBS mit und ohne physiologisch relevante Proteine (Albumin, Alexin, Fibrinogen, Fibrin und Fibroneptin und dergleichen) und in Kulturmedien mit oder ohne physiologisch relevante Zellen (vasculäre Endothelialzellen, Fibroblasten und dergleichen) untersucht. Alle Testpuffer und Kulturmedien enthielten 5,6 mM Glukose. Der Sensor wurde kontinuierlich bei + 0,7 V polarisiert. Um den Sensor zu testen, wurden höhere Mengen steriler Glukoselösung zugesetzt und die Sensitivität (in nA/mM) die Hintergrundspannung und die Antwortzeit des Sensors bestimmt. Die Auswirkung von Verbindungen wir Ascorbinsäure, Harnsäure, Acetaminophen, von denen bekannt ist, daß diese mit Glukosesensoren Wechselwirken, wurden gleichfalls evaluiert, um eine Sensorkonfiguration zu bestimmen, die den besten Schutz gegen elektrochemische Wechselwirkungen bietet.
- Beispiel 9 In vitro Verhalten eines Glukosesensors mit bioaktiver Schicht und Gewebereaktionsmodifikatoren (voraussichtlich)
- Die Adsorption von Schlüsselplasma und Gewebsproteinen an die Implantatsoberfläche und/oder die bioaktive Schicht wurde unter Verwendung von radioaktiv markierten Proteinen, wie z. B. Albumin, der dritten Komponente des Alexin (C3) und Fibrinogen/Fibrin, und Fibronectin, untersucht. Nachdem die allgemeinen Bindungscharakteristika dieser Proteine bestimmt waren, wurde die Fähigkeit der Materialien zur Aktivierung des Alexin und deren Koagulationspfade im Plasma bestimmt.
- Die in vitro Bestimmung, welche Implantat/bioaktive Schicht/Gewebereaktionsmodifikator-Konfiguration die Fibroblastemmigration, Proliferation und Kollagensynthese minimiert und die vasculäre Endothelialzellprofliferation und Migration maximiert, erlaubt die Entwicklung von Implantatkonfigurationen, die die Implantatslebenszeit in vivo optimal erhöhen. Der Einfluß auf die Fibroblasten und vasculäre Endothelialzellproliferation wurde unter Verwendung eines Standard H3 Thymidintests bestimmt. Die Fibroblastensynthese des Kollagens (Typ III und Typ I) wurde unter Hydroxyprolinaufnahme und Verwendung eines ELISA-Tests bestimmt. Die Fibroblast und Vasculärendothelialzellmigration wurden mittels computerunterstützter Videomikroskopie und Mikroträger Fleckenproben bestimmt.
- Beispiel 10 In vivo Gewebsreaktion auf einen Glukosesensor (Kontrolle)
- Zur Charakterisierung der Grundlinie der Gewebsreaktion wurde ein Glukosesensor ohne Gewebereaktionsmodifikator, wie in
1 10 gezeigt, konstruiert, aufweisend eine Glukose-anzeigende (Arbeits) Elektrode12 und eine Referenzgegenelektrode16 . Die Glukoseoxidase wurde in einer Bovin Serum Albumin/Glutaraldehydmatrix18 immobilisiert. Der Sensor10 weist des weiteren eine äußere Membran aus NAFION, welche thermisch bei 120° oder höher zur Verhinderung des in vivo Abbaus konditioniert wurde. Der thermisch behandelte Sensor zeigte eine lineare Empfindlichkeit bis mindestens 20 mM Glukose und eine Flankensteilheit von 3,2 nA/nM mit einem Achsabschnitt von 5,7 nA. Die Antwortzeit des Sensors betrug ungefähr 30 Sekunden und die Zeit zum Abklingen der Hintergrundsspannung und zum Erreichen des stationären Zustands nach der erstmaligen Polarisation betrugt ungefähr 35 Minuten. Der Sensor zeigte eine hohe Selektivität gegenüber Glukose und ein geringer O2 Partialdruck beeinflußte die Empfindlichkeit des Sensors nur für Werte unter 8 mm Hg. - Der Sensor wurde in den Rücken von Hunden implantiert und regelmäßig innerhalb von 10 Tagen getestet. Ca. 45 Minuten wurden zur Spannungsstabilisierung nach der Polarisation in vivo nötig. Nach dieser Zeit wurde ein Bolus mit Glukose intravenös injiziert und der Sensor Output beobachtet. Das Blut wurde periodisch aus einem Dauerkatheter zur Bestimmung des Blutglukosespiegels geprobt. Eine 5 bis 10 minütige Verzögerung wurde zwischen dem Maximum der Blutglukose und dem Sensorsignal beobachtet, was mit der bekannten Verzögerungszeit zwischen Blut und subkutanem Glukosespiegel korrespondiert. Auch die Experimente mit Hunden zeigten, daß die Empfindlichkeit einiger Sensoren für mindestens 10 Tage stabil blieben, wobei andere ausfielen. Diese Unzuverlässigkeit, die alle implantierbaren Glukosesensoren weltweit gemein haben, wird auf die Gewebereaktion gegenüber dem Sensor zurückgeführt.
- Zusätzlich wurden die Sensoren in Sprague-Dawley-Ratten implantiert und Gewebeproben nach einem Tag und einem Monat nach der Implantation entnommen. Die Proben wurden einer traditionellen histopathologischen Untersuchung unter Verwendung eines H und E – Stainings (wie auch eines Trichrom-Stainings) (Fibrin und Kollagenablagerung) untersucht. Einen Tag nach der Implantation wurden massive Entzündungsreaktionen am Gewebe ringum des Sensors beobachtet. Die Entzündungsreaktion wies hauptsächlich polymorphonukleare (PMN) und mononukleare Leukozyten sowie Fibrinablagerungen auf. Einen Monat nach der Implantation waren signifikante chronische Entzündungen und Fibrosen im Gewebe um den Sensor zu beobachten, zusammen mit altem Kollagen und Fibroblasten und einem Verlust an Vasculation. Die chronischen Entzündungen, die nach einem Monat beobachtet wurden, schienen lymphozytischer Natur zu sein.
- Beispiel 11 In vivo Reaktion auf die Implantation eines Glukosesensors mit bioaktiver Schicht und Gewebereaktionsmodifikator (voraussichtlich)
- Diabetes wurde in Ratten durch intraperitoneale Injektion von Streptozotocin (75 mg/kg) 10 Tage vor der Implantation hervorgerufen und mittels Teststreifen beobachtet. Die Tiere wurden des weiteren täglich auf klinische Symptome von Erkrankungen untersucht und Tiere, welche signifikante klinische Erkrankungen zeigten, wurden getötet. Sensoren mit einer semipermeablen Membran und einer bioaktiven Schicht wurden in das interscapulare subkutane Gewebe von betäubten normalen und Diabetesratten implantiert (250 bis 300 g Körpergewicht). Zwei Sensoren pro Ratte wurden implantiert. Zur Minimierung der Gewebsverletzung wurden die Sensoren durch eine Dünnwandnadel (18 bis 20 Gauge) implantiert und die Nadel entfernt, wobei der Sensor verblieb und die Verbindungsdrähte aus der Haut herausragten. Die Drähte wurden an der Haut gesichert, um einen Entfernen der Sensoren zu verhindern. Das Ansprechverhalten der Sensoren wurde an den Tagen 0, 3, 7, 14, 21 und 28 getestet. Während jedem Test wurden die Ratten betäubt und die Sensoren vor der Verabreichung von Glukose an kleine Potentiostaten (Petit Ampere, BAS) angeschlossen und mit 0,7 V beaufschlagt. Der Strom, der durch die Sensoren erzeugt wurde, wurde entweder direkt am Digitaldisplay der Potentiostaten abgelesen oder auf einem Schmalstreifenrecorder aufgenommen. Nach einem Vorlauf von ungefähr 1 Stunde zur Beobachtung eines stabilen Signals wurde eine Glukoselösung (30%ige Lösung, 1 g/kg Körpergewicht) intraperitoneal (I. P.) injiziert. Die Plasmaglukosekonzentration wurde durch Blutproben aus den Hüftvenen mit heparinisierten Pasteur-Pipetten bestimmt. Die Konzentration der Glukose in den Blutproben wurde mittels eines Beckman Glukose Analysators II bestimmt. Das Glycemin der Ratten korreliert mit dem vom Sensor erzeugten Strom. In vivo Studien haben gezeigt, daß der Plasmaglukosespiegel auf ein Plateau ansteigt, das mindestens 10 Minuten hält. Dieses Zeitintervall ist lang genug, um ein Gleichgewicht zwischen dem Plasma und den subkutanen Glukosekonzentrationen herzustellen. Durch Verwendung des Plasmaglukosespiegels und dem korrespondierenden Strom sowohl im Basalstadium als auch in der Spitze, wurde ein in vivo Empfindlichkeitskoeffizient (in nA/mM) und ein extrapolierter Hintergrundsstrom bestimmt.
- Zur besseren Abschätzung der Antwortzeit des Sensors wurde ein intravenöser Glukosetoleranztest (IVGTT) an einigen Tieren vorgenommen. Für diesen Test wurde, vor der Tötung der Tiere am Ende der jeweils 4-wöchigen Studie, ein Katheter in eine Vene der betäubten Ratten eingeführt und Glukose schnell intravenös (I. V.) injiziert. Die I. V. Injektion der Glukose erlaubt eine bessere Bestimmung der Antwortzeit des Sensors, da der Wechsel des Glukosespiegels schneller erfolgt als bei der IP Injektion der Glukose. Das Glycemin der Ratte und der vom Sensor erzeugte Strom wurden gemessen und wie oben korreliert.
- Zusätzlich beeinflußt der Gewebereaktionsmodifikator in vivo teilweise die pharmakokinetischen Daten (PK). Intravenöse und subkutane Lösungs PK Daten im normalen und behandelten Tiermodell (z. B. Ratten) wurden zur Bestimmung der lokal effektiven Konzentration zur Kontrolle von Entzündungen, Fibrosen und der Neovascularisation genutzt und als Ausgangspunkt zur Berechnung der Mikrosphären Arzneimittelbeladung und der Freisetzungsrate verwendet. Lösungs PK Daten sind zur Dekonvolution (mathematische Separation) der Mikrosphären PK Daten notwendig, da Gewebereaktionsmodifikator PKs oftmals in Mikrosphären alternieren.
- Zusätzlich wurde das Objekt und das verbundene Hydrogel in normalen und behandelten Ratten implantiert. Eine Dekonvolution, ein modell-unabhängiger Ansatz und die Wagner-Nelson-Methode wurden zur Analyse des Plasmakonzentrationzeitprofils benutzt. Die Reaktion von normalen Tieren auf die subkutane Implantation mit Hydrogel und angelagertem Gewebereaktionsmodifikator wurde unter Verwendung standardhistologischer Protokolle untersucht.
- Sensoren, die ihre Funktion in vivo verloren, wurden explantiert und das umgebende Gewebe entfernt. Zur Bestimmung der Fehlergründe wurden die explantierten Sensoren in vitro getestet und ihr in vitro Verhalten bestimmt. Einige Sensoren wurden auch zur Oberflächenanalyse zur Bestimmung der chemischen und physikalischen Wechselwirkungen zwischen Sensormembran und interaktivem Hydrogel genutzt.
- Der Zusatz unterschiedlicher Kombinationen von Polymer/Gewebereaktionsmodifikatoren zu Implantaten erlaubt eine extrem einfache, flexible und effektive Möglichkeit zur Kontrolle der Implantat/Gewebeschnittstellen, es verbessert die Implantatlebenszeit und Funktion. Die enge Verbindung der Gewebereaktionsmodifikatoren überwindet die Nachteile der einfachen Injektion dieser Reagenzien an der Implantationsstelle, wo der Blutfluß oder die Muskelbewegung allein schon die Migration der Reagenzien weg von der Implantationsstelle bewirken kann. Für proteinische Reagenzien, die insbesondere dem biologischen Abbau unterliegen, kann die Anbindung des therapeutischen Reagenz an das Implantat einen signifikanten Verlust an Effizienz verhindern.
Claims (27)
- Implantat mit einer Gewebe/Implantatschnittstelle, aufweisend ein Implantat mit einer äußeren Oberfläche und einer sich selbst aufbauenden Polymerschicht mit Metallkationen, wobei die sich selbst aufbauende Polymerschicht mindestens an einem Teil der äußeren Oberfläche angrenzt und wobei die sich selbst aufbauende bioaktive Polymerschicht mindestens einen Gewebereaktionsmodifikator in einer Menge an der Stelle der Implantation bereitstellt, die hinreichend ist, um die Gewebereaktion an der Stelle der Implantation zu kontrollieren.
- Implantat gemäß Anspruch 1, wobei die bioaktive Polymerschicht einen Poly(anion)/Poly(kation)film aufweist.
- Implantat gemäß Anspruch 1, wobei die bioaktive Polymerschicht ein perfluoriertes Harz mit Sulfonsäurefunktionalitäten aufweist.
- Implantat gemäß der Ansprüche 1 bis 3, wobei der Gewebereaktionsmodifikator in einer kontrollierten Freisetzungsform durch Nanopartikel, Emulsionen, Liposome oder Mikrosphären bereitgestellt wird.
- Implantat gemäß Anspruch 2, wobei der Gewebereaktionsmodifikator in einer Mikrosphäre gekapselt ist, physikalisch von einer Mikrosphäre mitgerissen wird oder kovalent an eine Mikrosphäre gebunden ist.
- Implantat gemäß der Ansprüche 1 bis 5, wobei die Gewebereaktion eine Entzündung, eine Fibrose, eine Fibroblastenbildung, eine Fibroblastenfunktion, eine Zellproliferation, eine Neovaskularisation, eine Zellverletzung, Zelltod, eine Leukozytenaktivierung, eine Leukozytenanhaftung, eine Lymphozytenaktivierung, eine Lymphozytenanhaftung, eine Makrophargenaktivierung, eine Makrophargenanhaftung, eine Thrombose, ein Geschwulst, eine Proteinanhaftung an das Implantat oder eine Kombination mit zumindest einer der zuvor beschriebenen Reaktionen ist.
- Implantat gemäß Anspruch 1 bis 5, wobei der Gewebereaktionsmodifikator ein Antifibrosereagenz, ein steroidales entzündungshemmendes Reagenz, ein nicht steroidales entzündungshemmendes Reagenz, ein Antiproliferationsreagenz, ein Zytokin, ein Zytokininhibitor, ein Wachstumsfaktor, ein vaskulärer Wachstumsfaktor, ein neutralisierter Antikörper, ein anhaftender Ligand, ein Hormon, ein zytotoxisches Reagenz oder eine Kombination mit mindestens einem der zuvor genannten ist.
- Implantat gemäß Anspruch 1 bis 5, aufweisend einen Gewebereaktionsmodifikator, der Entzündungen beeinflußt.
- Implantat gemäß Anspruch 1 bis 5, aufweisend einen Gewebereaktionsmodifikator, der die Neovaskularisation beeinflußt.
- Implantat gemäß Anspruch 1 bis 3, erstens aufweisend einen Gewebereaktionsmodifikator, der Entzündungen beeinflußt und zweitens einen Gewebereaktonsmodifikator, der die Neovaskularisation beeinflußt.
- Implantat gemäß Anspruch 1 bis 3, wobei der Gewebereaktionsmodifikator Ketoprofen, Dexamethason, Methylprednison, Triameinolon, Hydrocortison, Cyclosporin, Naproxen, Ibuprofin, Mitomicyin C, Umwandlungswachstumsfaktor Alpha, Antiumwandlungsfaktor Beta, Epidermalwachstumsfaktor, Vaskulärendothelialwachstumsfaktor, Antiumwandlungsfaktor Beta Antikörper, Antifibroblasten Antikörper, Antiumwandlungsfaktor Beta Rezeptor Antikörper, Argininglycinasparaginsäure, REDV oder eine Kombination dieser ist.
- Implantat gemäß Anspruch 1 bis 3, wobei der Gewebereaktionsmodifikator kovalent an die selbstaufbauende bioaktive Polymerschicht gebunden ist, in die selbstaufbauende bioaktive Polymerschicht eingeschlossen ist, mit der äußeren Oberfläche der selbstaufbauenden bioaktiven Polymerschicht verbunden ist oder eine Kombination dieser Möglichkeiten aufweist.
- Implantat gemäß Anspruch 1 bis 3, wobei die selbstaufbauende bioaktive Polymerschicht ein synthetisches Polymer ist.
- Implantat gemäß Anspruch 1, wobei die selbstaufbauende bioaktive Polymerschicht des weiteren kovalent gebundenes Poly(ethlyenoxid), Phosphatidylcholin, Polyvinylalkohol, Polyethylenimin, einen anhaftenden Liganden oder eine Kombination dieser aufweist.
- Implantat gemäß Anspruch 1, wobei die selbstaufbauende bioaktive Polymerschicht ein Muschelanhaftungsprotein ist.
- Implantat gemäß Anspruch 1, wobei die selbstaufbauende bioaktive Polymerschicht aus Huminsäure aufgebaut ist.
- Implantat gemäß Anspruch 1, wobei die selbstaufbauende bioaktive Polymerschicht aus Glutaminsäure aufgebaut ist.
- Implantat gemäß Anspruch 1, wobei die Metallkationen Fe3+ oder Ca2+ sind.
- Implantat gemäß Anspruch 1 bis 3, wobei die Stelle der Implantation der Gastrointestinaltrakt, der Gallentrakt, der Harntrakt, der Genitaltrakt, das zentrale Nervensystem oder das endokrine System ist.
- Implantat gemäß Anspruch 1 bis 3, wobei die Stelle der Implantation Blutgefäße, Knochen, Gelenke, Sehnen, Nerven, Muskeln, der Kopf und der Nacken oder Organe sind.
- Implantat gemäß Anspruch 1 bis 3, wobei das Implantat ein Material ist, eine Prothese, ein künstliches Organ, ein Reparaturapparat, ein implantierbares Arzneiversorgungssystem oder ein Biosensor ist.
- Implantat gemäß Anspruch 1 bis 3, wobei das Implantat des weiteren eine zusätzliche bioaktive Polymerschicht aufweist.
- Implantat gemäß Anspruch 22, wobei die zusätzliche bioaktive Polymerschicht ein Hydrogel ist.
- Implantat gemäß Anspruch 1, zusätzlich aufweisend eine bioaktive Polymerschicht gebildet durch die Polymerisation von 2-Hydroxyethylmethacrylat, 2-Hydroxyethylmethacrylat, fluorierten Acrylaten, Acrylsäure und Methacrylsäure und einer Kombination dieser mit im wesentlichen ungesättigten Co-Monomeren.
- Implantat gemäß Anspruch 24, wobei die bioaktive Polymerschicht durch Copolymerisation von 2-Hydroxyethylmethacrylat mit Hydroxypropylmethacrylat, N-Vinylpyrrolidon, 2-Hydroxyethylacrylat, Glycerolmethacrylat, N-Isopropylacrylamid, N,N-Dimethylacrylamid, Glycidylmethacrylat und einer Kombination dieser gebildet wird.
- Implantat gemäß Anspruch 24, wobei die bioaktive Polymerschicht durch Copolymerisation von 2-Hydroxyethylmethacrylat, N-Vinylpyrrolidon und 2-N-Ethylperfluorooktansulfamidoethylacrylat in Gegenwart von EGDMA gebildet wird.
- Implantat gemäß Anspruch 1, wobei der Biosensor den Blut pH-Wert, die Ionenkonzentration, den Metabolitenspiegel, die Sauerstoffkonzentration, die Kohlendioxidkonzentration, den Druck, einen klinisch-chemischen Analyt oder den Glykosespiegel registriert.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10928998P | 1998-11-20 | 1998-11-20 | |
| US109289P | 1998-11-20 | ||
| PCT/US1999/027542 WO2000030698A1 (en) | 1998-11-20 | 1999-11-19 | Apparatus and method for control of tissue/implant interactions |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69918159D1 DE69918159D1 (de) | 2004-07-22 |
| DE69918159T2 true DE69918159T2 (de) | 2005-03-17 |
Family
ID=22326873
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69924749T Expired - Fee Related DE69924749T2 (de) | 1998-11-20 | 1999-11-19 | Generisch integrierte implantierbare Potentiostatfernmeßanordnung für elektrochemische Fühler |
| DE69918159T Expired - Lifetime DE69918159T2 (de) | 1998-11-20 | 1999-11-19 | Verfahren und vorrichtung zur steuerung der gewebeimplantat-interaktionen |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69924749T Expired - Fee Related DE69924749T2 (de) | 1998-11-20 | 1999-11-19 | Generisch integrierte implantierbare Potentiostatfernmeßanordnung für elektrochemische Fühler |
Country Status (6)
| Country | Link |
|---|---|
| US (2) | US6497729B1 (de) |
| EP (2) | EP1130996B1 (de) |
| AT (2) | ATE269114T1 (de) |
| CA (2) | CA2354060C (de) |
| DE (2) | DE69924749T2 (de) |
| WO (2) | WO2000030532A1 (de) |
Families Citing this family (513)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5593852A (en) * | 1993-12-02 | 1997-01-14 | Heller; Adam | Subcutaneous glucose electrode |
| CA2050057A1 (en) | 1991-03-04 | 1992-09-05 | Adam Heller | Interferant eliminating biosensors |
| JP3348528B2 (ja) * | 1994-07-20 | 2002-11-20 | 富士通株式会社 | 半導体装置の製造方法と半導体装置及び電子回路装置の製造方法と電子回路装置 |
| US5869079A (en) * | 1995-06-02 | 1999-02-09 | Oculex Pharmaceuticals, Inc. | Formulation for controlled release of drugs by combining hydrophilic and hydrophobic agents |
| US6933331B2 (en) * | 1998-05-22 | 2005-08-23 | Nanoproducts Corporation | Nanotechnology for drug delivery, contrast agents and biomedical implants |
| US6001067A (en) | 1997-03-04 | 1999-12-14 | Shults; Mark C. | Device and method for determining analyte levels |
| US7899511B2 (en) | 2004-07-13 | 2011-03-01 | Dexcom, Inc. | Low oxygen in vivo analyte sensor |
| US7192450B2 (en) | 2003-05-21 | 2007-03-20 | Dexcom, Inc. | Porous membranes for use with implantable devices |
| US9155496B2 (en) | 1997-03-04 | 2015-10-13 | Dexcom, Inc. | Low oxygen in vivo analyte sensor |
| US20050033132A1 (en) * | 1997-03-04 | 2005-02-10 | Shults Mark C. | Analyte measuring device |
| US6862465B2 (en) | 1997-03-04 | 2005-03-01 | Dexcom, Inc. | Device and method for determining analyte levels |
| US7657297B2 (en) * | 2004-05-03 | 2010-02-02 | Dexcom, Inc. | Implantable analyte sensor |
| US8527026B2 (en) | 1997-03-04 | 2013-09-03 | Dexcom, Inc. | Device and method for determining analyte levels |
| US7722671B1 (en) * | 1998-01-27 | 2010-05-25 | St. Jude Medical, Inc. | Medical devices with associated growth factors |
| US6134461A (en) | 1998-03-04 | 2000-10-17 | E. Heller & Company | Electrochemical analyte |
| US6175752B1 (en) | 1998-04-30 | 2001-01-16 | Therasense, Inc. | Analyte monitoring device and methods of use |
| US8480580B2 (en) | 1998-04-30 | 2013-07-09 | Abbott Diabetes Care Inc. | Analyte monitoring device and methods of use |
| US8465425B2 (en) | 1998-04-30 | 2013-06-18 | Abbott Diabetes Care Inc. | Analyte monitoring device and methods of use |
| US6949816B2 (en) | 2003-04-21 | 2005-09-27 | Motorola, Inc. | Semiconductor component having first surface area for electrically coupling to a semiconductor chip and second surface area for electrically coupling to a substrate, and method of manufacturing same |
| US8974386B2 (en) | 1998-04-30 | 2015-03-10 | Abbott Diabetes Care Inc. | Analyte monitoring device and methods of use |
| US8346337B2 (en) | 1998-04-30 | 2013-01-01 | Abbott Diabetes Care Inc. | Analyte monitoring device and methods of use |
| US8688188B2 (en) | 1998-04-30 | 2014-04-01 | Abbott Diabetes Care Inc. | Analyte monitoring device and methods of use |
| US9066695B2 (en) | 1998-04-30 | 2015-06-30 | Abbott Diabetes Care Inc. | Analyte monitoring device and methods of use |
| WO2000043539A2 (en) * | 1999-01-25 | 2000-07-27 | Biochip Technologies Gmbh | Immobilization of molecules on surfaces via polymer brushes |
| SE0000285D0 (sv) * | 1999-12-07 | 2000-01-31 | Mika Lahtinen | Medical implant |
| DE10015816A1 (de) * | 2000-03-30 | 2001-10-18 | Infineon Technologies Ag | Biosensorchip |
| US6726918B1 (en) | 2000-07-05 | 2004-04-27 | Oculex Pharmaceuticals, Inc. | Methods for treating inflammation-mediated conditions of the eye |
| US9008786B2 (en) * | 2000-08-21 | 2015-04-14 | Cochlear Limited | Determining stimulation signals for neural stimulation |
| AUPQ952800A0 (en) | 2000-08-21 | 2000-09-14 | Cochlear Limited | Power efficient electrical stimulation |
| US8285382B2 (en) * | 2000-08-21 | 2012-10-09 | Cochlear Limited | Determining stimulation signals for neural stimulation |
| DE60114229T2 (de) | 2000-11-29 | 2006-07-06 | Allergan, Inc., Irvine | Verhinderung von transplantatabstossung im auge |
| US6560471B1 (en) * | 2001-01-02 | 2003-05-06 | Therasense, Inc. | Analyte monitoring device and methods of use |
| GB0100761D0 (en) | 2001-01-11 | 2001-02-21 | Biocompatibles Ltd | Drug delivery from stents |
| US20030089030A1 (en) * | 2001-03-22 | 2003-05-15 | Jordan Frederick L. | Method and composition for using organic, plant-derived, oil-extracted materials in resid fuels for reduced emissions |
| EP1397068A2 (de) | 2001-04-02 | 2004-03-17 | Therasense, Inc. | Gerät und verfahren zur blutzuckerverfolgung |
| US7259448B2 (en) * | 2001-05-07 | 2007-08-21 | Broadcom Corporation | Die-up ball grid array package with a heat spreader and method for making the same |
| US6656506B1 (en) | 2001-05-09 | 2003-12-02 | Advanced Cardiovascular Systems, Inc. | Microparticle coated medical device |
| AUPR604801A0 (en) * | 2001-06-29 | 2001-07-26 | Cochlear Limited | Multi-electrode cochlear implant system with distributed electronics |
| US6444318B1 (en) * | 2001-07-17 | 2002-09-03 | Surmodics, Inc. | Self assembling monolayer compositions |
| US7858679B2 (en) | 2001-07-20 | 2010-12-28 | Northwestern University | Polymeric compositions and related methods of use |
| US8815793B2 (en) | 2001-07-20 | 2014-08-26 | Northwestern University | Polymeric compositions and related methods of use |
| US7618937B2 (en) | 2001-07-20 | 2009-11-17 | Northwestern University | Peptidomimetic polymers for antifouling surfaces |
| US6702857B2 (en) | 2001-07-27 | 2004-03-09 | Dexcom, Inc. | Membrane for use with implantable devices |
| US20030032874A1 (en) | 2001-07-27 | 2003-02-13 | Dexcom, Inc. | Sensor head for use with implantable devices |
| US6670179B1 (en) * | 2001-08-01 | 2003-12-30 | University Of Kentucky Research Foundation | Molecular functionalization of carbon nanotubes and use as substrates for neuronal growth |
| US6913626B2 (en) * | 2001-08-14 | 2005-07-05 | Mcghan Jim J. | Medical implant having bioabsorbable textured surface |
| US7563457B2 (en) * | 2001-10-02 | 2009-07-21 | The Regents Of The University Of California | Nanoparticle assembled hollow spheres |
| JP2005518827A (ja) * | 2001-10-05 | 2005-06-30 | サーモディクス,インコーポレイテッド | 粒子固定化コーティングおよびその使用 |
| EP1434607A1 (de) * | 2001-10-11 | 2004-07-07 | Straumann Holding AG | Osteophile implantate |
| NL1019316C2 (nl) * | 2001-11-06 | 2003-05-07 | Tno | Een vasculaire prothese. |
| US6948079B2 (en) * | 2001-12-26 | 2005-09-20 | Intel Corporation | Method and apparatus for providing supply voltages for a processor |
| US20080255438A1 (en) * | 2001-12-27 | 2008-10-16 | Medtronic Minimed, Inc. | System for monitoring physiological characteristics |
| US7399277B2 (en) * | 2001-12-27 | 2008-07-15 | Medtronic Minimed, Inc. | System for monitoring physiological characteristics |
| US20050239155A1 (en) * | 2002-01-04 | 2005-10-27 | Javier Alarcon | Entrapped binding protein as biosensors |
| US20030153026A1 (en) * | 2002-01-04 | 2003-08-14 | Javier Alarcon | Entrapped binding protein as biosensors |
| WO2003061840A1 (en) * | 2002-01-22 | 2003-07-31 | Talton James D Ph D | Method of pulsed laser assisted surface modification |
| US8271202B1 (en) | 2002-02-11 | 2012-09-18 | Fernandez Dennis S | Modified host bio-data management |
| US8010174B2 (en) | 2003-08-22 | 2011-08-30 | Dexcom, Inc. | Systems and methods for replacing signal artifacts in a glucose sensor data stream |
| US7613491B2 (en) | 2002-05-22 | 2009-11-03 | Dexcom, Inc. | Silicone based membranes for use in implantable glucose sensors |
| US9247901B2 (en) | 2003-08-22 | 2016-02-02 | Dexcom, Inc. | Systems and methods for replacing signal artifacts in a glucose sensor data stream |
| US9282925B2 (en) | 2002-02-12 | 2016-03-15 | Dexcom, Inc. | Systems and methods for replacing signal artifacts in a glucose sensor data stream |
| US8364229B2 (en) | 2003-07-25 | 2013-01-29 | Dexcom, Inc. | Analyte sensors having a signal-to-noise ratio substantially unaffected by non-constant noise |
| US8260393B2 (en) | 2003-07-25 | 2012-09-04 | Dexcom, Inc. | Systems and methods for replacing signal data artifacts in a glucose sensor data stream |
| US7396537B1 (en) * | 2002-02-28 | 2008-07-08 | The Trustees Of The University Of Pennsylvania | Cell delivery patch for myocardial tissue engineering |
| AU2003234176A1 (en) * | 2002-04-22 | 2003-11-03 | The Children's Hospital Of Philadelphia | Low profile combination device for gastrostomy or jejunostomy applications having anti-granuloma formation characteristics |
| US20070227907A1 (en) * | 2006-04-04 | 2007-10-04 | Rajiv Shah | Methods and materials for controlling the electrochemistry of analyte sensors |
| US7813780B2 (en) * | 2005-12-13 | 2010-10-12 | Medtronic Minimed, Inc. | Biosensors and methods for making and using them |
| US9492111B2 (en) * | 2002-04-22 | 2016-11-15 | Medtronic Minimed, Inc. | Methods and materials for stabilizing analyte sensors |
| ATE515277T1 (de) | 2002-05-24 | 2011-07-15 | Angiotech Int Ag | Zusammensetzungen und verfahren zum beschichten von medizinischen implantaten |
| US8313760B2 (en) | 2002-05-24 | 2012-11-20 | Angiotech International Ag | Compositions and methods for coating medical implants |
| US8911831B2 (en) | 2002-07-19 | 2014-12-16 | Northwestern University | Surface independent, surface-modifying, multifunctional coatings and applications thereof |
| US20060034807A1 (en) * | 2002-08-09 | 2006-02-16 | Ottawa Health Research Institute | Innervated artificial tissues and uses thereof |
| US7482427B2 (en) | 2002-08-20 | 2009-01-27 | Biosurface Engineering Technologies, Inc. | Positive modulator of bone morphogenic protein-2 |
| US7981862B2 (en) | 2003-08-19 | 2011-07-19 | Biosurface Engineering Technologies, Inc. | Composition comprising BMP-2 amplifier/co-activator for enhancement of osteogenesis |
| US7598224B2 (en) * | 2002-08-20 | 2009-10-06 | Biosurface Engineering Technologies, Inc. | Dual chain synthetic heparin-binding growth factor analogs |
| US8227411B2 (en) | 2002-08-20 | 2012-07-24 | BioSurface Engineering Technologies, Incle | FGF growth factor analogs |
| US7862831B2 (en) * | 2002-10-09 | 2011-01-04 | Synthasome, Inc. | Method and material for enhanced tissue-biomaterial integration |
| US9237865B2 (en) * | 2002-10-18 | 2016-01-19 | Medtronic Minimed, Inc. | Analyte sensors and methods for making and using them |
| US20050272989A1 (en) * | 2004-06-04 | 2005-12-08 | Medtronic Minimed, Inc. | Analyte sensors and methods for making and using them |
| US8105652B2 (en) * | 2002-10-24 | 2012-01-31 | Massachusetts Institute Of Technology | Methods of making decomposable thin films of polyelectrolytes and uses thereof |
| US7381184B2 (en) | 2002-11-05 | 2008-06-03 | Abbott Diabetes Care Inc. | Sensor inserter assembly |
| US7708974B2 (en) | 2002-12-10 | 2010-05-04 | Ppg Industries Ohio, Inc. | Tungsten comprising nanomaterials and related nanotechnology |
| US7468210B1 (en) * | 2002-12-10 | 2008-12-23 | Biosurface Engineering Technologies, Inc. | Cross-linked heparin coatings and methods |
| US7578912B2 (en) * | 2002-12-30 | 2009-08-25 | California Institute Of Technology | Electro-active sensor, method for constructing the same; apparatus and circuitry for detection of electro-active species |
| AU2003303597A1 (en) | 2002-12-31 | 2004-07-29 | Therasense, Inc. | Continuous glucose monitoring system and methods of use |
| US8771183B2 (en) | 2004-02-17 | 2014-07-08 | Abbott Diabetes Care Inc. | Method and system for providing data communication in continuous glucose monitoring and management system |
| US20050048099A1 (en) | 2003-01-09 | 2005-03-03 | Allergan, Inc. | Ocular implant made by a double extrusion process |
| US20040185013A1 (en) * | 2003-01-30 | 2004-09-23 | Burgio Paul A. | Dental whitening compositions and methods |
| US20040151691A1 (en) * | 2003-01-30 | 2004-08-05 | Oxman Joel D. | Hardenable thermally responsive compositions |
| US7223826B2 (en) * | 2003-01-30 | 2007-05-29 | 3M Innovative Properties Company | Amide-functional polymers, compositions, and methods |
| DE10305810A1 (de) * | 2003-02-12 | 2004-08-26 | Ethicon Gmbh | Knochenfüllmaterial |
| US7134999B2 (en) | 2003-04-04 | 2006-11-14 | Dexcom, Inc. | Optimized sensor geometry for an implantable glucose sensor |
| DE10322182A1 (de) * | 2003-05-16 | 2004-12-02 | Blue Membranes Gmbh | Verfahren zur Herstellung von porösem, kohlenstoffbasiertem Material |
| DE202004009060U1 (de) * | 2003-05-16 | 2004-08-12 | Blue Membranes Gmbh | Biokompatibel beschichtete medizinische Implantate |
| DE202004009059U1 (de) * | 2003-05-16 | 2004-09-16 | Blue Membranes Gmbh | Mit kohlenstoffbasiertem Material beschichtete Substrate |
| US7875293B2 (en) | 2003-05-21 | 2011-01-25 | Dexcom, Inc. | Biointerface membranes incorporating bioactive agents |
| EA009836B1 (ru) * | 2003-05-28 | 2008-04-28 | Синвеншн Аг | Имплантаты с функционализированными углеродными поверхностями |
| US8066639B2 (en) | 2003-06-10 | 2011-11-29 | Abbott Diabetes Care Inc. | Glucose measuring device for use in personal area network |
| US7695239B2 (en) * | 2003-07-14 | 2010-04-13 | Fortrend Engineering Corporation | End effector gripper arms having corner grippers which reorient reticle during transfer |
| US7074307B2 (en) | 2003-07-25 | 2006-07-11 | Dexcom, Inc. | Electrode systems for electrochemical sensors |
| US8423113B2 (en) | 2003-07-25 | 2013-04-16 | Dexcom, Inc. | Systems and methods for processing sensor data |
| US8282549B2 (en) * | 2003-12-09 | 2012-10-09 | Dexcom, Inc. | Signal processing for continuous analyte sensor |
| US9763609B2 (en) | 2003-07-25 | 2017-09-19 | Dexcom, Inc. | Analyte sensors having a signal-to-noise ratio substantially unaffected by non-constant noise |
| US7778680B2 (en) | 2003-08-01 | 2010-08-17 | Dexcom, Inc. | System and methods for processing analyte sensor data |
| US8676287B2 (en) | 2003-08-01 | 2014-03-18 | Dexcom, Inc. | System and methods for processing analyte sensor data |
| US7494465B2 (en) | 2004-07-13 | 2009-02-24 | Dexcom, Inc. | Transcutaneous analyte sensor |
| US9135402B2 (en) | 2007-12-17 | 2015-09-15 | Dexcom, Inc. | Systems and methods for processing sensor data |
| US8275437B2 (en) | 2003-08-01 | 2012-09-25 | Dexcom, Inc. | Transcutaneous analyte sensor |
| US7774145B2 (en) | 2003-08-01 | 2010-08-10 | Dexcom, Inc. | Transcutaneous analyte sensor |
| US8369919B2 (en) | 2003-08-01 | 2013-02-05 | Dexcom, Inc. | Systems and methods for processing sensor data |
| US20070208245A1 (en) * | 2003-08-01 | 2007-09-06 | Brauker James H | Transcutaneous analyte sensor |
| US20190357827A1 (en) | 2003-08-01 | 2019-11-28 | Dexcom, Inc. | Analyte sensor |
| US8160669B2 (en) * | 2003-08-01 | 2012-04-17 | Dexcom, Inc. | Transcutaneous analyte sensor |
| US8845536B2 (en) | 2003-08-01 | 2014-09-30 | Dexcom, Inc. | Transcutaneous analyte sensor |
| US8285354B2 (en) | 2003-08-01 | 2012-10-09 | Dexcom, Inc. | System and methods for processing analyte sensor data |
| US8761856B2 (en) | 2003-08-01 | 2014-06-24 | Dexcom, Inc. | System and methods for processing analyte sensor data |
| US20080119703A1 (en) | 2006-10-04 | 2008-05-22 | Mark Brister | Analyte sensor |
| US7591801B2 (en) * | 2004-02-26 | 2009-09-22 | Dexcom, Inc. | Integrated delivery device for continuous glucose sensor |
| US8233959B2 (en) | 2003-08-22 | 2012-07-31 | Dexcom, Inc. | Systems and methods for processing analyte sensor data |
| US20140121989A1 (en) | 2003-08-22 | 2014-05-01 | Dexcom, Inc. | Systems and methods for processing analyte sensor data |
| US7920906B2 (en) | 2005-03-10 | 2011-04-05 | Dexcom, Inc. | System and methods for processing analyte sensor data for sensor calibration |
| US20050124896A1 (en) * | 2003-08-25 | 2005-06-09 | Jacob Richter | Method for protecting implantable sensors and protected implantable sensors |
| US20050090607A1 (en) * | 2003-10-28 | 2005-04-28 | Dexcom, Inc. | Silicone composition for biocompatible membrane |
| EP1682161A4 (de) * | 2003-10-29 | 2011-12-07 | Gentis Inc | Polymerisierbare emulsionen für die gewebeherstellung |
| US7299082B2 (en) | 2003-10-31 | 2007-11-20 | Abbott Diabetes Care, Inc. | Method of calibrating an analyte-measurement device, and associated methods, devices and systems |
| USD914881S1 (en) | 2003-11-05 | 2021-03-30 | Abbott Diabetes Care Inc. | Analyte sensor electronic mount |
| EP1689321B1 (de) * | 2003-11-07 | 2017-01-04 | The University of Connecticut | Künstliche gewebesysteme und ihre verwendungen |
| US20070224278A1 (en) | 2003-11-12 | 2007-09-27 | Lyons Robert T | Low immunogenicity corticosteroid compositions |
| US20050101582A1 (en) | 2003-11-12 | 2005-05-12 | Allergan, Inc. | Compositions and methods for treating a posterior segment of an eye |
| US9247900B2 (en) | 2004-07-13 | 2016-02-02 | Dexcom, Inc. | Analyte sensor |
| WO2005051170A2 (en) | 2003-11-19 | 2005-06-09 | Dexcom, Inc. | Integrated receiver for continuous analyte sensor |
| EP2256493B1 (de) | 2003-12-05 | 2014-02-26 | DexCom, Inc. | Kalibrierverfahren für einen kontinuierlichen Analytsensor |
| US8423114B2 (en) | 2006-10-04 | 2013-04-16 | Dexcom, Inc. | Dual electrode system for a continuous analyte sensor |
| US8364231B2 (en) | 2006-10-04 | 2013-01-29 | Dexcom, Inc. | Analyte sensor |
| US11633133B2 (en) | 2003-12-05 | 2023-04-25 | Dexcom, Inc. | Dual electrode system for a continuous analyte sensor |
| US8287453B2 (en) | 2003-12-05 | 2012-10-16 | Dexcom, Inc. | Analyte sensor |
| US8084513B2 (en) * | 2003-12-30 | 2011-12-27 | Beisang Arthur A | Implant filling material and method |
| US7988986B2 (en) * | 2003-12-30 | 2011-08-02 | Beisang Arthur A | Implant filling material and method |
| JP2007518804A (ja) | 2004-01-20 | 2007-07-12 | アラーガン、インコーポレイテッド | トリアムシノロンアセトニドおよびヒアルロン酸を好ましく含有する眼局所治療用組成物 |
| US7699964B2 (en) | 2004-02-09 | 2010-04-20 | Abbott Diabetes Care Inc. | Membrane suitable for use in an analyte sensor, analyte sensor, and associated method |
| US8165651B2 (en) | 2004-02-09 | 2012-04-24 | Abbott Diabetes Care Inc. | Analyte sensor, and associated system and method employing a catalytic agent |
| US20080227696A1 (en) | 2005-02-22 | 2008-09-18 | Biosurface Engineering Technologies, Inc. | Single branch heparin-binding growth factor analogs |
| WO2009048462A1 (en) | 2007-10-09 | 2009-04-16 | Dexcom, Inc. | Integrated insulin delivery system with continuous glucose sensor |
| US8808228B2 (en) | 2004-02-26 | 2014-08-19 | Dexcom, Inc. | Integrated medicament delivery device for use with continuous analyte sensor |
| US20050208093A1 (en) | 2004-03-22 | 2005-09-22 | Thierry Glauser | Phosphoryl choline coating compositions |
| US20050224370A1 (en) * | 2004-04-07 | 2005-10-13 | Jun Liu | Electrochemical deposition analysis system including high-stability electrode |
| US8048437B2 (en) * | 2004-04-21 | 2011-11-01 | Richard Nagler | Medical device with surface coating comprising bioactive compound |
| US6984299B2 (en) * | 2004-04-27 | 2006-01-10 | Advanced Technology Material, Inc. | Methods for determining organic component concentrations in an electrolytic solution |
| US20050244458A1 (en) * | 2004-04-30 | 2005-11-03 | Allergan, Inc. | Sustained release intraocular implants and methods for treating ocular neuropathies |
| US20050244463A1 (en) | 2004-04-30 | 2005-11-03 | Allergan, Inc. | Sustained release intraocular implants and methods for treating ocular vasculopathies |
| US8591885B2 (en) | 2004-04-30 | 2013-11-26 | Allergan, Inc. | Carbonic anhydrase inhibitor sustained release intraocular drug delivery systems |
| US8673341B2 (en) | 2004-04-30 | 2014-03-18 | Allergan, Inc. | Intraocular pressure reduction with intracameral bimatoprost implants |
| US7771742B2 (en) | 2004-04-30 | 2010-08-10 | Allergan, Inc. | Sustained release intraocular implants containing tyrosine kinase inhibitors and related methods |
| US7435320B2 (en) | 2004-04-30 | 2008-10-14 | Advanced Technology Materials, Inc. | Methods and apparatuses for monitoring organic additives in electrochemical deposition solutions |
| US8425929B2 (en) | 2004-04-30 | 2013-04-23 | Allergan, Inc. | Sustained release intraocular implants and methods for preventing retinal dysfunction |
| US7799336B2 (en) | 2004-04-30 | 2010-09-21 | Allergan, Inc. | Hypotensive lipid-containing biodegradable intraocular implants and related methods |
| US20050244469A1 (en) | 2004-04-30 | 2005-11-03 | Allergan, Inc. | Extended therapeutic effect ocular implant treatments |
| US8147865B2 (en) | 2004-04-30 | 2012-04-03 | Allergan, Inc. | Steroid-containing sustained release intraocular implants and related methods |
| US7993634B2 (en) | 2004-04-30 | 2011-08-09 | Allergan, Inc. | Oil-in-oil emulsified polymeric implants containing a hypotensive lipid and related methods |
| US8722097B2 (en) | 2004-04-30 | 2014-05-13 | Allergan, Inc. | Oil-in-water method for making polymeric implants containing a hypotensive lipid |
| US8512738B2 (en) | 2004-04-30 | 2013-08-20 | Allergan, Inc. | Biodegradable intravitreal tyrosine kinase implants |
| US8119154B2 (en) | 2004-04-30 | 2012-02-21 | Allergan, Inc. | Sustained release intraocular implants and related methods |
| US9498457B2 (en) | 2004-04-30 | 2016-11-22 | Allergan, Inc. | Hypotensive prostamide-containing biodegradable intraocular implants and related implants |
| US20050245799A1 (en) * | 2004-05-03 | 2005-11-03 | Dexcom, Inc. | Implantable analyte sensor |
| US8792955B2 (en) | 2004-05-03 | 2014-07-29 | Dexcom, Inc. | Transcutaneous analyte sensor |
| US7427346B2 (en) * | 2004-05-04 | 2008-09-23 | Advanced Technology Materials, Inc. | Electrochemical drive circuitry and method |
| US8241655B2 (en) * | 2004-05-12 | 2012-08-14 | Surmodics, Inc. | Coatings for medical articles including natural biodegradable polysaccharides |
| US7125382B2 (en) * | 2004-05-20 | 2006-10-24 | Digital Angel Corporation | Embedded bio-sensor system |
| US9561309B2 (en) | 2004-05-27 | 2017-02-07 | Advanced Cardiovascular Systems, Inc. | Antifouling heparin coatings |
| CA2569375A1 (en) * | 2004-06-01 | 2006-08-17 | Microchips, Inc. | Devices and methods for measuring and enhancing drug or analyte transport to/from medical implant |
| WO2005119524A2 (en) | 2004-06-04 | 2005-12-15 | Therasense, Inc. | Diabetes care host-client architecture and data management system |
| EP1754059B1 (de) * | 2004-06-09 | 2010-08-04 | Becton, Dickinson and Company | Sensor für mehrere analyte |
| US7519435B2 (en) * | 2004-06-23 | 2009-04-14 | Cochlear Limited | Methods for maintaining low impedance of electrodes |
| US8170803B2 (en) | 2004-07-13 | 2012-05-01 | Dexcom, Inc. | Transcutaneous analyte sensor |
| US8452368B2 (en) | 2004-07-13 | 2013-05-28 | Dexcom, Inc. | Transcutaneous analyte sensor |
| US8886272B2 (en) | 2004-07-13 | 2014-11-11 | Dexcom, Inc. | Analyte sensor |
| US20080242961A1 (en) * | 2004-07-13 | 2008-10-02 | Dexcom, Inc. | Transcutaneous analyte sensor |
| US8565848B2 (en) | 2004-07-13 | 2013-10-22 | Dexcom, Inc. | Transcutaneous analyte sensor |
| US20070045902A1 (en) | 2004-07-13 | 2007-03-01 | Brauker James H | Analyte sensor |
| US7537590B2 (en) * | 2004-07-30 | 2009-05-26 | Microchips, Inc. | Multi-reservoir device for transdermal drug delivery and sensing |
| CN100488635C (zh) | 2004-09-01 | 2009-05-20 | 微芯片公司 | 用于控制释放或者暴露储库内容物的多盖储库装置 |
| US7205701B2 (en) * | 2004-09-03 | 2007-04-17 | Honeywell International Inc. | Passive wireless acoustic wave chemical sensor |
| WO2006038866A1 (en) * | 2004-10-01 | 2006-04-13 | Bio Polymer Products Of Sweden Ab | Improved coating comprising a bioadhesive polyphenolic protein derived from a byssus-forming mussel |
| US9259175B2 (en) | 2006-10-23 | 2016-02-16 | Abbott Diabetes Care, Inc. | Flexible patch for fluid delivery and monitoring body analytes |
| US10226207B2 (en) | 2004-12-29 | 2019-03-12 | Abbott Diabetes Care Inc. | Sensor inserter having introducer |
| US8029441B2 (en) | 2006-02-28 | 2011-10-04 | Abbott Diabetes Care Inc. | Analyte sensor transmitter unit configuration for a data monitoring and management system |
| US7883464B2 (en) | 2005-09-30 | 2011-02-08 | Abbott Diabetes Care Inc. | Integrated transmitter unit and sensor introducer mechanism and methods of use |
| US9743862B2 (en) | 2011-03-31 | 2017-08-29 | Abbott Diabetes Care Inc. | Systems and methods for transcutaneously implanting medical devices |
| US8571624B2 (en) | 2004-12-29 | 2013-10-29 | Abbott Diabetes Care Inc. | Method and apparatus for mounting a data transmission device in a communication system |
| US7697967B2 (en) | 2005-12-28 | 2010-04-13 | Abbott Diabetes Care Inc. | Method and apparatus for providing analyte sensor insertion |
| US20090082693A1 (en) * | 2004-12-29 | 2009-03-26 | Therasense, Inc. | Method and apparatus for providing temperature sensor module in a data communication system |
| US20090105569A1 (en) | 2006-04-28 | 2009-04-23 | Abbott Diabetes Care, Inc. | Introducer Assembly and Methods of Use |
| US9351669B2 (en) | 2009-09-30 | 2016-05-31 | Abbott Diabetes Care Inc. | Interconnect for on-body analyte monitoring device |
| US8333714B2 (en) | 2006-09-10 | 2012-12-18 | Abbott Diabetes Care Inc. | Method and system for providing an integrated analyte sensor insertion device and data processing unit |
| US7731657B2 (en) | 2005-08-30 | 2010-06-08 | Abbott Diabetes Care Inc. | Analyte sensor introducer and methods of use |
| US9572534B2 (en) | 2010-06-29 | 2017-02-21 | Abbott Diabetes Care Inc. | Devices, systems and methods for on-skin or on-body mounting of medical devices |
| US9636450B2 (en) | 2007-02-19 | 2017-05-02 | Udo Hoss | Pump system modular components for delivering medication and analyte sensing at seperate insertion sites |
| US8512243B2 (en) | 2005-09-30 | 2013-08-20 | Abbott Diabetes Care Inc. | Integrated introducer and transmitter assembly and methods of use |
| US9398882B2 (en) | 2005-09-30 | 2016-07-26 | Abbott Diabetes Care Inc. | Method and apparatus for providing analyte sensor and data processing device |
| US8545403B2 (en) | 2005-12-28 | 2013-10-01 | Abbott Diabetes Care Inc. | Medical device insertion |
| US9788771B2 (en) | 2006-10-23 | 2017-10-17 | Abbott Diabetes Care Inc. | Variable speed sensor insertion devices and methods of use |
| MX2007008425A (es) | 2005-01-13 | 2007-12-10 | Cinv Ag | Materiales compuestos que contienen nanoparticulas de carbono. |
| AU2006208131A1 (en) * | 2005-01-25 | 2006-08-03 | Microchips, Inc. | Control of drug release by transient modification of local microenvironments |
| MX2007009430A (es) * | 2005-02-03 | 2007-08-17 | Cinv Ag | Materiales para suministro de farmacos producidos mediante la tecnologia de sol/gel. |
| US7545272B2 (en) | 2005-02-08 | 2009-06-09 | Therasense, Inc. | RF tag on test strips, test strip vials and boxes |
| BRPI0608186A2 (pt) * | 2005-02-18 | 2011-01-04 | Synthasome Inc | estrutura sintética para reparo de tecidos moles |
| US8133178B2 (en) | 2006-02-22 | 2012-03-13 | Dexcom, Inc. | Analyte sensor |
| US20060229715A1 (en) * | 2005-03-29 | 2006-10-12 | Sdgi Holdings, Inc. | Implants incorporating nanotubes and methods for producing the same |
| US8744546B2 (en) | 2005-05-05 | 2014-06-03 | Dexcom, Inc. | Cellulosic-based resistance domain for an analyte sensor |
| WO2006110193A2 (en) | 2005-04-08 | 2006-10-19 | Dexcom, Inc. | Cellulosic-based interference domain for an analyte sensor |
| US8060174B2 (en) | 2005-04-15 | 2011-11-15 | Dexcom, Inc. | Analyte sensing biointerface |
| US7182783B2 (en) * | 2005-04-25 | 2007-02-27 | Sdgi Holdings, Inc. | Selectively expandable composite structures for spinal arthroplasty |
| US8112240B2 (en) | 2005-04-29 | 2012-02-07 | Abbott Diabetes Care Inc. | Method and apparatus for providing leak detection in data monitoring and management systems |
| US7715911B2 (en) * | 2005-05-31 | 2010-05-11 | Medtronic, Inc. | Apparatus for tissue stimulation |
| AU2006270221B2 (en) | 2005-07-15 | 2012-01-19 | Micell Technologies, Inc. | Polymer coatings containing drug powder of controlled morphology |
| WO2007011708A2 (en) | 2005-07-15 | 2007-01-25 | Micell Technologies, Inc. | Stent with polymer coating containing amorphous rapamycin |
| JP2009507224A (ja) | 2005-08-31 | 2009-02-19 | ユニヴァーシティー オブ ヴァージニア パテント ファンデーション | 連続グルコースセンサの精度の改善 |
| US9521968B2 (en) | 2005-09-30 | 2016-12-20 | Abbott Diabetes Care Inc. | Analyte sensor retention mechanism and methods of use |
| US8880138B2 (en) | 2005-09-30 | 2014-11-04 | Abbott Diabetes Care Inc. | Device for channeling fluid and methods of use |
| KR100720052B1 (ko) | 2005-10-07 | 2007-05-18 | (주) 차바이오텍 | 성장인자를 함유한 나노입자가 코팅된 연골 조직 재건 및재생을 위한 마이크로스피어 또는 마이크로비드 |
| US7766829B2 (en) | 2005-11-04 | 2010-08-03 | Abbott Diabetes Care Inc. | Method and system for providing basal profile modification in analyte monitoring and management systems |
| CA2633768A1 (en) * | 2005-11-10 | 2007-05-18 | Bayer Schering Pharma Aktiengesellschaft | Reduction of restenosis |
| US20070127745A1 (en) * | 2005-12-07 | 2007-06-07 | Cochlear Limited | Prevention of static bonding between medical device components |
| US11298058B2 (en) | 2005-12-28 | 2022-04-12 | Abbott Diabetes Care Inc. | Method and apparatus for providing analyte sensor insertion |
| US9757061B2 (en) | 2006-01-17 | 2017-09-12 | Dexcom, Inc. | Low oxygen in vivo analyte sensor |
| US7736310B2 (en) | 2006-01-30 | 2010-06-15 | Abbott Diabetes Care Inc. | On-body medical device securement |
| US7732539B2 (en) * | 2006-02-16 | 2010-06-08 | National Science Foundation | Modified acrylic block copolymers for hydrogels and pressure sensitive wet adhesives |
| US7885698B2 (en) | 2006-02-28 | 2011-02-08 | Abbott Diabetes Care Inc. | Method and system for providing continuous calibration of implantable analyte sensors |
| US7826879B2 (en) | 2006-02-28 | 2010-11-02 | Abbott Diabetes Care Inc. | Analyte sensors and methods of use |
| US7801582B2 (en) | 2006-03-31 | 2010-09-21 | Abbott Diabetes Care Inc. | Analyte monitoring and management system and methods therefor |
| US9675290B2 (en) | 2012-10-30 | 2017-06-13 | Abbott Diabetes Care Inc. | Sensitivity calibration of in vivo sensors used to measure analyte concentration |
| US8140312B2 (en) | 2007-05-14 | 2012-03-20 | Abbott Diabetes Care Inc. | Method and system for determining analyte levels |
| US8374668B1 (en) | 2007-10-23 | 2013-02-12 | Abbott Diabetes Care Inc. | Analyte sensor with lag compensation |
| US8226891B2 (en) | 2006-03-31 | 2012-07-24 | Abbott Diabetes Care Inc. | Analyte monitoring devices and methods therefor |
| US7618369B2 (en) | 2006-10-02 | 2009-11-17 | Abbott Diabetes Care Inc. | Method and system for dynamically updating calibration parameters for an analyte sensor |
| US9326709B2 (en) | 2010-03-10 | 2016-05-03 | Abbott Diabetes Care Inc. | Systems, devices and methods for managing glucose levels |
| US9392969B2 (en) | 2008-08-31 | 2016-07-19 | Abbott Diabetes Care Inc. | Closed loop control and signal attenuation detection |
| US8478557B2 (en) | 2009-07-31 | 2013-07-02 | Abbott Diabetes Care Inc. | Method and apparatus for providing analyte monitoring system calibration accuracy |
| US8224415B2 (en) | 2009-01-29 | 2012-07-17 | Abbott Diabetes Care Inc. | Method and device for providing offset model based calibration for analyte sensor |
| US7620438B2 (en) | 2006-03-31 | 2009-11-17 | Abbott Diabetes Care Inc. | Method and system for powering an electronic device |
| US8219173B2 (en) | 2008-09-30 | 2012-07-10 | Abbott Diabetes Care Inc. | Optimizing analyte sensor calibration |
| US8346335B2 (en) | 2008-03-28 | 2013-01-01 | Abbott Diabetes Care Inc. | Analyte sensor calibration management |
| US8473022B2 (en) | 2008-01-31 | 2013-06-25 | Abbott Diabetes Care Inc. | Analyte sensor with time lag compensation |
| US7630748B2 (en) | 2006-10-25 | 2009-12-08 | Abbott Diabetes Care Inc. | Method and system for providing analyte monitoring |
| US7653425B2 (en) | 2006-08-09 | 2010-01-26 | Abbott Diabetes Care Inc. | Method and system for providing calibration of an analyte sensor in an analyte monitoring system |
| US9339217B2 (en) | 2011-11-25 | 2016-05-17 | Abbott Diabetes Care Inc. | Analyte monitoring system and methods of use |
| WO2007127363A2 (en) | 2006-04-26 | 2007-11-08 | Micell Technologies, Inc. | Coatings containing multiple drugs |
| TW200813181A (en) * | 2006-06-01 | 2008-03-16 | Akzo Nobel Coatings Int Bv | Adhesive system |
| US20070277928A1 (en) * | 2006-06-01 | 2007-12-06 | Akzo Nobel Coatings International B.V. | Adhesive system |
| US20070281145A1 (en) * | 2006-06-01 | 2007-12-06 | Akzo Nobel Coatings International B.V. | Adhesive system |
| US7820172B1 (en) | 2006-06-01 | 2010-10-26 | Biosurface Engineering Technologies, Inc. | Laminin-derived multi-domain peptides |
| US8703167B2 (en) * | 2006-06-05 | 2014-04-22 | Advanced Cardiovascular Systems, Inc. | Coatings for implantable medical devices for controlled release of a hydrophilic drug and a hydrophobic drug |
| US8323676B2 (en) | 2008-06-30 | 2012-12-04 | Abbott Cardiovascular Systems Inc. | Poly(ester-amide) and poly(amide) coatings for implantable medical devices for controlled release of a protein or peptide and a hydrophobic drug |
| US20090258028A1 (en) * | 2006-06-05 | 2009-10-15 | Abbott Cardiovascular Systems Inc. | Methods Of Forming Coatings For Implantable Medical Devices For Controlled Release Of A Peptide And A Hydrophobic Drug |
| US7920907B2 (en) | 2006-06-07 | 2011-04-05 | Abbott Diabetes Care Inc. | Analyte monitoring system and method |
| US8114150B2 (en) | 2006-06-14 | 2012-02-14 | Advanced Cardiovascular Systems, Inc. | RGD peptide attached to bioabsorbable stents |
| US8802128B2 (en) * | 2006-06-23 | 2014-08-12 | Allergan, Inc. | Steroid-containing sustained release intraocular implants and related methods |
| EP2037977A2 (de) * | 2006-06-28 | 2009-03-25 | SurModics, Inc. | Wirkstoffbeschichtete matrizen mit partikeln |
| US7722665B2 (en) * | 2006-07-07 | 2010-05-25 | Graft Technologies, Inc. | System and method for providing a graft in a vascular environment |
| US8685430B1 (en) | 2006-07-14 | 2014-04-01 | Abbott Cardiovascular Systems Inc. | Tailored aliphatic polyesters for stent coatings |
| US8563117B2 (en) | 2006-08-04 | 2013-10-22 | Phillip B. Messersmith | Biomimetic modular adhesive complex: materials, methods and applications therefore |
| US7622533B2 (en) | 2006-08-04 | 2009-11-24 | Nerites Corporation | Biomimetic compounds and synthetic methods therefor |
| US8914090B2 (en) | 2006-09-27 | 2014-12-16 | The University Of Connecticut | Implantable biosensor and methods of use thereof |
| US8636767B2 (en) | 2006-10-02 | 2014-01-28 | Micell Technologies, Inc. | Surgical sutures having increased strength |
| US7943034B2 (en) * | 2006-10-19 | 2011-05-17 | Agamatrix, Inc. | Method and apparatus for providing a stable voltage to an analytical system |
| EP2081694B1 (de) | 2006-10-23 | 2020-05-13 | Micell Technologies, Inc. | Halter zum elektrischen laden eines substrats während der beschichtung |
| CN101636104B (zh) | 2006-10-26 | 2012-07-18 | 雅培糖尿病护理公司 | 实时检测分析物传感器灵敏度下降的方法及系统 |
| CA2667890C (en) | 2006-10-31 | 2015-01-27 | Surmodics Pharmaceuticals, Inc. | Spheronized polymer particles |
| US7713541B1 (en) | 2006-11-21 | 2010-05-11 | Abbott Cardiovascular Systems Inc. | Zwitterionic terpolymers, method of making and use on medical devices |
| US8969415B2 (en) | 2006-12-01 | 2015-03-03 | Allergan, Inc. | Intraocular drug delivery systems |
| JP5603598B2 (ja) | 2007-01-08 | 2014-10-08 | ミセル テクノロジーズ、インコーポレイテッド | 生物分解層を有するステント |
| US11426494B2 (en) | 2007-01-08 | 2022-08-30 | MT Acquisition Holdings LLC | Stents having biodegradable layers |
| DE102007005817A1 (de) | 2007-02-06 | 2008-08-14 | Laser Zentrum Hannover E.V. | Biologisch wirksame Vorrichtung und Verfahren zu ihrer Herstellung |
| US20080199894A1 (en) | 2007-02-15 | 2008-08-21 | Abbott Diabetes Care, Inc. | Device and method for automatic data acquisition and/or detection |
| US8121857B2 (en) | 2007-02-15 | 2012-02-21 | Abbott Diabetes Care Inc. | Device and method for automatic data acquisition and/or detection |
| US8383092B2 (en) * | 2007-02-16 | 2013-02-26 | Knc Ner Acquisition Sub, Inc. | Bioadhesive constructs |
| US8673286B2 (en) | 2007-04-09 | 2014-03-18 | Northwestern University | DOPA-functionalized, branched, poly(aklylene oxide) adhesives |
| US8732188B2 (en) | 2007-02-18 | 2014-05-20 | Abbott Diabetes Care Inc. | Method and system for providing contextual based medication dosage determination |
| US8930203B2 (en) | 2007-02-18 | 2015-01-06 | Abbott Diabetes Care Inc. | Multi-function analyte test device and methods therefor |
| US20100291180A1 (en) * | 2007-02-20 | 2010-11-18 | Uhrich Kathryn E | Nerve guidance tubes |
| US8123686B2 (en) | 2007-03-01 | 2012-02-28 | Abbott Diabetes Care Inc. | Method and apparatus for providing rolling data in communication systems |
| CA2680886A1 (en) * | 2007-03-15 | 2008-09-18 | Boston Scientific Limited | Methods to improve the stability of cellular adhesive proteins and peptides |
| US20080249385A1 (en) * | 2007-04-04 | 2008-10-09 | Luong Ngoc Phan | Isolated intravenous analyte monitoring system |
| US8093039B2 (en) * | 2007-04-10 | 2012-01-10 | The Trustees Of The Stevens Institute Of Technology | Surfaces differentially adhesive to eukaryotic cells and non-eukaryotic cells |
| EP2146623B1 (de) | 2007-04-14 | 2014-01-08 | Abbott Diabetes Care Inc. | Verfahren und vorrichtung zur datenverarbeitung und steuerung in einem medizinischen kommunikationssystem |
| CA2683962C (en) | 2007-04-14 | 2017-06-06 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in medical communication system |
| ES2817503T3 (es) | 2007-04-14 | 2021-04-07 | Abbott Diabetes Care Inc | Procedimiento y aparato para proporcionar el procesamiento y control de datos en un sistema de comunicación médica |
| CA2683930A1 (en) | 2007-04-14 | 2008-10-23 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in medical communication system |
| EP2146624B1 (de) | 2007-04-14 | 2020-03-25 | Abbott Diabetes Care Inc. | Verfahren und vorrichtung zur datenverarbeitung und steuerung in einem medizinischen kommunikationssystem |
| EP2146622B1 (de) | 2007-04-14 | 2016-05-11 | Abbott Diabetes Care Inc. | Verfahren und vorrichtung für dynamische mehrstufige signalverstärkung bei einer medizinischen vorrichtung |
| US7777631B2 (en) * | 2007-04-29 | 2010-08-17 | James Neil Rodgers | Body chip |
| US8461985B2 (en) | 2007-05-08 | 2013-06-11 | Abbott Diabetes Care Inc. | Analyte monitoring system and methods |
| US8665091B2 (en) | 2007-05-08 | 2014-03-04 | Abbott Diabetes Care Inc. | Method and device for determining elapsed sensor life |
| US8456301B2 (en) | 2007-05-08 | 2013-06-04 | Abbott Diabetes Care Inc. | Analyte monitoring system and methods |
| US7928850B2 (en) | 2007-05-08 | 2011-04-19 | Abbott Diabetes Care Inc. | Analyte monitoring system and methods |
| US8103471B2 (en) | 2007-05-14 | 2012-01-24 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US7996158B2 (en) | 2007-05-14 | 2011-08-09 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US8260558B2 (en) | 2007-05-14 | 2012-09-04 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US8560038B2 (en) | 2007-05-14 | 2013-10-15 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US8239166B2 (en) | 2007-05-14 | 2012-08-07 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US10002233B2 (en) | 2007-05-14 | 2018-06-19 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US9125548B2 (en) | 2007-05-14 | 2015-09-08 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US8600681B2 (en) | 2007-05-14 | 2013-12-03 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US8444560B2 (en) | 2007-05-14 | 2013-05-21 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US20200037875A1 (en) | 2007-05-18 | 2020-02-06 | Dexcom, Inc. | Analyte sensors having a signal-to-noise ratio substantially unaffected by non-constant noise |
| EP2170418B1 (de) | 2007-05-25 | 2016-03-16 | Micell Technologies, Inc. | Polymerfilme zur beschichtung von medizinprodukten |
| WO2008150917A1 (en) * | 2007-05-31 | 2008-12-11 | Abbott Diabetes Care, Inc. | Insertion devices and methods |
| US8649840B2 (en) * | 2007-06-07 | 2014-02-11 | Microchips, Inc. | Electrochemical biosensors and arrays |
| AU2008262018A1 (en) | 2007-06-08 | 2008-12-18 | Dexcom, Inc. | Integrated medicament delivery device for use with continuous analyte sensor |
| US20080311177A1 (en) | 2007-06-14 | 2008-12-18 | Massachusetts Institute Of Technology | Self Assembled Films for Protein and Drug Delivery Applications |
| AU2008265541B2 (en) | 2007-06-21 | 2014-07-17 | Abbott Diabetes Care, Inc. | Health management devices and methods |
| WO2008157821A1 (en) | 2007-06-21 | 2008-12-24 | Abbott Diabetes Care, Inc. | Health monitor |
| US8160900B2 (en) | 2007-06-29 | 2012-04-17 | Abbott Diabetes Care Inc. | Analyte monitoring and management device and method to analyze the frequency of user interaction with the device |
| US20110130822A1 (en) * | 2007-07-20 | 2011-06-02 | Orbusneich Medical, Inc. | Bioabsorbable Polymeric Compositions and Medical Devices |
| US7768386B2 (en) * | 2007-07-31 | 2010-08-03 | Abbott Diabetes Care Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US20090036760A1 (en) * | 2007-07-31 | 2009-02-05 | Abbott Diabetes Care, Inc. | Method and apparatus for providing data processing and control in a medical communication system |
| US8834366B2 (en) | 2007-07-31 | 2014-09-16 | Abbott Diabetes Care Inc. | Method and apparatus for providing analyte sensor calibration |
| US20100098761A1 (en) * | 2007-08-03 | 2010-04-22 | University Of Massachusetts Medical School | Polymer Compositions For Biomedical And Material Applications |
| US8409093B2 (en) | 2007-10-23 | 2013-04-02 | Abbott Diabetes Care Inc. | Assessing measures of glycemic variability |
| US8216138B1 (en) | 2007-10-23 | 2012-07-10 | Abbott Diabetes Care Inc. | Correlation of alternative site blood and interstitial fluid glucose concentrations to venous glucose concentration |
| US8377031B2 (en) | 2007-10-23 | 2013-02-19 | Abbott Diabetes Care Inc. | Closed loop control system with safety parameters and methods |
| US8417312B2 (en) | 2007-10-25 | 2013-04-09 | Dexcom, Inc. | Systems and methods for processing sensor data |
| WO2009059203A1 (en) * | 2007-11-02 | 2009-05-07 | Edwards Lifesciences Corporation | Analyte monitoring system having back-up power source for use in either transport of the system or primary power loss |
| US8290559B2 (en) | 2007-12-17 | 2012-10-16 | Dexcom, Inc. | Systems and methods for processing sensor data |
| US20090164239A1 (en) | 2007-12-19 | 2009-06-25 | Abbott Diabetes Care, Inc. | Dynamic Display Of Glucose Information |
| JP5530934B2 (ja) * | 2008-01-24 | 2014-06-25 | ユニバーシティ オブ ユタ リサーチ ファンデーション | 接着複合コアセルベートならびにその作製および使用方法 |
| US8283384B2 (en) | 2008-01-24 | 2012-10-09 | University Of Utah Research Foundation | Adhesive complex coacervates and methods of making and using thereof |
| EP2252196A4 (de) | 2008-02-21 | 2013-05-15 | Dexcom Inc | Systeme und verfahren zur verarbeitung, übertragung und anzeige von sensordaten |
| US8396528B2 (en) | 2008-03-25 | 2013-03-12 | Dexcom, Inc. | Analyte sensor |
| US20090247855A1 (en) * | 2008-03-28 | 2009-10-01 | Dexcom, Inc. | Polymer membranes for continuous analyte sensors |
| US11730407B2 (en) | 2008-03-28 | 2023-08-22 | Dexcom, Inc. | Polymer membranes for continuous analyte sensors |
| US8583204B2 (en) | 2008-03-28 | 2013-11-12 | Dexcom, Inc. | Polymer membranes for continuous analyte sensors |
| US8252229B2 (en) | 2008-04-10 | 2012-08-28 | Abbott Diabetes Care Inc. | Method and system for sterilizing an analyte sensor |
| SG192523A1 (en) | 2008-04-17 | 2013-08-30 | Micell Technologies Inc | Stents having bioabsorbable layers |
| EP2265293B1 (de) * | 2008-04-18 | 2015-11-04 | SurModics, Inc. | Beschichtungssysteme zur gesteuerten freisetzung hydrophiler biowirkstoffe |
| US8591410B2 (en) | 2008-05-30 | 2013-11-26 | Abbott Diabetes Care Inc. | Method and apparatus for providing glycemic control |
| US7826382B2 (en) | 2008-05-30 | 2010-11-02 | Abbott Diabetes Care Inc. | Close proximity communication device and methods |
| US8924159B2 (en) | 2008-05-30 | 2014-12-30 | Abbott Diabetes Care Inc. | Method and apparatus for providing glycemic control |
| US8765162B2 (en) * | 2008-06-30 | 2014-07-01 | Abbott Cardiovascular Systems Inc. | Poly(amide) and poly(ester-amide) polymers and drug delivery particles and coatings containing same |
| US8876755B2 (en) | 2008-07-14 | 2014-11-04 | Abbott Diabetes Care Inc. | Closed loop control system interface and methods |
| CN102159257B (zh) | 2008-07-17 | 2015-11-25 | 米歇尔技术公司 | 药物递送医疗设备 |
| WO2010021973A2 (en) | 2008-08-17 | 2010-02-25 | Massachusetts Institute Of Technology | Controlled delivery of bioactive agents from decomposable films |
| US8622988B2 (en) | 2008-08-31 | 2014-01-07 | Abbott Diabetes Care Inc. | Variable rate closed loop control and methods |
| US8734422B2 (en) | 2008-08-31 | 2014-05-27 | Abbott Diabetes Care Inc. | Closed loop control with improved alarm functions |
| US20100057040A1 (en) | 2008-08-31 | 2010-03-04 | Abbott Diabetes Care, Inc. | Robust Closed Loop Control And Methods |
| US9943644B2 (en) | 2008-08-31 | 2018-04-17 | Abbott Diabetes Care Inc. | Closed loop control with reference measurement and methods thereof |
| US20110257702A1 (en) * | 2008-09-04 | 2011-10-20 | Sule Kara | Self-assembled monolayer coating on electrically conductive regions of a medical implant |
| US20100066378A1 (en) * | 2008-09-18 | 2010-03-18 | Uti Limited Partnership | Current Mirror Potentiostat |
| US8986208B2 (en) | 2008-09-30 | 2015-03-24 | Abbott Diabetes Care Inc. | Analyte sensor sensitivity attenuation mitigation |
| US9326707B2 (en) | 2008-11-10 | 2016-05-03 | Abbott Diabetes Care Inc. | Alarm characterization for analyte monitoring devices and systems |
| US8834913B2 (en) | 2008-12-26 | 2014-09-16 | Battelle Memorial Institute | Medical implants and methods of making medical implants |
| US20100179646A1 (en) * | 2009-01-09 | 2010-07-15 | Rainbow Medical Ltd. | Glucose oxidase techniques |
| US8103456B2 (en) | 2009-01-29 | 2012-01-24 | Abbott Diabetes Care Inc. | Method and device for early signal attenuation detection using blood glucose measurements |
| FI20095084A0 (fi) | 2009-01-30 | 2009-01-30 | Pekka Vallittu | Komposiitti ja sen käyttö |
| US9402544B2 (en) | 2009-02-03 | 2016-08-02 | Abbott Diabetes Care Inc. | Analyte sensor and apparatus for insertion of the sensor |
| US20100239635A1 (en) | 2009-03-23 | 2010-09-23 | Micell Technologies, Inc. | Drug delivery medical device |
| US9446194B2 (en) * | 2009-03-27 | 2016-09-20 | Dexcom, Inc. | Methods and systems for promoting glucose management |
| CA2757276C (en) | 2009-04-01 | 2017-06-06 | Micell Technologies, Inc. | Coated stents |
| US8497777B2 (en) | 2009-04-15 | 2013-07-30 | Abbott Diabetes Care Inc. | Analyte monitoring system having an alert |
| EP2419015A4 (de) | 2009-04-16 | 2014-08-20 | Abbott Diabetes Care Inc | Kalibrierung eines analytsensors |
| CA2759015C (en) | 2009-04-17 | 2017-06-20 | James B. Mcclain | Stents having controlled elution |
| WO2010127050A1 (en) | 2009-04-28 | 2010-11-04 | Abbott Diabetes Care Inc. | Error detection in critical repeating data in a wireless sensor system |
| US8368556B2 (en) | 2009-04-29 | 2013-02-05 | Abbott Diabetes Care Inc. | Method and system for providing data communication in continuous glucose monitoring and management system |
| WO2010127051A1 (en) | 2009-04-29 | 2010-11-04 | Abbott Diabetes Care Inc. | Method and system for providing real time analyte sensor calibration with retrospective backfill |
| US9572693B2 (en) * | 2009-05-14 | 2017-02-21 | Orbusneich Medical, Inc. | Self-expanding stent with polygon transition zone |
| US9184490B2 (en) | 2009-05-29 | 2015-11-10 | Abbott Diabetes Care Inc. | Medical device antenna systems having external antenna configurations |
| US9517023B2 (en) | 2009-06-01 | 2016-12-13 | Profusa, Inc. | Method and system for directing a localized biological response to an implant |
| US8613892B2 (en) | 2009-06-30 | 2013-12-24 | Abbott Diabetes Care Inc. | Analyte meter with a moveable head and methods of using the same |
| EP2453834A4 (de) | 2009-07-16 | 2014-04-16 | Micell Technologies Inc | Medizinische wirkstofffreisetzungsvorrichtung |
| EP4276652A3 (de) | 2009-07-23 | 2024-01-31 | Abbott Diabetes Care, Inc. | Echtzeitverwaltung von daten in zusammenhang mit der physiologischen steuerung von glucosespiegeln |
| US9795326B2 (en) | 2009-07-23 | 2017-10-24 | Abbott Diabetes Care Inc. | Continuous analyte measurement systems and systems and methods for implanting them |
| US9597430B2 (en) * | 2009-07-31 | 2017-03-21 | Synthasome, Inc. | Synthetic structure for soft tissue repair |
| EP4070729A1 (de) | 2009-08-31 | 2022-10-12 | Abbott Diabetes Care, Inc. | Anzeigeeinheiten für ein medizinisches gerät |
| EP2473963A4 (de) | 2009-08-31 | 2014-01-08 | Abbott Diabetes Care Inc | Medizinische geräte und verfahren |
| EP2473099A4 (de) | 2009-08-31 | 2015-01-14 | Abbott Diabetes Care Inc | Analytüberwachungssystem und -verfahren zur leistungs- und rauschverwaltung |
| WO2011026147A1 (en) | 2009-08-31 | 2011-03-03 | Abbott Diabetes Care Inc. | Analyte signal processing device and methods |
| US9320461B2 (en) | 2009-09-29 | 2016-04-26 | Abbott Diabetes Care Inc. | Method and apparatus for providing notification function in analyte monitoring systems |
| US8185181B2 (en) | 2009-10-30 | 2012-05-22 | Abbott Diabetes Care Inc. | Method and apparatus for detecting false hypoglycemic conditions |
| NZ716349A (en) | 2009-11-09 | 2017-07-28 | Allergan Inc | Compositions and methods for stimulating hair growth |
| US8660628B2 (en) * | 2009-12-21 | 2014-02-25 | Medtronic Minimed, Inc. | Analyte sensors comprising blended membrane compositions and methods for making and using them |
| USD924406S1 (en) | 2010-02-01 | 2021-07-06 | Abbott Diabetes Care Inc. | Analyte sensor inserter |
| EP2531140B1 (de) | 2010-02-02 | 2017-11-01 | Micell Technologies, Inc. | Stent und stenteinsatzsystem mit verbesserter einsetzbarkeit |
| EP2549918B2 (de) | 2010-03-24 | 2023-01-25 | Abbott Diabetes Care, Inc. | Vorrichtungen zum einsetzen von medizingeräten sowie verfahren zum einsetzen und anwenden von medizingeräten |
| US8795762B2 (en) | 2010-03-26 | 2014-08-05 | Battelle Memorial Institute | System and method for enhanced electrostatic deposition and surface coatings |
| CA2797110C (en) | 2010-04-22 | 2020-07-21 | Micell Technologies, Inc. | Stents and other devices having extracellular matrix coating |
| EP2575906B1 (de) | 2010-05-24 | 2014-12-10 | University of Utah Research Foundation | Mit komplexcoacervate verstärkter kleber, verfahren zur herstellung und verwendung |
| US10010272B2 (en) | 2010-05-27 | 2018-07-03 | Profusa, Inc. | Tissue-integrating electronic apparatus |
| US8635046B2 (en) | 2010-06-23 | 2014-01-21 | Abbott Diabetes Care Inc. | Method and system for evaluating analyte sensor response characteristics |
| US10092229B2 (en) | 2010-06-29 | 2018-10-09 | Abbott Diabetes Care Inc. | Calibration of analyte measurement system |
| CA2802229C (en) | 2010-06-29 | 2019-01-29 | Surmodics, Inc. | Fluorinated polymers and lubricious coatings |
| US11064921B2 (en) | 2010-06-29 | 2021-07-20 | Abbott Diabetes Care Inc. | Devices, systems and methods for on-skin or on-body mounting of medical devices |
| WO2012009684A2 (en) | 2010-07-16 | 2012-01-19 | Micell Technologies, Inc. | Drug delivery medical device |
| CN105147300B (zh) | 2010-10-06 | 2019-09-03 | 普罗弗萨股份有限公司 | 组织整合性传感器 |
| WO2012048168A2 (en) | 2010-10-07 | 2012-04-12 | Abbott Diabetes Care Inc. | Analyte monitoring devices and methods |
| EP2637707A4 (de) | 2010-11-09 | 2014-10-01 | Kensey Nash Corp | Haftverbindungen und anwendungsverfahren für herniereparatur |
| CA2812599A1 (en) * | 2010-11-12 | 2012-05-18 | University Of Utah Research Foundation | Simple adhesive coacervates and methods of making and using thereof |
| US20120142648A1 (en) * | 2010-12-03 | 2012-06-07 | Warsaw Orthopedic, Inc. | Methods for delivering clonidine compositions in biodegradable polymer carrier and local steriods to a target tissue site |
| CA2823355C (en) | 2010-12-30 | 2017-08-22 | Micell Technologies, Inc. | Nanoparticle and surface-modified particulate coatings, coated balloons, and methods therefore |
| US8981025B2 (en) | 2011-02-10 | 2015-03-17 | Corning Incorporated | Polymerizable catonic peptide monomers and polymers |
| US8515540B2 (en) | 2011-02-24 | 2013-08-20 | Cochlear Limited | Feedthrough having a non-linear conductor |
| CA2827196A1 (en) | 2011-02-28 | 2012-11-15 | Jai Karan | Devices, systems, and methods associated with analyte monitoring devices and devices incorporating the same |
| US10136845B2 (en) | 2011-02-28 | 2018-11-27 | Abbott Diabetes Care Inc. | Devices, systems, and methods associated with analyte monitoring devices and devices incorporating the same |
| AU2012234345A1 (en) * | 2011-03-28 | 2013-09-05 | F. Hoffmann-La Roche Ag | Improved diffusion layer for an enzymatic in-vivo sensor |
| US20120323311A1 (en) | 2011-04-13 | 2012-12-20 | Micell Technologies, Inc. | Stents having controlled elution |
| DK3575796T3 (da) | 2011-04-15 | 2021-01-18 | Dexcom Inc | Avanceret analytsensorkalibrering og fejldetektion |
| US10464100B2 (en) | 2011-05-31 | 2019-11-05 | Micell Technologies, Inc. | System and process for formation of a time-released, drug-eluting transferable coating |
| CA2841360A1 (en) | 2011-07-15 | 2013-01-24 | Micell Technologies, Inc. | Drug delivery medical device |
| WO2013023051A1 (en) * | 2011-08-09 | 2013-02-14 | University Of Utah Research Foundation | Methods and compositions for improving the biocompatability of biomedical implants |
| US10188772B2 (en) | 2011-10-18 | 2019-01-29 | Micell Technologies, Inc. | Drug delivery medical device |
| WO2013066849A1 (en) | 2011-10-31 | 2013-05-10 | Abbott Diabetes Care Inc. | Model based variable risk false glucose threshold alarm prevention mechanism |
| US9069536B2 (en) | 2011-10-31 | 2015-06-30 | Abbott Diabetes Care Inc. | Electronic devices having integrated reset systems and methods thereof |
| AU2012335830B2 (en) | 2011-11-07 | 2017-05-04 | Abbott Diabetes Care Inc. | Analyte monitoring device and methods |
| US9317656B2 (en) | 2011-11-23 | 2016-04-19 | Abbott Diabetes Care Inc. | Compatibility mechanisms for devices in a continuous analyte monitoring system and methods thereof |
| US8710993B2 (en) | 2011-11-23 | 2014-04-29 | Abbott Diabetes Care Inc. | Mitigating single point failure of devices in an analyte monitoring system and methods thereof |
| EP4056105B1 (de) | 2011-12-11 | 2023-10-11 | Abbott Diabetes Care, Inc. | Analytsensorvorrichtungen |
| US8927529B2 (en) | 2012-01-30 | 2015-01-06 | SpineThera | Treatment of back pain by injection of microparticles of dexamethasone acetate and a polymer |
| US9120095B2 (en) | 2012-03-29 | 2015-09-01 | Biomet Biologics, Llc | Apparatus and method for separating and concentrating a component of a fluid |
| WO2013163234A1 (en) | 2012-04-23 | 2013-10-31 | Massachusetts Institute Of Technology | Stable layer-by-layer coated particles |
| US8798332B2 (en) | 2012-05-15 | 2014-08-05 | Google Inc. | Contact lenses |
| US8857981B2 (en) | 2012-07-26 | 2014-10-14 | Google Inc. | Facilitation of contact lenses with capacitive sensors |
| US9523865B2 (en) | 2012-07-26 | 2016-12-20 | Verily Life Sciences Llc | Contact lenses with hybrid power sources |
| US9158133B1 (en) | 2012-07-26 | 2015-10-13 | Google Inc. | Contact lens employing optical signals for power and/or communication |
| US9298020B1 (en) | 2012-07-26 | 2016-03-29 | Verily Life Sciences Llc | Input system |
| US8919953B1 (en) | 2012-08-02 | 2014-12-30 | Google Inc. | Actuatable contact lenses |
| US9696564B1 (en) | 2012-08-21 | 2017-07-04 | Verily Life Sciences Llc | Contact lens with metal portion and polymer layer having indentations |
| US9111473B1 (en) | 2012-08-24 | 2015-08-18 | Google Inc. | Input system |
| EP2890297B1 (de) | 2012-08-30 | 2018-04-11 | Abbott Diabetes Care, Inc. | Ausfallerkennung bei kontinuierlichen analytüberwachungsdaten bei datenabweichungen |
| US8820934B1 (en) | 2012-09-05 | 2014-09-02 | Google Inc. | Passive surface acoustic wave communication |
| US20140192315A1 (en) | 2012-09-07 | 2014-07-10 | Google Inc. | In-situ tear sample collection and testing using a contact lens |
| US9398868B1 (en) | 2012-09-11 | 2016-07-26 | Verily Life Sciences Llc | Cancellation of a baseline current signal via current subtraction within a linear relaxation oscillator-based current-to-frequency converter circuit |
| US10010270B2 (en) | 2012-09-17 | 2018-07-03 | Verily Life Sciences Llc | Sensing system |
| US9968306B2 (en) | 2012-09-17 | 2018-05-15 | Abbott Diabetes Care Inc. | Methods and apparatuses for providing adverse condition notification with enhanced wireless communication range in analyte monitoring systems |
| US9326710B1 (en) | 2012-09-20 | 2016-05-03 | Verily Life Sciences Llc | Contact lenses having sensors with adjustable sensitivity |
| US8870370B1 (en) | 2012-09-24 | 2014-10-28 | Google Inc. | Contact lens that facilitates antenna communication via sensor impedance modulation |
| US8960898B1 (en) | 2012-09-24 | 2015-02-24 | Google Inc. | Contact lens that restricts incoming light to the eye |
| US20140088372A1 (en) | 2012-09-25 | 2014-03-27 | Google Inc. | Information processing method |
| US8989834B2 (en) | 2012-09-25 | 2015-03-24 | Google Inc. | Wearable device |
| US8979271B2 (en) | 2012-09-25 | 2015-03-17 | Google Inc. | Facilitation of temperature compensation for contact lens sensors and temperature sensing |
| US9884180B1 (en) | 2012-09-26 | 2018-02-06 | Verily Life Sciences Llc | Power transducer for a retinal implant using a contact lens |
| US8960899B2 (en) | 2012-09-26 | 2015-02-24 | Google Inc. | Assembling thin silicon chips on a contact lens |
| WO2014052136A1 (en) | 2012-09-26 | 2014-04-03 | Abbott Diabetes Care Inc. | Method and apparatus for improving lag correction during in vivo measurement of analyte concentration with analyte concentration variability and range data |
| US8985763B1 (en) | 2012-09-26 | 2015-03-24 | Google Inc. | Contact lens having an uneven embedded substrate and method of manufacture |
| US8821811B2 (en) | 2012-09-26 | 2014-09-02 | Google Inc. | In-vitro contact lens testing |
| US9063351B1 (en) | 2012-09-28 | 2015-06-23 | Google Inc. | Input detection system |
| US8965478B2 (en) | 2012-10-12 | 2015-02-24 | Google Inc. | Microelectrodes in an ophthalmic electrochemical sensor |
| US9176332B1 (en) | 2012-10-24 | 2015-11-03 | Google Inc. | Contact lens and method of manufacture to improve sensor sensitivity |
| KR20140052393A (ko) | 2012-10-24 | 2014-05-07 | 삼성전자주식회사 | 가시광 통신 시스템에서 광량 제어 방법 및 장치 |
| US9757056B1 (en) | 2012-10-26 | 2017-09-12 | Verily Life Sciences Llc | Over-molding of sensor apparatus in eye-mountable device |
| US8874182B2 (en) | 2013-01-15 | 2014-10-28 | Google Inc. | Encapsulated electronics |
| US9289954B2 (en) | 2013-01-17 | 2016-03-22 | Verily Life Sciences Llc | Method of ring-shaped structure placement in an eye-mountable device |
| US9636016B1 (en) | 2013-01-25 | 2017-05-02 | Verily Life Sciences Llc | Eye-mountable devices and methods for accurately placing a flexible ring containing electronics in eye-mountable devices |
| US20140209481A1 (en) * | 2013-01-25 | 2014-07-31 | Google Inc. | Standby Biasing Of Electrochemical Sensor To Reduce Sensor Stabilization Time During Measurement |
| WO2014123665A1 (en) | 2013-02-06 | 2014-08-14 | Kci Licensing, Inc. | Polymers, preparation and use thereof |
| AU2014216112B2 (en) | 2013-02-15 | 2019-02-21 | Allergan, Inc. | Sustained drug delivery implant |
| WO2014134029A1 (en) | 2013-02-26 | 2014-09-04 | Massachusetts Institute Of Technology | Nucleic acid particles, methods and use thereof |
| WO2014165264A1 (en) | 2013-03-12 | 2014-10-09 | Micell Technologies, Inc. | Bioabsorbable biomedical implants |
| US10130288B2 (en) | 2013-03-14 | 2018-11-20 | Cell and Molecular Tissue Engineering, LLC | Coated sensors, and corresponding systems and methods |
| US10405961B2 (en) | 2013-03-14 | 2019-09-10 | Cell and Molecular Tissue Engineering, LLC | Coated surgical mesh, and corresponding systems and methods |
| CN108013881B (zh) | 2013-03-14 | 2021-06-15 | 普罗菲尤萨股份有限公司 | 用于校正光学信号的方法和装置 |
| US10433773B1 (en) | 2013-03-15 | 2019-10-08 | Abbott Diabetes Care Inc. | Noise rejection methods and apparatus for sparsely sampled analyte sensor data |
| US9474475B1 (en) | 2013-03-15 | 2016-10-25 | Abbott Diabetes Care Inc. | Multi-rate analyte sensor data collection with sample rate configurable signal processing |
| US10076285B2 (en) | 2013-03-15 | 2018-09-18 | Abbott Diabetes Care Inc. | Sensor fault detection using analyte sensor data pattern comparison |
| WO2014150074A1 (en) | 2013-03-15 | 2014-09-25 | Massachusetts Institute Of Technology | Compositions and methods for nucleic acid delivery |
| US9161712B2 (en) | 2013-03-26 | 2015-10-20 | Google Inc. | Systems and methods for encapsulating electronics in a mountable device |
| US9113829B2 (en) | 2013-03-27 | 2015-08-25 | Google Inc. | Systems and methods for encapsulating electronics in a mountable device |
| EP2996629B1 (de) | 2013-05-15 | 2021-09-22 | Micell Technologies, Inc. | Bioabsorbierbare biomedizinische implantate |
| EP3777656A1 (de) | 2013-06-06 | 2021-02-17 | Profusa, Inc. | Vorrichtung und verfahren zur detektion optischer signale aus implantierten sensoren |
| US20140371560A1 (en) | 2013-06-14 | 2014-12-18 | Google Inc. | Body-Mountable Devices and Methods for Embedding a Structure in a Body-Mountable Device |
| US9084561B2 (en) | 2013-06-17 | 2015-07-21 | Google Inc. | Symmetrically arranged sensor electrodes in an ophthalmic electrochemical sensor |
| US9948895B1 (en) | 2013-06-18 | 2018-04-17 | Verily Life Sciences Llc | Fully integrated pinhole camera for eye-mountable imaging system |
| US9685689B1 (en) | 2013-06-27 | 2017-06-20 | Verily Life Sciences Llc | Fabrication methods for bio-compatible devices |
| US9028772B2 (en) | 2013-06-28 | 2015-05-12 | Google Inc. | Methods for forming a channel through a polymer layer using one or more photoresist layers |
| US9814387B2 (en) | 2013-06-28 | 2017-11-14 | Verily Life Sciences, LLC | Device identification |
| US9307901B1 (en) | 2013-06-28 | 2016-04-12 | Verily Life Sciences Llc | Methods for leaving a channel in a polymer layer using a cross-linked polymer plug |
| US9492118B1 (en) | 2013-06-28 | 2016-11-15 | Life Sciences Llc | Pre-treatment process for electrochemical amperometric sensor |
| US9654674B1 (en) | 2013-12-20 | 2017-05-16 | Verily Life Sciences Llc | Image sensor with a plurality of light channels |
| US9572522B2 (en) | 2013-12-20 | 2017-02-21 | Verily Life Sciences Llc | Tear fluid conductivity sensor |
| CN105899132B (zh) | 2013-12-31 | 2020-02-18 | 雅培糖尿病护理公司 | 自供电分析物传感器以及使用其的装置 |
| US9366570B1 (en) | 2014-03-10 | 2016-06-14 | Verily Life Sciences Llc | Photodiode operable in photoconductive mode and photovoltaic mode |
| US9184698B1 (en) | 2014-03-11 | 2015-11-10 | Google Inc. | Reference frequency from ambient light signal |
| US9789655B1 (en) | 2014-03-14 | 2017-10-17 | Verily Life Sciences Llc | Methods for mold release of body-mountable devices including microelectronics |
| EP3865063A1 (de) | 2014-03-30 | 2021-08-18 | Abbott Diabetes Care, Inc. | Verfahren und vorrichtung zur bestimmung des starts einer mahlzeit und von spitzenwertereignissen in analytüberwachungssystemen |
| US9913927B2 (en) | 2014-07-14 | 2018-03-13 | University Of Utah Research Foundation | In situ solidifying complex coacervates and methods of making and using thereof |
| US9764122B2 (en) | 2014-07-25 | 2017-09-19 | Warsaw Orthopedic, Inc. | Drug delivery device and methods having an occluding member |
| US9775978B2 (en) | 2014-07-25 | 2017-10-03 | Warsaw Orthopedic, Inc. | Drug delivery device and methods having a retaining member |
| US10101265B1 (en) | 2014-11-07 | 2018-10-16 | Board Of Regents For The University Of Nebraska | Birefringence imaging chromatography based on highly ordered 3D nanostructures |
| WO2016123197A1 (en) * | 2015-01-27 | 2016-08-04 | The Texas A&M University System | Self-cleaning membrane for medical devices |
| GB2536410A (en) * | 2015-03-06 | 2016-09-21 | The Queen's Univ Of Belfast | Coating composition and uses thereof |
| US10213139B2 (en) | 2015-05-14 | 2019-02-26 | Abbott Diabetes Care Inc. | Systems, devices, and methods for assembling an applicator and sensor control device |
| JP6986007B2 (ja) | 2015-07-10 | 2021-12-22 | アボット ダイアベティス ケア インコーポレイテッドAbbott Diabetes Care Inc. | 生理学的パラメータに対する動的グルコースプロファイル応答のシステム、デバイス及び方法 |
| US10076650B2 (en) | 2015-11-23 | 2018-09-18 | Warsaw Orthopedic, Inc. | Enhanced stylet for drug depot injector |
| US10792477B2 (en) | 2016-02-08 | 2020-10-06 | Orbusneich Medical Pte. Ltd. | Drug eluting balloon |
| US20210196932A1 (en) | 2016-02-08 | 2021-07-01 | Orbusneich Medical, Inc. | Drug Eluting Balloon |
| ES2959428T3 (es) | 2016-04-22 | 2024-02-26 | Lilly Co Eli | Dispositivo de infusión con componentes que comprenden un sorbente polimérico para reducir la concentración de m-cresol en la insulina |
| USD802755S1 (en) | 2016-06-23 | 2017-11-14 | Warsaw Orthopedic, Inc. | Drug pellet cartridge |
| US20180085498A1 (en) | 2016-09-23 | 2018-03-29 | Micell Technologies, Inc. | Prolonged drug-eluting products |
| CN110099677A (zh) | 2016-10-28 | 2019-08-06 | 斯皮内特赫拉公司 | 药物组合物及其用途 |
| US10434261B2 (en) | 2016-11-08 | 2019-10-08 | Warsaw Orthopedic, Inc. | Drug pellet delivery system and method |
| WO2018119400A1 (en) | 2016-12-22 | 2018-06-28 | Profusa, Inc. | System and single-channel luminescent sensor for and method of determining analyte value |
| EP3600014A4 (de) | 2017-03-21 | 2020-10-21 | Abbott Diabetes Care Inc. | Verfahren, vorrichtungen und system zur bereitstellung der diagnose und therapie von diabetischen zuständen |
| US11331022B2 (en) | 2017-10-24 | 2022-05-17 | Dexcom, Inc. | Pre-connected analyte sensors |
| CN209606445U (zh) | 2017-10-24 | 2019-11-08 | 德克斯康公司 | 预连接分析物传感器 |
| WO2019089567A1 (en) | 2017-10-30 | 2019-05-09 | Massachusetts Institute Of Technology | Layer-by-layer nanoparticles for cytokine therapy in cancer treatment |
| CN111742019B (zh) * | 2018-01-22 | 2022-08-05 | W.L.戈尔有限公司 | 用于形成抗静电涂层的组合物以及用该组合物涂覆的制品 |
| US11896234B2 (en) | 2018-01-26 | 2024-02-13 | Fluidx Medical Technology, Llc | Apparatus and method of using in situ solidifying complex coacervates for vascular occlusion |
| USD1002852S1 (en) | 2019-06-06 | 2023-10-24 | Abbott Diabetes Care Inc. | Analyte sensor device |
| WO2020261281A1 (en) * | 2019-06-27 | 2020-12-30 | Ramot At Tel-Aviv University Ltd. | Semaphorin 3a antibodies and uses thereof |
| US20210106718A1 (en) * | 2019-10-14 | 2021-04-15 | Board Of Regents, The University Of Texas System | Mussel inspired nancomposite adhesives for biomedical applications |
| EP3862032A1 (de) | 2020-02-07 | 2021-08-11 | Micell Technologies, Inc. | Stents mit biologisch abbaubaren schichten |
| CN111759552A (zh) | 2020-07-06 | 2020-10-13 | 苏州莱诺医疗器械有限公司 | 一种可吸收支架系统 |
| USD999913S1 (en) | 2020-12-21 | 2023-09-26 | Abbott Diabetes Care Inc | Analyte sensor inserter |
| US11846600B2 (en) * | 2021-09-01 | 2023-12-19 | Cirrus Logic Inc. | Circuitry for analyte measurement |
| GB2620979A (en) * | 2022-07-28 | 2024-01-31 | Imperial College Innovations Ltd | Implantable device for monitoring of human wellbeing and different health conditions |
Family Cites Families (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3773919A (en) | 1969-10-23 | 1973-11-20 | Du Pont | Polylactide-drug mixtures |
| US3921636A (en) * | 1973-01-15 | 1975-11-25 | Alza Corp | Novel drug delivery device |
| US4070347A (en) | 1976-08-16 | 1978-01-24 | Alza Corporation | Poly(orthoester) co- and homopolymers and poly(orthocarbonate) co- and homopolymers having carbonyloxy functionality |
| US4122605A (en) | 1976-09-22 | 1978-10-31 | Kyoto Ceramic Kabushiki Kaisha | Somatic element of single crystalline sapphire ceramics |
| US4186189A (en) | 1977-09-28 | 1980-01-29 | Ethicon, Inc. | Absorbable pharmaceutical compositions based on poly(alkylene oxalates) |
| US4130639A (en) | 1977-09-28 | 1978-12-19 | Ethicon, Inc. | Absorbable pharmaceutical compositions based on isomorphic copolyoxalates |
| US4304591A (en) | 1978-01-25 | 1981-12-08 | Ciba-Geigy Corporation | Water-insoluble hydrophilic copolymers used as carriers for medicaments and pesticides |
| US4498039A (en) * | 1979-06-18 | 1985-02-05 | International Business Machines Corporation | Instrument for use with an electrochemical cell |
| US4379138A (en) | 1981-12-28 | 1983-04-05 | Research Triangle Institute | Biodegradable polymers of lactones |
| IT1170375B (it) | 1983-04-19 | 1987-06-03 | Giuseppe Bombardieri | Apparecchio che infonde insulina o glucosio nel soggetto diabetico sulla base di determinazioni di concentrazioni di glucosio ottenute senza bisogno di prelievi del sangue del paziente |
| US4648880A (en) | 1984-08-30 | 1987-03-10 | Daniel Brauman | Implantable prosthetic devices |
| US4900556A (en) | 1985-04-26 | 1990-02-13 | Massachusetts Institute Of Technology | System for delayed and pulsed release of biologically active substances |
| US4703756A (en) | 1986-05-06 | 1987-11-03 | The Regents Of The University Of California | Complete glucose monitoring system with an implantable, telemetered sensor module |
| US5342622A (en) | 1986-05-16 | 1994-08-30 | The State Of Victoria | Subdermal biocompatible implants |
| US4994081A (en) | 1986-10-16 | 1991-02-19 | Cbs Lens | Method for locating on a cornea an artificial lens fabricated from a collagen-hydrogel for promoting epithelial cell growth |
| US4983181A (en) | 1986-10-16 | 1991-01-08 | Cbs Lens, | Collagen hydrogel for promoting epithelial cell growth and artificial lens using the same |
| US5282856A (en) | 1987-12-22 | 1994-02-01 | Ledergerber Walter J | Implantable prosthetic device |
| US5510418A (en) * | 1988-11-21 | 1996-04-23 | Collagen Corporation | Glycosaminoglycan-synthetic polymer conjugates |
| US5101814A (en) * | 1989-08-11 | 1992-04-07 | Palti Yoram Prof | System for monitoring and controlling blood glucose |
| US5271961A (en) * | 1989-11-06 | 1993-12-21 | Alkermes Controlled Therapeutics, Inc. | Method for producing protein microspheres |
| US5529914A (en) | 1990-10-15 | 1996-06-25 | The Board Of Regents The Univeristy Of Texas System | Gels for encapsulation of biological materials |
| NZ286242A (en) | 1991-03-26 | 1997-11-24 | Csl Ltd | Use of veterinary implant as a single dose vaccination system: rupturable polymer film coating around core of active agent and water soluble excipient |
| US5705178A (en) | 1991-05-31 | 1998-01-06 | Gliatech, Inc. | Methods and compositions based on inhibition of cell invasion and fibrosis by anionic polymers |
| IL103284A0 (en) | 1991-10-31 | 1993-02-21 | Transtech Medical Inc | Transplant protective coating |
| AU3469893A (en) * | 1992-01-15 | 1993-08-03 | Allergan, Inc. | Hydrogel compositions and structures made from same |
| NL9200207A (nl) | 1992-02-05 | 1993-09-01 | Nedap Nv | Implanteerbare biomedische sensorinrichting, in het bijzonder voor meting van de glucoseconcentratie. |
| US5656297A (en) * | 1992-03-12 | 1997-08-12 | Alkermes Controlled Therapeutics, Incorporated | Modulated release from biocompatible polymers |
| US5306294A (en) * | 1992-08-05 | 1994-04-26 | Ultrasonic Sensing And Monitoring Systems, Inc. | Stent construction of rolled configuration |
| JPH08507715A (ja) | 1993-03-18 | 1996-08-20 | シーダーズ サイナイ メディカル センター | 生体人工部材のための薬剤導入性および放出性重合性コーティング |
| DE19501159B4 (de) * | 1995-01-06 | 2004-05-13 | Ehwald, Rudolf, Prof. Dr.sc.nat. | Mikrosensor zur Bestimmung der Konzentration von Glukose und anderen Analyten in Flüssigkeiten auf der Basis der Affinitätsviskosimetrie |
| MX9707593A (es) * | 1995-04-04 | 1997-12-31 | Novartis Ag | Macromero de eter perfluoroalquilico polimerizable. |
| US5711861A (en) | 1995-11-22 | 1998-01-27 | Ward; W. Kenneth | Device for monitoring changes in analyte concentration |
| AU705101B2 (en) | 1996-02-15 | 1999-05-13 | Interface Biologics Inc. | Bioresponsive pharmacologically-active polymers and articles made therefrom |
| US5916585A (en) * | 1996-06-03 | 1999-06-29 | Gore Enterprise Holdings, Inc. | Materials and method for the immobilization of bioactive species onto biodegradable polymers |
| US5932539A (en) * | 1996-10-15 | 1999-08-03 | The Board Of Trustees Of The University Of Illinois | Biodegradable polymer matrix for tissue repair |
| US5914026A (en) | 1997-01-06 | 1999-06-22 | Implanted Biosystems Inc. | Implantable sensor employing an auxiliary electrode |
| US6175752B1 (en) * | 1998-04-30 | 2001-01-16 | Therasense, Inc. | Analyte monitoring device and methods of use |
-
1999
- 1999-11-19 AT AT99959054T patent/ATE269114T1/de not_active IP Right Cessation
- 1999-11-19 AT AT99959055T patent/ATE292931T1/de not_active IP Right Cessation
- 1999-11-19 US US09/443,857 patent/US6497729B1/en not_active Expired - Lifetime
- 1999-11-19 CA CA2354060A patent/CA2354060C/en not_active Expired - Fee Related
- 1999-11-19 US US09/443,764 patent/US6366794B1/en not_active Expired - Fee Related
- 1999-11-19 EP EP99959055A patent/EP1130996B1/de not_active Expired - Lifetime
- 1999-11-19 WO PCT/US1999/027543 patent/WO2000030532A1/en active IP Right Grant
- 1999-11-19 DE DE69924749T patent/DE69924749T2/de not_active Expired - Fee Related
- 1999-11-19 CA CA002351734A patent/CA2351734A1/en not_active Abandoned
- 1999-11-19 EP EP99959054A patent/EP1131114B1/de not_active Expired - Lifetime
- 1999-11-19 DE DE69918159T patent/DE69918159T2/de not_active Expired - Lifetime
- 1999-11-19 WO PCT/US1999/027542 patent/WO2000030698A1/en active IP Right Grant
Also Published As
| Publication number | Publication date |
|---|---|
| WO2000030698A1 (en) | 2000-06-02 |
| EP1131114B1 (de) | 2004-06-16 |
| CA2351734A1 (en) | 2000-06-02 |
| DE69924749D1 (de) | 2005-05-19 |
| EP1130996A1 (de) | 2001-09-12 |
| EP1130996B1 (de) | 2005-04-13 |
| US6366794B1 (en) | 2002-04-02 |
| ATE292931T1 (de) | 2005-04-15 |
| US6497729B1 (en) | 2002-12-24 |
| WO2000030532A1 (en) | 2000-06-02 |
| EP1131114A1 (de) | 2001-09-12 |
| ATE269114T1 (de) | 2004-07-15 |
| DE69918159D1 (de) | 2004-07-22 |
| CA2354060A1 (en) | 2000-06-02 |
| DE69924749T2 (de) | 2006-04-27 |
| CA2354060C (en) | 2014-01-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69918159T2 (de) | Verfahren und vorrichtung zur steuerung der gewebeimplantat-interaktionen | |
| US20030099682A1 (en) | Apparatus and method for control of tissue/implant interactions | |
| US10668185B2 (en) | Methods of manufacturing injectable microgel scaffolds | |
| Ratner et al. | Synthetic hydrogels for biomedical applications | |
| US8512693B2 (en) | Self-assembling membranes and related methods thereof | |
| EP2842481B1 (de) | Hydrogel-Implantat für Sensorik von Metaboliten in Körpergewebe | |
| DE69819343T2 (de) | Zusammensetzungen und ihre verwendung zur verhütung von verklebungen zwischen körpergewebe | |
| Han et al. | Hydrogel–electrospun fiber mat composite coatings for neural prostheses | |
| JP2009540936A (ja) | コラーゲン足場、それを伴う医療用埋植物、およびその使用方法 | |
| DE4204012A1 (de) | Mitogenfreie substanz, deren herstellung und verwendung | |
| CA2386151A1 (en) | Reactive polymeric valve, dispensing devices and methods using same | |
| Raval et al. | Surface modifications of biomaterials and their implication on biocompatibility | |
| Yang et al. | Minimally invasive bioprinting for in situ liver regeneration | |
| EP2493453B1 (de) | Therapeutische verwendung von biokompatiblen zusammensetzungen und hieraus polymerisierten materialien zur inhibierung der angiogenese | |
| US20210386833A1 (en) | Angiogenesis promoter and therapeutic method | |
| US20240024090A1 (en) | Establishing a physiological skin-material connection | |
| KR102258737B1 (ko) | 안전성이 향상된 조직확장기의 표면 코팅방법 | |
| Ju | A novel biostable three-dimensional porous collagen scaffold for implantable biosensor | |
| WO2019151450A1 (ja) | 神経細胞培養材および神経損傷治療剤 | |
| WO2022058809A1 (es) | Matriz polimérica multicapa | |
| Gabi | Cells and currents | |
| CN114225098A (zh) | 一种具有抗菌和促进伤口愈合的医用敷料 | |
| Kim | Surface modification of neural prosthetic devices by functional polymers incorporating neurotrophic and pharmacological agents | |
| Lewitus | Biomaterial strategies towards the development of next generation neural prosthetic devices | |
| Satish | Formulation and Evaluation of Self-regulated drug delivery Systems of Insulin |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition |