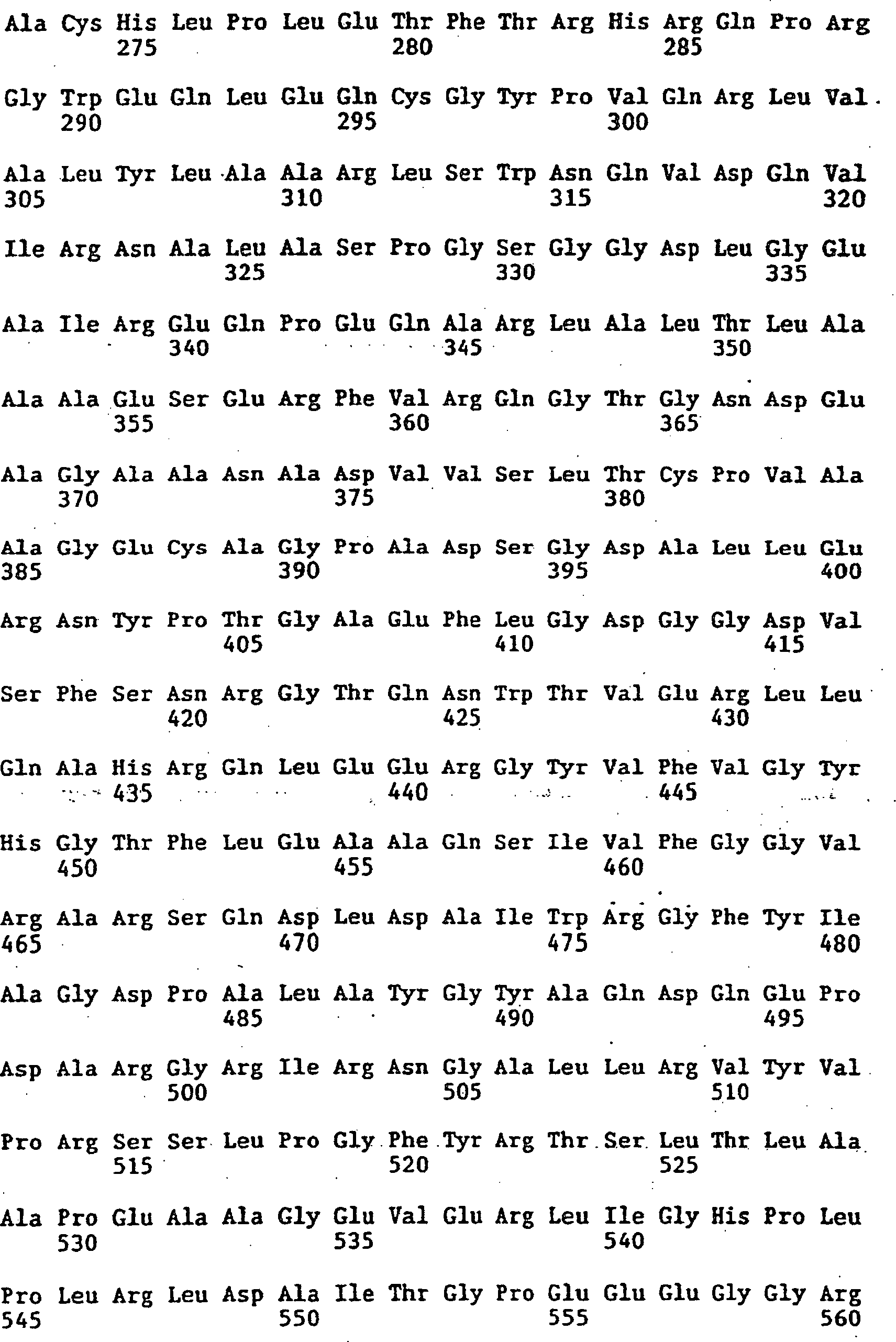|
US7838216B1
(en)
|
1986-03-05 |
2010-11-23 |
The United States Of America, As Represented By The Department Of Health And Human Services |
Human gene related to but distinct from EGF receptor gene
|
|
US5869620A
(en)
*
|
1986-09-02 |
1999-02-09 |
Enzon, Inc. |
Multivalent antigen-binding proteins
|
|
US20050058638A1
(en)
*
|
1987-05-21 |
2005-03-17 |
Huston James S. |
Biosynthetic binding proteins for immuno-targeting
|
|
JP2919890B2
(ja)
*
|
1988-11-11 |
1999-07-19 |
メディカル リサーチ カウンスル |
単一ドメインリガンド、そのリガンドからなる受容体、その製造方法、ならびにそのリガンドおよび受容体の使用
|
|
ATE241011T1
(de)
*
|
1991-02-27 |
2003-06-15 |
Micromet Ag |
Serin-reiche peptidlinker
|
|
KR100334696B1
(ko)
*
|
1991-08-05 |
2002-04-27 |
리차아드제이마세이 |
표적화된 촉매 단백질에 의해 활성화되는 선구 약제
|
|
US6025165A
(en)
|
1991-11-25 |
2000-02-15 |
Enzon, Inc. |
Methods for producing multivalent antigen-binding proteins
|
|
US20070031931A1
(en)
*
|
1992-02-06 |
2007-02-08 |
Chiron Corporation |
Biosynthetic binding proteins for immuno-targeting
|
|
CA2129663C
(en)
*
|
1992-02-06 |
2005-07-05 |
James S. Huston |
Biosynthetic binding protein for cancer marker
|
|
US7754211B2
(en)
*
|
1992-04-10 |
2010-07-13 |
Research Development Foundation |
Immunotoxins directed against c-erbB-2(HER-2/neu) related surface antigens
|
|
US20080152586A1
(en)
*
|
1992-09-25 |
2008-06-26 |
Avipep Pty Limited |
High avidity polyvalent and polyspecific reagents
|
|
WO1994012520A1
(en)
*
|
1992-11-20 |
1994-06-09 |
Enzon, Inc. |
Linker for linked fusion polypeptides
|
|
GB9225453D0
(en)
|
1992-12-04 |
1993-01-27 |
Medical Res Council |
Binding proteins
|
|
DK0672142T3
(da)
*
|
1992-12-04 |
2001-06-18 |
Medical Res Council |
Multivalente og multispecifikke bindingsproteiner samt fremstilling og anvendelse af disse
|
|
AU680685B2
(en)
|
1993-09-22 |
1997-08-07 |
Medical Research Council |
Retargeting antibodies
|
|
US5753225A
(en)
|
1993-12-03 |
1998-05-19 |
The Regents Of The University Of California |
Antibodies that mimic actions of neurotrophins
|
|
IT1264083B1
(it)
*
|
1993-12-10 |
1996-09-10 |
Enea Ente Nuove Tec |
Procedimento per la produzione in piante di anticorpi ingegnerizzati, anticorpi prodotti e loro uso in diagnosi e terapia.
|
|
US5763733A
(en)
*
|
1994-10-13 |
1998-06-09 |
Enzon, Inc. |
Antigen-binding fusion proteins
|
|
US6514942B1
(en)
*
|
1995-03-14 |
2003-02-04 |
The Board Of Regents, The University Of Texas System |
Methods and compositions for stimulating T-lymphocytes
|
|
AUPO591797A0
(en)
*
|
1997-03-27 |
1997-04-24 |
Commonwealth Scientific And Industrial Research Organisation |
High avidity polyvalent and polyspecific reagents
|
|
US6267958B1
(en)
|
1995-07-27 |
2001-07-31 |
Genentech, Inc. |
Protein formulation
|
|
US6685940B2
(en)
*
|
1995-07-27 |
2004-02-03 |
Genentech, Inc. |
Protein formulation
|
|
US5968511A
(en)
|
1996-03-27 |
1999-10-19 |
Genentech, Inc. |
ErbB3 antibodies
|
|
WO1997035885A1
(en)
*
|
1996-03-27 |
1997-10-02 |
Genentech, Inc. |
ErbB3 ANTIBODIES
|
|
US6136311A
(en)
|
1996-05-06 |
2000-10-24 |
Cornell Research Foundation, Inc. |
Treatment and diagnosis of cancer
|
|
JP2000515735A
(ja)
*
|
1996-07-03 |
2000-11-28 |
ジェネンテック インコーポレーテッド |
肝細胞成長因子レセプターアゴニスト
|
|
EP0922111B1
(de)
*
|
1996-07-23 |
2004-12-01 |
Tanox Pharma B.V. |
Induzierung von t zell toleranz unter verwendung eines löslichen moleküls, dass gleichzeitig zwei kostimulierungswege blockieren kann
|
|
JP2000516808A
(ja)
*
|
1996-08-05 |
2000-12-19 |
プレジデント アンド フェローズ オブ ハーバード カレッジ |
Mhc結合ペプチドオリゴマーおよび使用方法
|
|
US7371376B1
(en)
*
|
1996-10-18 |
2008-05-13 |
Genentech, Inc. |
Anti-ErbB2 antibodies
|
|
ATE444760T1
(de)
*
|
1997-01-13 |
2009-10-15 |
Univ Emory |
Glutathion zur behandlung von influenzainfektionen
|
|
WO1998033809A1
(en)
*
|
1997-01-31 |
1998-08-06 |
The General Hospital Corporation |
Compositions and methods for imaging gene expression
|
|
US20030109680A1
(en)
*
|
2001-11-21 |
2003-06-12 |
Sunol Molecular Corporation |
Antibodies for inhibiting blood coagulation and methods of use thereof
|
|
US7749498B2
(en)
*
|
1997-03-10 |
2010-07-06 |
Genentech, Inc. |
Antibodies for inhibiting blood coagulation and methods of use thereof
|
|
US5986065A
(en)
*
|
1997-03-10 |
1999-11-16 |
Sunol Molecular Corporation |
Antibodies for inhibiting blood coagulation and methods of use thereof
|
|
US20060235209A9
(en)
*
|
1997-03-10 |
2006-10-19 |
Jin-An Jiao |
Use of anti-tissue factor antibodies for treating thromboses
|
|
US20040009166A1
(en)
*
|
1997-04-30 |
2004-01-15 |
Filpula David R. |
Single chain antigen-binding polypeptides for polymer conjugation
|
|
US6323322B1
(en)
|
1997-04-30 |
2001-11-27 |
Enzon, Inc. |
Single-chain antigen-binding proteins capable of glycosylation, production and uses thereof
|
|
DE69837760T3
(de)
|
1997-06-13 |
2012-06-21 |
Genentech, Inc. |
Proteinreinigung mittels chromatographie und darauffolgende filtration auf beladener schicht
|
|
US5994511A
(en)
|
1997-07-02 |
1999-11-30 |
Genentech, Inc. |
Anti-IgE antibodies and methods of improving polypeptides
|
|
US6172213B1
(en)
|
1997-07-02 |
2001-01-09 |
Genentech, Inc. |
Anti-IgE antibodies and method of improving polypeptides
|
|
FR2766826B1
(fr)
*
|
1997-08-04 |
2001-05-18 |
Pasteur Institut |
Vecteurs derives d'anticorps pour le transfert de substances dans les cellules
|
|
US6737249B1
(en)
*
|
1997-08-22 |
2004-05-18 |
Genentech, Inc. |
Agonist antibodies
|
|
ZA9811162B
(en)
*
|
1997-12-12 |
2000-06-07 |
Genentech Inc |
Treatment with anti-ERBB2 antibodies.
|
|
EP1947119A3
(de)
|
1997-12-12 |
2012-12-19 |
Genentech, Inc. |
Krebsbehandlung mit Antikörpern gegen ERBB2 und einem chemotherapeutischen Mittel
|
|
EP1941905A1
(de)
|
1998-03-27 |
2008-07-09 |
Genentech, Inc. |
APO-2 Liganden-Anti-HER-2-Antikörper-Synergismus
|
|
DE19819846B4
(de)
|
1998-05-05 |
2016-11-24 |
Deutsches Krebsforschungszentrum Stiftung des öffentlichen Rechts |
Multivalente Antikörper-Konstrukte
|
|
AU4009899A
(en)
*
|
1998-05-23 |
1999-12-13 |
Tanox, Inc. |
Molecules targeting cd40 and tumor cells
|
|
GB9812545D0
(en)
*
|
1998-06-10 |
1998-08-05 |
Celltech Therapeutics Ltd |
Biological products
|
|
US7387772B1
(en)
|
1999-06-22 |
2008-06-17 |
Immunimedics, Inc. |
Chimeric, human and humanized anti-CSAP monoclonal antibodies
|
|
US6962702B2
(en)
*
|
1998-06-22 |
2005-11-08 |
Immunomedics Inc. |
Production and use of novel peptide-based agents for use with bi-specific antibodies
|
|
US7138103B2
(en)
*
|
1998-06-22 |
2006-11-21 |
Immunomedics, Inc. |
Use of bi-specific antibodies for pre-targeting diagnosis and therapy
|
|
US7405320B2
(en)
|
1998-06-22 |
2008-07-29 |
Immunomedics, Inc. |
Therapeutic and diagnostic conjugates for use with multispecific antibodies
|
|
DE69942148D1
(de)
*
|
1998-06-22 |
2010-04-29 |
Immunomedics Inc |
Gebrauch von bispezifischen antikörpern in diagnose und therapie
|
|
US7833528B2
(en)
*
|
1998-06-22 |
2010-11-16 |
Immunomedics, Inc. |
Use of multispecific, non-covalent complexes for targeted delivery of therapeutics
|
|
DE19831429A1
(de)
*
|
1998-07-07 |
2000-04-27 |
Jerini Biotools Gmbh |
Verfahren zur Identifizierung und chemisch-synthetischen Nachahmung von Bindungsstellen auf Proteinen
|
|
US6228360B1
(en)
*
|
1998-08-19 |
2001-05-08 |
Ajinomoto Co., Inc. |
Antithrombotic agent and humanized anti-von Willebrand factor monoclonal antibody
|
|
US7067144B2
(en)
*
|
1998-10-20 |
2006-06-27 |
Omeros Corporation |
Compositions and methods for systemic inhibition of cartilage degradation
|
|
US6333396B1
(en)
|
1998-10-20 |
2001-12-25 |
Enzon, Inc. |
Method for targeted delivery of nucleic acids
|
|
US6818749B1
(en)
|
1998-10-31 |
2004-11-16 |
The United States Of America As Represented By The Department Of Health And Human Services |
Variants of humanized anti carcinoma monoclonal antibody cc49
|
|
US7118743B2
(en)
|
1998-11-17 |
2006-10-10 |
Tanox, Inc. |
Bispecific molecules cross-linking ITIM and ITAM for therapy
|
|
WO2000029431A1
(en)
*
|
1998-11-17 |
2000-05-25 |
Tanox, Inc. |
Bispecific molecules cross-linking itim and itam for therapy
|
|
EP1950300A3
(de)
|
1998-11-18 |
2011-03-23 |
Genentech, Inc. |
Antikörpervarianten mit höherer Bindungsaffinität im Vergleich zu verwandten Antikörpern
|
|
US20030086924A1
(en)
*
|
1999-06-25 |
2003-05-08 |
Genentech, Inc. |
Treatment with anti-ErbB2 antibodies
|
|
DK1189634T3
(da)
*
|
1999-06-25 |
2007-06-25 |
Genentech Inc |
Behandling af prostatacancer med anti-ErbB2-antistoffer
|
|
US6949245B1
(en)
*
|
1999-06-25 |
2005-09-27 |
Genentech, Inc. |
Humanized anti-ErbB2 antibodies and treatment with anti-ErbB2 antibodies
|
|
US20040013667A1
(en)
*
|
1999-06-25 |
2004-01-22 |
Genentech, Inc. |
Treatment with anti-ErbB2 antibodies
|
|
AU784045B2
(en)
|
1999-06-25 |
2006-01-19 |
Genentech Inc. |
Humanized anti-ErbB2 antibodies and treatment with anti-ErbB2 antibodies
|
|
US7041292B1
(en)
|
1999-06-25 |
2006-05-09 |
Genentech, Inc. |
Treating prostate cancer with anti-ErbB2 antibodies
|
|
BRPI0012196B8
(pt)
|
1999-06-25 |
2021-05-25 |
Genentech Inc |
artigo industrializado
|
|
KR20110008112A
(ko)
|
1999-08-27 |
2011-01-25 |
제넨테크, 인크. |
항-ErbB2 항체 투여 치료 방법
|
|
CA2385528C
(en)
|
1999-10-01 |
2013-12-10 |
Immunogen, Inc. |
Compositions and methods for treating cancer using immunoconjugates and chemotherapeutic agents
|
|
US6794494B1
(en)
*
|
2003-04-14 |
2004-09-21 |
Arius Research, Inc. |
Cancerous disease modifying antibodies
|
|
UA74803C2
(uk)
|
1999-11-11 |
2006-02-15 |
Осі Фармасьютікалз, Інк. |
Стійкий поліморф гідрохлориду n-(3-етинілфеніл)-6,7-біс(2-метоксіетокси)-4-хіназолінаміну, спосіб його одержання (варіанти) та фармацевтичне застосування
|
|
AU3662101A
(en)
|
2000-02-01 |
2001-08-14 |
Tanox Inc |
Cd40-binding apc-activating molecules
|
|
EP1259548A1
(de)
*
|
2000-02-24 |
2002-11-27 |
Eidgenössische Technische Hochschule Zürich |
Antikörper gegen die ed-b domäne von fibronektin, konjugate die diesen antikörper enthalten, und deren verwendung zum nachweis und zur behandlung von angiogenese
|
|
US6319694B1
(en)
*
|
2000-03-03 |
2001-11-20 |
Genopsys, Inc. |
Random truncation and amplification of nucleic acid
|
|
US7097840B2
(en)
*
|
2000-03-16 |
2006-08-29 |
Genentech, Inc. |
Methods of treatment using anti-ErbB antibody-maytansinoid conjugates
|
|
JP2003531588A
(ja)
|
2000-04-11 |
2003-10-28 |
ジェネンテック・インコーポレーテッド |
多価抗体とその用途
|
|
EP1284752A4
(de)
*
|
2000-04-26 |
2004-08-18 |
Elusys Therapeutics Inc |
Biospezifische moleküle und deren verwendung
|
|
WO2001083781A2
(en)
*
|
2000-04-28 |
2001-11-08 |
Millennium Pharmaceuticals, Inc. |
14094, a novel human trypsin family member and uses thereof
|
|
DK1282443T3
(da)
|
2000-05-19 |
2010-01-04 |
Genentech Inc |
Gendetektionsassay til at forbedre sandsynligheden for et effektivt respons på en ErbB-antagonist cancerterapi
|
|
WO2001091793A1
(en)
*
|
2000-05-26 |
2001-12-06 |
Smithkline Beecham Corporation |
Anti-rank ligand monoclonal antibodies useful in treatment of rank ligand mediated disorders
|
|
JP2004512262A
(ja)
|
2000-06-20 |
2004-04-22 |
アイデック ファーマスーティカルズ コーポレイション |
非放射性抗cd20抗体/放射標識抗cd22抗体の組合せ
|
|
GB0027328D0
(en)
*
|
2000-06-23 |
2000-12-27 |
Aventis Pharma Inc |
Bioengineered vehicles for targeted nucleic acid delivery
|
|
PL364358A1
(en)
*
|
2000-09-07 |
2004-12-13 |
Schering Ag |
Receptor in the edb fibronectin domain (ii)
|
|
US20020106327A1
(en)
*
|
2000-11-15 |
2002-08-08 |
Brian Storrie |
B/b-like fragment targeting for the purposes of photodynamic therapy and medical imaging
|
|
MY143465A
(en)
|
2001-01-05 |
2011-05-13 |
Pfizer |
Antibodies to insulin-like growth factor i receptor
|
|
US20020159996A1
(en)
|
2001-01-31 |
2002-10-31 |
Kandasamy Hariharan |
Use of CD23 antagonists for the treatment of neoplastic disorders
|
|
PT1381384E
(pt)
|
2001-04-24 |
2011-09-01 |
Merck Patent Gmbh |
Terapia de combinação usando agentes anti-angiogénicos e tnfa
|
|
CN1195779C
(zh)
*
|
2001-05-24 |
2005-04-06 |
中国科学院遗传与发育生物学研究所 |
抗人卵巢癌抗人cd3双特异性抗体
|
|
US20070160576A1
(en)
|
2001-06-05 |
2007-07-12 |
Genentech, Inc. |
IL-17A/F heterologous polypeptides and therapeutic uses thereof
|
|
DK2000545T3
(da)
|
2001-06-20 |
2011-11-28 |
Genentech Inc |
Sammensætninger og fremgangsmåder til diagnose og behandling af lunge-tumor
|
|
US6995171B2
(en)
|
2001-06-21 |
2006-02-07 |
Agouron Pharmaceuticals, Inc. |
Bicyclic pyrimidine and pyrimidine derivatives useful as anticancer agents
|
|
CA2460120A1
(en)
|
2001-09-18 |
2003-03-27 |
Genentech, Inc. |
Compositions and methods for the diagnosis and treatment of tumor
|
|
US20050123925A1
(en)
|
2002-11-15 |
2005-06-09 |
Genentech, Inc. |
Compositions and methods for the diagnosis and treatment of tumor
|
|
AR039067A1
(es)
*
|
2001-11-09 |
2005-02-09 |
Pfizer Prod Inc |
Anticuerpos para cd40
|
|
JP2005525095A
(ja)
|
2002-01-02 |
2005-08-25 |
ジェネンテック・インコーポレーテッド |
腫瘍の診断と治療のための組成物と方法
|
|
EP1461360B1
(de)
*
|
2002-01-03 |
2010-08-18 |
Bayer Schering Pharma Aktiengesellschaft |
Konjugate mit einem für die ed-b-domäne von fibronectin spezifischen antikörper, und deren verwendung zum nachweis und zur behandlung von tumoren
|
|
US6870034B2
(en)
|
2002-02-05 |
2005-03-22 |
Genentech, Inc. |
Protein purification
|
|
US6869787B2
(en)
*
|
2002-02-27 |
2005-03-22 |
The United States Of America As Represented By The Secretary Of The Army |
Ricin vaccine and methods of making and using thereof
|
|
WO2003087131A2
(en)
|
2002-04-10 |
2003-10-23 |
Genentech, Inc |
Anti-her2 antibody variants
|
|
US20030228606A1
(en)
*
|
2002-04-11 |
2003-12-11 |
Amgen Inc., A Corporation Of The State Of Delaware |
Her-2 receptor tyrosine kinase molecules and uses thereof
|
|
AU2003230874A1
(en)
|
2002-04-16 |
2003-11-03 |
Genentech, Inc. |
Compositions and methods for the diagnosis and treatment of tumor
|
|
UA77303C2
(en)
*
|
2002-06-14 |
2006-11-15 |
Pfizer |
Derivatives of thienopyridines substituted by benzocondensed heteroarylamide useful as therapeutic agents, pharmaceutical compositions and methods for their use
|
|
US7569673B2
(en)
*
|
2002-06-28 |
2009-08-04 |
The United States Of America As Represented By The Department Of Health And Human Services |
Humanized anti-tag 72 cc49 for diagnosis and therapy of human tumors
|
|
CN101711866A
(zh)
|
2002-07-15 |
2010-05-26 |
健泰科生物技术公司 |
鉴定对用抗ErbB2抗体处理响应的肿瘤的方法
|
|
PT1543038T
(pt)
|
2002-09-11 |
2017-07-07 |
Genentech Inc |
Purificação de proteína
|
|
AU2002951853A0
(en)
*
|
2002-10-04 |
2002-10-24 |
Commonwealth Scientific And Industrial Research Organisation |
Crystal structure of erbb2 and uses thereof
|
|
US9701754B1
(en)
|
2002-10-23 |
2017-07-11 |
City Of Hope |
Covalent disulfide-linked diabodies and uses thereof
|
|
EP1572972A4
(de)
*
|
2002-11-21 |
2007-11-21 |
Genentech Inc |
Therapie nichtmaligner krankheiten oder störungen mit anti-erbb2-antikörpern
|
|
US20040186160A1
(en)
*
|
2002-12-13 |
2004-09-23 |
Sugen, Inc. |
Hexahydro-cyclohepta-pyrrole oxindole as potent kinase inhibitors
|
|
MXPA05006676A
(es)
*
|
2002-12-19 |
2005-08-16 |
Pfizer |
Compuestos de indazol y composiciones farmaceuticas para inhibir proteinquinasas, y procedimientos para su uso.
|
|
US7531169B2
(en)
|
2003-02-01 |
2009-05-12 |
Tanox, Inc. |
High affinity anti-human IgE antibodies
|
|
AP2114A
(en)
|
2003-02-26 |
2010-03-04 |
Sugen Inc |
Aminoheteroaryl compounds as protein kinase inhibitors
|
|
CA2520932A1
(en)
*
|
2003-04-03 |
2004-10-14 |
Pfizer Inc. |
Dosage forms comprising ag013736
|
|
PT2335725T
(pt)
|
2003-04-04 |
2017-01-06 |
Novartis Ag |
Formulações de elevada concentração de anticorpos e proteínas
|
|
ZA200507805B
(en)
|
2003-04-09 |
2006-12-27 |
Genentech Inc |
Therapy of autoimmune disease in a patient with an inadequate response to a TNF-alpha inhibitor
|
|
US7425328B2
(en)
*
|
2003-04-22 |
2008-09-16 |
Purdue Pharma L.P. |
Tissue factor antibodies and uses thereof
|
|
US8088387B2
(en)
|
2003-10-10 |
2012-01-03 |
Immunogen Inc. |
Method of targeting specific cell populations using cell-binding agent maytansinoid conjugates linked via a non-cleavable linker, said conjugates, and methods of making said conjugates
|
|
JP2007525466A
(ja)
|
2003-05-30 |
2007-09-06 |
ジェネンテック・インコーポレーテッド |
抗vegf抗体での治療
|
|
PT2272868E
(pt)
|
2003-06-05 |
2015-07-07 |
Genentech Inc |
Terapêutica de combinação para distúrbios de células b
|
|
JP5114055B2
(ja)
*
|
2003-06-19 |
2013-01-09 |
ジェネンテック, インク. |
障害に関連する凝固の治療用組成物および方法
|
|
PL1641822T3
(pl)
|
2003-07-08 |
2013-10-31 |
Genentech Inc |
Heterologiczne polipeptydy IL-17 A/F i ich zastosowania terapeutyczne
|
|
DK1648940T3
(en)
|
2003-07-28 |
2016-08-15 |
Genentech Inc |
Reduction of leaching of protein A during protein A affinity chromatography
|
|
HN2004000285A
(es)
|
2003-08-04 |
2006-04-27 |
Pfizer Prod Inc |
ANTICUERPOS DIRIGIDOS A c-MET
|
|
MXPA06002256A
(es)
*
|
2003-08-29 |
2006-05-17 |
Pfizer |
Naftaleno carboxamidas y sus derivados utiles como agentes anti-angiogenicos.
|
|
US7589181B2
(en)
*
|
2003-08-29 |
2009-09-15 |
The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services |
Minimally immunogenic variants of SDR-grafted humanized antibody CC49 and their use
|
|
ES2314444T3
(es)
*
|
2003-08-29 |
2009-03-16 |
Pfizer Inc. |
Tienopiridina-fenilacetaminasy sus derivados utiles como nuevos agentes antiangiogenicos.
|
|
AR045563A1
(es)
|
2003-09-10 |
2005-11-02 |
Warner Lambert Co |
Anticuerpos dirigidos a m-csf
|
|
ZA200603619B
(en)
|
2003-11-06 |
2008-10-29 |
Seattle Genetics Inc |
Monomethylvaline compounds capable of conjugation to ligands
|
|
CA2747871C
(en)
|
2003-11-17 |
2018-04-10 |
Genentech, Inc. |
Compositions and methods for the treatment of tumor of hematopoietic origin
|
|
EP1689721B1
(de)
*
|
2003-11-26 |
2010-07-14 |
Pfizer Products Inc. |
Aminopyrazolderivate als gsk-3-inhibitoren
|
|
US8298532B2
(en)
|
2004-01-16 |
2012-10-30 |
Regeneron Pharmaceuticals, Inc. |
Fusion polypeptides capable of activating receptors
|
|
ATE452147T1
(de)
|
2004-02-19 |
2010-01-15 |
Genentech Inc |
Antikörper mit korrigierten cdr
|
|
WO2005094830A1
(en)
*
|
2004-03-30 |
2005-10-13 |
Pfizer Products Inc. |
Combinations of signal transduction inhibitors
|
|
NZ550217A
(en)
|
2004-03-31 |
2009-11-27 |
Genentech Inc |
Humanized anti-TGF-beta antibodies
|
|
US20150017671A1
(en)
|
2004-04-16 |
2015-01-15 |
Yaping Shou |
Methods for detecting lp-pla2 activity and inhibition of lp-pla2 activity
|
|
CN102973947A
(zh)
|
2004-06-01 |
2013-03-20 |
健泰科生物技术公司 |
抗体-药物偶联物和方法
|
|
WO2005117978A2
(en)
|
2004-06-04 |
2005-12-15 |
Genentech, Inc. |
Method for treating multiple sclerosis
|
|
GT200500155A
(es)
|
2004-06-16 |
2006-05-15 |
|
Terapia del càncer resistente al platino
|
|
EP2335727A3
(de)
*
|
2004-07-16 |
2011-09-28 |
Pfizer Products Inc. |
Kombinationsbehandlung für nicht-hämatologische bösartige Erkrankungen mit einem anti-IGF-1R-Antikörper
|
|
US8604185B2
(en)
|
2004-07-20 |
2013-12-10 |
Genentech, Inc. |
Inhibitors of angiopoietin-like 4 protein, combinations, and their use
|
|
CN101044164A
(zh)
|
2004-07-20 |
2007-09-26 |
健泰科生物技术公司 |
血管生成素样4蛋白抑制剂,组合,以及其用途
|
|
AU2005276132B2
(en)
*
|
2004-08-26 |
2011-09-29 |
Pfizer Inc. |
Pyrazole-substituted aminoheteroaryl compounds as protein kinase inhibitors
|
|
EA013678B1
(ru)
|
2004-08-26 |
2010-06-30 |
Пфайзер Инк. |
Энантиомерно чистые аминогетероарильные соединения в качестве ингибиторов протеинкиназы
|
|
CA2578075A1
(en)
*
|
2004-08-26 |
2006-03-02 |
Pfizer Inc. |
Aminoheteroaryl compounds as protein tyrosine kinase inhibitors
|
|
WO2006034335A2
(en)
*
|
2004-09-21 |
2006-03-30 |
Government Of The United States Of America, Represented By The Secretary, Department Of Health And Human Services |
Method of detecting cancer based on immune reaction to boris
|
|
KR101270829B1
(ko)
|
2004-09-23 |
2013-06-07 |
제넨테크, 인크. |
시스테인 유전자조작 항체 및 접합체
|
|
US20100111856A1
(en)
|
2004-09-23 |
2010-05-06 |
Herman Gill |
Zirconium-radiolabeled, cysteine engineered antibody conjugates
|
|
JO3000B1
(ar)
|
2004-10-20 |
2016-09-05 |
Genentech Inc |
مركبات أجسام مضادة .
|
|
US20060107555A1
(en)
*
|
2004-11-09 |
2006-05-25 |
Curtis Marc D |
Universal snow plow adapter
|
|
ES2343746T3
(es)
|
2005-01-07 |
2010-08-09 |
Diadexus, Inc. |
Composiciones de anticuerpo ovr110 y metodos de uso.
|
|
RU2438705C2
(ru)
|
2005-01-21 |
2012-01-10 |
Дженентек, Инк. |
Введение фиксированных доз her-антител
|
|
US20060177448A1
(en)
*
|
2005-02-09 |
2006-08-10 |
Genentech, Inc. |
Inhibiting HER2 shedding with matrix metalloprotease antagonists
|
|
CA2597924C
(en)
|
2005-02-15 |
2018-10-02 |
Duke University |
Anti-cd19 antibodies and uses in oncology
|
|
NZ590431A
(en)
|
2005-02-23 |
2012-08-31 |
Genentech Inc |
Extending time to disease progression or survival in cancer patients using a HER dimerization inhibitor
|
|
WO2006096861A2
(en)
*
|
2005-03-08 |
2006-09-14 |
Genentech, Inc. |
METHODS FOR IDENTIFYING TUMORS RESPONSIVE TO TREATMENT WITH HER DIMERIZATION INHIBITORS (HDIs)
|
|
CA2603093A1
(en)
|
2005-03-31 |
2006-10-05 |
Agensys, Inc. |
Antibodies and related molecules that bind to 161p2f10b proteins
|
|
EP2444421A1
(de)
|
2005-04-26 |
2012-04-25 |
Pfizer Inc. |
P-Cadherin-Antikörper
|
|
AU2006244445B2
(en)
|
2005-05-05 |
2013-04-18 |
Duke University |
Anti-CD19 antibody therapy for autoimmune disease
|
|
JP2006316040A
(ja)
|
2005-05-13 |
2006-11-24 |
Genentech Inc |
Herceptin(登録商標)補助療法
|
|
CA2610709A1
(en)
|
2005-06-06 |
2006-12-14 |
Genentech, Inc. |
Transgenic models for different genes and their use for gene characterization
|
|
AU2006269422B2
(en)
|
2005-07-07 |
2012-12-06 |
Seagen Inc. |
Monomethylvaline compounds having phenylalanine side-chain modifications at the C-terminus
|
|
WO2007021423A2
(en)
|
2005-08-15 |
2007-02-22 |
Genentech, Inc. |
Gene disruptions, compositions and methods relating thereto
|
|
TWI541253B
(zh)
|
2005-09-07 |
2016-07-11 |
艾默根佛蒙特有限公司 |
針對類活化素受體激酶-1之人類單株抗體
|
|
AU2006292278B2
(en)
|
2005-09-20 |
2012-03-08 |
Osi Pharmaceuticals, Inc. |
Biological markers predictive of anti-cancer response to insulin-like growth factor-1 receptor kinase inhibitors
|
|
KR20180002911A
(ko)
|
2005-11-04 |
2018-01-08 |
제넨테크, 인크. |
안질환 치료를 위한 보체 경로 억제제의 용도
|
|
MY149159A
(en)
|
2005-11-15 |
2013-07-31 |
Hoffmann La Roche |
Method for treating joint damage
|
|
JP2009516514A
(ja)
|
2005-11-21 |
2009-04-23 |
ジェネンテック・インコーポレーテッド |
新規遺伝子破壊、それらに関する組成物および方法
|
|
CA2631961A1
(en)
|
2005-12-02 |
2007-11-08 |
Genentech, Inc. |
Compositions and methods for the treatment of diseases and disorders associated with cytokine signaling relating to antibodies that bind to il-22
|
|
CA2633887C
(en)
|
2005-12-15 |
2015-12-22 |
Genentech, Inc. |
Methods and compositions for targeting polyubiquitin
|
|
US7625759B2
(en)
|
2005-12-19 |
2009-12-01 |
Genentech, Inc. |
Method for using BOC/CDO to modulate hedgehog signaling
|
|
PT1973950E
(pt)
|
2006-01-05 |
2014-12-29 |
Genentech Inc |
Anticorpos anti-epbh4 e métodos que os utilizam
|
|
PE20081186A1
(es)
*
|
2006-01-13 |
2008-09-24 |
Irm Llc |
Metodos y composiciones para el tratamiento de enfermedades alergicas
|
|
EA201200560A1
(ru)
|
2006-01-18 |
2012-09-28 |
Мерк Патент Гмбх |
Специфическая терапия, использующая интегриновые лиганды для лечения рака
|
|
ZA200807714B
(en)
|
2006-02-17 |
2010-01-27 |
Genentech Inc |
Gene disruptions, compositions and methods relating thereto
|
|
EP2650306A1
(de)
|
2006-03-06 |
2013-10-16 |
Aeres Biomedical Limited |
Humanisierte Anti-CD22-Antikörper und ihre Verwendung bei der Behandlung von Krebs, Transplantationen und Autoimmunerkrankungen
|
|
AR059851A1
(es)
|
2006-03-16 |
2008-04-30 |
Genentech Inc |
Anticuerpos de la egfl7 y metodos de uso
|
|
CA2646329C
(en)
|
2006-03-20 |
2018-07-03 |
The Regents Of The University Of California |
Engineered anti-prostate stem cell antigen (psca) antibodies for cancer targeting
|
|
MX2008012013A
(es)
|
2006-03-23 |
2008-10-03 |
Novartis Ag |
Tratamiento con anticuerpo antigeno de celulas neoplasicas.
|
|
EP2614839A3
(de)
|
2006-04-05 |
2015-01-28 |
Genentech, Inc. |
Verfahren zur Verwendung von BOC/CDO zur Modulation der Hedgehog-Signalisierung
|
|
US20090288176A1
(en)
|
2006-04-19 |
2009-11-19 |
Genentech, Inc. |
Novel Gene Disruptions, Compositions and Methods Relating Thereto
|
|
JP4383525B2
(ja)
|
2006-05-09 |
2009-12-16 |
ファイザー・プロダクツ・インク |
シクロアルキルアミノ酸誘導体およびその医薬組成物
|
|
NL2000613C2
(nl)
|
2006-05-11 |
2007-11-20 |
Pfizer Prod Inc |
Triazoolpyrazinederivaten.
|
|
ES2567402T3
(es)
|
2006-05-30 |
2016-04-22 |
Genentech, Inc. |
Anticuerpos anti CD22, sus inmunoconjugados y usos de los mismos
|
|
WO2007143098A2
(en)
|
2006-06-02 |
2007-12-13 |
Aveo Pharmaceuticals, Inc. |
Hepatocyte growth factor (hgf) binding proteins
|
|
SG158112A1
(en)
|
2006-06-02 |
2010-01-29 |
Aveo Pharmaceuticals Inc |
Hepatocyte growth factor (hgf) binding proteins
|
|
FR2902799B1
(fr)
|
2006-06-27 |
2012-10-26 |
Millipore Corp |
Procede et unite de preparation d'un echantillon pour l'analyse microbiologique d'un liquide
|
|
EP2426150B1
(de)
|
2006-06-30 |
2017-10-25 |
Novo Nordisk A/S |
Anti-NKG2A-Antikörper und deren Verwendungen
|
|
MX2009000696A
(es)
|
2006-07-19 |
2009-01-30 |
Univ Pennsylvania |
Wsx-1/p28 como un objetivo para respuestas anti-inflamatorias.
|
|
WO2008016431A2
(en)
|
2006-07-29 |
2008-02-07 |
Robert Lamar Bjork |
Bi-specific monoclonal antibody (specific for both cd3 and cd11b) therapeutic drug
|
|
AU2007284651B2
(en)
|
2006-08-09 |
2014-03-20 |
Institute For Systems Biology |
Organ-specific proteins and methods of their use
|
|
JP2010501172A
(ja)
|
2006-08-25 |
2010-01-21 |
オンコセラピー・サイエンス株式会社 |
肺癌に対する予後マーカーおよび治療標的
|
|
EP2469282A1
(de)
|
2006-09-08 |
2012-06-27 |
University of Oxford |
Klinische Diagnose von Leberfibrose mithilfe einer neuartigen Tafel von menschlichen Serumprotein-Biomarkern
|
|
ATE551071T1
(de)
|
2006-09-08 |
2012-04-15 |
Medimmune Llc |
Humanisierte anti-cd19-antikörper und ihre verwendung für die behandlung von krebs, transplantationen und autoimmunerkrankungen
|
|
US20080076139A1
(en)
|
2006-09-21 |
2008-03-27 |
Sharat Singh |
Methods and compositions for detecting the activation states of multiple signal transducers in rare circulating cells
|
|
WO2011008990A1
(en)
|
2009-07-15 |
2011-01-20 |
Prometheus Laboratories Inc. |
Drug selection for gastric cancer therapy using antibody-based arrays
|
|
US8436147B2
(en)
|
2006-10-27 |
2013-05-07 |
Genentech, Inc. |
Antibodies and immunoconjugates and uses therefor
|
|
EP2503341A3
(de)
|
2006-11-14 |
2012-10-03 |
Genentech, Inc. |
Modulatoren neuronaler Regeneration
|
|
EP3156415A1
(de)
|
2006-11-22 |
2017-04-19 |
Bristol-Myers Squibb Company |
Gezielte therapeutik auf grundlage manipulierter proteine für tyrosinkinaserezeptoren, einschliesslich igf-ir
|
|
JP5391073B2
(ja)
|
2006-11-27 |
2014-01-15 |
ディアデクサス インコーポレーテッド |
Ovr110抗体組成物および使用方法
|
|
TWI419904B
(zh)
|
2006-12-18 |
2013-12-21 |
Genentech Inc |
拮抗劑抗-notch3抗體及其用於預防及治療notch3相關疾病之用途
|
|
US8362217B2
(en)
|
2006-12-21 |
2013-01-29 |
Emd Millipore Corporation |
Purification of proteins
|
|
US8569464B2
(en)
|
2006-12-21 |
2013-10-29 |
Emd Millipore Corporation |
Purification of proteins
|
|
US8163886B2
(en)
|
2006-12-21 |
2012-04-24 |
Emd Millipore Corporation |
Purification of proteins
|
|
CA2671585A1
(en)
*
|
2006-12-22 |
2008-07-03 |
Novelix Therapeutics Gmbh |
Treatment of diabetes by at least one epidermal growth factor receptor specific antibody or a derivative thereof
|
|
PT2101805E
(pt)
|
2007-01-18 |
2013-01-31 |
Merck Patent Gmbh |
Terapia específica e medicamento usando ligandos integrina para tratar o cancro
|
|
US7834154B2
(en)
|
2007-02-09 |
2010-11-16 |
Genentech, Inc. |
Anti-ROBO4 antibodies and uses therefor
|
|
CN101663407B
(zh)
|
2007-02-22 |
2017-08-08 |
健泰科生物技术公司 |
用于检测炎性肠病的方法
|
|
NZ578824A
(en)
|
2007-03-02 |
2012-03-30 |
Genentech Inc |
Predicting response to a her dimerisation inhibitor based on low her3 expression
|
|
US7960139B2
(en)
|
2007-03-23 |
2011-06-14 |
Academia Sinica |
Alkynyl sugar analogs for the labeling and visualization of glycoconjugates in cells
|
|
EP2851091B1
(de)
|
2007-04-13 |
2017-12-27 |
Dana-Farber Cancer Institute, Inc. |
Verfahren zur Behandlung von gegen ERBB-Therapeutika resistentem Krebs
|
|
WO2008137915A2
(en)
|
2007-05-07 |
2008-11-13 |
Medimmune, Llc |
Anti-icos antibodies and their use in treatment of oncology, transplantation and autoimmune disease
|
|
US20090163698A1
(en)
*
|
2007-05-11 |
2009-06-25 |
John Joseph Grigsby |
Method for Preparing Antibody Conjugates
|
|
US9551033B2
(en)
|
2007-06-08 |
2017-01-24 |
Genentech, Inc. |
Gene expression markers of tumor resistance to HER2 inhibitor treatment
|
|
DK2171090T3
(da)
*
|
2007-06-08 |
2013-06-10 |
Genentech Inc |
Genekspressionsmarkører for tumorresistens over for HER2-inhibitorbehandling
|
|
DK3597659T3
(da)
|
2007-07-09 |
2023-04-03 |
Genentech Inc |
Forhindring af disulfidbindingsreduktion under rekombinant produktion af polypeptider
|
|
JP5469600B2
(ja)
|
2007-07-16 |
2014-04-16 |
ジェネンテック, インコーポレイテッド |
抗CD79b抗体及びイムノコンジュゲートとその使用方法
|
|
AR067543A1
(es)
|
2007-07-16 |
2009-10-14 |
Genentech Inc |
Anticuerpos anti-cd79b e inmunoconjugados humanizados y metodos de uso
|
|
EP2190478B1
(de)
|
2007-08-24 |
2016-03-23 |
Oncotherapy Science, Inc. |
Dkk1-onkogen als therapeutisches ziel für krebs und diagnostischer marker
|
|
KR20100075452A
(ko)
|
2007-08-24 |
2010-07-02 |
온코세라피 사이언스 가부시키가이샤 |
전립선암 치료 및 진단의 표적 유전자로서의 pkib 및 naaladl2
|
|
CA2697513A1
(en)
|
2007-08-24 |
2009-03-05 |
Oncotherapy Science, Inc. |
Ebi3, dlx5, nptx1 and cdkn3 for target genes of lung cancer therapy and diagnosis
|
|
UY31309A1
(es)
|
2007-08-29 |
2009-03-31 |
|
Anticuerpos anti-cxcr5 humanizados, derivados de los mismos y su uso
|
|
JP6126773B2
(ja)
|
2007-09-04 |
2017-05-10 |
ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア |
癌のターゲッティングおよび検出のための高親和性抗前立腺幹細胞抗原(psca)抗体
|
|
PL2185574T3
(pl)
|
2007-09-07 |
2013-09-30 |
Agensys Inc |
Przeciwciała i powiązane cząsteczki, które wiążą się do białek 24P4C12
|
|
EP3789400A1
(de)
|
2007-09-26 |
2021-03-10 |
Chugai Seiyaku Kabushiki Kaisha |
Modifizierte antikörperkonstantregion
|
|
US8691222B2
(en)
|
2007-10-02 |
2014-04-08 |
Genentech, Inc. |
NLRR-1 antagonists and uses thereof
|
|
EP2050764A1
(de)
|
2007-10-15 |
2009-04-22 |
sanofi-aventis |
Neues polyvalentes bispezifisches Antikörperformat und Verwendung
|
|
PL2233149T3
(pl)
|
2007-10-16 |
2016-08-31 |
Zymogenetics Inc |
Kombinacja przezbłonowego aktywatora i ligandu cyklofiliny (taci) oraz przeciwciała anty-cd20 do leczenia chorób autoimmunologicznych
|
|
RU2498991C2
(ru)
|
2007-10-30 |
2013-11-20 |
Дженентек, Инк. |
Очистка антител с помощью катионообменной хроматографии
|
|
ES2662845T3
(es)
|
2007-11-07 |
2018-04-10 |
Genentech, Inc. |
IL-22 para su uso en el tratamiento de trastornos microbianos
|
|
CN102089324B
(zh)
|
2007-11-12 |
2014-04-16 |
特罗科隆科学有限公司 |
用于对流行性感冒进行治疗以及诊断的组合物以及方法
|
|
JP2011509071A
(ja)
|
2007-11-29 |
2011-03-24 |
ジェネンテック, インコーポレイテッド |
炎症性腸疾患のための遺伝子発現マーカー
|
|
TWI580694B
(zh)
|
2007-11-30 |
2017-05-01 |
建南德克公司 |
抗-vegf抗體
|
|
CA3102704A1
(en)
|
2007-12-14 |
2009-06-25 |
Novo Nordisk A/S |
Antibodies against human nkg2d and uses thereof
|
|
EP2235536A4
(de)
|
2007-12-20 |
2011-05-04 |
Lab Corp America Holdings |
Her-2-diagnoseverfahren
|
|
US8253725B2
(en)
*
|
2007-12-28 |
2012-08-28 |
St. Jude Medical, Atrial Fibrillation Division, Inc. |
Method and system for generating surface models of geometric structures
|
|
EP2077281A1
(de)
|
2008-01-02 |
2009-07-08 |
Bergen Teknologioverforing AS |
Anti-CD20-Antikörper oder Fragmente davon zur Behandlung von chronischen Ermüdungssyndrom
|
|
US7914785B2
(en)
|
2008-01-02 |
2011-03-29 |
Bergen Teknologieverforing As |
B-cell depleting agents, like anti-CD20 antibodies or fragments thereof for the treatment of chronic fatigue syndrome
|
|
AR070141A1
(es)
|
2008-01-23 |
2010-03-17 |
Glenmark Pharmaceuticals Sa |
Anticuerpos humanizados especificos para el factor von willebrand
|
|
EP2238162A1
(de)
*
|
2008-01-24 |
2010-10-13 |
The Government of the United States of America as represented by The Secretary of the Department of Health and Human Services |
Induzierte internalisierung von oberflächenrezeptoren
|
|
EP2628753A1
(de)
|
2008-01-24 |
2013-08-21 |
Novo Nordisk A/S |
Humanisierter monoklonaler Anti-human-NKG2A-Antikörper
|
|
TWI472339B
(zh)
|
2008-01-30 |
2015-02-11 |
Genentech Inc |
包含結合至her2結構域ii之抗體及其酸性變異體的組合物
|
|
PE20091318A1
(es)
|
2008-01-31 |
2009-09-16 |
Genentech Inc |
Anticuerpos anti-cd79b e inmunoconjugados y metodos de uso de los mismos
|
|
AU2009213141A1
(en)
|
2008-02-14 |
2009-08-20 |
Bristol-Myers Squibb Company |
Targeted therapeutics based on engineered proteins that bind EGFR
|
|
CA2716826C
(en)
|
2008-02-25 |
2017-05-09 |
Prometheus Laboratories Inc. |
Drug selection for breast cancer therapy using antibody-based arrays
|
|
JP5544309B2
(ja)
|
2008-03-10 |
2014-07-09 |
セラクローン サイエンシーズ, インコーポレイテッド |
サイトメガロウイルス感染の治療および診断のための組成物および方法
|
|
US8663643B2
(en)
|
2008-03-18 |
2014-03-04 |
Genentech, Inc. |
Combinations of an anti-HER2 antibody-drug conjugate and chemotherapeutic agents, and methods of use
|
|
ES2354661B1
(es)
|
2008-05-08 |
2012-02-01 |
Consejo Superior De Investigaciones Científicas (Csic) |
Método para generar anticuerpos monoclonales que reconocen antígenos de membrana de células progenitoras neurales, anticuerpos producidos por dicho método, y usos.
|
|
US8093018B2
(en)
|
2008-05-20 |
2012-01-10 |
Otsuka Pharmaceutical Co., Ltd. |
Antibody identifying an antigen-bound antibody and an antigen-unbound antibody, and method for preparing the same
|
|
EP2291399B1
(de)
|
2008-05-22 |
2014-06-25 |
Bristol-Myers Squibb Company |
Polyvalente proteine mit fibronectin-gerüstdomänen
|
|
WO2009151514A1
(en)
|
2008-06-11 |
2009-12-17 |
Millipore Corporation |
Stirred tank bioreactor
|
|
BRPI0812682A2
(pt)
|
2008-06-16 |
2010-06-22 |
Genentech Inc |
tratamento de cáncer de mama metastático
|
|
ES2442024T3
(es)
|
2008-07-15 |
2014-02-07 |
Academia Sinica |
Matrices de glucano sobre portaobjetos de vidrio revestidos con aluminio de tipo PTFE y métodos relacionados
|
|
US20100029675A1
(en)
*
|
2008-07-25 |
2010-02-04 |
Hwang Soo-In |
Pyrimidine-2, 4-diamine JAK2 Kinase inhibiting anti-inflammation use
|
|
PT2848625T
(pt)
|
2008-08-14 |
2019-10-25 |
Genentech Inc |
Métodos para remover um contaminante com a utilização de cromatografia de membrana de permuta iónica de deslocação de proteína indígena.
|
|
CN102282172B
(zh)
|
2008-09-07 |
2014-02-19 |
台湾醣联生技医药股份有限公司 |
抗伸展的ⅰ型鞘糖脂抗体、其衍生物以及用途
|
|
AR073295A1
(es)
|
2008-09-16 |
2010-10-28 |
Genentech Inc |
Metodos para tratar la esclerosis multiple progresiva. articulo de fabricacion.
|
|
JP5836125B2
(ja)
|
2008-10-16 |
2015-12-24 |
ユニバーシティ オブ ピッツバーグ − オブ ザ コモンウェルス システム オブ ハイヤー エデュケイション |
高分子量メラノーマ関連抗原に対する完全ヒト抗体およびその使用
|
|
WO2010048446A2
(en)
|
2008-10-22 |
2010-04-29 |
Genentech, Inc. |
Modulation of axon degeneration
|
|
AU2009308707A1
(en)
|
2008-10-31 |
2010-05-06 |
Biogen Idec Ma Inc. |
LIGHT targeting molecules and uses thereof
|
|
ES2719496T3
(es)
|
2008-11-12 |
2019-07-10 |
Medimmune Llc |
Formulación de anticuerpo
|
|
CA2742871C
(en)
|
2008-11-13 |
2018-10-23 |
Herb Lin |
Methods and compositions for regulating iron homeostasis by modulation of bmp-6
|
|
US8927694B2
(en)
*
|
2008-11-18 |
2015-01-06 |
Merrimack Pharmaceuticals, Inc. |
Human serum albumin linkers and conjugates thereof
|
|
SI2361085T2
(sl)
|
2008-11-22 |
2018-11-30 |
F. Hoffmann-La Roche Ag |
Uporaba protitelesa proti vegf v kombinaciji s kemoterapijo za zdravljenje raka dojk
|
|
US8211434B2
(en)
|
2008-11-26 |
2012-07-03 |
Allergan, Inc. |
KLK-13 antibody inhibitor for treating dry eye
|
|
US8349574B2
(en)
|
2009-01-15 |
2013-01-08 |
Laboratory Corporation Of America Holdings |
Methods of determining patient response by measurement of Her-3
|
|
WO2010065568A2
(en)
|
2008-12-01 |
2010-06-10 |
Laboratory Corporation Of America Holdings |
METHODS AND ASSAYS FOR MEASURING p95 AND/OR p95 IN A SAMPLE AND ANTIBODIES SPECIFIC FOR p95
|
|
DK2376535T3
(en)
|
2008-12-09 |
2017-06-12 |
Hoffmann La Roche |
ANTI-PD-L1 ANTIBODIES AND THEIR USE TO PROMOTE T CELL FUNCTION
|
|
EP2370561B1
(de)
|
2008-12-16 |
2019-08-07 |
EMD Millipore Corporation |
Rührkesselreaktor und verfahren
|
|
JP2012512244A
(ja)
|
2008-12-16 |
2012-05-31 |
イー・エム・デイー・ミリポア・コーポレイシヨン |
タンパク質の精製
|
|
CA2747248A1
(en)
|
2008-12-17 |
2010-07-15 |
Sharookh Kapadia |
Hepatitis c virus combination therapy
|
|
WO2010075249A2
(en)
|
2008-12-22 |
2010-07-01 |
Genentech, Inc. |
A method for treating rheumatoid arthritis with b-cell antagonists
|
|
SG172857A1
(en)
|
2009-02-09 |
2011-08-29 |
Supergen Inc |
Pyrrolopyrimidinyl axl kinase inhibitors
|
|
US10517969B2
(en)
|
2009-02-17 |
2019-12-31 |
Cornell University |
Methods and kits for diagnosis of cancer and prediction of therapeutic value
|
|
WO2010095031A2
(en)
|
2009-02-23 |
2010-08-26 |
Glenmark Pharmaceuticals S.A. |
Humanized antibodies that bind to cd19 and their uses
|
|
US20120189641A1
(en)
|
2009-02-25 |
2012-07-26 |
OSI Pharmaceuticals, LLC |
Combination anti-cancer therapy
|
|
EP2400990A2
(de)
|
2009-02-26 |
2012-01-04 |
OSI Pharmaceuticals, LLC |
In-situ-verfahren zur überwachung des emt-status von tumorzellen in vivo
|
|
WO2010099364A2
(en)
|
2009-02-27 |
2010-09-02 |
Osi Pharmaceuticals, Inc. |
Methods for the identification of agents that inhibit mesenchymal-like tumor cells or their formation
|
|
JP2012519281A
(ja)
|
2009-02-27 |
2012-08-23 |
オーエスアイ・ファーマシューティカルズ,エルエルシー |
間葉様腫瘍細胞またはその生成を阻害する薬剤を同定するための方法
|
|
WO2010099138A2
(en)
|
2009-02-27 |
2010-09-02 |
Osi Pharmaceuticals, Inc. |
Methods for the identification of agents that inhibit mesenchymal-like tumor cells or their formation
|
|
US20100222381A1
(en)
|
2009-02-27 |
2010-09-02 |
Hariprasad Vankayalapati |
Cyclopentathiophene/cyclohexathiophene DNA methyltransferase inhibitors
|
|
WO2010106535A1
(en)
|
2009-03-15 |
2010-09-23 |
Technion Research And Development Foundation Ltd. |
Soluble hla complexes for use in disease diagnosis
|
|
SI3260136T1
(sl)
|
2009-03-17 |
2021-05-31 |
Theraclone Sciences, Inc. |
Humani imunodeficientni virus (HIV)-nevtralizirajoča protitelesa
|
|
PE20120539A1
(es)
|
2009-03-20 |
2012-05-12 |
Genentech Inc |
Anticuerpos anti-her biespecifico
|
|
WO2010111367A1
(en)
|
2009-03-25 |
2010-09-30 |
Genentech, Inc. |
Anti-fgfr3 antibodies and methods using same
|
|
SG174891A1
(en)
|
2009-04-01 |
2011-11-28 |
Genentech Inc |
Treatment of insulin-resistant disorders
|
|
US8466260B2
(en)
|
2009-04-01 |
2013-06-18 |
Genentech, Inc. |
Anti-FcRH5 antibodies and immunoconjugates and methods of use
|
|
PL2417156T3
(pl)
|
2009-04-07 |
2015-07-31 |
Roche Glycart Ag |
Trójwartościowe, bispecyficzne przeciwciała
|
|
WO2010118243A2
(en)
|
2009-04-08 |
2010-10-14 |
Genentech, Inc. |
Use of il-27 antagonists to treat lupus
|
|
US8753631B2
(en)
*
|
2009-05-01 |
2014-06-17 |
New York University |
Therapeutic agents for inducing platelet fragmentation and treating thromboembolic disorders
|
|
ES2897692T3
(es)
|
2009-05-14 |
2022-03-02 |
Shox Science Ltd |
Diagnóstico clínico de la fibrosis hepática mediante un nuevo grupo de biomarcadores de proteínas plasmáticas humanas poco abundantes
|
|
CA2762302A1
(en)
|
2009-05-20 |
2010-11-25 |
Theraclone Sciences, Inc. |
Compositions and methods for the therapy and diagnosis of influenza
|
|
MX2011012491A
(es)
|
2009-05-25 |
2011-12-14 |
Merck Patent Gmbh |
Administracion continua de cilengitida en tratamientos contra el cancer.
|
|
SG10201507044PA
(en)
|
2009-05-29 |
2015-10-29 |
Hoffmann La Roche |
Modulators for her2 signaling in her2 expressing patients with gastric cancer
|
|
US9676845B2
(en)
|
2009-06-16 |
2017-06-13 |
Hoffmann-La Roche, Inc. |
Bispecific antigen binding proteins
|
|
WO2010151526A1
(en)
|
2009-06-23 |
2010-12-29 |
Alexion Pharmaceuticals, Inc. |
Bispecific antibodies that bind to complement proteins
|
|
SG177580A1
(en)
|
2009-07-07 |
2012-03-29 |
Genentech Inc |
Diagnosis and treatment of autoimmune demyelinating diseases
|
|
WO2011011339A1
(en)
|
2009-07-20 |
2011-01-27 |
Genentech, Inc. |
Gene expression markers for crohn's disease
|
|
TW201106972A
(en)
|
2009-07-27 |
2011-03-01 |
Genentech Inc |
Combination treatments
|
|
EP2459184A1
(de)
|
2009-07-31 |
2012-06-06 |
The Brigham and Women's Hospital, Inc. |
Modulation der sgk1-expression bei th17-zellen zur modulation von th17-vermittelten immunreaktionen
|
|
SG178177A1
(en)
|
2009-07-31 |
2012-03-29 |
Genentech Inc |
Inhibition of tumor metastasis using bv8- or g-csf-antagonists
|
|
WO2011019620A1
(en)
|
2009-08-10 |
2011-02-17 |
Genentech, Inc. |
Antibodies with enhanced adcc function
|
|
US20110038871A1
(en)
|
2009-08-11 |
2011-02-17 |
Veena Viswanth |
Ccr2 inhibitors for treating conditions of the eye
|
|
PT2464725T
(pt)
|
2009-08-11 |
2020-05-21 |
Hoffmann La Roche |
Produção de proteínas em meios de cultura celular isentos de glutamina
|
|
WO2011019622A1
(en)
|
2009-08-14 |
2011-02-17 |
Genentech, Inc. |
Cell culture methods to make antibodies with enhanced adcc function
|
|
WO2011022264A1
(en)
|
2009-08-15 |
2011-02-24 |
Genentech, Inc. |
Anti-angiogenesis therapy for the treatment of previously treated breast cancer
|
|
MX2012002565A
(es)
|
2009-09-01 |
2012-05-29 |
Genentech Inc |
Purificacion de proteina mejorada a traves de una elucion de proteina a modificada.
|
|
JP2013503846A
(ja)
|
2009-09-01 |
2013-02-04 |
ファイザー・インク |
ベンズイミダゾール誘導体
|
|
CA2772715C
(en)
|
2009-09-02 |
2019-03-26 |
Genentech, Inc. |
Mutant smoothened and methods of using the same
|
|
NZ701769A
(en)
|
2009-09-16 |
2016-06-24 |
Genentech Inc |
Coiled coil and/or tether containing protein complexes and uses thereof
|
|
JP5819307B2
(ja)
|
2009-10-20 |
2015-11-24 |
ネステク ソシエテ アノニム |
発癌性融合タンパク質を検出するための近接媒介性アッセイ
|
|
CN104043126A
(zh)
|
2009-10-22 |
2014-09-17 |
霍夫曼-拉罗奇有限公司 |
轴突变性的调节
|
|
WO2011050188A1
(en)
|
2009-10-22 |
2011-04-28 |
Genentech, Inc. |
Anti-hepsin antibodies and methods using same
|
|
WO2011050194A1
(en)
|
2009-10-22 |
2011-04-28 |
Genentech, Inc. |
Methods and compositions for modulating hepsin activation of macrophage-stimulating protein
|
|
WO2011056502A1
(en)
|
2009-10-26 |
2011-05-12 |
Genentech, Inc. |
Bone morphogenetic protein receptor type ii compositions and methods of use
|
|
WO2011056497A1
(en)
|
2009-10-26 |
2011-05-12 |
Genentech, Inc. |
Activin receptor type iib compositions and methods of use
|
|
WO2011056494A1
(en)
|
2009-10-26 |
2011-05-12 |
Genentech, Inc. |
Activin receptor-like kinase-1 antagonist and vegfr3 antagonist combinations
|
|
AU2010315101B2
(en)
|
2009-11-04 |
2016-01-28 |
Fabrus Llc |
Methods for affinity maturation-based antibody optimization
|
|
NZ598901A
(en)
|
2009-11-05 |
2014-08-29 |
Genentech Inc |
Methods and composition for secretion of heterologous polypeptides
|
|
TWI507524B
(zh)
|
2009-11-30 |
2015-11-11 |
Genentech Inc |
診斷及治療腫瘤之組合物及方法
|
|
US10087236B2
(en)
|
2009-12-02 |
2018-10-02 |
Academia Sinica |
Methods for modifying human antibodies by glycan engineering
|
|
RU2673908C2
(ru)
|
2009-12-02 |
2018-12-03 |
Имэджинэб, Инк. |
Мини-антитела j591 и цис-диатела для направленной доставки простата-специфичного мембранного антигена (psma) человека и способы их применения
|
|
US11377485B2
(en)
|
2009-12-02 |
2022-07-05 |
Academia Sinica |
Methods for modifying human antibodies by glycan engineering
|
|
TWI505836B
(zh)
|
2009-12-11 |
2015-11-01 |
Genentech Inc |
抗-vegf-c抗體及其使用方法
|
|
CN107095846A
(zh)
|
2009-12-21 |
2017-08-29 |
霍夫曼-拉罗奇有限公司 |
抗体配制剂
|
|
HUE027713T2
(en)
|
2009-12-23 |
2016-10-28 |
Hoffmann La Roche |
Anti-BV8 antibodies and their use
|
|
EP2519542B1
(de)
|
2009-12-28 |
2018-10-10 |
OncoTherapy Science, Inc. |
Anti-cdh3-antikörper und ihre verwendung
|
|
WO2011082187A1
(en)
|
2009-12-30 |
2011-07-07 |
Genentech, Inc. |
Methods for modulating a pdgf-aa mediated biological response
|
|
CA2789629A1
(en)
|
2010-02-10 |
2011-08-18 |
Immunogen, Inc. |
Cd20 antibodies and uses thereof
|
|
MX343383B
(es)
|
2010-02-12 |
2016-11-03 |
Pfizer Inc * |
Sales y polimorfos de 8-fluoro-2-{4-[(metilamino)metil]fenil}-1,3, 4,5-tetrahidro-6h-acepino[5,4,3-cd]indol-6-ona.
|
|
ES2519348T3
(es)
|
2010-02-18 |
2014-11-06 |
Genentech, Inc. |
Antagonistas de neurregulina y uso de los mismos en el tratamiento del cáncer
|
|
RU2012140447A
(ru)
|
2010-02-23 |
2014-03-27 |
Дженентек, Инк. |
Антиангиогенная терапия для лечения рака яичника
|
|
WO2011106222A2
(en)
*
|
2010-02-23 |
2011-09-01 |
Corning Incorporated |
Modified substrates for protection of peptide-immobilized surfaces from gamma radiation degradation
|
|
SG183335A1
(en)
|
2010-02-23 |
2012-09-27 |
Genentech Inc |
Compositions and methods for the diagnosis and treatment of tumor
|
|
CA2783665A1
(en)
|
2010-03-03 |
2011-09-09 |
OSI Pharmaceuticals, LLC |
Biological markers predictive of anti-cancer response to insulin-like growth factor-1 receptor kinase inhibitors
|
|
AU2011223643A1
(en)
|
2010-03-03 |
2012-06-28 |
OSI Pharmaceuticals, LLC |
Biological markers predictive of anti-cancer response to insulin-like growth factor-1 receptor kinase inhibitors
|
|
WO2011116396A2
(en)
|
2010-03-19 |
2011-09-22 |
The Board Of Trustees Of The Leland Stanford Junior University |
Hepatocyte growth factor fragments that function as potent met receptor agonists and antagonists
|
|
MX2012010853A
(es)
|
2010-03-24 |
2013-01-29 |
Genentech Inc |
Anticuerpos anti-lrp6.
|
|
TW201138821A
(en)
|
2010-03-26 |
2011-11-16 |
Roche Glycart Ag |
Bispecific antibodies
|
|
WO2011130332A1
(en)
|
2010-04-12 |
2011-10-20 |
Academia Sinica |
Glycan arrays for high throughput screening of viruses
|
|
WO2011133931A1
(en)
|
2010-04-22 |
2011-10-27 |
Genentech, Inc. |
Use of il-27 antagonists for treating inflammatory bowel disease
|
|
SG185027A1
(en)
|
2010-05-03 |
2012-11-29 |
Genentech Inc |
Compositions and methods for the diagnosis and treatment of tumor
|
|
DK2568976T3
(en)
|
2010-05-10 |
2016-01-11 |
Academia Sinica |
Zanamivir-phosphonate congener with the anti-influenza activity, and determining the sensitivity oseltamivir in influenza viruses
|
|
SG10201804385YA
(en)
|
2010-05-17 |
2018-06-28 |
Emd Millipore Corp |
Stimulus responsive polymers for the purification of biomolecules
|
|
WO2011146568A1
(en)
|
2010-05-19 |
2011-11-24 |
Genentech, Inc. |
Predicting response to a her inhibitor
|
|
RU2594163C2
(ru)
|
2010-05-25 |
2016-08-10 |
Дженентек, Инк. |
Способы очистки полипептидов
|
|
WO2011147834A1
(en)
|
2010-05-26 |
2011-12-01 |
Roche Glycart Ag |
Antibodies against cd19 and uses thereof
|
|
WO2011150241A2
(en)
|
2010-05-28 |
2011-12-01 |
Genentech, Inc. |
Decreasing lactate level and increasing polypeptide production by downregulating the expression of lactate dehydrogenase and pyruvate dehydrogenase kinase
|
|
WO2011153243A2
(en)
|
2010-06-02 |
2011-12-08 |
Genentech, Inc. |
Anti-angiogenesis therapy for treating gastric cancer
|
|
NZ701208A
(en)
|
2010-06-03 |
2016-05-27 |
Genentech Inc |
Immuno-pet imaging of antibodies and immunoconjugates and uses thereof
|
|
CN114246952A
(zh)
|
2010-06-08 |
2022-03-29 |
基因泰克公司 |
半胱氨酸改造的抗体和偶联物
|
|
US20110311527A1
(en)
|
2010-06-16 |
2011-12-22 |
Allergan, Inc. |
IL23p19 ANTIBODY INHIBITOR FOR TREATING OCULAR AND OTHER CONDITIONS
|
|
CN104689314B
(zh)
|
2010-06-16 |
2018-02-02 |
高等教育联邦系统-匹兹堡大学 |
内质蛋白的抗体及其用途
|
|
RU2577986C2
(ru)
|
2010-06-18 |
2016-03-20 |
Дженентек, Инк. |
Антитела против axl и способы их применения
|
|
WO2011161119A1
(en)
|
2010-06-22 |
2011-12-29 |
F. Hoffmann-La Roche Ag |
Antibodies against insulin-like growth factor i receptor and uses thereof
|
|
WO2011161189A1
(en)
|
2010-06-24 |
2011-12-29 |
F. Hoffmann-La Roche Ag |
Anti-hepsin antibodies and methods of use
|
|
SG186983A1
(en)
|
2010-07-09 |
2013-02-28 |
Genentech Inc |
Anti-neuropilin antibodies and methods of use
|
|
KR20130092561A
(ko)
|
2010-07-16 |
2013-08-20 |
메르크 파텐트 게엠베하 |
유방암 및/또는 뼈 전이의 치료에 사용하기 위한 펩티드
|
|
WO2012010582A1
(en)
|
2010-07-21 |
2012-01-26 |
Roche Glycart Ag |
Anti-cxcr5 antibodies and methods of use
|
|
AU2011280969A1
(en)
|
2010-07-23 |
2013-02-07 |
Trustees Of Boston University |
Anti-Despr inhibitors as therapeutics for inhibition of pathological angiogenesis and tumor cell invasiveness and for molecular imaging and targeted delivery
|
|
JP2013541501A
(ja)
|
2010-08-03 |
2013-11-14 |
エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト |
慢性リンパ性白血病(cll)のバイオマーカー
|
|
BR112013002532A2
(pt)
|
2010-08-05 |
2016-05-31 |
Hoffmann La Roche |
proteína de fusão de citocina anti-viral do anticorpo anti-mhc
|
|
CA2807664A1
(en)
|
2010-08-12 |
2012-02-16 |
Theraclone Sciences, Inc. |
Anti-hemagglutinin antibody compositions and methods of use thereof
|
|
EP2420250A1
(de)
|
2010-08-13 |
2012-02-22 |
Universitätsklinikum Münster |
Anti-Syndecan-4-Antikörper
|
|
KR101653030B1
(ko)
|
2010-08-13 |
2016-08-31 |
로슈 글리카트 아게 |
항-테나신-c a2 항체 및 이의 사용 방법
|
|
PL2603530T3
(pl)
|
2010-08-13 |
2018-03-30 |
Roche Glycart Ag |
Przeciwciała anty-FAP i sposoby stosowania
|
|
EP2609111B1
(de)
|
2010-08-24 |
2017-11-01 |
F. Hoffmann-La Roche AG |
Bispezifische antikörper die ein disulfid-stabilisiertes fv enthalten
|
|
KR101603001B1
(ko)
|
2010-08-25 |
2016-03-11 |
에프. 호프만-라 로슈 아게 |
Il-18r1에 대한 항체 및 그의 용도
|
|
EP3556396B1
(de)
|
2010-08-31 |
2022-04-20 |
Theraclone Sciences, Inc. |
Antikörper zur neutralisierung des humanen immundefizienzvirus (hiv)
|
|
EP2612151B1
(de)
|
2010-08-31 |
2017-08-09 |
Genentech, Inc. |
Biomarker und behandlungsverfahren
|
|
WO2012028683A1
(en)
|
2010-09-02 |
2012-03-08 |
Novartis Ag |
Antibody gel system for sustained drug delivery
|
|
WO2012030512A1
(en)
|
2010-09-03 |
2012-03-08 |
Percivia Llc. |
Flow-through protein purification process
|
|
CA2810668A1
(en)
|
2010-09-08 |
2012-03-15 |
Halozyme, Inc. |
Methods for assessing and identifying or evolving conditionally active therapeutic proteins
|
|
JP5974012B2
(ja)
|
2010-10-05 |
2016-08-23 |
ジェネンテック, インコーポレイテッド |
突然変異体スムースンド及びその使用方法
|
|
WO2012052948A1
(en)
|
2010-10-20 |
2012-04-26 |
Pfizer Inc. |
Pyridine- 2- derivatives as smoothened receptor modulators
|
|
EP3214442A1
(de)
|
2010-10-25 |
2017-09-06 |
F. Hoffmann-La Roche AG |
Behandlung von gastrointestinalen entzündungen und psoriasis und asthmaentzündung und psoriasis a
|
|
WO2012064836A1
(en)
|
2010-11-10 |
2012-05-18 |
Genentech, Inc. |
Methods and compositions for neural disease immunotherapy
|
|
WO2012069466A1
(en)
|
2010-11-24 |
2012-05-31 |
Novartis Ag |
Multispecific molecules
|
|
WO2012071436A1
(en)
|
2010-11-24 |
2012-05-31 |
Genentech, Inc. |
Method of treating autoimmune inflammatory disorders using il-23r loss-of-function mutants
|
|
WO2012075333A2
(en)
|
2010-12-02 |
2012-06-07 |
Prometheus Laboratories Inc. |
Her2delta16 peptides
|
|
BR122020012255B1
(pt)
|
2010-12-16 |
2022-08-09 |
Genentech, Inc |
Uso de um anticorpo anti-il-13, usos de um inibidor da via de th2 e anticorpos anti-periostina
|
|
NZ610976A
(en)
|
2010-12-20 |
2015-07-31 |
Genentech Inc |
Anti-mesothelin antibodies and immunoconjugates
|
|
JP2014511106A
(ja)
|
2010-12-22 |
2014-05-08 |
ジェネンテック, インコーポレイテッド |
抗pcsk9抗体及び使用方法
|
|
CN103384825B
(zh)
|
2010-12-23 |
2017-05-24 |
霍夫曼-拉罗奇有限公司 |
通过二价结合剂检测经翻译后修饰的多肽
|
|
SG10201510086VA
(en)
|
2010-12-23 |
2016-01-28 |
Nestec Sa |
Drug selection for malignant cancer therapy using antibody-based arrays
|
|
WO2012085113A1
(en)
|
2010-12-23 |
2012-06-28 |
Roche Diagnostics Gmbh |
Binding agent
|
|
CN103384831B
(zh)
|
2010-12-23 |
2016-02-10 |
霍夫曼-拉罗奇有限公司 |
通过二价结合剂来检测多肽二聚体
|
|
SG191153A1
(en)
|
2010-12-23 |
2013-07-31 |
Hoffmann La Roche |
Polypeptide-polynucleotide-complex and its use in targeted effector moiety delivery
|
|
WO2012092539A2
(en)
|
2010-12-31 |
2012-07-05 |
Takeda Pharmaceutical Company Limited |
Antibodies to dll4 and uses thereof
|
|
US9266938B2
(en)
|
2011-02-10 |
2016-02-23 |
Roche Glycart Ag |
Mutant interleukin-2 polypeptides
|
|
US20120258073A1
(en)
|
2011-02-10 |
2012-10-11 |
Christian Gerdes |
Immunotherapy
|
|
SG192727A1
(en)
|
2011-02-14 |
2013-09-30 |
Theraclone Sciences Inc |
Compositions and methods for the therapy and diagnosis of influenza
|
|
US20120214830A1
(en)
|
2011-02-22 |
2012-08-23 |
OSI Pharmaceuticals, LLC |
Biological markers predictive of anti-cancer response to insulin-like growth factor-1 receptor kinase inhibitors in hepatocellular carcinoma
|
|
CN103403025B
(zh)
|
2011-02-28 |
2016-10-12 |
弗·哈夫曼-拉罗切有限公司 |
单价抗原结合蛋白
|
|
JP5764677B2
(ja)
|
2011-02-28 |
2015-08-19 |
エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト |
抗原結合タンパク質
|
|
CN103732628B
(zh)
|
2011-03-03 |
2017-06-23 |
酵活有限公司 |
多价杂多聚体骨架设计和构建体
|
|
WO2012119989A2
(en)
|
2011-03-04 |
2012-09-13 |
Oryzon Genomics, S.A. |
Methods and antibodies for the diagnosis and treatment of cancer
|
|
ES2740399T3
(es)
|
2011-03-09 |
2020-02-05 |
Richard G Pestell |
Líneas de células de cáncer de próstata, firmas genéticas y usos de estas
|
|
KR20140012131A
(ko)
|
2011-03-15 |
2014-01-29 |
테라클론 사이언시스, 아이엔씨. |
인플루엔자의 치료 및 진단을 위한 조성물 및 방법
|
|
AR085911A1
(es)
|
2011-03-16 |
2013-11-06 |
Sanofi Sa |
Dosis terapeutica segura de una proteina similar a un anticuerpo con region v dual
|
|
MX336740B
(es)
|
2011-03-29 |
2016-01-29 |
Roche Glycart Ag |
Variantes de fragmento cristalizable (fc) de los anticuerpos.
|
|
MX2013011130A
(es)
|
2011-03-31 |
2013-10-30 |
Genentech Inc |
Metodos de administracion de antagonistas de integrina beta7.
|
|
CN103596983B
(zh)
|
2011-04-07 |
2016-10-26 |
霍夫曼-拉罗奇有限公司 |
抗fgfr4抗体及使用方法
|
|
WO2012142164A1
(en)
|
2011-04-12 |
2012-10-18 |
The United States Of America, As Represented By The Secretary, Department Of Health & Human Services |
Human monoclonal antibodies that bind insulin-like growth factor (igf) i and ii
|
|
CA2830972C
(en)
|
2011-04-19 |
2018-11-20 |
Pfizer Inc. |
Combinations of anti-4-1bb antibodies and adcc-inducing antibodies for the treatment of cancer
|
|
BR112013026423A2
(pt)
|
2011-04-20 |
2016-11-29 |
Roche Glycart Ag |
método e construtos para a passagem de pendente do ph da barreira sangue-cérebro
|
|
JP2014519813A
(ja)
|
2011-04-25 |
2014-08-21 |
オーエスアイ・ファーマシューティカルズ,エルエルシー |
癌薬剤発見、診断、および治療におけるemt遺伝子シグネチャーの使用
|
|
EA201892619A1
(ru)
|
2011-04-29 |
2019-04-30 |
Роше Гликарт Аг |
Иммуноконъюгаты, содержащие мутантные полипептиды интерлейкина-2
|
|
ES2567276T3
(es)
|
2011-05-12 |
2016-04-21 |
Genentech, Inc. |
Método de LC-MS/MS de monitoreo de múltiples reacciones para detectar anticuerpos terapéuticos en muestras de animales usando péptidos de cambio de marco
|
|
US9085626B2
(en)
|
2011-05-16 |
2015-07-21 |
Genentech, Inc. |
FGFR1 agonists and methods of use
|
|
KR101629073B1
(ko)
|
2011-06-15 |
2016-06-09 |
에프. 호프만-라 로슈 아게 |
항-인간 에리스로포이에틴 수용체 항체 및 이의 사용 방법
|
|
MX2013014687A
(es)
|
2011-06-30 |
2014-02-17 |
Genentech Inc |
Formulaciones de anticuerpo anti-c-met.
|
|
JP2013040160A
(ja)
|
2011-07-01 |
2013-02-28 |
Genentech Inc |
自己免疫疾患を治療するための抗cd83アゴニスト抗体の使用
|
|
CA3158257A1
(en)
|
2011-07-11 |
2013-01-17 |
Ichnos Sciences SA |
Antibodies that bind to ox40 and their uses
|
|
PT3409278T
(pt)
|
2011-07-21 |
2020-12-18 |
Sumitomo Dainippon Pharma Oncology Inc |
Inibidores de proteína cinase heterocíclicos
|
|
US9120858B2
(en)
|
2011-07-22 |
2015-09-01 |
The Research Foundation Of State University Of New York |
Antibodies to the B12-transcobalamin receptor
|
|
US20130022551A1
(en)
|
2011-07-22 |
2013-01-24 |
Trustees Of Boston University |
DEspR ANTAGONISTS AND AGONISTS AS THERAPEUTICS
|
|
WO2013015821A1
(en)
|
2011-07-22 |
2013-01-31 |
The Research Foundation Of State University Of New York |
Antibodies to the b12-transcobalamin receptor
|
|
KR20140068877A
(ko)
|
2011-08-17 |
2014-06-09 |
제넨테크, 인크. |
불응성 종양에서의 혈관신생의 억제
|
|
MX2014001766A
(es)
|
2011-08-17 |
2014-05-01 |
Genentech Inc |
Anticuerpos de neuregulina y sus usos.
|
|
EA030147B1
(ru)
|
2011-08-23 |
2018-06-29 |
Роше Гликарт Аг |
Биспецифические антигенсвязывающие молекулы, активирующие т-клетки
|
|
MX2014002053A
(es)
|
2011-08-23 |
2014-04-25 |
Roche Glycart Ag |
Anticuerpos anti -mcsp y metodos de uso.
|
|
WO2013026837A1
(en)
|
2011-08-23 |
2013-02-28 |
Roche Glycart Ag |
Bispecific t cell activating antigen binding molecules
|
|
CN103889452B
(zh)
|
2011-08-23 |
2017-11-03 |
罗切格利卡特公司 |
对t细胞活化性抗原和肿瘤抗原特异性的双特异性抗体及使用方法
|
|
US20130058937A1
(en)
|
2011-08-23 |
2013-03-07 |
Johannes Auer |
Bispecific antigen binding molecules
|
|
US8822651B2
(en)
|
2011-08-30 |
2014-09-02 |
Theraclone Sciences, Inc. |
Human rhinovirus (HRV) antibodies
|
|
GB201212550D0
(en)
|
2012-07-13 |
2012-08-29 |
Novartis Ag |
B cell assay
|
|
JP6186575B2
(ja)
|
2011-09-02 |
2017-08-30 |
ダイアテック ホールディングス, インコーポレイテッドDiaTech Holdings, Inc. |
治療有効性を判定するためのシグナル経路タンパク質のプロファイリング
|
|
JP2014533927A
(ja)
|
2011-09-15 |
2014-12-18 |
ジェネンテック, インコーポレイテッド |
分化を促進する方法
|
|
GB201116092D0
(en)
|
2011-09-16 |
2011-11-02 |
Bioceros B V |
Antibodies and uses thereof
|
|
WO2013043715A1
(en)
|
2011-09-19 |
2013-03-28 |
Genentech, Inc. |
Combination treatments comprising c-met antagonists and b-raf antagonists
|
|
MX2014003501A
(es)
|
2011-09-22 |
2014-07-22 |
Pfizer |
Derivados de pirrolopirimidina y purina.
|
|
AU2011378675B2
(en)
|
2011-10-04 |
2017-10-05 |
Epsilogen Ltd |
IgE anti -HMW-MAA antibody
|
|
US9663573B2
(en)
|
2011-10-05 |
2017-05-30 |
Genentech, Inc. |
Methods of treating liver conditions using Notch2 antagonists
|
|
AU2012322618A1
(en)
|
2011-10-14 |
2014-05-29 |
Genentech, Inc. |
Anti-HtrA1 antibodies and methods of use
|
|
KR20140084164A
(ko)
|
2011-10-15 |
2014-07-04 |
제넨테크, 인크. |
암의 치료를 위한 scd1 길항제
|
|
WO2013059531A1
(en)
|
2011-10-20 |
2013-04-25 |
Genentech, Inc. |
Anti-gcgr antibodies and uses thereof
|
|
US9327023B2
(en)
|
2011-10-25 |
2016-05-03 |
The Regents Of The University Of Michigan |
HER2 targeting agent treatment in non-HER2-amplified cancers having HER2 expressing cancer stem cells
|
|
CA2850034A1
(en)
|
2011-10-28 |
2013-05-02 |
Genentech, Inc. |
Therapeutic combinations and methods of treating melanoma
|
|
PL3257564T3
(pl)
|
2011-11-02 |
2019-06-28 |
F. Hoffmann-La Roche Ag |
Chromatografia elucyjna z przeładowaniem
|
|
BR112014011115A2
(pt)
|
2011-11-08 |
2017-06-13 |
Pfizer |
métodos para tratamento de distúrbios inflamatórios usando anticorpos anti-m-csf
|
|
AR088920A1
(es)
|
2011-11-21 |
2014-07-16 |
Genentech Inc |
Purificacion de anticuerpos anti-c-met
|
|
AU2012340623A1
(en)
|
2011-11-23 |
2014-07-17 |
Igenica Biotherapeutics, Inc. |
Anti-CD98 antibodies and methods of use thereof
|
|
EP2786151B1
(de)
|
2011-11-29 |
2019-07-03 |
F.Hoffmann-La Roche Ag |
Verfahren zur prostatakrebs analyse
|
|
MX2014006529A
(es)
|
2011-11-30 |
2014-11-25 |
Genentech Inc |
Mutaciones de erbb3 en cancer.
|
|
US20140335084A1
(en)
|
2011-12-06 |
2014-11-13 |
Hoffmann-La Roche Inc. |
Antibody formulation
|
|
EP2788500A1
(de)
|
2011-12-09 |
2014-10-15 |
F.Hoffmann-La Roche Ag |
Identifizierung von non-respondern auf her2-inhibitoren
|
|
IL267585B
(en)
|
2011-12-22 |
2022-09-01 |
Genentech Inc |
Ion exchange membrane chromatography
|
|
SG11201403223PA
(en)
|
2011-12-22 |
2014-07-30 |
Hoffmann La Roche |
Expression vector organization, novel production cell generation methods and their use for the recombinant production of polypeptides
|
|
KR102048556B1
(ko)
|
2011-12-22 |
2019-11-26 |
에프. 호프만-라 로슈 아게 |
발현 벡터 구성원 조합, 신규한 제조 세포 생성 방법 및 폴리펩티드의 재조합적 제조를 위한 그의 용도
|
|
WO2013091903A1
(en)
|
2011-12-22 |
2013-06-27 |
Novo Nordisk A/S |
Anti-crac channel antibodies
|
|
AR089434A1
(es)
|
2011-12-23 |
2014-08-20 |
Genentech Inc |
Procedimiento para preparar formulaciones con alta concentracion de proteinas
|
|
WO2013101771A2
(en)
|
2011-12-30 |
2013-07-04 |
Genentech, Inc. |
Compositions and method for treating autoimmune diseases
|
|
WO2013106485A2
(en)
|
2012-01-09 |
2013-07-18 |
The Scripps Research Institute |
Ultralong complementarity determining regions and uses thereof
|
|
JP2015509091A
(ja)
|
2012-01-09 |
2015-03-26 |
ザ スクリプス リサーチ インスティテュート |
ヒト化抗体
|
|
SG11201404198TA
(en)
|
2012-01-18 |
2014-08-28 |
Genentech Inc |
Anti-lrp5 antibodies and methods of use
|
|
RU2014133547A
(ru)
|
2012-01-18 |
2016-03-10 |
Дженентек, Инк. |
Способы применения модуляторов fgf19
|
|
WO2013113641A1
(en)
|
2012-01-31 |
2013-08-08 |
Roche Glycart Ag |
Use of nkp46 as a predictive biomarker for cancer treatment with adcc- enhanced antibodies
|
|
WO2013116287A1
(en)
|
2012-01-31 |
2013-08-08 |
Genentech, Inc. |
Anti-ig-e m1' antibodies and methods using same
|
|
CA2861124A1
(en)
|
2012-02-10 |
2013-08-15 |
Genentech, Inc. |
Single-chain antibodies and other heteromultimers
|
|
AU2013216753B2
(en)
|
2012-02-11 |
2017-09-21 |
Genentech, Inc. |
R-spondin translocations and methods using the same
|
|
WO2013120929A1
(en)
|
2012-02-15 |
2013-08-22 |
F. Hoffmann-La Roche Ag |
Fc-receptor based affinity chromatography
|
|
JP2015511702A
(ja)
|
2012-03-02 |
2015-04-20 |
ロシュ グリクアート アーゲー |
Adcc増強抗体を用いた癌治療のための予測バイオマーカー
|
|
BR112014022228A2
(pt)
|
2012-03-08 |
2017-07-11 |
Halozyme Inc |
anticorpos anti-epidérmicos de receptor de fator de crescimento condicionalmente ativo e métodos de uso dos mesmos
|
|
US9592289B2
(en)
|
2012-03-26 |
2017-03-14 |
Sanofi |
Stable IgG4 based binding agent formulations
|
|
AU2013240261A1
(en)
|
2012-03-27 |
2014-09-18 |
Genentech, Inc. |
Diagnosis and treatments relating to HER3 inhibitors
|
|
AR090549A1
(es)
|
2012-03-30 |
2014-11-19 |
Genentech Inc |
Anticuerpos anti-lgr5 e inmunoconjugados
|
|
WO2013152252A1
(en)
|
2012-04-06 |
2013-10-10 |
OSI Pharmaceuticals, LLC |
Combination anti-cancer therapy
|
|
US10130714B2
(en)
|
2012-04-14 |
2018-11-20 |
Academia Sinica |
Enhanced anti-influenza agents conjugated with anti-inflammatory activity
|
|
TW201402609A
(zh)
|
2012-05-01 |
2014-01-16 |
Genentech Inc |
抗pmel17抗體及免疫結合物
|
|
US20130336973A1
(en)
|
2012-05-10 |
2013-12-19 |
Zymeworks Inc. |
Heteromultimer Constructs of Immunoglobulin Heavy Chains with Mutations in the Fc Domain
|
|
WO2013170191A1
(en)
|
2012-05-11 |
2013-11-14 |
Genentech, Inc. |
Methods of using antagonists of nad biosynthesis from nicotinamide
|
|
AU2013262977A1
(en)
|
2012-05-14 |
2015-01-22 |
Prostagene, Llc |
Using modulators of CCR5 for treating cancer
|
|
WO2013177470A1
(en)
|
2012-05-23 |
2013-11-28 |
Genentech, Inc. |
Selection method for therapeutic agents
|
|
ES2666126T3
(es)
|
2012-06-08 |
2018-05-03 |
Glenmark Pharmaceuticals S.A. |
Anticuerpos anti-TrkA humanizados con sustituciones de aminoácidos
|
|
MX2014014830A
(es)
|
2012-06-15 |
2015-05-11 |
Genentech Inc |
Anticuerpos anti-pcsk9, formulaciones, dosificacion y metodos de uso.
|
|
WO2014001325A1
(en)
|
2012-06-27 |
2014-01-03 |
F. Hoffmann-La Roche Ag |
Method for making antibody fc-region conjugates comprising at least one binding entity that specifically binds to a target and uses thereof
|
|
EP2867255B1
(de)
|
2012-06-27 |
2017-07-19 |
F. Hoffmann-La Roche AG |
Verfahren zur auswahl und herstellung massgeschneiderter, selektiver und multispezifischer therapiemoleküle mit mindestens zwei verschiedenen targeting-einheiten sowie verwendungen davon
|
|
KR20150023889A
(ko)
|
2012-06-27 |
2015-03-05 |
에프. 호프만-라 로슈 아게 |
2 개 이상의 상이한 결합 단위를 함유하는 맞춤-제작된 고도로 선별적이고 다중-특이적인 표적화 단위의 선별 및 제조 방법 및 이의 용도
|
|
EP3138578B1
(de)
|
2012-07-04 |
2022-01-12 |
F. Hoffmann-La Roche AG |
Anti-theophyllin-antikörper und verfahren zur verwendung davon
|
|
RU2684595C2
(ru)
|
2012-07-04 |
2019-04-09 |
Ф.Хоффманн-Ля Рош Аг |
Ковалентно связанные конъюгаты антиген-антитело
|
|
EP3339328A1
(de)
|
2012-07-04 |
2018-06-27 |
F. Hoffmann-La Roche AG |
Anti-biotin-antikörper und verwendungsverfahren
|
|
MX356162B
(es)
|
2012-07-05 |
2018-05-16 |
Genentech Inc |
Sistema de expresion y secrecion.
|
|
AU2013288932A1
(en)
|
2012-07-09 |
2014-12-11 |
Genentech, Inc. |
Immunoconjugates comprising anti - CD79b antibodies
|
|
JP2015527318A
(ja)
|
2012-07-09 |
2015-09-17 |
ジェネンテック, インコーポレイテッド |
抗cd22を含む免疫複合体
|
|
MX2015000359A
(es)
|
2012-07-09 |
2015-04-14 |
Genentech Inc |
Anticuerpos e inmunoconjugados anti-cd79b.
|
|
MX2015000315A
(es)
|
2012-07-09 |
2015-07-06 |
Genentech Inc |
Anticuerpos anti-cd22 e inmunoconjugados.
|
|
WO2014012082A2
(en)
|
2012-07-13 |
2014-01-16 |
Zymeworks Inc. |
Multivalent heteromultimer scaffold design an constructs
|
|
HRP20211641T1
(hr)
|
2012-07-13 |
2022-02-04 |
Roche Glycart Ag |
Bispecifična protutijela anti-vegf/anti-ang-2 i njihova primjena u liječenju vaskularnih očnih bolesti
|
|
CN112587658A
(zh)
|
2012-07-18 |
2021-04-02 |
博笛生物科技有限公司 |
癌症的靶向免疫治疗
|
|
SG10201800535XA
(en)
|
2012-08-07 |
2018-02-27 |
Roche Glycart Ag |
Composition comprising two antibodies engineered to have reduced and increased effector function
|
|
PE20150645A1
(es)
|
2012-08-08 |
2015-05-11 |
Roche Glycart Ag |
Proteinas de fusion de interleuquina 10 y usos de las mismas
|
|
WO2014023709A1
(en)
|
2012-08-09 |
2014-02-13 |
Roche Glycart Ag |
Asgpr antibodies and uses thereof
|
|
US9914956B2
(en)
|
2012-08-18 |
2018-03-13 |
Academia Sinica |
Cell-permeable probes for identification and imaging of sialidases
|
|
WO2014031762A1
(en)
|
2012-08-21 |
2014-02-27 |
Academia Sinica |
Benzocyclooctyne compounds and uses thereof
|
|
WO2014036520A1
(en)
|
2012-08-30 |
2014-03-06 |
Merrimack Pharmaceuticals, Inc. |
Combination therapies comprising anti-erbb3 agents
|
|
MX2015002407A
(es)
|
2012-09-14 |
2015-06-22 |
Hoffmann La Roche |
Metodo para produccion y seleccion de moleculas que comprenden al menos dos entidades diferentes y usos del mismo.
|
|
ES2738305T3
(es)
|
2012-10-05 |
2020-01-21 |
Hoffmann La Roche |
Procedimientos para diagnosticar y tratar enfermedades inflamatorias intestinales
|
|
RU2015117393A
(ru)
|
2012-10-08 |
2016-12-10 |
Роше Гликарт Аг |
Лишенные fc антитела, содержащие два Fab-фрагмента, и способы их применения
|
|
EP2906598A1
(de)
|
2012-10-09 |
2015-08-19 |
Igenica Biotherapeutics, Inc. |
Anti-c16orf54-antikörper und verfahren zur verwendung davon
|
|
EP2909181B1
(de)
|
2012-10-16 |
2017-08-09 |
Tolero Pharmaceuticals, Inc. |
Pkm2-modulatoren und verfahren zu deren verwendung
|
|
CA2890207A1
(en)
|
2012-11-05 |
2014-05-08 |
Foundation Medicine, Inc. |
Novel ntrk1 fusion molecules and uses thereof
|
|
WO2014072306A1
(en)
|
2012-11-08 |
2014-05-15 |
F. Hoffmann-La Roche Ag |
Her3 antigen binding proteins binding to the beta-hairpin of her3
|
|
TWI657095B
(zh)
|
2012-11-13 |
2019-04-21 |
美商建南德克公司 |
抗血球凝集素抗體及使用方法
|
|
EP2920586A4
(de)
|
2012-11-15 |
2017-01-04 |
F. Hoffmann-La Roche SA |
Durch ionenstärke vermittelte ph-gradienten-ionenaustausch-chromatografie
|
|
KR102291355B1
(ko)
|
2012-11-30 |
2021-08-19 |
에프. 호프만-라 로슈 아게 |
Pd-l1 억제제 공동치료를 필요로 하는 환자의 식별방법
|
|
US9260426B2
(en)
|
2012-12-14 |
2016-02-16 |
Arrien Pharmaceuticals Llc |
Substituted 1H-pyrrolo [2, 3-b] pyridine and 1H-pyrazolo [3, 4-b] pyridine derivatives as salt inducible kinase 2 (SIK2) inhibitors
|
|
SG11201505186SA
(en)
|
2013-01-02 |
2015-07-30 |
Glenmark Pharmaceuticals Sa |
Antibodies that bind to tl1a and their uses
|
|
CA2898326C
(en)
|
2013-01-18 |
2022-05-17 |
Foundation Medicine, Inc. |
Methods of treating cholangiocarcinoma
|
|
WO2014116749A1
(en)
|
2013-01-23 |
2014-07-31 |
Genentech, Inc. |
Anti-hcv antibodies and methods of using thereof
|
|
WO2014114595A1
(en)
|
2013-01-23 |
2014-07-31 |
Roche Glycart Ag |
Predictive biomarker for cancer treatment with adcc-enhanced antibodies
|
|
JP2016509045A
(ja)
|
2013-02-22 |
2016-03-24 |
エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト |
がんを治療し、薬剤耐性を防止する方法
|
|
KR20150123811A
(ko)
|
2013-02-26 |
2015-11-04 |
로슈 글리카트 아게 |
항-mcsp 항체
|
|
CN105143270B
(zh)
|
2013-02-26 |
2019-11-12 |
罗切格利卡特公司 |
双特异性t细胞活化抗原结合分子
|
|
EP3708584A1
(de)
|
2013-02-26 |
2020-09-16 |
Roche Glycart AG |
Bispezifische antigenbindende moleküle zur t-zellen-aktivierung
|
|
RU2015140917A
(ru)
|
2013-02-26 |
2017-04-03 |
Роше Гликарт Аг |
Биспецифические антигенсвязывающие молекулы, активирующие т-клетки
|
|
US9925240B2
(en)
|
2013-03-06 |
2018-03-27 |
Genentech, Inc. |
Methods of treating and preventing cancer drug resistance
|
|
AR095398A1
(es)
|
2013-03-13 |
2015-10-14 |
Genentech Inc |
Formulaciones con oxidación reducida
|
|
MY189047A
(en)
|
2013-03-13 |
2022-01-21 |
Genentech Inc |
Antibody formulations
|
|
WO2014160497A1
(en)
|
2013-03-13 |
2014-10-02 |
Genentech, Inc. |
Formulations with reduced oxidation
|
|
US10653779B2
(en)
|
2013-03-13 |
2020-05-19 |
Genentech, Inc. |
Formulations with reduced oxidation
|
|
HUE039948T2
(hu)
|
2013-03-13 |
2019-02-28 |
Hoffmann La Roche |
Csökkent oxidációjú készítmények
|
|
KR20150127216A
(ko)
|
2013-03-14 |
2015-11-16 |
제넨테크, 인크. |
암의 치료 및 암 약물 내성의 예방 방법
|
|
CN105246508A
(zh)
|
2013-03-14 |
2016-01-13 |
基因泰克公司 |
Mek抑制剂化合物与her3/egfr抑制剂化合物的组合及使用方法
|
|
US10150813B2
(en)
|
2013-03-14 |
2018-12-11 |
Genentech, Inc. |
Anti-B7-H4 antibodies and immunoconjugates
|
|
US9562099B2
(en)
|
2013-03-14 |
2017-02-07 |
Genentech, Inc. |
Anti-B7-H4 antibodies and immunoconjugates
|
|
KR102334260B1
(ko)
|
2013-03-14 |
2021-12-02 |
스미토모 다이니폰 파마 온콜로지, 인크. |
Jak2 및 alk2 억제제 및 이들의 사용 방법
|
|
CN105143265A
(zh)
|
2013-03-15 |
2015-12-09 |
豪夫迈·罗氏有限公司 |
抗CRTh2抗体及其用途
|
|
NZ712314A
(en)
|
2013-03-15 |
2021-07-30 |
Genentech Inc |
Biomarkers and methods of treating pd-1 and pd-l1 related conditions
|
|
PE20151750A1
(es)
|
2013-03-15 |
2015-12-07 |
Genentech Inc |
Composiciones y metodos para el diagnostico y tratamiento del cancer hepatico
|
|
RU2015144020A
(ru)
|
2013-03-15 |
2017-04-21 |
Дженентек, Инк. |
Среды для культивирования клеток и способы получения антител
|
|
US20160143910A1
(en)
|
2013-03-15 |
2016-05-26 |
Constellation Pharmaceuticals, Inc. |
Methods of treating cancer and preventing cancer drug resistance
|
|
CN105143258B
(zh)
|
2013-03-15 |
2020-06-23 |
Ac免疫有限公司 |
抗Tau抗体和使用方法
|
|
US20140283157A1
(en)
|
2013-03-15 |
2014-09-18 |
Diadexus, Inc. |
Lipoprotein-associated phospholipase a2 antibody compositions and methods of use
|
|
SG10201912621TA
(en)
|
2013-03-15 |
2020-02-27 |
Genentech Inc |
Cell culture compositions with antioxidants and methods for polypeptide production
|
|
JP2016515544A
(ja)
|
2013-03-18 |
2016-05-30 |
バイオセルオーエックス プロダクツ ビー.ブイ. |
ヒト化抗cd134(ox40)抗体およびその使用
|
|
MX2015011765A
(es)
|
2013-03-27 |
2016-01-15 |
Genentech Inc |
Uso de biomarcadores para la evaluacion del tratamiento de trastornos inflamatorios gastrointestinales con antagonistas de la integrina beta 7.
|
|
US20160053023A1
(en)
|
2013-04-09 |
2016-02-25 |
Annexon, Inc. |
Methods of treatment for neuromyelitis optica
|
|
US9206188B2
(en)
|
2013-04-18 |
2015-12-08 |
Arrien Pharmaceuticals Llc |
Substituted pyrrolo[2,3-b]pyridines as ITK and JAK inhibitors
|
|
EP2994164B1
(de)
|
2013-05-08 |
2020-08-05 |
Zymeworks Inc. |
Bispezifische her2- und her3-antigenbindende konstrukte
|
|
KR102293064B1
(ko)
|
2013-05-20 |
2021-08-23 |
제넨테크, 인크. |
항-트랜스페린 수용체 항체 및 사용 방법
|
|
AU2014269960B2
(en)
|
2013-05-24 |
2018-05-10 |
Société des Produits Nestlé S.A. |
Pathway specific assays for predicting irritable bowel syndrome diagnosis
|
|
WO2014210397A1
(en)
|
2013-06-26 |
2014-12-31 |
Academia Sinica |
Rm2 antigens and use thereof
|
|
US9981030B2
(en)
|
2013-06-27 |
2018-05-29 |
Academia Sinica |
Glycan conjugates and use thereof
|
|
EA037325B1
(ru)
|
2013-07-09 |
2021-03-12 |
Аннексон, Инк. |
Антитела против фактора комплемента c1q и их применения
|
|
EP3019516B1
(de)
|
2013-07-12 |
2018-11-14 |
H. Hoffnabb-La Roche Ag |
Darstellung einer eingabeoptimierung in der ionenaustauschchromatografie
|
|
WO2015009831A2
(en)
*
|
2013-07-17 |
2015-01-22 |
Foundation Medicine, Inc. |
Methods of treating urothelial carcinomas
|
|
US20160168231A1
(en)
|
2013-07-18 |
2016-06-16 |
Fabrus, Inc. |
Antibodies with ultralong complementarity determining regions
|
|
WO2015010100A2
(en)
|
2013-07-18 |
2015-01-22 |
Fabrus, Inc. |
Humanized antibodies with ultralong complementarity determining regions
|
|
AU2014306867B2
(en)
|
2013-08-12 |
2017-10-26 |
Genentech, Inc. |
Compositions and method for treating complement-associated conditions
|
|
JP6602765B2
(ja)
|
2013-09-05 |
2019-11-06 |
ジェネンテック, インコーポレイテッド |
クロマトグラフィー再使用のための方法
|
|
AU2014317889B2
(en)
|
2013-09-06 |
2020-03-05 |
Academia Sinica |
Human iNKT cell activation using glycolipids with altered glycosyl groups
|
|
EP3044236A2
(de)
|
2013-09-12 |
2016-07-20 |
Halozyme, Inc. |
Modifizierte anti-egfr-antikörper und verfahren zur verwendung davon
|
|
MY176026A
(en)
|
2013-09-13 |
2020-07-22 |
Genentech Inc |
Methods and composions comprising purified recombinant polypeptides
|
|
CA3174012A1
(en)
|
2013-09-13 |
2015-03-19 |
Genentech, Inc. |
Compositions and methods for detecting and quantifying host cell protein in cell lines and recombinant polypeptide products
|
|
KR20160055252A
(ko)
|
2013-09-17 |
2016-05-17 |
제넨테크, 인크. |
항-lgr5 항체의 사용 방법
|
|
LT3049441T
(lt)
|
2013-09-27 |
2020-02-10 |
F. Hoffmann-La Roche Ag |
Anti-pdl1 antikūnų kompozicija
|
|
EP3049437A1
(de)
|
2013-09-27 |
2016-08-03 |
F. Hoffmann-La Roche AG |
Thermus-thermophilus-slyd-fkbp-domänenspezifische antikörper
|
|
US20150104392A1
(en)
|
2013-10-04 |
2015-04-16 |
Aptose Biosciences Inc. |
Compositions, biomarkers and their use in the treatment of cancer
|
|
WO2015054670A1
(en)
|
2013-10-11 |
2015-04-16 |
Genentech, Inc. |
Nsp4 inhibitors and methods of use
|
|
CN105612182B
(zh)
|
2013-10-11 |
2019-12-10 |
豪夫迈·罗氏有限公司 |
多特异性结构域交换共有可变轻链抗体
|
|
EP3057615B1
(de)
|
2013-10-18 |
2021-02-24 |
F.Hoffmann-La Roche Ag |
Anti-rspo-antikörper und verfahren zur verwendung
|
|
RU2016119425A
(ru)
|
2013-10-23 |
2017-11-28 |
Дженентек, Инк. |
Способы диагностики и лечения эозинофильных заболеваний
|
|
CA2930307A1
(en)
|
2013-11-13 |
2015-05-21 |
Zymeworks Inc. |
Monovalent antigen binding constructs targeting egfr and/or her2 and uses thereof
|
|
PT3071597T
(pt)
|
2013-11-21 |
2020-10-08 |
Hoffmann La Roche |
Anticorpos anti-alfa-sinucleína e métodos de utilização
|
|
UA115388C2
(uk)
|
2013-11-21 |
2017-10-25 |
Пфайзер Інк. |
2,6-заміщені пуринові похідні та їх застосування в лікуванні проліферативних захворювань
|
|
CN105980409B
(zh)
|
2013-11-27 |
2023-07-18 |
酵活生物制药有限公司 |
靶向her2的双特异性抗原结合构建体
|
|
US9546215B2
(en)
|
2013-12-09 |
2017-01-17 |
Allakos Inc. |
Anti-Siglec-8 antibodies and methods of use thereof
|
|
PE20160712A1
(es)
|
2013-12-13 |
2016-07-26 |
Genentech Inc |
Anticuerpos e inmunoconjugados anti-cd33
|
|
EP3083687A2
(de)
|
2013-12-17 |
2016-10-26 |
F. Hoffmann-La Roche AG |
Kombinationstherapie mit ox40-bindungsagonisten und pd-1-achsenbindungsantagonisten
|
|
AU2014364593A1
(en)
|
2013-12-17 |
2016-07-07 |
Genentech, Inc. |
Methods of treating cancer using PD-1 axis binding antagonists and an anti-CD20 antibody
|
|
AU2014364587B9
(en)
|
2013-12-17 |
2023-02-16 |
Genentech, Inc. |
Methods of treating cancers using PD-1 axis binding antagonists and taxanes
|
|
RS60443B1
(sr)
|
2013-12-17 |
2020-07-31 |
Genentech Inc |
Anti-cd3 antitela i postupci upotrebe
|
|
SG11201605044RA
(en)
|
2013-12-20 |
2016-07-28 |
Hoffmann La Roche |
HUMANIZED ANTI-Tau(pS422) ANTIBODIES AND METHODS OF USE
|
|
TWI670283B
(zh)
|
2013-12-23 |
2019-09-01 |
美商建南德克公司 |
抗體及使用方法
|
|
RU2682754C2
(ru)
|
2014-01-03 |
2019-03-21 |
Ф. Хоффманн-Ля Рош Аг |
Конъюгаты полипептидного токсина и антитела, соединенных ковалентной связью
|
|
CN111228509A
(zh)
|
2014-01-03 |
2020-06-05 |
豪夫迈·罗氏有限公司 |
双特异性抗-半抗原/抗-血脑屏障受体的抗体、其复合物及其作为血脑屏障穿梭物的应用
|
|
CA2930154A1
(en)
|
2014-01-03 |
2015-07-09 |
F. Hoffmann-La Roche Ag |
Covalently linked helicar-anti-helicar antibody conjugates and uses thereof
|
|
CN111057151B
(zh)
|
2014-01-06 |
2022-05-03 |
豪夫迈·罗氏有限公司 |
单价血脑屏障穿梭模块
|
|
EP3092254A4
(de)
|
2014-01-10 |
2017-09-20 |
Birdie Biopharmaceuticals Inc. |
Verbindungen und zusammensetzungen zur behandlung von her2-positiven tumoren
|
|
US10150818B2
(en)
|
2014-01-16 |
2018-12-11 |
Academia Sinica |
Compositions and methods for treatment and detection of cancers
|
|
WO2016114819A1
(en)
|
2015-01-16 |
2016-07-21 |
Academia Sinica |
Compositions and methods for treatment and detection of cancers
|
|
WO2015184009A1
(en)
|
2014-05-27 |
2015-12-03 |
Academia Sinica |
Compositions and methods relating to universal glycoforms for enhanced antibody efficacy
|
|
CA2937123A1
(en)
|
2014-01-16 |
2015-07-23 |
Academia Sinica |
Compositions and methods for treatment and detection of cancers
|
|
SI3097122T1
(sl)
|
2014-01-24 |
2020-07-31 |
Ngm Biopharmaceuticals, Inc. |
Protitelesa, ki se vežejo v domeni beta klotho 2, in metode za njihovo uporabo
|
|
KR20160111469A
(ko)
|
2014-01-24 |
2016-09-26 |
제넨테크, 인크. |
항-steap1 항체 및 면역접합체를 사용하는 방법
|
|
JOP20200094A1
(ar)
|
2014-01-24 |
2017-06-16 |
Dana Farber Cancer Inst Inc |
جزيئات جسم مضاد لـ pd-1 واستخداماتها
|
|
WO2015116902A1
(en)
|
2014-01-31 |
2015-08-06 |
Genentech, Inc. |
G-protein coupled receptors in hedgehog signaling
|
|
JOP20200096A1
(ar)
|
2014-01-31 |
2017-06-16 |
Children’S Medical Center Corp |
جزيئات جسم مضاد لـ tim-3 واستخداماتها
|
|
AU2015214264B2
(en)
|
2014-02-04 |
2018-12-20 |
Curis, Inc. |
Mutant Smoothened and methods of using the same
|
|
CA2938731A1
(en)
|
2014-02-08 |
2015-08-13 |
Genentech, Inc. |
Methods of treating alzheimer's disease
|
|
MY179105A
(en)
|
2014-02-08 |
2020-10-28 |
Genentech Inc |
Methods of treating alzheimer's disease
|
|
WO2015123325A1
(en)
|
2014-02-12 |
2015-08-20 |
Genentech, Inc. |
Anti-jagged1 antibodies and methods of use
|
|
BR112016018980A2
(pt)
|
2014-02-21 |
2017-10-10 |
Genentech Inc |
método de tratamento de um distúrbio, anticorpo multiespecífico, ácido nucleico isolado, célula hospedeira, métodos de produzir um anticorpo, de produção de uma metade de anticorpo ou de um anticorpo multiespecífico e de produção de um anticorpo multiespecífico, imunoconjugado e formulação farmacêutica
|
|
EP3110446B1
(de)
|
2014-02-28 |
2021-12-01 |
Allakos Inc. |
Verfahren und zusammensetzungen zur behandlung von siglec-8-assoziierten krankheiten
|
|
MY187246A
(en)
|
2014-03-14 |
2021-09-14 |
Novartis Ag |
Antibody molecules to lag-3 and uses thereof
|
|
EP3116999B1
(de)
|
2014-03-14 |
2021-09-15 |
F. Hoffmann-La Roche AG |
Verfahren und zusammensetzungen für die sekretion von heterologen polypeptiden
|
|
US20170335281A1
(en)
|
2014-03-15 |
2017-11-23 |
Novartis Ag |
Treatment of cancer using chimeric antigen receptor
|
|
US20170107294A1
(en)
|
2014-03-21 |
2017-04-20 |
Nordlandssykehuset Hf |
Anti-cd14 antibodies and uses thereof
|
|
RU2016141385A
(ru)
|
2014-03-24 |
2018-04-28 |
Дженентек, Инк. |
Лечение рака антагонистами с-мет и их корреляция с экспрессией hgf
|
|
WO2015148915A1
(en)
|
2014-03-27 |
2015-10-01 |
Academia Sinica |
Reactive labelling compounds and uses thereof
|
|
EP3122377A4
(de)
|
2014-03-27 |
2018-03-14 |
F.Hoffmann-La Roche Ag |
Verfahren zur diagnose und behandlung von entzündlicher darmerkrankung
|
|
CA2943834A1
(en)
|
2014-03-31 |
2015-10-08 |
Genentech, Inc. |
Combination therapy comprising anti-angiogenesis agents and ox40 binding agonists
|
|
KR20160145624A
(ko)
|
2014-03-31 |
2016-12-20 |
제넨테크, 인크. |
항-ox40 항체 및 사용 방법
|
|
WO2015155624A1
(en)
|
2014-04-10 |
2015-10-15 |
Pfizer Inc. |
Dihydropyrrolopyrimidine derivatives
|
|
MA52909A
(fr)
|
2014-04-18 |
2021-04-21 |
Acceleron Pharma Inc |
Procédés d'augmentation des taux de globules rouges et de traitement de la drépanocytose
|
|
WO2015164615A1
(en)
|
2014-04-24 |
2015-10-29 |
University Of Oslo |
Anti-gluten antibodies and uses thereof
|
|
CA2983794A1
(en)
|
2014-04-25 |
2015-10-29 |
The Brigham And Women's Hospital, Inc. |
Methods to manipulate alpha-fetoprotein (afp)
|
|
AP2016009530A0
(en)
|
2014-04-30 |
2016-10-31 |
Pfizer |
Cycloalkyl-linked diheterocycle derivatives
|
|
CN106536561A
(zh)
|
2014-05-01 |
2017-03-22 |
豪夫迈·罗氏有限公司 |
抗‑因子d抗体变体及其用途
|
|
AU2015255883A1
(en)
|
2014-05-08 |
2016-10-27 |
Novodiax, Inc. |
Direct immunohistochemistry assay
|
|
JP2017522861A
(ja)
|
2014-05-22 |
2017-08-17 |
ジェネンテック, インコーポレイテッド |
抗gpc3抗体及びイムノコンジュゲート
|
|
MX2016015163A
(es)
|
2014-05-23 |
2017-03-03 |
Genentech Inc |
Biomarcadores mit y metodos para su uso.
|
|
US10005847B2
(en)
|
2014-05-27 |
2018-06-26 |
Academia Sinica |
Anti-HER2 glycoantibodies and uses thereof
|
|
JP2017518989A
(ja)
|
2014-05-27 |
2017-07-13 |
アカデミア シニカAcademia Sinica |
抗cd20糖操作抗体群およびその使用
|
|
US10118969B2
(en)
|
2014-05-27 |
2018-11-06 |
Academia Sinica |
Compositions and methods relating to universal glycoforms for enhanced antibody efficacy
|
|
US11332523B2
(en)
|
2014-05-28 |
2022-05-17 |
Academia Sinica |
Anti-TNF-alpha glycoantibodies and uses thereof
|
|
CA2949982A1
(en)
|
2014-06-11 |
2015-12-17 |
Genentech, Inc. |
Anti-lgr5 antibodies and uses thereof
|
|
CN107073121A
(zh)
|
2014-06-13 |
2017-08-18 |
基因泰克公司 |
治疗及预防癌症药物抗性的方法
|
|
MA40008A
(fr)
|
2014-06-13 |
2021-05-05 |
Acceleron Pharma Inc |
Antagoniste actrii pour le traitement et la prevention d'un ulcere cutane chez un sujet ayant l'anemie
|
|
AR100978A1
(es)
|
2014-06-26 |
2016-11-16 |
Hoffmann La Roche |
LANZADERAS CEREBRALES DE ANTICUERPO HUMANIZADO ANTI-Tau(pS422) Y USOS DE LAS MISMAS
|
|
RU2705299C2
(ru)
|
2014-06-26 |
2019-11-06 |
Ф. Хоффманн-Ля Рош Аг |
Антитела против 5-бром-2'-дезоксиуридина и способы применения
|
|
WO2016001789A1
(en)
|
2014-06-30 |
2016-01-07 |
Pfizer Inc. |
Pyrimidine derivatives as pi3k inhibitors for use in the treatment of cancer
|
|
PL3164492T3
(pl)
|
2014-07-03 |
2020-04-30 |
F. Hoffmann-La Roche Ag |
Układy ekspresji polipeptydu
|
|
CA2953149A1
(en)
|
2014-07-03 |
2016-01-07 |
Yale University |
Dickkopf2 (dkk2) inhibition suppresses tumor formation
|
|
EP3166976B1
(de)
|
2014-07-09 |
2022-02-23 |
Birdie Biopharmaceuticals Inc. |
Anti-pd-l1-kombinationen zur tumorbehandlung
|
|
CN112546231A
(zh)
|
2014-07-09 |
2021-03-26 |
博笛生物科技有限公司 |
用于治疗癌症的联合治疗组合物和联合治疗方法
|
|
AU2015288232B2
(en)
|
2014-07-11 |
2020-10-15 |
Ventana Medical Systems, Inc. |
Anti-PD-L1 antibodies and diagnostic uses thereof
|
|
MX2017000363A
(es)
|
2014-07-11 |
2017-04-27 |
Genentech Inc |
Inhibicion de la via de notch.
|
|
US9777061B2
(en)
|
2014-07-21 |
2017-10-03 |
Novartis Ag |
Treatment of cancer using a CD33 chimeric antigen receptor
|
|
US11542488B2
(en)
|
2014-07-21 |
2023-01-03 |
Novartis Ag |
Sortase synthesized chimeric antigen receptors
|
|
JP2017528433A
(ja)
|
2014-07-21 |
2017-09-28 |
ノバルティス アーゲー |
低い免疫増強用量のmTOR阻害剤とCARの組み合わせ
|
|
RU2751660C2
(ru)
|
2014-07-21 |
2021-07-15 |
Новартис Аг |
Лечение злокачественного новообразования с использованием гуманизированного химерного антигенного рецептора против всма
|
|
EP3174546B1
(de)
|
2014-07-31 |
2019-10-30 |
Novartis AG |
Teilmengenoptimierte chimäre antigenrezeptorhaltige t-zellen
|
|
BR112016030462A2
(pt)
|
2014-08-04 |
2018-01-16 |
F. Hoffmann-La Roche Ag |
moléculas de ligação, um ou mais polinucleotídeos isolados, um ou mais vetores, célula hospedeira, método de produção de uma molécula de ligação, composição farmacêutica, uso da molécula de ligação, método de tratamento de doenças e de indução da lise de células alvo
|
|
CA2955086A1
(en)
|
2014-08-08 |
2016-02-11 |
Alector Llc |
Anti-trem2 antibodies and methods of use thereof
|
|
JP6919118B2
(ja)
|
2014-08-14 |
2021-08-18 |
ノバルティス アーゲー |
GFRα−4キメラ抗原受容体を用いる癌の治療
|
|
JP7084138B2
(ja)
|
2014-08-19 |
2022-06-14 |
ノバルティス アーゲー |
癌処置に使用するための抗cd123キメラ抗原受容体(car)
|
|
WO2016033331A1
(en)
|
2014-08-28 |
2016-03-03 |
Bioatla, Llc |
Conditionally active chimeric antigen receptors for modified t-cells
|
|
HUE043847T2
(hu)
|
2014-08-28 |
2019-09-30 |
Halozyme Inc |
Hialuronán-lebontó enzimmel és egy immun checkpoint inhibitorral végzett kombinációs terápia
|
|
CN112546238A
(zh)
|
2014-09-01 |
2021-03-26 |
博笛生物科技有限公司 |
用于治疗肿瘤的抗-pd-l1结合物
|
|
AU2015315294B2
(en)
|
2014-09-08 |
2020-09-17 |
Academia Sinica |
Human iNKT cell activation using glycolipids
|
|
PE20170670A1
(es)
|
2014-09-12 |
2017-06-06 |
Genentech Inc |
Anticuerpos anti-cll-1 e inmunoconjugados
|
|
SG10201809668TA
(en)
|
2014-09-12 |
2018-11-29 |
Genentech Inc |
Anti-her2 antibodies and immunoconjugates
|
|
JP2017531620A
(ja)
|
2014-09-12 |
2017-10-26 |
ジェネンテック, インコーポレイテッド |
システイン操作抗体及びコンジュゲート
|
|
CN113698485A
(zh)
|
2014-09-12 |
2021-11-26 |
基因泰克公司 |
抗-b7-h4抗体及免疫缀合物
|
|
KR20170057339A
(ko)
|
2014-09-15 |
2017-05-24 |
제넨테크, 인크. |
항체 제형
|
|
EP3967709A1
(de)
|
2014-09-17 |
2022-03-16 |
Novartis AG |
Targeting von zytotoxischen zellen mit chimären rezeptoren zur adoptiven immuntherapie
|
|
MX2017003472A
(es)
|
2014-09-17 |
2017-10-31 |
Genentech Inc |
Inmunoconjugados que comprenden anticuerpos anti-her2.
|
|
ES2796903T3
(es)
|
2014-09-23 |
2020-11-30 |
Hoffmann La Roche |
Procedimiento de uso de inmunoconjugados anti-CD79b
|
|
JP6877339B2
(ja)
|
2014-10-14 |
2021-05-26 |
ノバルティス アーゲー |
Pd−l1に対する抗体分子およびその使用
|
|
WO2016061389A2
(en)
|
2014-10-16 |
2016-04-21 |
Genentech, Inc. |
Anti-alpha-synuclein antibodies and methods of use
|
|
BR112017009151A2
(pt)
|
2014-11-03 |
2018-03-06 |
Genentech, Inc. |
ensaios para detectar subgrupos imunológicos de célula t e métodos de uso dos mesmos
|
|
AU2015343339A1
(en)
|
2014-11-03 |
2017-06-15 |
Genentech, Inc. |
Methods and biomarkers for predicting efficacy and evaluation of an OX40 agonist treatment
|
|
CA2966558C
(en)
|
2014-11-05 |
2024-03-12 |
Genentech, Inc. |
Methods of producing two chain proteins in bacteria
|
|
CN113699203A
(zh)
|
2014-11-05 |
2021-11-26 |
基因泰克公司 |
在细菌中产生双链蛋白质的方法
|
|
MX2017003478A
(es)
|
2014-11-05 |
2018-02-01 |
Genentech Inc |
Anticuerpos anti-fgfr2/3 y metodos para su uso.
|
|
KR102626877B1
(ko)
|
2014-11-05 |
2024-01-19 |
애넥슨, 인코포레이티드 |
인간화 항-보체 인자 c1q 항체 및 이의 용도
|
|
US20160152720A1
(en)
|
2014-11-06 |
2016-06-02 |
Genentech, Inc. |
Combination therapy comprising ox40 binding agonists and tigit inhibitors
|
|
WO2016073157A1
(en)
|
2014-11-06 |
2016-05-12 |
Genentech, Inc. |
Anti-ang2 antibodies and methods of use thereof
|
|
CA2960297A1
(en)
|
2014-11-10 |
2016-05-19 |
Genentech, Inc. |
Anti-interleukin-33 antibodies and uses thereof
|
|
WO2016077369A1
(en)
|
2014-11-10 |
2016-05-19 |
Genentech, Inc. |
Animal model for nephropathy and agents for treating the same
|
|
MA53242A
(fr)
|
2014-11-14 |
2021-06-23 |
Hoffmann La Roche |
Molécules de liaison d'antigène comprenant un trimère de ligand de la famille tnf
|
|
CA2967368A1
(en)
|
2014-11-17 |
2016-05-26 |
Genentech, Inc. |
Combination therapy comprising ox40 binding agonists and pd-1 axis binding antagonists
|
|
JP6779876B2
(ja)
|
2014-11-19 |
2020-11-04 |
ジェネンテック, インコーポレイテッド |
抗トランスフェリン受容体抗体及びその使用方法
|
|
SG11201703729RA
(en)
|
2014-11-19 |
2017-06-29 |
Nestec Sa |
Antibodies against serotonin, tryptophan and kynurenine metabolites and uses thereof
|
|
CN107108745B
(zh)
|
2014-11-19 |
2021-01-12 |
基因泰克公司 |
抗bace1的抗体和其用于神经疾病免疫疗法的用途
|
|
JP6993228B2
(ja)
|
2014-11-19 |
2022-03-03 |
ジェネンテック, インコーポレイテッド |
抗トランスフェリン受容体/抗bace1多重特異性抗体および使用方法
|
|
RU2747011C2
(ru)
|
2014-11-20 |
2021-04-23 |
Ф.Хоффманн-Ля Рош Аг |
Общие легкие цепи и способы их применения
|
|
CN107206072B
(zh)
|
2014-11-20 |
2022-01-21 |
豪夫迈·罗氏有限公司 |
T细胞活化性双特异性抗原结合分子CD3 ABD叶酸受体1(FolR1)和PD-1轴结合拮抗剂的组合疗法
|
|
EP3227341A1
(de)
|
2014-12-02 |
2017-10-11 |
CeMM - Forschungszentrum für Molekulare Medizin GmbH |
Anti-mutante calreticulin-antikörper und deren verwendung bei der diagnose und therapie von myeloiden malignomen
|
|
EP3227332B1
(de)
|
2014-12-03 |
2019-11-06 |
F.Hoffmann-La Roche Ag |
Multispezifische antikörper
|
|
WO2016090034A2
(en)
|
2014-12-03 |
2016-06-09 |
Novartis Ag |
Methods for b cell preconditioning in car therapy
|
|
MA41119A
(fr)
|
2014-12-03 |
2017-10-10 |
Acceleron Pharma Inc |
Méthodes de traitement de syndromes myélodysplasiques et d'anémie sidéroblastique
|
|
SG11201704449VA
(en)
|
2014-12-05 |
2017-06-29 |
Genentech Inc |
ANTI-CD79b ANTIBODIES AND METHODS OF USE
|
|
RU2017120039A
(ru)
|
2014-12-10 |
2019-01-10 |
Дженентек, Инк. |
Антитела к рецепторам гематоэнцефалического барьера и способы их применения
|
|
US20160168237A1
(en)
|
2014-12-12 |
2016-06-16 |
Alexion Pharmaceuticals, Inc. |
Method for treating a complement mediated disorder caused by an infectious agent in a patient
|
|
WO2016097918A1
(en)
|
2014-12-18 |
2016-06-23 |
Pfizer Inc. |
Pyrimidine and triazine derivatives and their use as axl inhibitors
|
|
US9765135B2
(en)
|
2014-12-19 |
2017-09-19 |
Chugai Seiyaku Kabushiki Kaisha |
Anti-C5 antibodies
|
|
EP3034130B1
(de)
|
2014-12-19 |
2019-12-04 |
Althia Health, S.L. |
Monoklonaler Antikörper zur Diagnose, Behandlung und/oder Prävention von Hirntumoren und Hirnverletzungen
|
|
WO2016115345A1
(en)
|
2015-01-14 |
2016-07-21 |
The Brigham And Women's Hospital, |
Treatment of cancer with anti-lap monoclonal antibodies
|
|
US9975965B2
(en)
|
2015-01-16 |
2018-05-22 |
Academia Sinica |
Compositions and methods for treatment and detection of cancers
|
|
US10495645B2
(en)
|
2015-01-16 |
2019-12-03 |
Academia Sinica |
Cancer markers and methods of use thereof
|
|
EP3247723A1
(de)
|
2015-01-22 |
2017-11-29 |
Chugai Seiyaku Kabushiki Kaisha |
Kombination von zwei oder mehr anti-c5-antikörpern und verfahren zur verwendung
|
|
CA2972731A1
(en)
|
2015-01-24 |
2016-07-28 |
Chi-Huey Wong |
Cancer markers and methods of use thereof
|
|
EP3789766A1
(de)
|
2015-01-24 |
2021-03-10 |
Academia Sinica |
Neuartige glycankonjugate und verfahren zur verwendung davon
|
|
CN107407677B
(zh)
|
2015-01-28 |
2020-07-17 |
豪夫迈·罗氏有限公司 |
多发性硬化的基因表达标志和治疗
|
|
WO2016123591A2
(en)
|
2015-01-30 |
2016-08-04 |
Academia Sinica |
Compositions and methods for treatment and detection of cancers
|
|
US10330683B2
(en)
|
2015-02-04 |
2019-06-25 |
Genentech, Inc. |
Mutant smoothened and methods of using the same
|
|
KR20170110129A
(ko)
|
2015-02-05 |
2017-10-10 |
추가이 세이야쿠 가부시키가이샤 |
이온 농도 의존적 항원 결합 도메인을 포함하는 항체, Fc 영역 개변체, IL-8에 결합하는 항체, 및 그들의 사용
|
|
US10906948B2
(en)
|
2015-02-23 |
2021-02-02 |
Seagull Therapeutics Sas |
Non-natural Semaphorins 3 and their medical use
|
|
CN107257693A
(zh)
|
2015-02-26 |
2017-10-17 |
豪夫迈·罗氏有限公司 |
治疗Crohn病的整联蛋白β7拮抗剂和方法
|
|
EP3265557B1
(de)
|
2015-03-06 |
2019-10-16 |
F. Hoffmann-La Roche AG |
Ultrareine dsba und dsbc und verfahren zur herstellung und verwendung davon
|
|
CA2977285A1
(en)
|
2015-03-16 |
2016-09-22 |
F. Hoffmann-La Roche Ag |
Methods of detecting and quantifying il-13 and uses in diagnosing and treating th2-associated diseases
|
|
WO2016145536A1
(en)
|
2015-03-18 |
2016-09-22 |
Immunobiochem Corporation |
Conjugates for the treatment of cancer targeted at intracellular tumor-associated antigens
|
|
WO2016146833A1
(en)
|
2015-03-19 |
2016-09-22 |
F. Hoffmann-La Roche Ag |
Biomarkers for nad(+)-diphthamide adp ribosyltransferase resistance
|
|
MA41919A
(fr)
|
2015-04-06 |
2018-02-13 |
Acceleron Pharma Inc |
Hétéromultimères alk4:actriib et leurs utilisations
|
|
WO2016164503A1
(en)
|
2015-04-06 |
2016-10-13 |
Acceleron Pharma Inc. |
Alk7:actriib heteromultimers and uses thereof
|
|
CA2981851A1
(en)
|
2015-04-07 |
2016-10-13 |
Alector Llc |
Anti-sortilin antibodies and methods of use thereof
|
|
KR20180002653A
(ko)
|
2015-04-07 |
2018-01-08 |
제넨테크, 인크. |
효능작용 활성을 갖는 항원 결합 복합체 및 사용 방법
|
|
EP4056588A1
(de)
|
2015-04-08 |
2022-09-14 |
Novartis AG |
Cd20-therapien, cd22-therapien und kombinationstherapien mit einer zelle zur expression des chimären antigen-rezeptors (car) cd19
|
|
CA2982928A1
(en)
|
2015-04-20 |
2016-10-27 |
Tolero Pharmaceuticals, Inc. |
Predicting response to alvocidib by mitochondrial profiling
|
|
CN113552350A
(zh)
|
2015-04-21 |
2021-10-26 |
基因泰克公司 |
用于前列腺癌分析的组合物和方法
|
|
GB201506870D0
(en)
|
2015-04-22 |
2015-06-03 |
Ucb Biopharma Sprl |
Method
|
|
WO2016172583A1
(en)
|
2015-04-23 |
2016-10-27 |
Novartis Ag |
Treatment of cancer using chimeric antigen receptor and protein kinase a blocker
|
|
PL3286315T3
(pl)
|
2015-04-24 |
2021-11-02 |
F. Hoffmann-La Roche Ag |
Sposoby identyfikacji bakterii zawierających polipeptydy wiążące
|
|
MX2017013956A
(es)
|
2015-05-01 |
2018-09-05 |
Cocrystal Pharma Inc |
Analogos de nucleosidos para el tratamiento de la familia de virus flaviviridae y cancer.
|
|
EP3778640A1
(de)
|
2015-05-01 |
2021-02-17 |
Genentech, Inc. |
Maskierte anti-cd3-antikörper und verfahren zur verwendung
|
|
CN116196414A
(zh)
|
2015-05-11 |
2023-06-02 |
豪夫迈·罗氏有限公司 |
治疗狼疮性肾炎的组合物和方法
|
|
LT3294770T
(lt)
|
2015-05-12 |
2020-12-28 |
F. Hoffmann-La Roche Ag |
Vėžio gydymo ir diagnostikos būdai
|
|
DK3298021T3
(da)
|
2015-05-18 |
2019-08-05 |
Tolero Pharmaceuticals Inc |
Alvocidib-prodrugs, der har øget biotilgængelighed
|
|
EP3795679A1
(de)
|
2015-05-28 |
2021-03-24 |
Genentech, Inc. |
Zellbasierter test zum nachweis von anti-cd3-homodimeren
|
|
WO2016196381A1
(en)
|
2015-05-29 |
2016-12-08 |
Genentech, Inc. |
Pd-l1 promoter methylation in cancer
|
|
JP2018520658A
(ja)
|
2015-05-29 |
2018-08-02 |
ジェネンテック, インコーポレイテッド |
ヒト化抗エボラウイルス糖タンパク質抗体及びその使用
|
|
JP7144935B2
(ja)
|
2015-05-29 |
2022-09-30 |
ジェネンテック, インコーポレイテッド |
癌のための治療方法及び診断方法
|
|
JP2018516982A
(ja)
|
2015-05-31 |
2018-06-28 |
キュアジェニックス コーポレーション |
免疫療法用併用剤組成物
|
|
JP2018516933A
(ja)
|
2015-06-02 |
2018-06-28 |
ジェネンテック, インコーポレイテッド |
抗il−34抗体を使用して神経学的疾患を治療するための組成物及び方法
|
|
RU2732122C2
(ru)
|
2015-06-05 |
2020-09-11 |
Дженентек, Инк. |
Антитела против тау-белка и способы их применения
|
|
WO2016200835A1
(en)
|
2015-06-08 |
2016-12-15 |
Genentech, Inc. |
Methods of treating cancer using anti-ox40 antibodies and pd-1 axis binding antagonists
|
|
AU2016274585A1
(en)
|
2015-06-08 |
2017-12-14 |
Genentech, Inc. |
Methods of treating cancer using anti-OX40 antibodies
|
|
KR20180033502A
(ko)
|
2015-06-12 |
2018-04-03 |
알렉터 엘엘씨 |
항-cd33 항체 및 그의 사용 방법
|
|
US11174313B2
(en)
|
2015-06-12 |
2021-11-16 |
Alector Llc |
Anti-CD33 antibodies and methods of use thereof
|
|
JP2018524295A
(ja)
|
2015-06-15 |
2018-08-30 |
ジェネンテック, インコーポレイテッド |
抗体及び免疫複合体
|
|
EP3310811B1
(de)
|
2015-06-16 |
2021-06-16 |
Genentech, Inc. |
Anti-cd3-antikörper und verfahren zur verwendung
|
|
WO2016205520A1
(en)
|
2015-06-16 |
2016-12-22 |
Genentech, Inc. |
Humanized and affinity matured antibodies to fcrh5 and methods of use
|
|
WO2016205200A1
(en)
|
2015-06-16 |
2016-12-22 |
Genentech, Inc. |
Anti-cll-1 antibodies and methods of use
|
|
CN107787331B
(zh)
|
2015-06-17 |
2022-01-11 |
豪夫迈·罗氏有限公司 |
抗her2抗体和使用方法
|
|
AU2016278239B9
(en)
|
2015-06-17 |
2022-08-11 |
Allakos Inc. |
Methods and compositions for treating fibrotic diseases
|
|
WO2016205320A1
(en)
|
2015-06-17 |
2016-12-22 |
Genentech, Inc. |
Methods of treating locally advanced or metastatic breast cancers using pd-1 axis binding antagonists and taxanes
|
|
WO2016207245A1
(en)
|
2015-06-24 |
2016-12-29 |
F. Hoffmann-La Roche Ag |
Humanized anti-tau(ps422) antibodies and methods of use
|
|
KR20180021864A
(ko)
|
2015-06-29 |
2018-03-05 |
제넨테크, 인크. |
장기 이식에서 사용하기 위한 유형 ii 항-cd20 항체
|
|
WO2017001350A1
(en)
|
2015-06-29 |
2017-01-05 |
Ventana Medical Systems, Inc. |
Materials and methods for performing histochemical assays for human pro-epiregulin and amphiregulin
|
|
WO2017009751A1
(en)
|
2015-07-15 |
2017-01-19 |
Pfizer Inc. |
Pyrimidine derivatives
|
|
EP3878465A1
(de)
|
2015-07-29 |
2021-09-15 |
Novartis AG |
Kombinationstherapien mit antikörpermolekülen gegen tim-3
|
|
EP3964528A1
(de)
|
2015-07-29 |
2022-03-09 |
Novartis AG |
Kombinationstherapien mit antikörpermolekülen gegen lag-3
|
|
EP3331510A4
(de)
|
2015-08-03 |
2019-04-03 |
Tolero Pharmaceuticals, Inc. |
Kombinationstherapien zur behandlung von krebs
|
|
WO2017024171A1
(en)
|
2015-08-04 |
2017-02-09 |
Acceleron Pharma Inc. |
Methods for treating myeloproliferative disorders
|
|
TW202330904A
(zh)
|
2015-08-04 |
2023-08-01 |
美商再生元醫藥公司 |
補充牛磺酸之細胞培養基及用法
|
|
CN115960230A
(zh)
|
2015-08-07 |
2023-04-14 |
伊麦吉纳博公司 |
靶向分子的抗原结合构建体
|
|
CN105384825B
(zh)
|
2015-08-11 |
2018-06-01 |
南京传奇生物科技有限公司 |
一种基于单域抗体的双特异性嵌合抗原受体及其应用
|
|
WO2017040342A1
(en)
|
2015-08-28 |
2017-03-09 |
Genentech, Inc. |
Anti-hypusine antibodies and uses thereof
|
|
CN115960235A
(zh)
|
2015-08-28 |
2023-04-14 |
艾利妥 |
抗siglec-7抗体及其使用方法
|
|
EP3344806A4
(de)
|
2015-09-04 |
2019-03-20 |
OBI Pharma, Inc. |
Glycanarrays und verfahren zur verwendung
|
|
EP3328885A1
(de)
|
2015-09-11 |
2018-06-06 |
Bruce Andrien |
Rekombinantes glykosyliertes eculizumab und eculizumabvarianten
|
|
TW202342532A
(zh)
|
2015-09-18 |
2023-11-01 |
日商中外製藥股份有限公司 |
Il-8結合抗體及其用途
|
|
CA2999369C
(en)
|
2015-09-22 |
2023-11-07 |
Spring Bioscience Corporation |
Anti-ox40 antibodies and diagnostic uses thereof
|
|
CN116987187A
(zh)
|
2015-09-23 |
2023-11-03 |
豪夫迈·罗氏有限公司 |
抗-vegf抗体的优化的变体
|
|
WO2017058881A1
(en)
|
2015-09-28 |
2017-04-06 |
The Trustees Of Columbia University In The City Of New York |
Use of pentoxifylline with immune checkpoint-blockade therapies for the treatment of melanoma
|
|
CN108289953B
(zh)
|
2015-09-29 |
2022-03-11 |
细胞基因公司 |
Pd-1结合蛋白及其使用方法
|
|
AR106188A1
(es)
|
2015-10-01 |
2017-12-20 |
Hoffmann La Roche |
Anticuerpos anti-cd19 humano humanizados y métodos de utilización
|
|
WO2017055393A1
(en)
|
2015-10-02 |
2017-04-06 |
F. Hoffmann-La Roche Ag |
Anti-cd3xtim-3 bispecific t cell activating antigen binding molecules
|
|
BR112018000835A2
(pt)
|
2015-10-02 |
2018-09-11 |
Hoffmann La Roche |
molécula, um ou mais polinucleotídeos, um ou mais vetores, célula, método de produção da molécula, composição, uso da molécula, método de tratamento de uma doença e método para induzir a lise de uma célula-alvo
|
|
WO2017055314A1
(en)
|
2015-10-02 |
2017-04-06 |
F. Hoffmann-La Roche Ag |
Bispecific anti-cd19xcd3 t cell activating antigen binding molecules
|
|
WO2017055385A1
(en)
|
2015-10-02 |
2017-04-06 |
F. Hoffmann-La Roche Ag |
Anti-cd3xgd2 bispecific t cell activating antigen binding molecules
|
|
US20180282410A1
(en)
|
2015-10-02 |
2018-10-04 |
Hoffmann-La Roche Inc. |
Anti-cd3xrob04 bispecific t cell activating antigen binding molecules
|
|
CN107949574A
(zh)
|
2015-10-02 |
2018-04-20 |
豪夫迈·罗氏有限公司 |
双特异性t细胞活化性抗原结合分子
|
|
MA43345A
(fr)
|
2015-10-02 |
2018-08-08 |
Hoffmann La Roche |
Conjugués anticorps-médicaments de pyrrolobenzodiazépine et méthodes d'utilisation
|
|
WO2017055392A1
(en)
|
2015-10-02 |
2017-04-06 |
F. Hoffmann-La Roche Ag |
Anti-cd3xcd44v6 bispecific t cell activating antigen binding molecules
|
|
US20170247454A1
(en)
|
2015-10-02 |
2017-08-31 |
Hoffmann-La Roche Inc. |
Anti-pd1 antibodies and methods of use
|
|
BR112018002570A2
(pt)
|
2015-10-02 |
2018-10-16 |
Hoffmann La Roche |
molécula de ligação ao antígeno biespecífica, anticorpo biespecífico, polinucleotídeos, anticorpo que se liga especificamente ao ox40, composição farmacêutica e método para inibir o crescimento de células tumorais em um indivíduo
|
|
ES2886569T3
(es)
|
2015-10-02 |
2021-12-20 |
Hoffmann La Roche |
Anticuerpos biespecíficos específicos para PD1 y TIM3
|
|
AR106365A1
(es)
|
2015-10-02 |
2018-01-10 |
Hoffmann La Roche |
Moléculas biespecíficas de unión a antígeno activadoras de células t
|
|
KR20180068999A
(ko)
|
2015-10-06 |
2018-06-22 |
알렉터 엘엘씨 |
항-trem2 항체 및 그의 사용방법
|
|
EP3359572A2
(de)
|
2015-10-06 |
2018-08-15 |
H. Hoffnabb-La Roche Ag |
Verfahren zur behandlung von multipler sklerose
|
|
JP2018530574A
(ja)
|
2015-10-07 |
2018-10-18 |
アレクシオン ファーマシューティカルズ, インコーポレイテッド |
患者の加齢黄斑変性を治療する方法
|
|
EP3359568B1
(de)
|
2015-10-07 |
2022-03-09 |
F. Hoffmann-La Roche AG |
Bispezifische antikörper mit vierwertigkeit für einen co-stimulierenden tnf-rezeptor
|
|
MA43354A
(fr)
|
2015-10-16 |
2018-08-22 |
Genentech Inc |
Conjugués médicamenteux à pont disulfure encombré
|
|
MA45326A
(fr)
|
2015-10-20 |
2018-08-29 |
Genentech Inc |
Conjugués calichéamicine-anticorps-médicament et procédés d'utilisation
|
|
US10604577B2
(en)
|
2015-10-22 |
2020-03-31 |
Allakos Inc. |
Methods and compositions for treating systemic mastocytosis
|
|
WO2017070554A1
(en)
|
2015-10-23 |
2017-04-27 |
Fred Hutchinson Cancer Research Center |
Methods to create chemically-induced dimerizing protein systems for regulation of cellular events
|
|
WO2017074774A1
(en)
|
2015-10-28 |
2017-05-04 |
Yale University |
Humanized anti-dkk2 antibody and uses thereof
|
|
CN108431041B
(zh)
|
2015-10-29 |
2022-08-16 |
艾利妥 |
抗siglec-9抗体及其使用方法
|
|
EP3184547A1
(de)
|
2015-10-29 |
2017-06-28 |
F. Hoffmann-La Roche AG |
Anti-tpbg-antikörper und verfahren zur verwendung
|
|
IL295756A
(en)
|
2015-10-29 |
2022-10-01 |
Hoffmann La Roche |
Antibodies against fc-variable region and methods of use
|
|
CA3001362C
(en)
|
2015-10-30 |
2020-10-13 |
Genentech, Inc. |
Anti-htra1 antibodies and methods of use thereof
|
|
EP3368074A2
(de)
|
2015-10-30 |
2018-09-05 |
Hoffmann-La Roche AG |
Anti-faktor-d-antikörper und -konjugate
|
|
CN108472382A
(zh)
|
2015-10-30 |
2018-08-31 |
豪夫迈·罗氏有限公司 |
抗-因子d抗体变体缀合物及其用途
|
|
WO2017079768A1
(en)
|
2015-11-08 |
2017-05-11 |
Genentech, Inc. |
Methods of screening for multispecific antibodies
|
|
EP3380121B1
(de)
|
2015-11-23 |
2023-12-20 |
Acceleron Pharma Inc. |
Actrii-antagonist zur verwendung in der behandlung von augenerkrankungen
|
|
CN106729743B
(zh)
|
2015-11-23 |
2021-09-21 |
四川科伦博泰生物医药股份有限公司 |
抗ErbB2抗体-药物偶联物及其组合物、制备方法和应用
|
|
SG11201804360XA
(en)
|
2015-12-03 |
2018-06-28 |
Agios Pharmaceuticals Inc |
Mat2a inhibitors for treating mtap null cancer
|
|
EP3178848A1
(de)
|
2015-12-09 |
2017-06-14 |
F. Hoffmann-La Roche AG |
Type ii anti-cd20 antikörper zur verringerung der bildung von antikörpern gegen medikamente
|
|
CA2997406A1
(en)
|
2015-12-09 |
2017-06-15 |
F. Hoffmann-La Roche Ag |
Type ii anti-cd20 antibody for reducing formation of anti-drug antibodies or cytokine release
|
|
EA201891186A1
(ru)
|
2015-12-15 |
2018-12-28 |
Джилид Сайэнс, Инк. |
Антитела, нейтрализующие вирус иммунодефицита человека
|
|
MX2018007423A
(es)
|
2015-12-17 |
2018-11-09 |
Novartis Ag |
Moleculas de anticuerpo que se unen a pd-1 y usos de las mismas.
|
|
JP2019502695A
(ja)
|
2015-12-17 |
2019-01-31 |
ノバルティス アーゲー |
PD−1に対する抗体分子とC−Met阻害剤との組合せおよびその使用
|
|
EP4342529A2
(de)
|
2015-12-18 |
2024-03-27 |
Chugai Seiyaku Kabushiki Kaisha |
Anti-c5-antikörper und verfahren zur verwendung
|
|
BR112018013071A2
(pt)
|
2015-12-30 |
2018-12-11 |
Genentech Inc |
uso de derivados de triptofano para formulações de proteínas
|
|
JP7008023B2
(ja)
|
2015-12-30 |
2022-01-25 |
ジェネンテック, インコーポレイテッド |
低減されたポリソルベート分解を有する製剤
|
|
US20200270365A1
(en)
|
2016-01-05 |
2020-08-27 |
Jiangsu Hengrui Medicine Co., Ltd. |
Pcsk9 antibody, antigen-binding fragment thereof, and medical uses thereof
|
|
BR112018011029A2
(pt)
|
2016-01-08 |
2018-11-21 |
Hoffmann La Roche |
métodos para tratar ou atrasar a progressão do câncer e para melhorar a função imune em um indivíduo com câncer, usos de um antagonista de ligação e de um anticorpo biespecífico, composições e kits
|
|
US20190016791A1
(en)
|
2016-01-20 |
2019-01-17 |
Genentech, Inc. |
High dose treatments for alzheimer's disease
|
|
US20210198368A1
(en)
|
2016-01-21 |
2021-07-01 |
Novartis Ag |
Multispecific molecules targeting cll-1
|
|
WO2017132279A1
(en)
|
2016-01-25 |
2017-08-03 |
Genentech, Inc. |
Methods for assaying t-cell dependent bispecific antibodies
|
|
CN109071625A
(zh)
|
2016-02-04 |
2018-12-21 |
柯瑞斯公司 |
平滑化突变体和其使用方法
|
|
US10982136B2
(en)
|
2016-02-26 |
2021-04-20 |
The Regents Of The University Of California |
Ligand-sensitized lanthanide nanocrystals as ultraviolet downconverters
|
|
KR20180119632A
(ko)
|
2016-02-29 |
2018-11-02 |
제넨테크, 인크. |
암에 대한 치료 및 진단 방법
|
|
WO2017152102A2
(en)
|
2016-03-04 |
2017-09-08 |
Alector Llc |
Anti-trem1 antibodies and methods of use thereof
|
|
JP2019513347A
(ja)
|
2016-03-04 |
2019-05-30 |
ノバルティス アーゲー |
複数のキメラ抗原受容体(car)分子を発現する細胞およびその使用
|
|
EP3216458A1
(de)
|
2016-03-07 |
2017-09-13 |
Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. |
Modifizierter vaskulärer endothelialen wachstumsfaktor a (vegf-a) und dessen medizinische verwendung
|
|
US10336784B2
(en)
|
2016-03-08 |
2019-07-02 |
Academia Sinica |
Methods for modular synthesis of N-glycans and arrays thereof
|
|
PL3430054T3
(pl)
|
2016-03-15 |
2022-05-23 |
Chugai Seiyaku Kabushiki Kaisha |
Sposoby leczenia nowotworów z zastosowaniem antagonistów wiązania z osią PD-1 i przeciwciał anty-GPC3
|
|
WO2017161206A1
(en)
|
2016-03-16 |
2017-09-21 |
Halozyme, Inc. |
Conjugates containing conditionally active antibodies or antigen-binding fragments thereof, and methods of use
|
|
DK3433280T3
(da)
|
2016-03-22 |
2023-06-19 |
Hoffmann La Roche |
Protease-aktiverede T-celle-bispecifikke molekyler
|
|
MA43724B1
(fr)
|
2016-03-22 |
2023-06-28 |
Hoffmann La Roche |
Molécules bispécifiques de cellules t activées par une protéase
|
|
WO2017165683A1
(en)
|
2016-03-23 |
2017-09-28 |
Novartis Ag |
Cell secreted minibodies and uses thereof
|
|
JP6943872B2
(ja)
|
2016-03-25 |
2021-10-06 |
ジェネンテック, インコーポレイテッド |
多重全抗体及び抗体複合体化薬物定量化アッセイ
|
|
US10980894B2
(en)
|
2016-03-29 |
2021-04-20 |
Obi Pharma, Inc. |
Antibodies, pharmaceutical compositions and methods
|
|
EP3231813A1
(de)
|
2016-03-29 |
2017-10-18 |
F. Hoffmann-La Roche AG |
Trimere kostimulatorische tnf-familien-ligandenhaltige antigenbindende moleküle
|
|
TWI780045B
(zh)
|
2016-03-29 |
2022-10-11 |
台灣浩鼎生技股份有限公司 |
抗體、醫藥組合物及方法
|
|
US20170319688A1
(en)
|
2016-04-14 |
2017-11-09 |
Genentech, Inc. |
Anti-rspo3 antibodies and methods of use
|
|
CA3019921A1
(en)
|
2016-04-15 |
2017-10-19 |
Genentech, Inc. |
Methods for monitoring and treating cancer
|
|
KR102606938B1
(ko)
|
2016-04-15 |
2023-11-29 |
바이오아트라, 인코퍼레이티드 |
항 Axl항체 및 이의 면역접합체와 이것들의 용도
|
|
JP2019515670A
(ja)
|
2016-04-15 |
2019-06-13 |
ジェネンテック, インコーポレイテッド |
がんをモニタリングし治療するための方法
|
|
DK3443096T3
(da)
|
2016-04-15 |
2023-05-22 |
Novartis Ag |
Sammensætninger og fremgangsmåder til selektiv ekspression af kimære antigenreceptorer
|
|
KR20180128496A
(ko)
|
2016-04-22 |
2018-12-03 |
오비아이 파머 인코퍼레이티드 |
글로보 계열 항원을 통한 면역 활성화 또는 면역 조정에 의한 암 면역요법
|
|
PE20181890A1
(es)
|
2016-05-02 |
2018-12-11 |
Hoffmann La Roche |
Contorsbody - un ligante de diana monocatenario
|
|
US20190151346A1
(en)
|
2016-05-10 |
2019-05-23 |
INSERM (Institute National de la Santé et de la Recherche Médicale) |
Combinations therapies for the treatment of cancer
|
|
CN109071640B
(zh)
|
2016-05-11 |
2022-10-18 |
豪夫迈·罗氏有限公司 |
经修饰抗生腱蛋白抗体及使用方法
|
|
EP3243836A1
(de)
|
2016-05-11 |
2017-11-15 |
F. Hoffmann-La Roche AG |
C-terminal-fusionierte antigenbindende moleküle mit ligandentrimer der tnf-familie
|
|
WO2017194442A1
(en)
|
2016-05-11 |
2017-11-16 |
F. Hoffmann-La Roche Ag |
Antigen binding molecules comprising a tnf family ligand trimer and a tenascin binding moiety
|
|
MX2018013306A
(es)
|
2016-05-13 |
2019-01-30 |
Bioatla Llc |
Anticuerpos anti-ror2, fragmentos de anticuerpos, sus inmunoconjugados y usos de los mismos.
|
|
EP3243832A1
(de)
|
2016-05-13 |
2017-11-15 |
F. Hoffmann-La Roche AG |
Antigenbindende moleküle mit einem ligandentrimer der tnf-familie und pd1-bindungsteil
|
|
CA3024465A1
(en)
|
2016-05-17 |
2017-11-23 |
Genentech, Inc. |
Stromal gene signatures for diagnosis and use in immunotherapy
|
|
EP3458101B1
(de)
|
2016-05-20 |
2020-12-30 |
H. Hoffnabb-La Roche Ag |
Protac-antikörper-konjugate und verfahren zur verwendung
|
|
JP7022080B2
(ja)
|
2016-05-27 |
2022-02-17 |
ジェネンテック, インコーポレイテッド |
部位特異的抗体-薬物複合体の特徴付けのための生化学分析的方法
|
|
EP3464375A2
(de)
|
2016-06-02 |
2019-04-10 |
Novartis AG |
Therapeutische schemata für chimäre antigenrezeptor(car)-exprimierende zellen
|
|
BR112019022558A2
(pt)
|
2016-06-02 |
2020-05-19 |
Hoffmann La Roche |
anticorpos, métodos para tratar ou retardar a progressão de uma doença proliferativa e para tratar ou retardar a progressão do câncer em um indivíduo, composições farmacêuticas, kit, usos de uma combinação de um anticorpo anti-cd20 e de um anticorpo e invenção
|
|
EP3252078A1
(de)
|
2016-06-02 |
2017-12-06 |
F. Hoffmann-La Roche AG |
Typ ii anti-cd20 antikörper und anti-cd20/cd3 bispecific antikörper zur behandlung von krebs
|
|
WO2017207694A1
(en)
|
2016-06-02 |
2017-12-07 |
Kohlmann Angelica |
Antibodies that bind to human anti-müllerian hormone (amh) and their uses
|
|
CN109476648B
(zh)
|
2016-06-06 |
2022-09-13 |
豪夫迈·罗氏有限公司 |
司维司群抗体-药物缀合物和使用方法
|
|
SG11201810777WA
(en)
|
2016-06-17 |
2018-12-28 |
Genentech Inc |
Purification of multispecific antibodies
|
|
WO2017223405A1
(en)
|
2016-06-24 |
2017-12-28 |
Genentech, Inc. |
Anti-polyubiquitin multispecific antibodies
|
|
WO2018011691A1
(en)
|
2016-07-12 |
2018-01-18 |
Nestec S.A. |
Competitive immunoassay methods
|
|
WO2018014001A1
(en)
|
2016-07-14 |
2018-01-18 |
Fred Hutchinson Cancer Research Center |
Multiple bi-specific binding domain constructs with different epitope binding to treat cancer
|
|
EP3496739B1
(de)
|
2016-07-15 |
2021-04-28 |
Acceleron Pharma Inc. |
Zusammensetzungen enthaltend actriia-polypeptide zur verwendung bei der behandlung von pulmonaler hypertonie
|
|
JP7219376B2
(ja)
|
2016-07-15 |
2023-02-08 |
ノバルティス アーゲー |
キメラ抗原受容体をキナーゼ阻害薬と併用して使用したサイトカイン放出症候群の治療及び予防
|
|
WO2018014260A1
(en)
|
2016-07-20 |
2018-01-25 |
Nanjing Legend Biotech Co., Ltd. |
Multispecific antigen binding proteins and methods of use thereof
|
|
US20180050085A1
(en)
|
2016-07-27 |
2018-02-22 |
Acceleron Pharma Inc. |
Methods and compositions for treating myelofibrosis
|
|
AU2017302038B2
(en)
|
2016-07-27 |
2024-03-21 |
Obi Pharma, Inc. |
Immunogenic/therapeutic glycan compositions and uses thereof
|
|
JP2019523301A
(ja)
|
2016-07-28 |
2019-08-22 |
ノバルティス アーゲー |
キメラ抗原受容体とpd−1阻害薬との併用療法
|
|
TWI786054B
(zh)
|
2016-07-29 |
2022-12-11 |
台灣浩鼎生技股份有限公司 |
人類抗體、醫藥組合物、及其方法
|
|
MX2018015721A
(es)
|
2016-07-29 |
2019-05-27 |
Chugai Pharmaceutical Co Ltd |
Anticuerpos biespecificos que exhiben actividad de funcion de cofactor fviii alternativa mejorada.
|
|
AU2017306267A1
(en)
|
2016-08-01 |
2019-02-14 |
Novartis Ag |
Treatment of cancer using a chimeric antigen receptor in combination with an inhibitor of a pro-M2 macrophage molecule
|
|
WO2018025982A1
(ja)
|
2016-08-05 |
2018-02-08 |
中外製薬株式会社 |
Il-8関連疾患の治療用又は予防用組成物
|
|
EP3494139B1
(de)
|
2016-08-05 |
2022-01-12 |
F. Hoffmann-La Roche AG |
Multivalente und multiepitopische anitikörper mit agonistischer wirkung und verfahren zur verwendung
|
|
WO2018029124A1
(en)
|
2016-08-08 |
2018-02-15 |
F. Hoffmann-La Roche Ag |
Therapeutic and diagnostic methods for cancer
|
|
JP7093767B2
(ja)
|
2016-08-11 |
2022-06-30 |
ジェネンテック, インコーポレイテッド |
ピロロベンゾジアゼピンプロドラッグ及びその抗体コンジュゲート
|
|
AU2017312540B2
(en)
|
2016-08-15 |
2023-02-02 |
Genentech, Inc. |
Chromatography method for quantifying a non-ionic surfactant in a composition comprising the non-ionic surfactant and a polypeptide
|
|
KR102588027B1
(ko)
|
2016-08-22 |
2023-10-12 |
초 파마 인크. |
항체, 결합 단편 및 사용 방법
|
|
WO2018044812A2
(en)
|
2016-08-29 |
2018-03-08 |
Fred Hutchinson Cancer Research Center |
Chelating platform for delivery of radionuclides
|
|
BR112019003408A2
(pt)
|
2016-08-31 |
2019-06-25 |
Oncotherapy Science Inc |
anticorpo monoclonal contra a melk e utilização da mesma
|
|
JP7018210B2
(ja)
|
2016-09-06 |
2022-02-10 |
ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア |
ヒドロキシピリドネートアクチニド/ランタニド体外除去剤の製剤
|
|
WO2018049083A1
(en)
|
2016-09-07 |
2018-03-15 |
The Regents Of The University Of California |
Antibodies to oxidation-specific epitopes
|
|
SG10201607778XA
(en)
|
2016-09-16 |
2018-04-27 |
Chugai Pharmaceutical Co Ltd |
Anti-Dengue Virus Antibodies, Polypeptides Containing Variant Fc Regions, And Methods Of Use
|
|
JP2019531284A
(ja)
|
2016-09-19 |
2019-10-31 |
セルジーン コーポレイション |
Pd−1結合タンパク質を使用して免疫障害を治療する方法
|
|
EP3515943A4
(de)
|
2016-09-19 |
2020-05-06 |
Celgene Corporation |
Verfahren zur behandlung von vitiligo mithilfe von pd-1-bindenden proteinen
|
|
CN116731197A
(zh)
|
2016-09-19 |
2023-09-12 |
豪夫迈·罗氏有限公司 |
基于补体因子的亲和层析
|
|
JOP20190009A1
(ar)
|
2016-09-21 |
2019-01-27 |
Alx Oncology Inc |
أجسام مضادة ضد بروتين ألفا منظم للإشارات وطرق استخدامها
|
|
TWI787203B
(zh)
|
2016-09-23 |
2022-12-21 |
美商建南德克公司 |
Il-13拮抗劑用於治療異位性皮炎之用途
|
|
EP3519437B1
(de)
|
2016-09-30 |
2021-09-08 |
F. Hoffmann-La Roche AG |
Bispezifiche antikörper gegen p95her2
|
|
JP7050770B2
(ja)
|
2016-10-05 |
2022-04-08 |
エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト |
抗体薬物コンジュゲートの調製方法
|
|
AU2017340504A1
(en)
|
2016-10-05 |
2019-04-11 |
Acceleron Pharma, Inc. |
Compositions and method for treating kidney disease
|
|
TWI762516B
(zh)
|
2016-10-06 |
2022-05-01 |
日商腫瘤療法 科學股份有限公司 |
針對fzd10之單株抗體及其用途
|
|
CA3038712A1
(en)
|
2016-10-06 |
2018-04-12 |
Genentech, Inc. |
Therapeutic and diagnostic methods for cancer
|
|
MX2019003886A
(es)
|
2016-10-07 |
2019-08-05 |
Novartis Ag |
Receptores de antigenos quimericos para el tratamiento del cancer.
|
|
WO2018068201A1
(en)
|
2016-10-11 |
2018-04-19 |
Nanjing Legend Biotech Co., Ltd. |
Single-domain antibodies and variants thereof against ctla-4
|
|
EP3529619B1
(de)
|
2016-10-19 |
2021-06-30 |
Alexion Pharmaceuticals, Inc. |
Verfahren zur quantifizierung von ungebundenem c5a in einer probe
|
|
EP3529618B1
(de)
|
2016-10-19 |
2020-12-02 |
Alexion Pharmaceuticals, Inc. |
Verfahren zur quantifizierung von ungebundenem c5 in einer probe
|
|
EP3532496A1
(de)
|
2016-10-28 |
2019-09-04 |
Banyan Biomarkers, Inc. |
Antikörper gegen ubiquitin c-terminale hydrolase l1 (uch-l1) und gliales fibrilläres saures protein (gfap) und verwandte verfahren
|
|
JP2019535250A
(ja)
|
2016-10-29 |
2019-12-12 |
ジェネンテック, インコーポレイテッド |
抗mic抗体及び使用方法
|
|
EP3541843A1
(de)
|
2016-11-15 |
2019-09-25 |
Genentech, Inc. |
Dosierung zur behandlung mit anti-cd20/anti-cd3-bispezifischen antikörpern
|
|
US11279694B2
(en)
|
2016-11-18 |
2022-03-22 |
Sumitomo Dainippon Pharma Oncology, Inc. |
Alvocidib prodrugs and their use as protein kinase inhibitors
|
|
TW201829463A
(zh)
|
2016-11-18 |
2018-08-16 |
瑞士商赫孚孟拉羅股份公司 |
抗hla-g抗體及其用途
|
|
JOP20190100A1
(ar)
|
2016-11-19 |
2019-05-01 |
Potenza Therapeutics Inc |
بروتينات ربط مولد ضد مضاد لـ gitr وطرق استخدامها
|
|
CN110290800A
(zh)
|
2016-11-21 |
2019-09-27 |
台湾浩鼎生技股份有限公司 |
缀合生物分子、医药组合物及方法
|
|
CN110290801B
(zh)
|
2016-12-07 |
2024-01-26 |
基因泰克公司 |
抗tau抗体和使用方法
|
|
TWI789371B
(zh)
|
2016-12-07 |
2023-01-11 |
美商建南德克公司 |
抗-tau抗體及使用方法
|
|
WO2018108759A1
(en)
|
2016-12-13 |
2018-06-21 |
F. Hoffmann-La Roche Ag |
Method to determine the presence of a target antigen in a tumor sample
|
|
AU2017379847B2
(en)
|
2016-12-19 |
2022-05-26 |
Sumitomo Pharma Oncology, Inc. |
Profiling peptides and methods for sensitivity profiling
|
|
WO2018114754A1
(en)
|
2016-12-19 |
2018-06-28 |
F. Hoffmann-La Roche Ag |
Combination therapy with targeted 4-1bb (cd137) agonists
|
|
EP3559034B1
(de)
|
2016-12-20 |
2020-12-02 |
H. Hoffnabb-La Roche Ag |
Kombinationstherapie von anti-cd20/anti-cd3-bispezifischen antikörpern und 4-1bb (cd137)-agonisten
|
|
JOP20190134A1
(ar)
|
2016-12-23 |
2019-06-02 |
Potenza Therapeutics Inc |
بروتينات رابطة لمولد ضد مضادة لنيوروبيلين وطرق استخدامها
|
|
BR112019013189A2
(pt)
|
2017-01-03 |
2019-12-10 |
Hoffmann La Roche |
moléculas de ligação ao antígeno biespecífica, polinucleotídeo, célula hospedeira, método de produção da molécula de ligação ao antígeno biespecífica, composição farmacêutica, uso, métodos para inibir o crescimento de células tumorais em um indivíduo e para tratar o câncer ou uma doença infecciosa
|
|
TW201825515A
(zh)
|
2017-01-04 |
2018-07-16 |
美商伊繆諾金公司 |
Met抗體以及其免疫結合物及用途
|
|
CN110709419B
(zh)
|
2017-01-06 |
2023-11-28 |
博奥信生物技术(南京)有限公司 |
Erbb2抗体及其用途
|
|
EP4043485A1
(de)
|
2017-01-26 |
2022-08-17 |
Novartis AG |
Cd28-zusammensetzungen und verfahren für chimäre antigenrezeptortherapie
|
|
US11266745B2
(en)
|
2017-02-08 |
2022-03-08 |
Imaginab, Inc. |
Extension sequences for diabodies
|
|
CN110494453B
(zh)
|
2017-02-10 |
2023-05-26 |
豪夫迈·罗氏有限公司 |
抗类胰蛋白酶抗体、其组合物及其用途
|
|
WO2018152496A1
(en)
|
2017-02-17 |
2018-08-23 |
The Usa, As Represented By The Secretary, Dept. Of Health And Human Services |
Compositions and methods for the diagnosis and treatment of zika virus infection
|
|
US20200048359A1
(en)
|
2017-02-28 |
2020-02-13 |
Novartis Ag |
Shp inhibitor compositions and uses for chimeric antigen receptor therapy
|
|
MX2019010295A
(es)
|
2017-03-01 |
2019-11-21 |
Genentech Inc |
Métodos de diagnóstico y terapéuticos para el cáncer.
|
|
WO2018158719A1
(en)
|
2017-03-02 |
2018-09-07 |
Novartis Ag |
Engineered heterodimeric proteins
|
|
TWI808963B
(zh)
|
2017-03-22 |
2023-07-21 |
法商賽諾菲公司 |
使用人類化抗cxcr5抗體治療狼瘡
|
|
AR111249A1
(es)
|
2017-03-22 |
2019-06-19 |
Genentech Inc |
Composiciones de anticuerpo optimizadas para el tratamiento de trastornos oculares
|
|
CN110891611B
(zh)
|
2017-03-22 |
2024-03-29 |
阿森迪斯制药公司 |
水凝胶交联透明质酸前药组合物和方法
|
|
TW201900673A
(zh)
|
2017-03-27 |
2019-01-01 |
瑞士商赫孚孟拉羅股份公司 |
改良之抗原結合受體
|
|
MA49355A
(fr)
|
2017-03-27 |
2020-02-05 |
Hoffmann La Roche |
Formats de récepteurs de liaison d'antigène améliorés
|
|
MX2019011423A
(es)
|
2017-03-28 |
2019-11-01 |
Genentech Inc |
Metodos de tratamiento de enfermedades neurodegenerativas.
|
|
WO2018178074A1
(en)
|
2017-03-29 |
2018-10-04 |
F. Hoffmann-La Roche Ag |
Trimeric antigen binding molecules specific for a costimulatory tnf receptor
|
|
WO2018178055A1
(en)
|
2017-03-29 |
2018-10-04 |
F. Hoffmann-La Roche Ag |
Bispecific antigen binding molecule for a costimulatory tnf receptor
|
|
WO2018178076A1
(en)
|
2017-03-29 |
2018-10-04 |
F. Hoffmann-La Roche Ag |
Bispecific antigen binding molecule for a costimulatory tnf receptor
|
|
JOP20190203A1
(ar)
|
2017-03-30 |
2019-09-03 |
Potenza Therapeutics Inc |
بروتينات رابطة لمولد ضد مضادة لـ tigit وطرق استخدامها
|
|
WO2018184965A1
(en)
|
2017-04-03 |
2018-10-11 |
F. Hoffmann-La Roche Ag |
Immunoconjugates of il-2 with an anti-pd-1 and tim-3 bispecific antibody
|
|
BR112019018767A2
(pt)
|
2017-04-03 |
2020-05-05 |
Hoffmann La Roche |
anticorpos, molécula de ligação ao antígeno biespecífica, um ou mais polinucleotídeos isolados, um ou mais vetores, célula hospedeira, método para produzir um anticorpo, composição farmacêutica, usos, método para tratar uma doença em um indivíduo e invenção
|
|
RU2761377C2
(ru)
|
2017-04-03 |
2021-12-07 |
Ф. Хоффманн-Ля Рош Аг |
Иммуноконъюгаты антитела к pd-1 с мутантом il-2 или с il-15
|
|
TWI704158B
(zh)
|
2017-04-04 |
2020-09-11 |
瑞士商赫孚孟拉羅股份公司 |
能夠特異性結合至cd40及fap之新穎雙特異性抗原結合分子
|
|
AU2018247794A1
(en)
|
2017-04-05 |
2019-08-22 |
F. Hoffmann-La Roche Ag |
Bispecific antibodies specifically binding to PD1 and LAG3
|
|
HUE060019T2
(hu)
|
2017-04-05 |
2023-01-28 |
Hoffmann La Roche |
Anti-LAG3 antitestek
|
|
RU2665790C1
(ru)
|
2017-04-17 |
2018-09-04 |
Закрытое Акционерное Общество "Биокад" |
Моноклональное антитело к pd-l1
|
|
CN108728444A
(zh)
|
2017-04-18 |
2018-11-02 |
长春华普生物技术股份有限公司 |
免疫调节性多核苷酸及其应用
|
|
SG11201909048TA
(en)
|
2017-04-21 |
2019-11-28 |
Genentech Inc |
Use of klk5 antagonists for treatment of a disease
|
|
EP3615569A1
(de)
|
2017-04-25 |
2020-03-04 |
The U.S.A. As Represented By The Secretary, Department Of Health And Human Services |
Antikörper und verfahren zur diagnose und behandlung von epstein-barr-virus-infektionen
|
|
EP3615055A1
(de)
|
2017-04-28 |
2020-03-04 |
Novartis AG |
Zellen, die einen auf bcma abzielenden chimären antigenrezeptor exprimieren, und kombinationsbehandlung mit einem gamma-sekretase-inhibitor
|
|
US20200179511A1
(en)
|
2017-04-28 |
2020-06-11 |
Novartis Ag |
Bcma-targeting agent, and combination therapy with a gamma secretase inhibitor
|
|
KR20200016232A
(ko)
|
2017-05-05 |
2020-02-14 |
알라코스 인크. |
알레르기성 안구 질환을 치료하기 위한 방법 및 조성물
|
|
US11168129B2
(en)
|
2017-05-15 |
2021-11-09 |
University Of Rochester |
Broadly neutralizing anti-influenza human monoclonal antibody and uses thereof
|
|
US11359014B2
(en)
|
2017-05-16 |
2022-06-14 |
Alector Llc |
Anti-siglec-5 antibodies and methods of use thereof
|
|
WO2018215535A1
(en)
|
2017-05-23 |
2018-11-29 |
Helmholtz Zentrum München - Deutsches Forschungszentrum für Gesundheit und Umwelt (GmbH) |
Novel cd73 antibody, preparation and uses thereof
|
|
EP3409322A1
(de)
|
2017-06-01 |
2018-12-05 |
F. Hoffmann-La Roche AG |
Behandlungsverfahren
|
|
US11312783B2
(en)
|
2017-06-22 |
2022-04-26 |
Novartis Ag |
Antibody molecules to CD73 and uses thereof
|
|
US20200223924A1
(en)
|
2017-06-27 |
2020-07-16 |
Novartis Ag |
Dosage regimens for anti-tim-3 antibodies and uses thereof
|
|
WO2019000223A1
(en)
|
2017-06-27 |
2019-01-03 |
Nanjing Legend Biotech Co., Ltd. |
ENABLERS OF IMMUNE EFFECTOR CELLS OF CHIMERIC ANTIBODIES AND METHODS OF USE THEREOF
|
|
AU2018301393A1
(en)
|
2017-07-11 |
2020-02-06 |
Compass Therapeutics Llc |
Agonist antibodies that bind human CD137 and uses thereof
|
|
WO2019018629A1
(en)
|
2017-07-19 |
2019-01-24 |
The Usa, As Represented By The Secretary, Dept. Of Health And Human Services |
ANTIBODIES AND METHODS FOR DIAGNOSING AND TREATING INFECTION WITH HEPATITIS B VIRUS
|
|
CA3070095A1
(en)
|
2017-07-20 |
2019-01-24 |
Novartis Ag |
Dosage regimens of anti-lag-3 antibodies and uses thereof
|
|
AU2018304458B2
(en)
|
2017-07-21 |
2021-12-09 |
Foundation Medicine, Inc. |
Therapeutic and diagnostic methods for cancer
|
|
MX2020000957A
(es)
|
2017-07-26 |
2020-07-22 |
Forty Seven Inc |
Anticuerpos anti-sirp-alfa y metodos relacionados.
|
|
BR112020000566A2
(pt)
|
2017-07-28 |
2020-07-21 |
F. Hoffmann-La Roche Ag |
formulação farmacêutica, uso da formulação e invenção
|
|
TW202342547A
(zh)
|
2017-08-03 |
2023-11-01 |
美商阿列克特有限責任公司 |
抗trem2抗體及其使用方法
|
|
AU2018310985A1
(en)
|
2017-08-03 |
2019-11-07 |
Alector Llc |
Anti-CD33 antibodies and methods of use thereof
|
|
JP2020530297A
(ja)
|
2017-08-11 |
2020-10-22 |
ジェネンテック, インコーポレイテッド |
抗cd8抗体及びその使用
|
|
JP7196160B2
(ja)
|
2017-09-12 |
2022-12-26 |
スミトモ ファーマ オンコロジー, インコーポレイテッド |
Mcl-1阻害剤アルボシジブを用いた、bcl-2阻害剤に対して非感受性である癌の治療レジメン
|
|
EP3684413A1
(de)
|
2017-09-20 |
2020-07-29 |
Chugai Seiyaku Kabushiki Kaisha |
Dosierungsschema für kombinationstherapie unter verwendung von pd-1-achse-bindenden antagonisten und gegen gpc3 gerichteten wirkstoff
|
|
KR20200049764A
(ko)
|
2017-09-29 |
2020-05-08 |
추가이 세이야쿠 가부시키가이샤 |
혈액 응고 제 viii 인자(fviii) 보인자 기능 대체 활성을 갖는 다중특이성 항원 결합 분자 및 당해 분자를 유효 성분으로서 함유하는 약학적 제제
|
|
RU2698048C2
(ru)
|
2017-10-03 |
2019-08-21 |
Закрытое Акционерное Общество "Биокад" |
МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К IL-5Rα
|
|
EA039662B1
(ru)
|
2017-10-03 |
2022-02-24 |
Закрытое Акционерное Общество "Биокад" |
Антитела, специфичные к cd47 и pd-l1
|
|
US20200237766A1
(en)
|
2017-10-13 |
2020-07-30 |
Tolero Pharmaceuticals, Inc. |
Pkm2 activators in combination with reactive oxygen species for treatment of cancer
|
|
TW201932142A
(zh)
|
2017-10-20 |
2019-08-16 |
瑞士商赫孚孟拉羅股份公司 |
自單特異性抗體產生多特異性抗體之方法
|
|
MX2020004100A
(es)
|
2017-10-30 |
2020-07-24 |
Hoffmann La Roche |
Metodo para generacion in vivo de anticuerpos multiespecificos a partir de anticuerpos monoespecificos.
|
|
US11718679B2
(en)
|
2017-10-31 |
2023-08-08 |
Compass Therapeutics Llc |
CD137 antibodies and PD-1 antagonists and uses thereof
|
|
TWI829658B
(zh)
|
2017-11-01 |
2024-01-21 |
瑞士商赫孚孟拉羅股份公司 |
雙特異性2+1康特斯體(Contorsbody)
|
|
EP3704155A2
(de)
|
2017-11-01 |
2020-09-09 |
F. Hoffmann-La Roche AG |
Kombinationstherapie mit gezielten ox40-agonisten
|
|
CN111246884A
(zh)
|
2017-11-01 |
2020-06-05 |
豪夫迈·罗氏有限公司 |
新颖的含有tnf家族配体三聚体的抗原结合分子
|
|
EP3704146B1
(de)
|
2017-11-01 |
2021-12-15 |
F. Hoffmann-La Roche AG |
Trifab-contorsbody
|
|
WO2019086394A1
(en)
|
2017-11-01 |
2019-05-09 |
F. Hoffmann-La Roche Ag |
The compbody - a multivalent target binder
|
|
KR20200075860A
(ko)
|
2017-11-06 |
2020-06-26 |
제넨테크, 인크. |
암의 진단 및 치료 방법
|
|
CA3081602A1
(en)
|
2017-11-16 |
2019-05-23 |
Novartis Ag |
Combination therapies
|
|
WO2019100052A2
(en)
|
2017-11-20 |
2019-05-23 |
Compass Therapeutics Llc |
Cd137 antibodies and tumor antigen-targeting antibodies and uses thereof
|
|
MX2020006125A
(es)
|
2017-12-14 |
2020-08-24 |
Hoffmann La Roche |
Uso de un anticuerpo biespecifico de cea cd3 y un antagonista de la union al eje de pd-1 en un regimen de dosificacion para tratar el cancer.
|
|
EP3502140A1
(de)
|
2017-12-21 |
2019-06-26 |
F. Hoffmann-La Roche AG |
Kombinationstherapie von tumorabgezielten icos-agonisten mit t-zellenbispezifischen molekülen
|
|
WO2019122046A1
(en)
|
2017-12-21 |
2019-06-27 |
F. Hoffmann-La Roche Ag |
Universal reporter cell assay for specificity test of novel antigen binding moieties
|
|
AU2018390881A1
(en)
|
2017-12-21 |
2020-07-02 |
F. Hoffmann-La Roche Ag |
Antibodies binding to HLA-A2/WT1
|
|
JP2021508246A
(ja)
|
2017-12-21 |
2021-03-04 |
エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト |
新規抗原結合部分の特異性試験のためのcar−t細胞アッセイ
|
|
EP3728321A1
(de)
|
2017-12-22 |
2020-10-28 |
F. Hoffmann-La Roche AG |
Verwendung von pilra-bindenden mitteln zur behandlung einer erkrankung
|
|
EP3732202A4
(de)
|
2017-12-28 |
2022-06-15 |
Nanjing Legend Biotech Co., Ltd. |
Einzeldomänenantikörper und varianten davon gegen tigit
|
|
CN111542543B
(zh)
|
2017-12-28 |
2023-12-22 |
南京传奇生物科技有限公司 |
针对pd-l1的抗体及其变体
|
|
US11440957B2
(en)
|
2017-12-29 |
2022-09-13 |
Alector Llc |
Anti-TMEM106B antibodies and methods of use thereof
|
|
CN111479588A
(zh)
|
2017-12-29 |
2020-07-31 |
豪夫迈·罗氏有限公司 |
用于改善抗vegf抗体的vegf受体阻断选择性的方法
|
|
SG11202004233UA
(en)
|
2018-01-15 |
2020-06-29 |
Nanjing Legend Biotech Co Ltd |
Single-domain antibodies and variants thereof against pd-1
|
|
CA3088649A1
(en)
|
2018-01-16 |
2019-07-25 |
Lakepharma, Inc. |
Bispecific antibody that binds cd3 and another target
|
|
AU2019215031A1
(en)
|
2018-01-31 |
2020-08-20 |
Novartis Ag |
Combination therapy using a chimeric antigen receptor
|
|
JP7268038B2
(ja)
|
2018-01-31 |
2023-05-02 |
アレクトル エルエルシー |
抗ms4a4a抗体及びその使用方法
|
|
WO2019149715A1
(en)
|
2018-01-31 |
2019-08-08 |
F. Hoffmann-La Roche Ag |
Stabilized immunoglobulin domains
|
|
US20200354457A1
(en)
|
2018-01-31 |
2020-11-12 |
Hoffmann-La Roche Inc. |
Bispecific antibodies comprising an antigen-binding site binding to lag3
|
|
BR112020016169A2
(pt)
|
2018-02-08 |
2020-12-15 |
Genentech, Inc. |
Moléculas de ligação ao antígeno biespecíficas, ácido nucleico isolado, vetor, célula hospedeira, métodos para produzir a molécula de ligação, conjunto de ácidos nucleicos isolados, conjunto de vetores, conjunto de células hospedeiras, imunoconjugado, composição, uso da molécula de ligação, métodos para tratar ou retardar a progressão de um câncer, métodos para aperfeiçoar a função imune e kit
|
|
KR20220098056A
(ko)
|
2018-02-09 |
2022-07-08 |
제넨테크, 인크. |
비만 세포 매개 염증성 질환에 대한 치료 및 진단 방법
|
|
TWI829667B
(zh)
|
2018-02-09 |
2024-01-21 |
瑞士商赫孚孟拉羅股份公司 |
結合gprc5d之抗體
|
|
TW202000702A
(zh)
|
2018-02-26 |
2020-01-01 |
美商建南德克公司 |
用於抗tigit拮抗劑抗體及抗pd-l1拮抗劑抗體治療之投藥
|
|
WO2019166453A1
(en)
|
2018-03-01 |
2019-09-06 |
F. Hoffmann-La Roche Ag |
Specificity assay for novel target antigen binding moieties
|
|
BR112020015568A2
(pt)
|
2018-03-13 |
2020-12-29 |
F. Hoffmann-La Roche Ag |
Agonista de 4-1bb (cd137), produto farmacêutico, composição farmacêutica, uso de uma combinação de um agonista de 4-1bb e método para tratar ou retardar a progressão do câncer
|
|
TW202003561A
(zh)
|
2018-03-13 |
2020-01-16 |
瑞士商赫孚孟拉羅股份公司 |
使用靶向4-1bb (cd137)之促效劑的組合療法
|
|
US11485782B2
(en)
|
2018-03-14 |
2022-11-01 |
Beijing Xuanyi Pharmasciences Co., Ltd. |
Anti-claudin 18.2 antibodies
|
|
US20200040103A1
(en)
|
2018-03-14 |
2020-02-06 |
Genentech, Inc. |
Anti-klk5 antibodies and methods of use
|
|
MX2020009296A
(es)
|
2018-03-15 |
2020-11-13 |
Chugai Pharmaceutical Co Ltd |
Anticuerpos anti-virus del dengue que tienen reactividad cruzada con el virus zika y metodos de uso.
|
|
KR20200133376A
(ko)
|
2018-03-21 |
2020-11-27 |
알렉소 온콜로지 인크. |
신호-조절 단백질 알파에 대한 항체 및 사용 방법
|
|
KR20230042407A
(ko)
|
2018-03-29 |
2023-03-28 |
제넨테크, 인크. |
포유류 세포들에서 젖분비자극 활성의 조절
|
|
JP7104458B2
(ja)
|
2018-04-02 |
2022-07-21 |
上海博威生物医薬有限公司 |
リンパ球活性化遺伝子-3(lag-3)結合抗体およびその使用
|
|
TW202011029A
(zh)
|
2018-04-04 |
2020-03-16 |
美商建南德克公司 |
偵測及定量fgf21之方法
|
|
EP3775883A1
(de)
|
2018-04-04 |
2021-02-17 |
F. Hoffmann-La Roche AG |
Diagnostische assays zum nachweis von tumorantigenen bei krebspatienten
|
|
CN111742220A
(zh)
|
2018-04-04 |
2020-10-02 |
豪夫迈·罗氏有限公司 |
检测癌症患者中的肿瘤抗原的诊断性测定法
|
|
WO2019195181A1
(en)
|
2018-04-05 |
2019-10-10 |
Gilead Sciences, Inc. |
Antibodies and fragments thereof that bind hepatitis b virus protein x
|
|
KR20200144114A
(ko)
|
2018-04-13 |
2020-12-28 |
에프. 호프만-라 로슈 아게 |
4-1bbl을 포함하는 her-2 표적화 항원 결합 분자
|
|
US20210147547A1
(en)
|
2018-04-13 |
2021-05-20 |
Novartis Ag |
Dosage Regimens For Anti-Pd-L1 Antibodies And Uses Thereof
|
|
AR114789A1
(es)
|
2018-04-18 |
2020-10-14 |
Hoffmann La Roche |
Anticuerpos anti-hla-g y uso de los mismos
|
|
AR115052A1
(es)
|
2018-04-18 |
2020-11-25 |
Hoffmann La Roche |
Anticuerpos multiespecíficos y utilización de los mismos
|
|
US20210047405A1
(en)
|
2018-04-27 |
2021-02-18 |
Novartis Ag |
Car t cell therapies with enhanced efficacy
|
|
EP3788071A1
(de)
|
2018-05-02 |
2021-03-10 |
The United States Of America, As Represented By The Secretary, Department of Health and Human Services |
Antikörper und verfahren zur diagnose, prävention und behandlung von epstein-barr-virusinfektion
|
|
JP7402541B2
(ja)
|
2018-05-03 |
2023-12-21 |
ユニバーシティ オブ ロチェスター |
抗インフルエンザノイラミニダーゼモノクローナル抗体およびその使用
|
|
SG11202011309SA
(en)
|
2018-05-14 |
2020-12-30 |
Werewolf Therapeutics Inc |
Activatable interleukin 12 polypeptides and methods of use thereof
|
|
CA3100007A1
(en)
|
2018-05-14 |
2019-11-21 |
Werewolf Therapeutics, Inc. |
Activatable interleukin-2 polypeptides and methods of use thereof
|
|
AU2019269066B2
(en)
|
2018-05-18 |
2022-10-06 |
F. Hoffmann-La Roche Ag |
Targeted intracellular delivery of large nucleic acids
|
|
WO2019226658A1
(en)
|
2018-05-21 |
2019-11-28 |
Compass Therapeutics Llc |
Multispecific antigen-binding compositions and methods of use
|
|
TW202003580A
(zh)
|
2018-05-21 |
2020-01-16 |
美商坎伯斯治療有限責任公司 |
用於增強nk細胞對標靶細胞之殺死之組合物及方法
|
|
WO2019227003A1
(en)
|
2018-05-25 |
2019-11-28 |
Novartis Ag |
Combination therapy with chimeric antigen receptor (car) therapies
|
|
MX2020011828A
(es)
|
2018-05-25 |
2021-02-09 |
Alector Llc |
Anticuerpos anti proteina alfa reguladora de se?ales (sirpa) y metodos de uso de los mismos.
|
|
WO2019232244A2
(en)
|
2018-05-31 |
2019-12-05 |
Novartis Ag |
Antibody molecules to cd73 and uses thereof
|
|
JP7372237B2
(ja)
|
2018-06-04 |
2023-10-31 |
中外製薬株式会社 |
細胞質内での半減期が変化した抗原結合分子
|
|
BR112020024919A2
(pt)
|
2018-06-08 |
2021-03-09 |
Alector Llc |
Anticorpos, ácido nucleico, vetor, célula hospedeira, métodos de produção de um anticorpo e de prevenção, redução do risco ou tratamento de câncer e composição farmacêutica
|
|
EP3806962A1
(de)
|
2018-06-13 |
2021-04-21 |
Novartis AG |
Bcma-chimäre antigenrezeptoren und verwendungen davon
|
|
PE20210418A1
(es)
|
2018-06-19 |
2021-03-08 |
Atarga Llc |
Moleculas de anticuerpo de componente de complemento 5 y sus usos
|
|
SG11202012446UA
(en)
|
2018-06-23 |
2021-01-28 |
Genentech Inc |
Methods of treating lung cancer with a pd-1 axis binding antagonist, a platinum agent, and a topoisomerase ii inhibitor
|
|
WO2020006176A1
(en)
|
2018-06-27 |
2020-01-02 |
Obi Pharma, Inc. |
Glycosynthase variants for glycoprotein engineering and methods of use
|
|
CN112384532A
(zh)
|
2018-06-29 |
2021-02-19 |
艾利妥 |
抗SIRP-β1抗体及其使用方法
|
|
EP3818082A1
(de)
|
2018-07-04 |
2021-05-12 |
F. Hoffmann-La Roche AG |
Neuartige bispezifische agonistische 4-1bb-antigen-bindende moleküle
|
|
AR116109A1
(es)
|
2018-07-10 |
2021-03-31 |
Novartis Ag |
Derivados de 3-(5-amino-1-oxoisoindolin-2-il)piperidina-2,6-diona y usos de los mismos
|
|
WO2020014306A1
(en)
|
2018-07-10 |
2020-01-16 |
Immunogen, Inc. |
Met antibodies and immunoconjugates and uses thereof
|
|
KR20230065382A
(ko)
|
2018-07-13 |
2023-05-11 |
알렉터 엘엘씨 |
항-소틸린 항체 및 이들의 사용 방법
|
|
WO2020018789A1
(en)
|
2018-07-18 |
2020-01-23 |
Genentech, Inc. |
Methods of treating lung cancer with a pd-1 axis binding antagonist, an antimetabolite, and a platinum agent
|
|
US11214619B2
(en)
|
2018-07-20 |
2022-01-04 |
Surface Oncology, Inc. |
Anti-CD112R compositions and methods
|
|
WO2020021465A1
(en)
|
2018-07-25 |
2020-01-30 |
Advanced Accelerator Applications (Italy) S.R.L. |
Method of treatment of neuroendocrine tumors
|
|
US11040038B2
(en)
|
2018-07-26 |
2021-06-22 |
Sumitomo Dainippon Pharma Oncology, Inc. |
Methods for treating diseases associated with abnormal ACVR1 expression and ACVR1 inhibitors for use in the same
|
|
KR20210049106A
(ko)
|
2018-07-27 |
2021-05-04 |
알렉터 엘엘씨 |
항-siglec-5 항체 및 이의 사용 방법
|
|
JPWO2020027330A1
(ja)
|
2018-08-03 |
2021-08-19 |
中外製薬株式会社 |
互いに連結された2つの抗原結合ドメインを含む抗原結合分子
|
|
AU2019319822A1
(en)
|
2018-08-08 |
2021-03-18 |
Genentech, Inc. |
Use of tryptophan derivatives and L-methionine for protein formulation
|
|
AR114550A1
(es)
|
2018-08-10 |
2020-09-16 |
Chugai Pharmaceutical Co Ltd |
Moléculas de unión al antígeno anti-cd137 y sus usos
|
|
TW202021618A
(zh)
|
2018-08-17 |
2020-06-16 |
美商23與我有限公司 |
抗il1rap抗體及其使用方法
|
|
WO2020041360A1
(en)
|
2018-08-21 |
2020-02-27 |
Quidel Corporation |
Dbpa antibodies and uses thereof
|
|
US11401339B2
(en)
|
2018-08-23 |
2022-08-02 |
Seagen Inc. |
Anti-TIGIT antibodies
|
|
PE20211096A1
(es)
|
2018-08-31 |
2021-06-14 |
Alector Llc |
Anticuerpos anti-cd33 y metodos para usarlos
|
|
GB201814281D0
(en)
|
2018-09-03 |
2018-10-17 |
Femtogenix Ltd |
Cytotoxic agents
|
|
AR114732A1
(es)
|
2018-09-18 |
2020-10-07 |
Hoffmann La Roche |
Utilización de un inhibidor de catepsina s contra la formación de anticuerpos antifármaco
|
|
KR20210063330A
(ko)
|
2018-09-19 |
2021-06-01 |
제넨테크, 인크. |
방광암에 대한 치료 및 진단 방법
|
|
JP2022500638A
(ja)
|
2018-09-21 |
2022-01-04 |
ジェネンテック, インコーポレイテッド |
トリプルネガティブ乳癌のための診断方法
|
|
WO2020069398A1
(en)
|
2018-09-27 |
2020-04-02 |
Akrevia Therapeutics Inc. |
Masked cytokine polypeptides
|
|
CA3114295A1
(en)
|
2018-09-28 |
2020-04-02 |
Kyowa Kirin Co., Ltd. |
Il-36 antibodies and uses thereof
|
|
CN112654641A
(zh)
|
2018-10-01 |
2021-04-13 |
豪夫迈·罗氏有限公司 |
具有与cd40的三价结合的双特异性抗原结合分子
|
|
KR20210069675A
(ko)
|
2018-10-01 |
2021-06-11 |
에프. 호프만-라 로슈 아게 |
항-fap 클론 212를 포함하는 이중특이적 항원 결합 분자
|
|
US20200109200A1
(en)
|
2018-10-09 |
2020-04-09 |
Genentech, Inc. |
Methods and systems for determining synapse formation
|
|
KR20210079311A
(ko)
|
2018-10-18 |
2021-06-29 |
제넨테크, 인크. |
육종성 신장암에 대한 진단과 치료 방법
|
|
EP3870235A1
(de)
|
2018-10-24 |
2021-09-01 |
F. Hoffmann-La Roche AG |
Konjugierte chemische abbauauslöser und verwendungsverfahren
|
|
RU2724469C2
(ru)
|
2018-10-31 |
2020-06-23 |
Закрытое Акционерное Общество "Биокад" |
Моноклональное антитело, которое специфически связывается с cd20
|
|
EP3877407A1
(de)
|
2018-11-05 |
2021-09-15 |
F. Hoffmann-La Roche AG |
Verfahren zur herstellung von zwei kettenproteinen in prokaryotischen wirtszellen
|
|
KR20210107628A
(ko)
|
2018-11-13 |
2021-09-01 |
콤파스 테라퓨틱스 엘엘씨 |
체크포인트 분자에 대한 다중특이적 결합 작제물 및 이의 용도
|
|
EP3884276A2
(de)
|
2018-11-23 |
2021-09-29 |
Katholieke Universiteit Leuven |
Vorhersage einer behandlungsreaktion bei entzündlichen darmerkrankungen
|
|
WO2020117988A1
(en)
|
2018-12-04 |
2020-06-11 |
Tolero Pharmaceuticals, Inc. |
Cdk9 inhibitors and polymorphs thereof for use as agents for treatment of cancer
|
|
CA3119798A1
(en)
|
2018-12-06 |
2020-06-11 |
Genentech, Inc. |
Combination therapy of diffuse large b-cell lymphoma comprising an anti-cd79b immunoconjugates, an alkylating agent and an anti-cd20 antibody
|
|
CN113227119A
(zh)
|
2018-12-10 |
2021-08-06 |
基因泰克公司 |
用于与含Fc的蛋白质进行位点特异性缀合的光交联肽
|
|
AU2019400980A1
(en)
|
2018-12-20 |
2021-06-24 |
Novartis Ag |
Pharmaceutical combinations
|
|
JP2022514315A
(ja)
|
2018-12-20 |
2022-02-10 |
ノバルティス アーゲー |
3-(1-オキソイソインドリン-2-イル)ピペリジン-2,6-ジオン誘導体を含む投与計画及び薬剤組み合わせ
|
|
AR117327A1
(es)
|
2018-12-20 |
2021-07-28 |
23Andme Inc |
Anticuerpos anti-cd96 y métodos de uso de estos
|
|
EP3898687A1
(de)
|
2018-12-20 |
2021-10-27 |
Kyowa Kirin Co., Ltd. |
Fn14-antikörper und verwendungen davon
|
|
CN113286822A
(zh)
|
2018-12-21 |
2021-08-20 |
豪夫迈·罗氏有限公司 |
靶向肿瘤的超激动性cd28抗原结合分子
|
|
KR20210107025A
(ko)
|
2018-12-21 |
2021-08-31 |
제넨테크, 인크. |
세포사멸에 내성인 세포주를 사용한 폴리펩티드 생산 방법
|
|
AU2019405782A1
(en)
|
2018-12-21 |
2021-06-17 |
23Andme, Inc. |
Anti-IL-36 antibodies and methods of use thereof
|
|
WO2020127618A1
(en)
|
2018-12-21 |
2020-06-25 |
F. Hoffmann-La Roche Ag |
Tumor-targeted agonistic cd28 antigen binding molecules
|
|
CN113621062A
(zh)
|
2018-12-21 |
2021-11-09 |
豪夫迈·罗氏有限公司 |
与cd3结合的抗体
|
|
WO2020139920A2
(en)
|
2018-12-26 |
2020-07-02 |
City Of Hope |
Activatable masked anti-ctla4 binding proteins
|
|
JP2022515543A
(ja)
|
2018-12-30 |
2022-02-18 |
エフ.ホフマン-ラ ロシュ アーゲー |
抗ウサギcd19抗体および使用方法
|
|
AU2020208193A1
(en)
|
2019-01-14 |
2021-07-29 |
BioNTech SE |
Methods of treating cancer with a PD-1 axis binding antagonist and an RNA vaccine
|
|
WO2020153467A1
(ja)
|
2019-01-24 |
2020-07-30 |
中外製薬株式会社 |
新規がん抗原及びそれらの抗原に対する抗体
|
|
GB201901197D0
(en)
|
2019-01-29 |
2019-03-20 |
Femtogenix Ltd |
G-A Crosslinking cytotoxic agents
|
|
WO2020167990A1
(en)
|
2019-02-12 |
2020-08-20 |
Tolero Pharmaceuticals, Inc. |
Formulations comprising heterocyclic protein kinase inhibitors
|
|
CN113490528A
(zh)
|
2019-02-15 |
2021-10-08 |
诺华股份有限公司 |
3-(1-氧代-5-(哌啶-4-基)异吲哚啉-2-基)哌啶-2,6-二酮衍生物及其用途
|
|
WO2020165834A1
(en)
|
2019-02-15 |
2020-08-20 |
Novartis Ag |
Substituted 3-(1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives and uses thereof
|
|
US10871640B2
(en)
|
2019-02-15 |
2020-12-22 |
Perkinelmer Cellular Technologies Germany Gmbh |
Methods and systems for automated imaging of three-dimensional objects
|
|
WO2020169698A1
(en)
|
2019-02-21 |
2020-08-27 |
F. Hoffmann-La Roche Ag |
Sensitization of cancer cells to tnf by bet inhibition
|
|
US20220088075A1
(en)
|
2019-02-22 |
2022-03-24 |
The Trustees Of The University Of Pennsylvania |
Combination therapies of egfrviii chimeric antigen receptors and pd-1 inhibitors
|
|
CN113710706A
(zh)
|
2019-02-27 |
2021-11-26 |
豪夫迈·罗氏有限公司 |
用于抗tigit抗体和抗cd20抗体或抗cd38抗体治疗的给药
|
|
MX2021010565A
(es)
|
2019-03-08 |
2021-10-13 |
Genentech Inc |
Metodos para detectar y cuantificar proteinas asociadas a la membrana en vesiculas extracelulares.
|
|
EP3938784A1
(de)
|
2019-03-13 |
2022-01-19 |
Merck Patent GmbH |
Verfahren zur herstellung lipidierter proteinhaltiger strukturen
|
|
EP3938403A1
(de)
|
2019-03-14 |
2022-01-19 |
F. Hoffmann-La Roche AG |
Behandlung von krebs mit her2xcd3-bispezifischen antikörpern in kombination mit anti-her2-mab
|
|
WO2020191326A1
(en)
|
2019-03-20 |
2020-09-24 |
Sumitomo Dainippon Pharma Oncology, Inc. |
Treatment of acute myeloid leukemia (aml) with venetoclax failure
|
|
JP2022519923A
(ja)
|
2019-03-22 |
2022-03-25 |
スミトモ ダイニッポン ファーマ オンコロジー, インコーポレイテッド |
Pkm2モジュレーターを含む組成物およびそれを使用する処置の方法
|
|
MA55519A
(fr)
|
2019-03-29 |
2022-02-09 |
Atarga Llc |
Anticorps anti-fgf23
|
|
JP7301155B2
(ja)
|
2019-04-12 |
2023-06-30 |
エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト |
リポカリンムテインを含む二重特異性抗原結合分子
|
|
CN113692414A
(zh)
|
2019-04-12 |
2021-11-23 |
豪夫迈·罗氏有限公司 |
使用CEA CD3双特异性抗体和Wnt信号传导抑制剂的癌症治疗
|
|
SG11202111345PA
(en)
|
2019-04-19 |
2021-11-29 |
Chugai Pharmaceutical Co Ltd |
Chimeric receptor that recognizes engineered site in antibody
|
|
CN114364703A
(zh)
|
2019-04-19 |
2022-04-15 |
豪夫迈·罗氏有限公司 |
抗mertk抗体及它们的使用方法
|
|
RU2734432C1
(ru)
|
2019-04-23 |
2020-10-16 |
Закрытое Акционерное Общество "Биокад" |
Моноклональное антитело, которое специфически связывается с GITR
|
|
AU2020270376A1
(en)
|
2019-05-03 |
2021-10-07 |
Genentech, Inc. |
Methods of treating cancer with an anti-PD-L1 antibody
|
|
SG11202112223XA
(en)
|
2019-05-10 |
2021-12-30 |
Takeda Pharmaceuticals Co |
Antibody drug conjugates
|
|
MX2021013766A
(es)
|
2019-05-14 |
2022-02-21 |
Werewolf Therapeutics Inc |
Restos de separacion y metodos de uso de los mismos.
|
|
AU2020275415A1
(en)
|
2019-05-14 |
2021-11-25 |
Genentech, Inc. |
Methods of using anti-CD79B immunoconjugates to treat follicular lymphoma
|
|
WO2020232295A1
(en)
|
2019-05-16 |
2020-11-19 |
Procisedx Inc. |
An assay method for the detection of vcam-1 and alpha-2-macroglobulin in blood
|
|
JP2022532381A
(ja)
|
2019-05-16 |
2022-07-14 |
プロサイセデクス インコーポレイティド |
Vcam-1及びカルプロテクチンのための分析検出方法
|
|
WO2020236528A1
(en)
|
2019-05-23 |
2020-11-26 |
Procisedx Inc. |
Assay methods for the detection of human serum albumin, vitamin d, c-reactive protein, and anti-transglutaminase autoantibody
|
|
AR119264A1
(es)
|
2019-06-05 |
2021-12-09 |
Genentech Inc |
Método para reutilización de cromatografía
|
|
WO2020247159A1
(en)
|
2019-06-06 |
2020-12-10 |
Procisedx Inc. |
DETECTION OF HEMOGLOBIN A1C (HbA1c) IN BLOOD
|
|
MX2021015212A
(es)
|
2019-06-11 |
2022-04-06 |
Alector Llc |
Anticuerpos antisortilina para uso en terapia.
|
|
JP2022540764A
(ja)
|
2019-06-25 |
2022-09-20 |
プロサイセデクス インコーポレイティド |
抗TNFα生物製剤および抗薬剤抗体の検出
|
|
JP2022538075A
(ja)
|
2019-06-26 |
2022-08-31 |
エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト |
抗体結合cea及び4-1bblの融合
|
|
CN114531878A
(zh)
|
2019-06-27 |
2022-05-24 |
豪夫迈·罗氏有限公司 |
新颖icos抗体及包含它们的肿瘤靶向抗原结合分子
|
|
US11865177B2
(en)
|
2019-06-28 |
2024-01-09 |
Genentech, Inc. |
Composition and methods for stabilizing liquid protein formulations
|
|
CN114051500A
(zh)
|
2019-07-02 |
2022-02-15 |
豪夫迈·罗氏有限公司 |
包含白细胞介素-2突变体和抗cd8抗体的免疫缀合物
|
|
AR119382A1
(es)
|
2019-07-12 |
2021-12-15 |
Hoffmann La Roche |
Anticuerpos de pre-direccionamiento y métodos de uso
|
|
EP3998083A4
(de)
|
2019-07-12 |
2023-08-23 |
Chugai Seiyaku Kabushiki Kaisha |
Antikörper gegen mutationstyp fgfr3 und verwendung davon
|
|
AR119393A1
(es)
|
2019-07-15 |
2021-12-15 |
Hoffmann La Roche |
Anticuerpos que se unen a nkg2d
|
|
AU2020315878A1
(en)
|
2019-07-19 |
2022-03-03 |
Oncoresponse, Inc. |
Immunomodulatory antibodies and methods of use thereof
|
|
WO2021018925A1
(en)
|
2019-07-31 |
2021-02-04 |
F. Hoffmann-La Roche Ag |
Antibodies binding to gprc5d
|
|
KR20220058540A
(ko)
|
2019-07-31 |
2022-05-09 |
알렉터 엘엘씨 |
항-ms4a4a 항체 및 이의 사용 방법
|
|
JP2022543553A
(ja)
|
2019-07-31 |
2022-10-13 |
エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト |
Gprc5dに結合する抗体
|
|
CA3146616A1
(en)
|
2019-09-12 |
2021-03-18 |
Matthew Dominic CASCINO |
Compositions and methods of treating lupus nephritis
|
|
AU2020349509A1
(en)
|
2019-09-18 |
2022-03-31 |
Genentech, Inc. |
Anti-KLK7 antibodies, anti-KLK5 antibodies, multispecific anti-KLK5/KLK7 antibodies, and methods of use
|
|
CR20220149A
(es)
|
2019-09-20 |
2022-05-23 |
Genentech Inc |
Dosis para anticuerpos anti-triptasa
|
|
EP4036116A4
(de)
|
2019-09-27 |
2024-01-24 |
Nanjing Genscript Biotech Co Ltd |
Anti-vhh-domänen-antikörper und verwendung davon
|
|
CN114555116A
(zh)
|
2019-09-27 |
2022-05-27 |
豪夫迈·罗氏有限公司 |
用于抗tigit和抗pd-l1拮抗剂抗体治疗的给药
|
|
AU2020365836A1
(en)
|
2019-10-18 |
2022-04-28 |
F. Hoffmann-La Roche Ag |
Methods of using anti-CD79b immunoconjugates to treat diffuse large B-cell lymphoma
|
|
EP4048285A1
(de)
|
2019-10-21 |
2022-08-31 |
Novartis AG |
Tim-3-inhibitoren und verwendungen davon
|
|
BR112022007376A2
(pt)
|
2019-10-21 |
2022-07-05 |
Novartis Ag |
Terapias de combinação com venetoclax e inibidores de tim-3
|
|
WO2021089513A1
(en)
|
2019-11-05 |
2021-05-14 |
F. Hoffmann-La Roche Ag |
Treatment of cancer using a hla-a2/wt1 x cd3 bispecific antibody and lenalidomide
|
|
CA3155922A1
(en)
|
2019-11-06 |
2021-05-14 |
Huang Huang |
Diagnostic and therapeutic methods for treatment of hematologic cancers
|
|
MX2022006391A
(es)
|
2019-11-26 |
2022-06-24 |
Novartis Ag |
Receptores de antigeno quimerico que se unen a bcma y cd19 y usos de los mismos.
|
|
MX2022006073A
(es)
|
2019-12-05 |
2022-08-04 |
Alector Llc |
Metodos para utilizar anticuerpos anti-trem2.
|
|
AU2020403021A1
(en)
|
2019-12-12 |
2022-06-23 |
Alector Llc |
Methods of use of anti-CD33 antibodies
|
|
CR20230210A
(es)
|
2019-12-13 |
2023-06-14 |
Genentech Inc |
ANTICUERPOS ANTI-LY6G6D Y MÉTODOS DE USO (Divisional 2022-0330)
|
|
IL293827A
(en)
|
2019-12-13 |
2022-08-01 |
Alector Llc |
Anti-mertko antibodies and methods of using them
|
|
CN114828965A
(zh)
|
2019-12-18 |
2022-07-29 |
豪夫迈·罗氏有限公司 |
与hla-a2/mage-a4结合的抗体
|
|
IL293834A
(en)
|
2019-12-20 |
2022-08-01 |
Novartis Ag |
A combination of anti-tim-3 antibody mbg453 and anti, nis793 tgf-beta antibody with or without decitabine or anti-pd-1 antibody spratlizumab, for the treatment of myelofibrosis and myelodysplastic syndrome
|
|
JP2023509390A
(ja)
|
2019-12-23 |
2023-03-08 |
ジェネンテック, インコーポレイテッド |
アポリポタンパク質l1特異的抗体及びその使用方法
|
|
AU2019479791A1
(en)
|
2019-12-27 |
2022-07-14 |
Chugai Seiyaku Kabushiki Kaisha |
Anti-CTLA-4 antibody and use thereof
|
|
CN114929734A
(zh)
|
2020-01-09 |
2022-08-19 |
豪夫迈·罗氏有限公司 |
新型含有4-1bbl三聚体的抗原结合分子
|
|
CN110818795B
(zh)
|
2020-01-10 |
2020-04-24 |
上海复宏汉霖生物技术股份有限公司 |
抗tigit抗体和使用方法
|
|
KR20220128389A
(ko)
|
2020-01-17 |
2022-09-20 |
노파르티스 아게 |
골수이형성 증후군 또는 만성 골수단핵구성 백혈병을 치료하는데 사용하기 위한 tim-3 억제제 및 저메틸화제를 포함하는 조합물
|
|
CN115298322A
(zh)
|
2020-01-17 |
2022-11-04 |
贝克顿迪金森公司 |
用于单细胞分泌组学的方法和组合物
|
|
WO2021194481A1
(en)
|
2020-03-24 |
2021-09-30 |
Genentech, Inc. |
Dosing for treatment with anti-tigit and anti-pd-l1 antagonist antibodies
|
|
WO2022050954A1
(en)
|
2020-09-04 |
2022-03-10 |
Genentech, Inc. |
Dosing for treatment with anti-tigit and anti-pd-l1 antagonist antibodies
|
|
WO2021155149A1
(en)
|
2020-01-31 |
2021-08-05 |
Genentech, Inc. |
Methods of inducing neoepitope-specific t cells with a pd-1 axis binding antagonist and an rna vaccine
|
|
WO2021155006A1
(en)
|
2020-01-31 |
2021-08-05 |
Les Laboratoires Servier Sas |
Inhibitors of cyclin-dependent kinases and uses thereof
|
|
EP4097143A1
(de)
|
2020-01-31 |
2022-12-07 |
The Cleveland Clinic Foundation |
Anti-müller-hormonrezeptor-2-antikörper und verwendungsverfahren
|
|
CA3167349A1
(en)
|
2020-02-10 |
2021-08-19 |
Qing Zhou |
Claudin 18.2 antibody and use thereof
|
|
CA3167299A1
(en)
|
2020-02-10 |
2021-08-19 |
Shanghai Escugen Biotechnology Co., Ltd. |
Cldn18.2 antibody and use thereof
|
|
TW202144395A
(zh)
|
2020-02-12 |
2021-12-01 |
日商中外製藥股份有限公司 |
用於癌症之治療的抗cd137抗原結合分子
|
|
WO2021173565A1
(en)
|
2020-02-24 |
2021-09-02 |
Alector Llc |
Methods of use of anti-trem2 antibodies
|
|
EP4110377A2
(de)
|
2020-02-27 |
2023-01-04 |
Novartis AG |
Verfahren zur herstellung von chimären antigenrezeptor exprimierenden zellen
|
|
IL296256A
(en)
|
2020-03-13 |
2022-11-01 |
Genentech Inc |
Antibodies against interleukin-33 and uses thereof
|
|
IL296427A
(en)
|
2020-03-19 |
2022-11-01 |
Genentech Inc |
Isoform-selective anti-tgf antibodies and methods of use
|
|
US11365239B2
(en)
|
2020-03-20 |
2022-06-21 |
Tsb Therapeutics (Beijing) Co., Ltd. |
Anti-SARS-COV-2 antibodies and uses thereof
|
|
BR112022018847A2
(pt)
|
2020-03-24 |
2022-11-22 |
Genentech Inc |
Anticorpos, ácido nucleico, célula hospedeira, conjugados, composição farmacêutica, dispositivo de entrega de ação prolongada para entrega ocular, método para tratar um distúrbio e uso do anticorpo
|
|
CN115315512A
(zh)
|
2020-03-26 |
2022-11-08 |
基因泰克公司 |
具有降低的宿主细胞蛋白质的经修饰的哺乳动物细胞
|
|
JP2023519962A
(ja)
|
2020-03-31 |
2023-05-15 |
アレクトル エルエルシー |
抗mertk抗体及びその使用方法
|
|
IL296802A
(en)
|
2020-03-31 |
2022-11-01 |
Chugai Pharmaceutical Co Ltd |
A method for the production of multispecific antigen binding molecules
|
|
EP4126934A1
(de)
|
2020-04-01 |
2023-02-08 |
University of Rochester |
Monoklonale antikörper gegen das hämagglutinin (ha) und die neuraminidase (na) von influenza-h3n2-viren
|
|
AR121706A1
(es)
|
2020-04-01 |
2022-06-29 |
Hoffmann La Roche |
Moléculas de unión a antígeno biespecíficas dirigidas a ox40 y fap
|
|
WO2021202959A1
(en)
|
2020-04-03 |
2021-10-07 |
Genentech, Inc. |
Therapeutic and diagnostic methods for cancer
|
|
EP4126953A2
(de)
|
2020-04-03 |
2023-02-08 |
Alector LLC |
Verfahren zur verwendung von anti-trem2-antikörpern
|
|
EP4133075A1
(de)
|
2020-04-09 |
2023-02-15 |
Technische Universität München |
Gezielte abgabe eines inhibitors von mir-21 an makrophagen zur behandlung von lungenfibrose
|
|
CN116249712A
(zh)
|
2020-04-15 |
2023-06-09 |
沃雅戈治疗公司 |
Tau结合化合物
|
|
IL294451A
(en)
|
2020-04-15 |
2022-09-01 |
Hoffmann La Roche |
immune conjugates
|
|
KR20230005172A
(ko)
|
2020-04-24 |
2023-01-09 |
에프. 호프만-라 로슈 아게 |
설프히드릴 화합물 및 이의 유도체를 사용한 효소 및 경로 조절
|
|
TW202206111A
(zh)
|
2020-04-24 |
2022-02-16 |
美商建南德克公司 |
使用抗cd79b免疫結合物之方法
|
|
KR20230004520A
(ko)
|
2020-04-27 |
2023-01-06 |
더 리젠츠 오브 더 유니버시티 오브 캘리포니아 |
지단백(a)에 대한 이소형-비의존성 항체
|
|
CN115885050A
(zh)
|
2020-04-28 |
2023-03-31 |
基因泰克公司 |
用于非小细胞肺癌免疫疗法的方法和组合物
|
|
TW202216757A
(zh)
|
2020-04-28 |
2022-05-01 |
美國洛克菲勒大學 |
中和性抗sars-cov-2抗體及其使用方法
|
|
WO2021222533A1
(en)
|
2020-04-30 |
2021-11-04 |
Procisedx Inc. |
Methods of detecting antibodies to sars-cov-2
|
|
AU2021267995A1
(en)
|
2020-05-03 |
2022-12-08 |
Levena (Suzhou) Biopharma Co., Ltd. |
Antibody-drug conjugates (ADCs) comprising an anti-Trop-2 antibody, compositions comprising such ADCs, as well as methods of making and using the same
|
|
US20230212260A1
(en)
|
2020-05-15 |
2023-07-06 |
Apogenix Ag |
Multi-specific immune modulators
|
|
JP2023528375A
(ja)
|
2020-05-29 |
2023-07-04 |
23アンドミー・インコーポレイテッド |
抗cd200r1抗体及びその使用方法
|
|
WO2021249990A2
(en)
|
2020-06-08 |
2021-12-16 |
Hoffmann-La Roche Inc. |
Anti-hbv antibodies and methods of use
|
|
JP2023529203A
(ja)
|
2020-06-11 |
2023-07-07 |
ジェネンテック, インコーポレイテッド |
ナノリポタンパク質-ポリペプチドコンジュゲート並びにそれを使用する組成物、システム、及び方法
|
|
JP2023529206A
(ja)
|
2020-06-12 |
2023-07-07 |
ジェネンテック, インコーポレイテッド |
がん免疫療法のための方法及び組成物
|
|
CA3181820A1
(en)
|
2020-06-16 |
2021-12-23 |
Genentech, Inc. |
Methods and compositions for treating triple-negative breast cancer
|
|
BR112022025801A2
(pt)
|
2020-06-18 |
2023-10-03 |
Hoffmann La Roche |
Métodos para tratar um paciente e para tratar um paciente com escc avançado, kit, anticorpo, uso de um anticorpo e uso de um antagonista de ligação
|
|
AU2021291002A1
(en)
|
2020-06-19 |
2022-10-13 |
F. Hoffmann-La Roche Ag |
Protease-activated T cell bispecific antibodies
|
|
WO2021255146A1
(en)
|
2020-06-19 |
2021-12-23 |
F. Hoffmann-La Roche Ag |
Antibodies binding to cd3 and cea
|
|
CA3153085A1
(en)
|
2020-06-19 |
2021-12-23 |
F. Hoffmann-La Roche Ag |
Antibodies binding to cd3 and cd19
|
|
IL296089A
(en)
|
2020-06-19 |
2022-11-01 |
Hoffmann La Roche |
Antibodies bind to cd3
|
|
EP4168446A1
(de)
|
2020-06-19 |
2023-04-26 |
F. Hoffmann-La Roche AG |
Antikörper mit bindung an cd3 und folr1
|
|
WO2021259880A1
(en)
|
2020-06-22 |
2021-12-30 |
Almirall, S.A. |
Anti-il-36 antibodies and methods of use thereof
|
|
IL297880A
(en)
|
2020-06-23 |
2023-01-01 |
Hoffmann La Roche |
Agonistic cd28 antigen-binding molecules targeting her2
|
|
WO2021260528A1
(en)
|
2020-06-23 |
2021-12-30 |
Novartis Ag |
Dosing regimen comprising 3-(1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives
|
|
MX2022016453A
(es)
|
2020-06-24 |
2023-02-01 |
Genentech Inc |
Lineas celulares resistentes a la apoptosis.
|
|
EP4172203A1
(de)
|
2020-06-25 |
2023-05-03 |
F. Hoffmann-La Roche AG |
Anti-cd3/anti-cd28 bispezifische antigenbindende moleküle
|
|
KR20230037578A
(ko)
|
2020-07-10 |
2023-03-16 |
에프. 호프만-라 로슈 아게 |
암 세포에 결합하고 방사성 핵종을 상기 세포로 표적화하는 항체
|
|
TW202204895A
(zh)
|
2020-07-13 |
2022-02-01 |
美商建南德克公司 |
預測多肽免疫性的基於細胞之方法
|
|
UY39324A
(es)
|
2020-07-16 |
2022-02-25 |
Novartis Ag |
Anticuerpos anti-betacelulina, sus fragmentos, moléculas de unión multiespecíficas, casetes de expresión, composiciones y métodos de tratamiento.
|
|
KR20230038735A
(ko)
|
2020-07-17 |
2023-03-21 |
제넨테크, 인크. |
항-notch2 항체 및 이용 방법
|
|
TW202216215A
(zh)
|
2020-07-21 |
2022-05-01 |
美商建南德克公司 |
Brm降解之抗體結合化學誘導物及其方法
|
|
WO2022026592A2
(en)
|
2020-07-28 |
2022-02-03 |
Celltas Bio, Inc. |
Antibody molecules to coronavirus and uses thereof
|
|
GB2597532A
(en)
|
2020-07-28 |
2022-02-02 |
Femtogenix Ltd |
Cytotoxic compounds
|
|
WO2022029573A1
(en)
|
2020-08-03 |
2022-02-10 |
Novartis Ag |
Heteroaryl substituted 3-(1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives and uses thereof
|
|
JP2023537683A
(ja)
|
2020-08-07 |
2023-09-05 |
ジェネンテック, インコーポレイテッド |
ポリペプチド免疫原性を予測するためのt細胞ベースの方法
|
|
CA3192344A1
(en)
|
2020-08-28 |
2022-03-03 |
Genentech, Inc. |
Crispr/cas9 multiplex knockout of host cell proteins
|
|
EP4204021A1
(de)
|
2020-08-31 |
2023-07-05 |
Advanced Accelerator Applications International S.A. |
Verfahren zur behandlung von psma-exprimierenden krebsarten
|
|
WO2022043558A1
(en)
|
2020-08-31 |
2022-03-03 |
Advanced Accelerator Applications International Sa |
Method of treating psma-expressing cancers
|
|
EP4211165A1
(de)
|
2020-09-14 |
2023-07-19 |
Ichnos Sciences SA |
An il1rap bindende antikörper und verwendungen davon
|
|
AU2021350075A1
(en)
|
2020-09-24 |
2023-03-09 |
F. Hoffmann-La Roche Ag |
Prevention or mitigation of T-cell bispecific antibody-related adverse effects
|
|
IL301547A
(en)
|
2020-10-05 |
2023-05-01 |
Genentech Inc |
Dosage for treatment with bispecific anti-FCRH5/anti-CD3 antibodies
|
|
KR20230091871A
(ko)
|
2020-10-20 |
2023-06-23 |
에프. 호프만-라 로슈 아게 |
Pd-1 축 결합 길항제 및 lrrk2 억제제의 병용 요법
|
|
AR123855A1
(es)
|
2020-10-20 |
2023-01-18 |
Genentech Inc |
Anticuerpos anti-mertk conjugados con peg y métodos de uso
|
|
IL302277A
(en)
|
2020-10-22 |
2023-06-01 |
Janssen Biotech Inc |
Proteins containing delta-like ligand antigen binding domains (DLL3) and uses thereof
|
|
WO2022093981A1
(en)
|
2020-10-28 |
2022-05-05 |
Genentech, Inc. |
Combination therapy comprising ptpn22 inhibitors and pd-l1 binding antagonists
|
|
EP4237450A1
(de)
|
2020-10-30 |
2023-09-06 |
F. Hoffmann-La Roche AG |
Behandlung von krebs mit einem bispezifischen cea-cd3-antikörper und einem tgfbeta-signalisierungshemmer
|
|
MX2023005132A
(es)
|
2020-11-04 |
2023-05-25 |
Genentech Inc |
Dosificacion para el tratamiento con anticuerpos biespecificos anti-cd20/anti-cd3.
|
|
US20220153858A1
(en)
|
2020-11-04 |
2022-05-19 |
Genentech, Inc. |
Subcutaneous dosing of anti-cd20/anti-cd3 bispecific antibodies
|
|
WO2022098648A2
(en)
|
2020-11-04 |
2022-05-12 |
Genentech, Inc. |
Dosing for treatment with anti-cd20/anti-cd3 bispecific antibodies and anti-cd79b antibody drug conjugates
|
|
WO2022098870A1
(en)
|
2020-11-04 |
2022-05-12 |
The Rockefeller University |
Neutralizing anti-sars-cov-2 antibodies
|
|
EP4240765A2
(de)
|
2020-11-06 |
2023-09-13 |
Novartis AG |
Antikörper-fc-varianten
|
|
WO2022098972A1
(en)
|
2020-11-08 |
2022-05-12 |
Seagen Inc. |
Combination-therapy antibody drug conjugate with immune cell inhibitor
|
|
WO2022097117A1
(en)
|
2020-11-09 |
2022-05-12 |
Takeda Pharmaceutical Company Ltd. |
Antibody drug conjugates
|
|
JP2023547523A
(ja)
|
2020-11-10 |
2023-11-10 |
エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト |
T細胞係合剤関連の有害作用の防止又は軽減
|
|
EP4243857A1
(de)
|
2020-11-13 |
2023-09-20 |
Novartis AG |
Kombinationstherapien mit zellen zur expression des chimären antigenrezeptors (car)
|
|
KR20230109674A
(ko)
|
2020-11-16 |
2023-07-20 |
에프. 호프만-라 로슈 아게 |
Fab 고 만노스 당형
|
|
WO2022101458A1
(en)
|
2020-11-16 |
2022-05-19 |
F. Hoffmann-La Roche Ag |
Combination therapy with fap-targeted cd40 agonists
|
|
EP4255930A1
(de)
|
2020-12-02 |
2023-10-11 |
Alector LLC |
Verfahren zur verwendung von anti-sortilin-antikörpern
|
|
KR20230117122A
(ko)
|
2020-12-04 |
2023-08-07 |
에프. 호프만-라 로슈 아게 |
pH 의존성 돌연변이체 인터류킨-2 폴리펩티드
|
|
JP2023551983A
(ja)
|
2020-12-07 |
2023-12-13 |
ユーシービー バイオファルマ エスアールエル |
インターロイキン-22に対する抗体
|
|
CN116670166A
(zh)
|
2020-12-07 |
2023-08-29 |
Ucb生物制药有限责任公司 |
多特异性抗体和抗体组合
|
|
CA3204702A1
(en)
|
2020-12-17 |
2022-06-23 |
F. Hoffmann-La Roche Ag |
Anti-hla-g antibodies and use thereof
|
|
JP2024502832A
(ja)
|
2020-12-31 |
2024-01-23 |
アラマー バイオサイエンシーズ, インコーポレイテッド |
高親和性及び/または特異性を有する結合剤分子ならびにその製造及び使用方法
|
|
KR20230117406A
(ko)
|
2021-01-06 |
2023-08-08 |
에프. 호프만-라 로슈 아게 |
Pd1-lag3 이중특이성 항체와 cd20 t 세포 이중특이성항체를 이용한 조합 요법
|
|
CN116829593A
(zh)
|
2021-01-12 |
2023-09-29 |
豪夫迈·罗氏有限公司 |
与癌细胞结合并将放射性核素靶向所述细胞的分裂抗体
|
|
CA3204291A1
(en)
|
2021-01-13 |
2022-07-21 |
F. Hoffmann-La Roche Ag |
Combination therapy
|
|
WO2022155324A1
(en)
|
2021-01-15 |
2022-07-21 |
The Rockefeller University |
Neutralizing anti-sars-cov-2 antibodies
|
|
BR112023014418A2
(pt)
|
2021-01-20 |
2023-10-31 |
Oncoresponse Inc |
Anticorpos imunomoduladores e usos dos mesmos
|
|
WO2022159984A1
(en)
|
2021-01-22 |
2022-07-28 |
Bionecure Therapeutics, Inc. |
Anti-her-2/trop-2 constructs and uses thereof
|
|
EP4284510A1
(de)
|
2021-01-29 |
2023-12-06 |
Novartis AG |
Dosierungsschemata für anti-cd73- und anti-enpd2-antikörper und verwendungen davon
|
|
TW202317612A
(zh)
|
2021-03-01 |
2023-05-01 |
美商艾希利歐發展股份有限公司 |
用於治療癌症的ctla4及pd1/pdl1抗體之組合
|
|
CN116917325A
(zh)
|
2021-03-01 |
2023-10-20 |
西里欧发展公司 |
用于治疗癌症的被掩蔽的ctla4和pd1/pdl1抗体的组合
|
|
JP2024509169A
(ja)
|
2021-03-03 |
2024-02-29 |
ソレント・セラピューティクス・インコーポレイテッド |
抗bcma抗体を含む抗体-薬物コンジュゲート
|
|
WO2022192647A1
(en)
|
2021-03-12 |
2022-09-15 |
Genentech, Inc. |
Anti-klk7 antibodies, anti-klk5 antibodies, multispecific anti-klk5/klk7 antibodies, and methods of use
|
|
KR20230156373A
(ko)
|
2021-03-15 |
2023-11-14 |
제넨테크, 인크. |
루푸스 신염의 치료 조성물 및 치료 방법
|
|
CN116981696A
(zh)
|
2021-03-18 |
2023-10-31 |
艾莱克特有限责任公司 |
抗tmem106b抗体及其使用方法
|
|
WO2022197877A1
(en)
|
2021-03-19 |
2022-09-22 |
Genentech, Inc. |
Methods and compositions for time delayed bio-orthogonal release of cytotoxic agents
|
|
EP4314063A1
(de)
|
2021-03-23 |
2024-02-07 |
Alector LLC |
Anti-tmem106b-antikörper zur behandlung und prävention von coronavirusinfektionen
|
|
GB202104104D0
(en)
|
2021-03-24 |
2021-05-05 |
Liliumx Ltd |
Platform and method
|
|
TW202304990A
(zh)
|
2021-03-26 |
2023-02-01 |
美商健生生物科技公司 |
針對成對螺旋絲tau之人源化抗體及其用途
|
|
JP2024512709A
(ja)
|
2021-03-30 |
2024-03-19 |
エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト |
プロテアーゼ活性化ポリペプチド
|
|
TW202304979A
(zh)
|
2021-04-07 |
2023-02-01 |
瑞士商諾華公司 |
抗TGFβ抗體及其他治療劑用於治療增殖性疾病之用途
|
|
WO2022217026A1
(en)
|
2021-04-09 |
2022-10-13 |
Seagen Inc. |
Methods of treating cancer with anti-tigit antibodies
|
|
AR125344A1
(es)
|
2021-04-15 |
2023-07-05 |
Chugai Pharmaceutical Co Ltd |
Anticuerpo anti-c1s
|
|
WO2022225880A1
(en)
|
2021-04-19 |
2022-10-27 |
Genentech, Inc. |
Modified mammalian cells
|
|
CN117222412A
(zh)
|
2021-04-23 |
2023-12-12 |
豪夫迈·罗氏有限公司 |
Nk细胞接合剂相关的不良反应的预防或减轻
|
|
CN117321078A
(zh)
|
2021-04-30 |
2023-12-29 |
豪夫迈·罗氏有限公司 |
针对用抗cd20/抗cd3双特异性抗体和抗cd79b抗体药物缀合物进行组合治疗的给药
|
|
CA3217803A1
(en)
|
2021-04-30 |
2022-11-03 |
F. Hoffmann-La Roche Ag |
Dosing for treatment with anti-cd20/anti-cd3 bispecific antibody
|
|
EP4334355A1
(de)
|
2021-05-03 |
2024-03-13 |
UCB Biopharma SRL |
Antikörper
|
|
WO2022235867A2
(en)
|
2021-05-06 |
2022-11-10 |
The Rockefeller University |
Neutralizing anti-sars- cov-2 antibodies and methods of use thereof
|
|
WO2022241446A1
(en)
|
2021-05-12 |
2022-11-17 |
Genentech, Inc. |
Methods of using anti-cd79b immunoconjugates to treat diffuse large b-cell lymphoma
|
|
TW202306993A
(zh)
|
2021-05-14 |
2023-02-16 |
美商建南德克公司 |
Trem2之促效劑
|
|
AR125874A1
(es)
|
2021-05-18 |
2023-08-23 |
Novartis Ag |
Terapias de combinación
|
|
WO2022243261A1
(en)
|
2021-05-19 |
2022-11-24 |
F. Hoffmann-La Roche Ag |
Agonistic cd40 antigen binding molecules targeting cea
|
|
CN117396599A
(zh)
|
2021-05-21 |
2024-01-12 |
基因泰克公司 |
用于生产目的重组产物的经修饰的细胞
|
|
AR126009A1
(es)
|
2021-06-02 |
2023-08-30 |
Hoffmann La Roche |
Moléculas agonistas de unión al antígeno cd28 que se dirigen a epcam
|
|
WO2022255440A1
(en)
|
2021-06-04 |
2022-12-08 |
Chugai Seiyaku Kabushiki Kaisha |
Anti-ddr2 antibodies and uses thereof
|
|
CA3216220A1
(en)
|
2021-06-09 |
2022-12-15 |
F. Hoffmann-La Roche Ag |
Combination of a particular braf inhibitor (paradox breaker) and a pd-1 axis binding antagonist for use in the treatment of cancer
|
|
CN117642426A
(zh)
|
2021-06-16 |
2024-03-01 |
艾莱克特有限责任公司 |
双特异性抗MerTK和抗PDL1抗体及其使用方法
|
|
WO2022266221A1
(en)
|
2021-06-16 |
2022-12-22 |
Alector Llc |
Monovalent anti-mertk antibodies and methods of use thereof
|
|
TW202317627A
(zh)
|
2021-06-25 |
2023-05-01 |
日商中外製藥股份有限公司 |
抗ctla-4抗體
|
|
KR20240024255A
(ko)
|
2021-06-25 |
2024-02-23 |
추가이 세이야쿠 가부시키가이샤 |
항ctla-4 항체의 사용
|
|
AU2022302170A1
(en)
|
2021-07-02 |
2023-12-21 |
F. Hoffmann-La Roche Ag |
Methods and compositions for treating cancer
|
|
IL309856A
(en)
|
2021-07-14 |
2024-02-01 |
Genentech Inc |
Antibodies anti-C-C motif receptor 8 (CCR8) and methods of use
|
|
WO2023004386A1
(en)
|
2021-07-22 |
2023-01-26 |
Genentech, Inc. |
Brain targeting compositions and methods of use thereof
|
|
CA3219606A1
(en)
|
2021-07-22 |
2023-01-26 |
F. Hoffmann-La Roche Ag |
Heterodimeric fc domain antibodies
|
|
WO2023010095A1
(en)
|
2021-07-28 |
2023-02-02 |
F. Hoffmann-La Roche Ag |
Methods and compositions for treating cancer
|
|
CN117794953A
(zh)
|
2021-08-03 |
2024-03-29 |
豪夫迈·罗氏有限公司 |
双特异性抗体及使用方法
|
|
WO2023019239A1
(en)
|
2021-08-13 |
2023-02-16 |
Genentech, Inc. |
Dosing for anti-tryptase antibodies
|
|
AU2022332285A1
(en)
|
2021-08-23 |
2024-02-15 |
Immunitas Therapeutics, Inc. |
Anti-cd161 antibodies and uses thereof
|
|
WO2023028591A1
(en)
|
2021-08-27 |
2023-03-02 |
Genentech, Inc. |
Methods of treating tau pathologies
|
|
TW202325727A
(zh)
|
2021-08-30 |
2023-07-01 |
美商建南德克公司 |
抗聚泛素多特異性抗體
|
|
WO2023044483A2
(en)
|
2021-09-20 |
2023-03-23 |
Voyager Therapeutics, Inc. |
Compositions and methods for the treatment of her2 positive cancer
|
|
TW202321308A
(zh)
|
2021-09-30 |
2023-06-01 |
美商建南德克公司 |
使用抗tigit抗體、抗cd38抗體及pd—1軸結合拮抗劑治療血液癌症的方法
|
|
WO2023056069A1
(en)
|
2021-09-30 |
2023-04-06 |
Angiex, Inc. |
Degrader-antibody conjugates and methods of using same
|
|
WO2023062048A1
(en)
|
2021-10-14 |
2023-04-20 |
F. Hoffmann-La Roche Ag |
Alternative pd1-il7v immunoconjugates for the treatment of cancer
|
|
WO2023062050A1
(en)
|
2021-10-14 |
2023-04-20 |
F. Hoffmann-La Roche Ag |
New interleukin-7 immunoconjugates
|
|
WO2023069919A1
(en)
|
2021-10-19 |
2023-04-27 |
Alector Llc |
Anti-cd300lb antibodies and methods of use thereof
|
|
WO2023073225A1
(en)
|
2021-11-01 |
2023-05-04 |
F. Hoffmann-La Roche Ag |
Treatment of cancer using a hla-a2/wt1 x cd3 bispecific antibody and a 4-1bb (cd137) agonist
|
|
WO2023081898A1
(en)
|
2021-11-08 |
2023-05-11 |
Alector Llc |
Soluble cd33 as a biomarker for anti-cd33 efficacy
|
|
WO2023086807A1
(en)
|
2021-11-10 |
2023-05-19 |
Genentech, Inc. |
Anti-interleukin-33 antibodies and uses thereof
|
|
WO2023088876A1
(en)
|
2021-11-16 |
2023-05-25 |
Apogenix Ag |
Multi-specific immune modulators
|
|
TW202337494A
(zh)
|
2021-11-16 |
2023-10-01 |
美商建南德克公司 |
用莫蘇妥珠單抗治療全身性紅斑狼瘡(sle)之方法及組成物
|
|
WO2023088889A1
(en)
|
2021-11-16 |
2023-05-25 |
Apogenix Ag |
CD137 ligands
|
|
WO2023092004A1
(en)
|
2021-11-17 |
2023-05-25 |
Voyager Therapeutics, Inc. |
Compositions and methods for the treatment of tau-related disorders
|
|
AR127806A1
(es)
|
2021-12-01 |
2024-02-28 |
Kadmon Corp Llc |
Anticuerpos b7-h4 y proteínas de fusión de anticuerpo b7-h4 / il-15
|
|
WO2023104938A1
(en)
|
2021-12-10 |
2023-06-15 |
F. Hoffmann-La Roche Ag |
Antibodies binding to cd3 and plap
|
|
TW202339797A
(zh)
|
2021-12-14 |
2023-10-16 |
瑞士商赫孚孟拉羅股份公司 |
使用hla-a2mage-a4xcd3雙特異性抗體及4-1bb(cd137)促效劑治療癌症
|
|
WO2023114544A1
(en)
|
2021-12-17 |
2023-06-22 |
Dana-Farber Cancer Institute, Inc. |
Antibodies and uses thereof
|
|
WO2023114543A2
(en)
|
2021-12-17 |
2023-06-22 |
Dana-Farber Cancer Institute, Inc. |
Platform for antibody discovery
|
|
TW202340248A
(zh)
|
2021-12-20 |
2023-10-16 |
瑞士商赫孚孟拉羅股份公司 |
促效性ltbr抗體及包含其之雙特異性抗體
|
|
US20230227545A1
(en)
|
2022-01-07 |
2023-07-20 |
Johnson & Johnson Enterprise Innovation Inc. |
Materials and methods of il-1beta binding proteins
|
|
WO2023141445A1
(en)
|
2022-01-19 |
2023-07-27 |
Genentech, Inc. |
Anti-notch2 antibodies and conjugates and methods of use
|
|
WO2023147329A1
(en)
|
2022-01-26 |
2023-08-03 |
Genentech, Inc. |
Antibody-conjugated chemical inducers of degradation and methods thereof
|
|
WO2023147328A1
(en)
|
2022-01-26 |
2023-08-03 |
Genentech, Inc. |
Antibody-conjugated chemical inducers of degradation with hydolysable maleimide linkers and methods thereof
|
|
WO2023150778A1
(en)
|
2022-02-07 |
2023-08-10 |
Visterra, Inc. |
Anti-idiotype antibody molecules and uses thereof
|
|
WO2023164516A1
(en)
|
2022-02-23 |
2023-08-31 |
Alector Llc |
Methods of use of anti-trem2 antibodies
|
|
WO2023173026A1
(en)
|
2022-03-10 |
2023-09-14 |
Sorrento Therapeutics, Inc. |
Antibody-drug conjugates and uses thereof
|
|
TW202346355A
(zh)
|
2022-03-11 |
2023-12-01 |
比利時商健生藥品公司 |
多特異性抗體及其用途(二)
|
|
WO2023170291A1
(en)
|
2022-03-11 |
2023-09-14 |
Janssen Pharmaceutica Nv |
Multispecific antibodies and uses thereof
|
|
WO2023170295A1
(en)
|
2022-03-11 |
2023-09-14 |
Janssen Pharmaceutica Nv |
Multispecific antibodies and uses thereof
|
|
TW202346365A
(zh)
|
2022-03-23 |
2023-12-01 |
瑞士商赫孚孟拉羅股份公司 |
抗cd20/抗cd3雙特異性抗體及化學療法之組合治療
|
|
TW202402790A
(zh)
|
2022-03-25 |
2024-01-16 |
英商梅迪繆思有限公司 |
減少呼吸系統感染之方法
|
|
WO2023186756A1
(en)
|
2022-03-28 |
2023-10-05 |
F. Hoffmann-La Roche Ag |
Interferon gamma variants and antigen binding molecules comprising these
|
|
WO2023192622A1
(en)
|
2022-04-01 |
2023-10-05 |
Genentech, Inc. |
Hydroxypropyl methyl cellulose derivatives to stabilize polypeptides
|
|
WO2023191816A1
(en)
|
2022-04-01 |
2023-10-05 |
Genentech, Inc. |
Dosing for treatment with anti-fcrh5/anti-cd3 bispecific antibodies
|
|
WO2023198727A1
(en)
|
2022-04-13 |
2023-10-19 |
F. Hoffmann-La Roche Ag |
Pharmaceutical compositions of anti-cd20/anti-cd3 bispecific antibodies and methods of use
|
|
US20230406930A1
(en)
|
2022-04-13 |
2023-12-21 |
Genentech, Inc. |
Pharmaceutical compositions of therapeutic proteins and methods of use
|
|
US20230357381A1
(en)
|
2022-04-26 |
2023-11-09 |
Novartis Ag |
Multispecific antibodies targeting il-13 and il-18
|
|
WO2023215737A1
(en)
|
2022-05-03 |
2023-11-09 |
Genentech, Inc. |
Anti-ly6e antibodies, immunoconjugates, and uses thereof
|
|
WO2023219613A1
(en)
|
2022-05-11 |
2023-11-16 |
Genentech, Inc. |
Dosing for treatment with anti-fcrh5/anti-cd3 bispecific antibodies
|
|
WO2023220695A2
(en)
|
2022-05-13 |
2023-11-16 |
Voyager Therapeutics, Inc. |
Compositions and methods for the treatment of her2 positive cancer
|
|
US20230416412A1
(en)
|
2022-05-31 |
2023-12-28 |
Hoffmann-La Roche Inc. |
Prevention or mitigation of t-cell engaging agent-related adverse effects
|
|
WO2023240058A2
(en)
|
2022-06-07 |
2023-12-14 |
Genentech, Inc. |
Prognostic and therapeutic methods for cancer
|
|
WO2023239803A1
(en)
|
2022-06-08 |
2023-12-14 |
Angiex, Inc. |
Anti-tm4sf1 antibody-drug conjugates comprising cleavable linkers and methods of using same
|
|
WO2024015897A1
(en)
|
2022-07-13 |
2024-01-18 |
Genentech, Inc. |
Dosing for treatment with anti-fcrh5/anti-cd3 bispecific antibodies
|
|
WO2024015993A1
(en)
|
2022-07-15 |
2024-01-18 |
Fibrogen, Inc. |
Modified anti-galectin-9 antibody and uses thereof
|
|
WO2024020432A1
(en)
|
2022-07-19 |
2024-01-25 |
Genentech, Inc. |
Dosing for treatment with anti-fcrh5/anti-cd3 bispecific antibodies
|
|
WO2024020564A1
(en)
|
2022-07-22 |
2024-01-25 |
Genentech, Inc. |
Anti-steap1 antigen-binding molecules and uses thereof
|
|
WO2024020579A1
(en)
|
2022-07-22 |
2024-01-25 |
Bristol-Myers Squibb Company |
Antibodies binding to human pad4 and uses thereof
|
|
WO2024026472A2
(en)
|
2022-07-29 |
2024-02-01 |
Alector Llc |
Transferrin receptor antigen-binding domains and uses therefor
|
|
WO2024026471A1
(en)
|
2022-07-29 |
2024-02-01 |
Alector Llc |
Cd98hc antigen-binding domains and uses therefor
|
|
WO2024026447A1
(en)
|
2022-07-29 |
2024-02-01 |
Alector Llc |
Anti-gpnmb antibodies and methods of use thereof
|
|
WO2024030976A2
(en)
|
2022-08-03 |
2024-02-08 |
Voyager Therapeutics, Inc. |
Compositions and methods for crossing the blood brain barrier
|
|
WO2024040216A2
(en)
|
2022-08-19 |
2024-02-22 |
Fibrogen, Inc. |
Anti-ccr8 antibodies and uses thereof
|
|
WO2024049949A1
(en)
|
2022-09-01 |
2024-03-07 |
Genentech, Inc. |
Therapeutic and diagnostic methods for bladder cancer
|
|
WO2024056862A1
(en)
|
2022-09-15 |
2024-03-21 |
Avidicure Ip B.V. |
Multispecific antigen binding proteins for tumor-targeting of nk cells and use thereof
|
|
WO2024059739A1
(en)
|
2022-09-15 |
2024-03-21 |
Voyager Therapeutics, Inc. |
Tau binding compounds
|