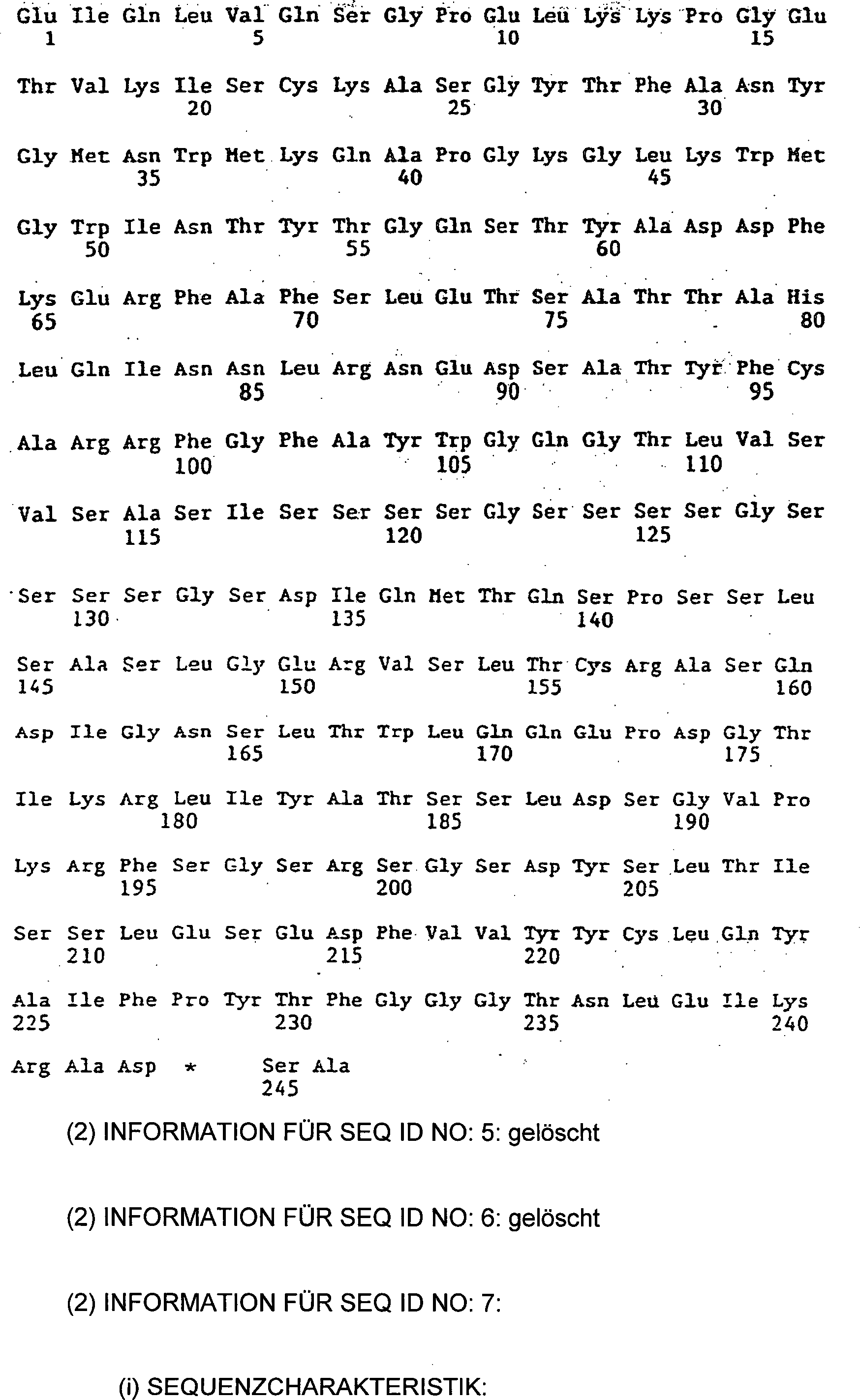
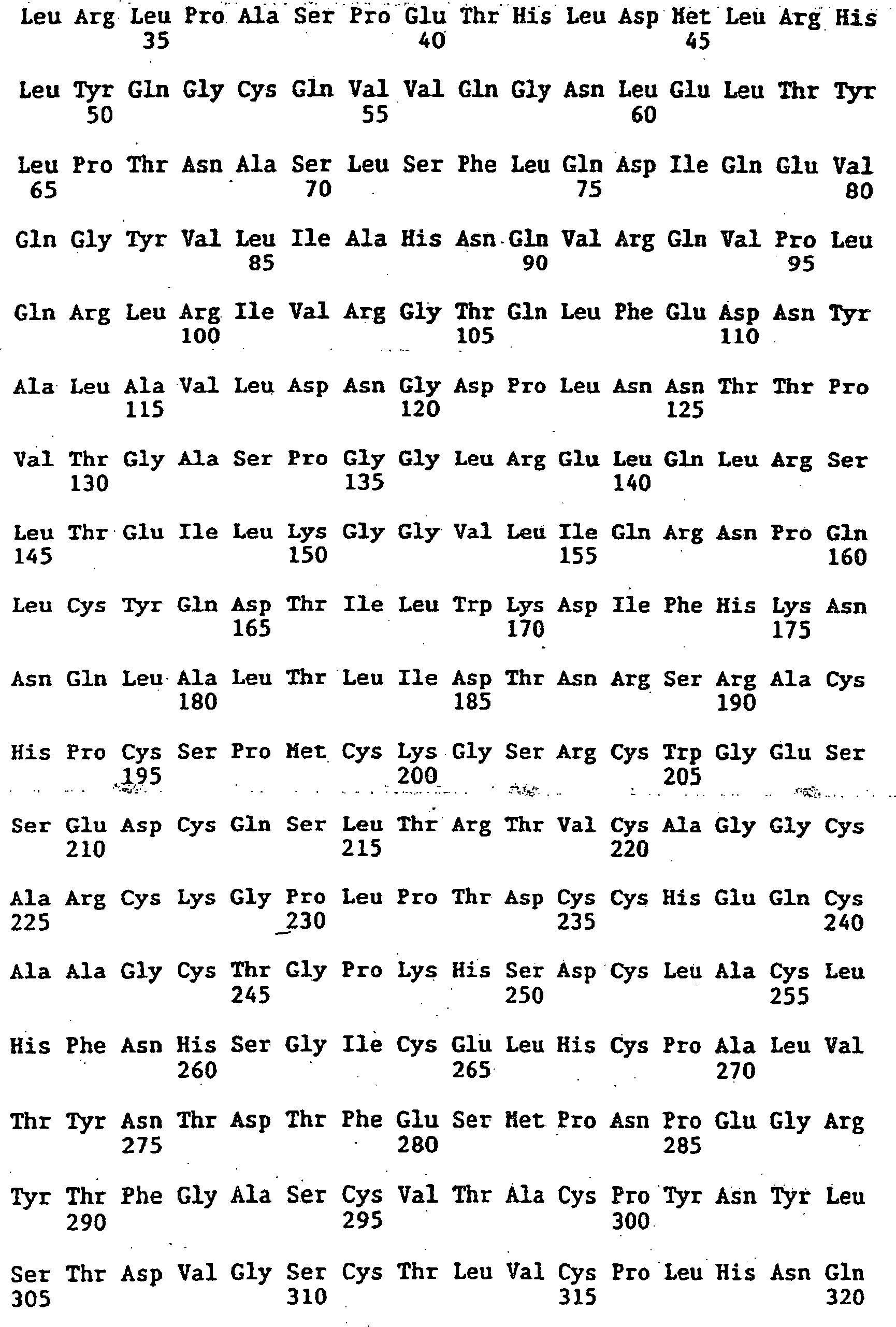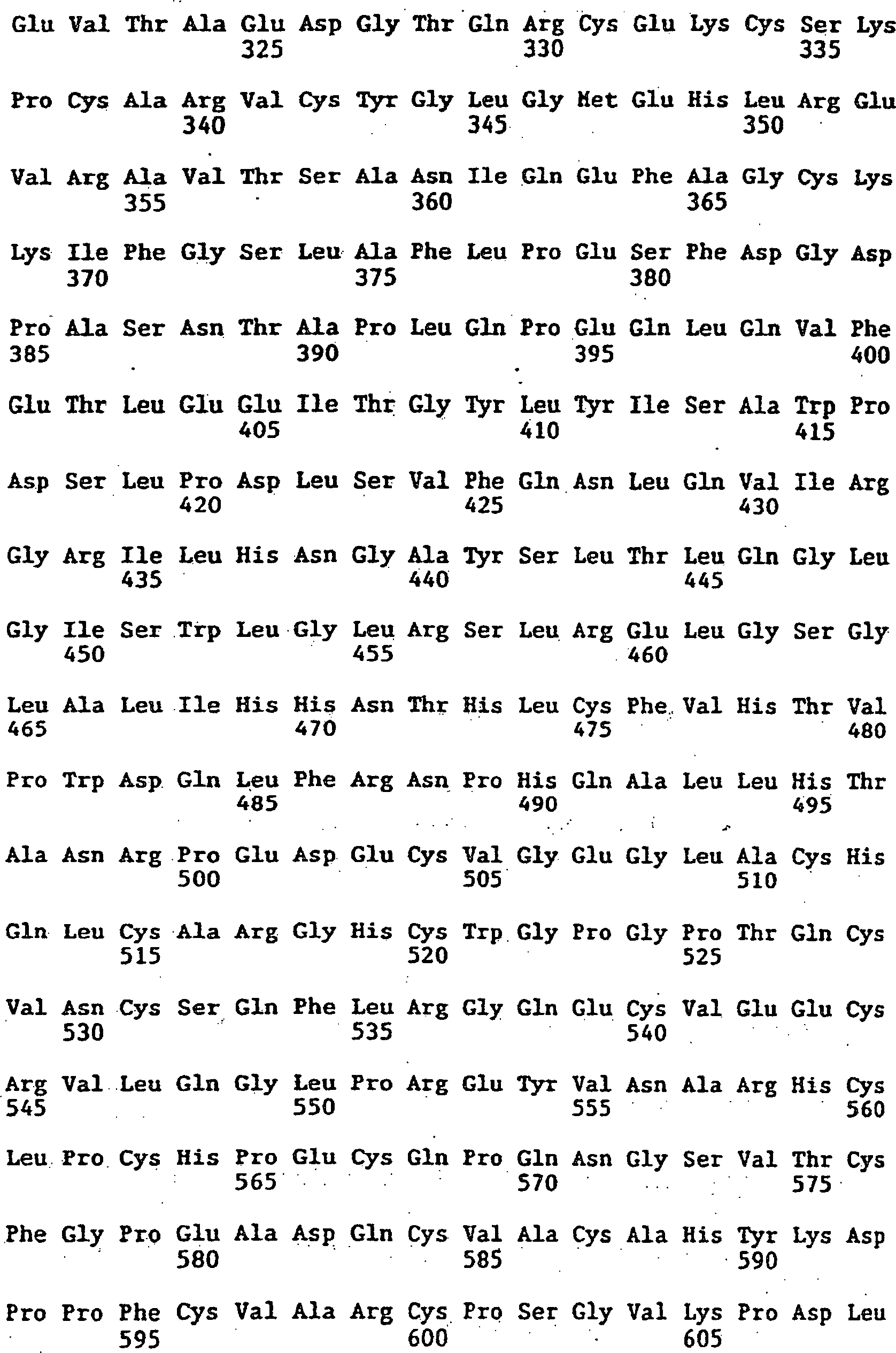|
US7838216B1
(en)
*
|
1986-03-05 |
2010-11-23 |
The United States Of America, As Represented By The Department Of Health And Human Services |
Human gene related to but distinct from EGF receptor gene
|
|
US6121424A
(en)
*
|
1991-11-25 |
2000-09-19 |
Enzon, Inc. |
Multivalent antigen-binding proteins
|
|
US5869620A
(en)
*
|
1986-09-02 |
1999-02-09 |
Enzon, Inc. |
Multivalent antigen-binding proteins
|
|
US20050058638A1
(en)
*
|
1987-05-21 |
2005-03-17 |
Huston James S. |
Biosynthetic binding proteins for immuno-targeting
|
|
KR0184860B1
(ko)
*
|
1988-11-11 |
1999-04-01 |
메디칼 리써어치 카운실 |
단일영역 리간드와 이를 포함하는 수용체 및 이들의 제조방법과 이용(법)
|
|
ES2194838T3
(es)
*
|
1991-02-27 |
2003-12-01 |
Micromet Ag |
Enlazadores peptidicos ricos en serina.
|
|
CA2114934A1
(en)
*
|
1991-08-05 |
1993-02-18 |
Mark T. Martin |
Prodrugs activated by targeted catalytic proteins
|
|
DE69333807T2
(de)
*
|
1992-02-06 |
2006-02-02 |
Chiron Corp., Emeryville |
Marker für krebs und biosynthetisches bindeprotein dafür
|
|
US20070031931A1
(en)
*
|
1992-02-06 |
2007-02-08 |
Chiron Corporation |
Biosynthetic binding proteins for immuno-targeting
|
|
US7754211B2
(en)
*
|
1992-04-10 |
2010-07-13 |
Research Development Foundation |
Immunotoxins directed against c-erbB-2(HER-2/neu) related surface antigens
|
|
US20080152586A1
(en)
*
|
1992-09-25 |
2008-06-26 |
Avipep Pty Limited |
High avidity polyvalent and polyspecific reagents
|
|
AU5670194A
(en)
*
|
1992-11-20 |
1994-06-22 |
Enzon, Inc. |
Linker for linked fusion polypeptides
|
|
GB9225453D0
(en)
|
1992-12-04 |
1993-01-27 |
Medical Res Council |
Binding proteins
|
|
AU690528B2
(en)
*
|
1992-12-04 |
1998-04-30 |
Medical Research Council |
Multivalent and multispecific binding proteins, their manufacture and use
|
|
AU680685B2
(en)
|
1993-09-22 |
1997-08-07 |
Medical Research Council |
Retargeting antibodies
|
|
US5753225A
(en)
|
1993-12-03 |
1998-05-19 |
The Regents Of The University Of California |
Antibodies that mimic actions of neurotrophins
|
|
IT1264083B1
(it)
*
|
1993-12-10 |
1996-09-10 |
Enea Ente Nuove Tec |
Procedimento per la produzione in piante di anticorpi ingegnerizzati, anticorpi prodotti e loro uso in diagnosi e terapia.
|
|
US5763733A
(en)
*
|
1994-10-13 |
1998-06-09 |
Enzon, Inc. |
Antigen-binding fusion proteins
|
|
US6514942B1
(en)
*
|
1995-03-14 |
2003-02-04 |
The Board Of Regents, The University Of Texas System |
Methods and compositions for stimulating T-lymphocytes
|
|
AUPO591797A0
(en)
*
|
1997-03-27 |
1997-04-24 |
Commonwealth Scientific And Industrial Research Organisation |
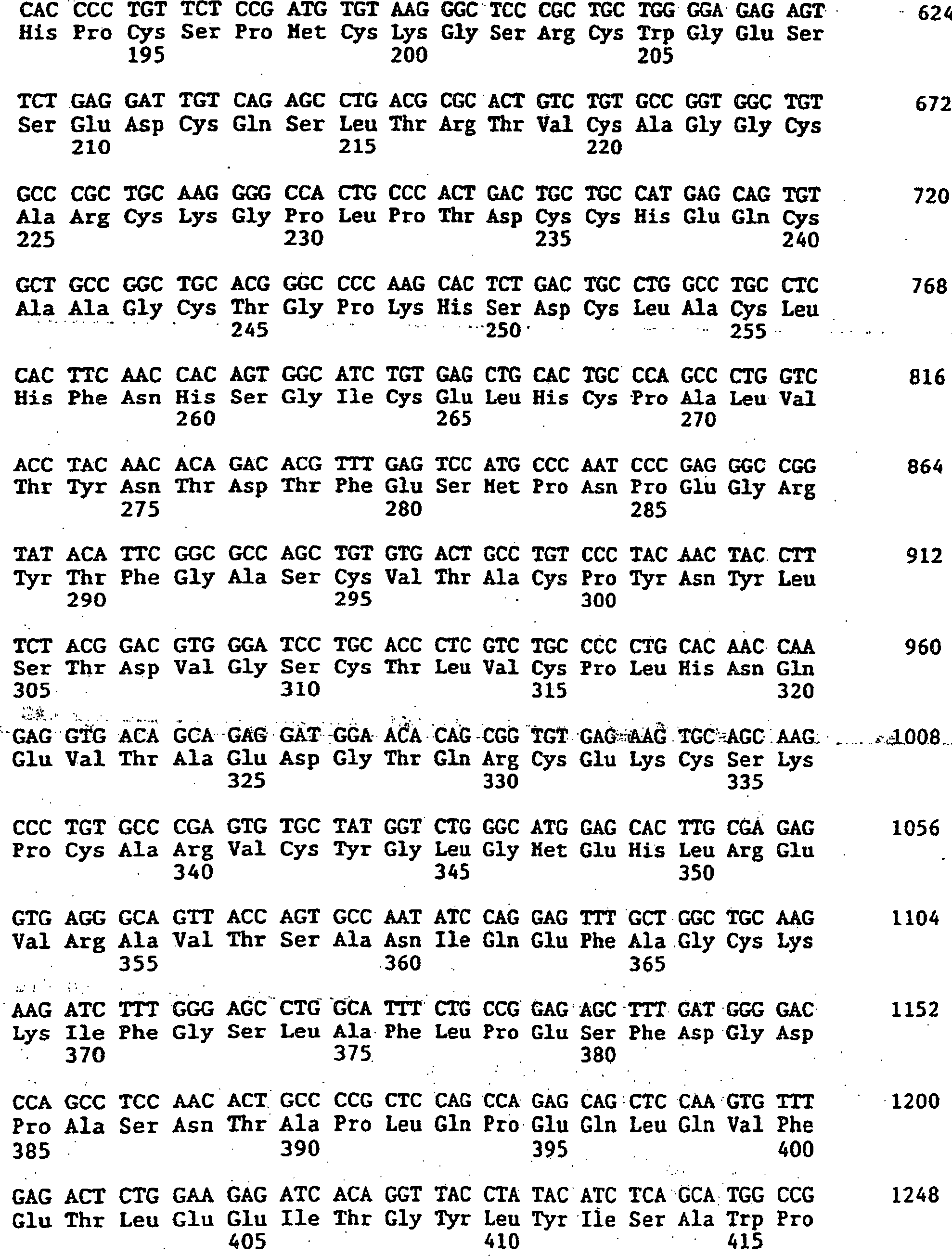
High avidity polyvalent and polyspecific reagents
|
|
US6685940B2
(en)
|
1995-07-27 |
2004-02-03 |
Genentech, Inc. |
Protein formulation
|
|
US6267958B1
(en)
|
1995-07-27 |
2001-07-31 |
Genentech, Inc. |
Protein formulation
|
|
US5968511A
(en)
*
|
1996-03-27 |
1999-10-19 |
Genentech, Inc. |
ErbB3 antibodies
|
|
JP3925943B2
(ja)
*
|
1996-03-27 |
2007-06-06 |
ジェネンテック インコーポレーテッド |
ErbB3抗体
|
|
US6136311A
(en)
|
1996-05-06 |
2000-10-24 |
Cornell Research Foundation, Inc. |
Treatment and diagnosis of cancer
|
|
JP2000515735A
(ja)
*
|
1996-07-03 |
2000-11-28 |
ジェネンテック インコーポレーテッド |
肝細胞成長因子レセプターアゴニスト
|
|
EP0922111B1
(de)
*
|
1996-07-23 |
2004-12-01 |
Tanox Pharma B.V. |
Induzierung von t zell toleranz unter verwendung eines löslichen moleküls, dass gleichzeitig zwei kostimulierungswege blockieren kann
|
|
CA2262001C
(en)
*
|
1996-08-05 |
2003-05-20 |
President And Fellows Of Harvard College |
Mhc binding peptide oligomers and methods of use
|
|
US7371376B1
(en)
|
1996-10-18 |
2008-05-13 |
Genentech, Inc. |
Anti-ErbB2 antibodies
|
|
US6013632A
(en)
*
|
1997-01-13 |
2000-01-11 |
Emory University |
Compounds and their combinations for the treatment of influenza infection
|
|
WO1998033809A1
(en)
*
|
1997-01-31 |
1998-08-06 |
The General Hospital Corporation |
Compositions and methods for imaging gene expression
|
|
US7749498B2
(en)
*
|
1997-03-10 |
2010-07-06 |
Genentech, Inc. |
Antibodies for inhibiting blood coagulation and methods of use thereof
|
|
US20030109680A1
(en)
*
|
2001-11-21 |
2003-06-12 |
Sunol Molecular Corporation |
Antibodies for inhibiting blood coagulation and methods of use thereof
|
|
US5986065A
(en)
*
|
1997-03-10 |
1999-11-16 |
Sunol Molecular Corporation |
Antibodies for inhibiting blood coagulation and methods of use thereof
|
|
US20060235209A9
(en)
*
|
1997-03-10 |
2006-10-19 |
Jin-An Jiao |
Use of anti-tissue factor antibodies for treating thromboses
|
|
CA2288994C
(en)
|
1997-04-30 |
2011-07-05 |
Enzon, Inc. |
Polyalkylene oxide-modified single chain polypeptides
|
|
US20040009166A1
(en)
*
|
1997-04-30 |
2004-01-15 |
Filpula David R. |
Single chain antigen-binding polypeptides for polymer conjugation
|
|
AU735883C
(en)
|
1997-06-13 |
2002-02-07 |
Genentech Inc. |
Protein recovery by chromatography followed by filtration upon a charged layer
|
|
US5994511A
(en)
|
1997-07-02 |
1999-11-30 |
Genentech, Inc. |
Anti-IgE antibodies and methods of improving polypeptides
|
|
US6172213B1
(en)
|
1997-07-02 |
2001-01-09 |
Genentech, Inc. |
Anti-IgE antibodies and method of improving polypeptides
|
|
FR2766826B1
(fr)
*
|
1997-08-04 |
2001-05-18 |
Pasteur Institut |
Vecteurs derives d'anticorps pour le transfert de substances dans les cellules
|
|
US6737249B1
(en)
*
|
1997-08-22 |
2004-05-18 |
Genentech, Inc. |
Agonist antibodies
|
|
EP1947119A3
(de)
|
1997-12-12 |
2012-12-19 |
Genentech, Inc. |
Krebsbehandlung mit Antikörpern gegen ERBB2 und einem chemotherapeutischen Mittel
|
|
ZA9811162B
(en)
*
|
1997-12-12 |
2000-06-07 |
Genentech Inc |
Treatment with anti-ERBB2 antibodies.
|
|
EP1941905A1
(de)
|
1998-03-27 |
2008-07-09 |
Genentech, Inc. |
APO-2 Liganden-Anti-HER-2-Antikörper-Synergismus
|
|
DE19819846B4
(de)
*
|
1998-05-05 |
2016-11-24 |
Deutsches Krebsforschungszentrum Stiftung des öffentlichen Rechts |
Multivalente Antikörper-Konstrukte
|
|
AU4009899A
(en)
*
|
1998-05-23 |
1999-12-13 |
Tanox, Inc. |
Molecules targeting cd40 and tumor cells
|
|
GB9812545D0
(en)
*
|
1998-06-10 |
1998-08-05 |
Celltech Therapeutics Ltd |
Biological products
|
|
US7074405B1
(en)
*
|
1998-06-22 |
2006-07-11 |
Immunomedics, Inc. |
Use of bi-specific antibodies for pre-targeting diagnosis and therapy
|
|
US7387772B1
(en)
|
1999-06-22 |
2008-06-17 |
Immunimedics, Inc. |
Chimeric, human and humanized anti-CSAP monoclonal antibodies
|
|
US6962702B2
(en)
*
|
1998-06-22 |
2005-11-08 |
Immunomedics Inc. |
Production and use of novel peptide-based agents for use with bi-specific antibodies
|
|
US7138103B2
(en)
*
|
1998-06-22 |
2006-11-21 |
Immunomedics, Inc. |
Use of bi-specific antibodies for pre-targeting diagnosis and therapy
|
|
US7405320B2
(en)
|
1998-06-22 |
2008-07-29 |
Immunomedics, Inc. |
Therapeutic and diagnostic conjugates for use with multispecific antibodies
|
|
US7833528B2
(en)
*
|
1998-06-22 |
2010-11-16 |
Immunomedics, Inc. |
Use of multispecific, non-covalent complexes for targeted delivery of therapeutics
|
|
DE19831429A1
(de)
*
|
1998-07-07 |
2000-04-27 |
Jerini Biotools Gmbh |
Verfahren zur Identifizierung und chemisch-synthetischen Nachahmung von Bindungsstellen auf Proteinen
|
|
US6228360B1
(en)
*
|
1998-08-19 |
2001-05-08 |
Ajinomoto Co., Inc. |
Antithrombotic agent and humanized anti-von Willebrand factor monoclonal antibody
|
|
US7067144B2
(en)
*
|
1998-10-20 |
2006-06-27 |
Omeros Corporation |
Compositions and methods for systemic inhibition of cartilage degradation
|
|
US6333396B1
(en)
|
1998-10-20 |
2001-12-25 |
Enzon, Inc. |
Method for targeted delivery of nucleic acids
|
|
US6818749B1
(en)
*
|
1998-10-31 |
2004-11-16 |
The United States Of America As Represented By The Department Of Health And Human Services |
Variants of humanized anti carcinoma monoclonal antibody cc49
|
|
US7118743B2
(en)
|
1998-11-17 |
2006-10-10 |
Tanox, Inc. |
Bispecific molecules cross-linking ITIM and ITAM for therapy
|
|
AU1727500A
(en)
*
|
1998-11-17 |
2000-06-05 |
Tanox, Inc. |
Bispecific molecules cross-linking itim and itam for therapy
|
|
SI1135498T1
(sl)
|
1998-11-18 |
2008-06-30 |
Genentech Inc |
Variante protitelesa z višjo vezavno afiniteto vprimerjavi z izvirnimi protitelesi
|
|
US7041292B1
(en)
|
1999-06-25 |
2006-05-09 |
Genentech, Inc. |
Treating prostate cancer with anti-ErbB2 antibodies
|
|
US20030086924A1
(en)
*
|
1999-06-25 |
2003-05-08 |
Genentech, Inc. |
Treatment with anti-ErbB2 antibodies
|
|
US6949245B1
(en)
*
|
1999-06-25 |
2005-09-27 |
Genentech, Inc. |
Humanized anti-ErbB2 antibodies and treatment with anti-ErbB2 antibodies
|
|
US20040013667A1
(en)
*
|
1999-06-25 |
2004-01-22 |
Genentech, Inc. |
Treatment with anti-ErbB2 antibodies
|
|
CN100340575C
(zh)
|
1999-06-25 |
2007-10-03 |
杰南技术公司 |
人源化抗ErbB2抗体及其在制备药物中的应用
|
|
DK1189634T3
(da)
*
|
1999-06-25 |
2007-06-25 |
Genentech Inc |
Behandling af prostatacancer med anti-ErbB2-antistoffer
|
|
SI2803367T1
(en)
|
1999-06-25 |
2018-04-30 |
Immunogen, Inc. |
Treatment methods with maytansinoid conjugated antibody anti-ERBB
|
|
DK1210115T3
(da)
*
|
1999-08-27 |
2009-11-30 |
Genentech Inc |
Doseringer til behandling med anti-ErB2-antistoffer
|
|
CA2385528C
(en)
|
1999-10-01 |
2013-12-10 |
Immunogen, Inc. |
Compositions and methods for treating cancer using immunoconjugates and chemotherapeutic agents
|
|
US6794494B1
(en)
*
|
2003-04-14 |
2004-09-21 |
Arius Research, Inc. |
Cancerous disease modifying antibodies
|
|
UA74803C2
(uk)
|
1999-11-11 |
2006-02-15 |
Осі Фармасьютікалз, Інк. |
Стійкий поліморф гідрохлориду n-(3-етинілфеніл)-6,7-біс(2-метоксіетокси)-4-хіназолінаміну, спосіб його одержання (варіанти) та фармацевтичне застосування
|
|
BR0108001A
(pt)
|
2000-02-01 |
2004-01-06 |
Tanox Inc |
Moléculas ativadoras de apc com ligação para cd-40
|
|
CA2400622A1
(en)
*
|
2000-02-24 |
2001-08-30 |
Eidgenossische Technische Hochschule Zurich |
Antibody specific for the ed-b domain of fibronectin, conjugates comprising said antibody, and their use for the detection and treatment of angiogenesis
|
|
US6319694B1
(en)
*
|
2000-03-03 |
2001-11-20 |
Genopsys, Inc. |
Random truncation and amplification of nucleic acid
|
|
US7097840B2
(en)
*
|
2000-03-16 |
2006-08-29 |
Genentech, Inc. |
Methods of treatment using anti-ErbB antibody-maytansinoid conjugates
|
|
LT2857516T
(lt)
|
2000-04-11 |
2017-09-11 |
Genentech, Inc. |
Multivalentiniai antikūnai ir jų panaudojimas
|
|
AU5720601A
(en)
*
|
2000-04-26 |
2001-11-07 |
Elusys Therapeutics Inc |
Bispecific molecules and uses thereof
|
|
AU2001259271A1
(en)
*
|
2000-04-28 |
2001-11-12 |
Millennium Pharmaceuticals, Inc. |
14094, a novel human trypsin family member and uses thereof
|
|
PL217410B1
(pl)
*
|
2000-05-19 |
2014-07-31 |
Genentech Inc |
Zastosowanie antagonisty ErbB, antagonista ErbB do zastosowania w metodzie leczenia raka i sposób identyfikacji pacjenta skłonnego do korzystnej odpowiedzi na antagonistę ErbB przy leczeniu raka
|
|
JP2003534022A
(ja)
*
|
2000-05-26 |
2003-11-18 |
スミスクライン・ビーチャム・コーポレイション |
Rankリガンド介在障害の治療に有用な抗−rankリガンドモノクローナル抗体
|
|
CA2411102A1
(en)
|
2000-06-20 |
2001-12-27 |
Idec Pharmaceutical Corporation |
Cold anti-cd20 antibody/radiolabeled anti-cd22 antibody combination
|
|
GB0027328D0
(en)
*
|
2000-06-23 |
2000-12-27 |
Aventis Pharma Inc |
Bioengineered vehicles for targeted nucleic acid delivery
|
|
ES2312478T3
(es)
*
|
2000-09-07 |
2009-03-01 |
Bayer Schering Pharma Aktiengesellschaft |
Receptor del dominio edb de fibronectina (ii).
|
|
US20020106327A1
(en)
*
|
2000-11-15 |
2002-08-08 |
Brian Storrie |
B/b-like fragment targeting for the purposes of photodynamic therapy and medical imaging
|
|
ME00502B
(me)
|
2001-01-05 |
2011-10-10 |
Amgen Fremont Inc |
Antitjela za insulinu sličan receptor faktora i rasta
|
|
US20020159996A1
(en)
|
2001-01-31 |
2002-10-31 |
Kandasamy Hariharan |
Use of CD23 antagonists for the treatment of neoplastic disorders
|
|
AU2002316855B2
(en)
|
2001-04-24 |
2008-03-13 |
Merck Patent Gmbh |
Combination therapy using anti-angiogenic agents and TNFalpha
|
|
CN1195779C
(zh)
*
|
2001-05-24 |
2005-04-06 |
中国科学院遗传与发育生物学研究所 |
抗人卵巢癌抗人cd3双特异性抗体
|
|
US20070160576A1
(en)
|
2001-06-05 |
2007-07-12 |
Genentech, Inc. |
IL-17A/F heterologous polypeptides and therapeutic uses thereof
|
|
MXPA03011985A
(es)
|
2001-06-20 |
2004-03-26 |
Genentech Inc |
Composiciones y metodos para el diagnostico y tratamiento de tumores.
|
|
AU2002345792A1
(en)
|
2001-06-21 |
2003-01-08 |
Pfizer Inc. |
Thienopyridine and thienopyrimidine anticancer agents
|
|
ES2390531T3
(es)
|
2001-09-18 |
2012-11-13 |
Genentech, Inc. |
Composiciones y procedimientos para el diagnósitco y tratamiento de tumor
|
|
US20050123925A1
(en)
|
2002-11-15 |
2005-06-09 |
Genentech, Inc. |
Compositions and methods for the diagnosis and treatment of tumor
|
|
AR039067A1
(es)
*
|
2001-11-09 |
2005-02-09 |
Pfizer Prod Inc |
Anticuerpos para cd40
|
|
EP2067472A1
(de)
|
2002-01-02 |
2009-06-10 |
Genentech, Inc. |
Zusammensetzungen und Verfahren zur Behandlung und Diagnose von Tumoren
|
|
RU2352582C2
(ru)
*
|
2002-01-03 |
2009-04-20 |
Шеринг Акциенгезельшафт |
Конъюгаты, содержащие антитело, специфическое для ed-в-домена фибронектина, и их применение для обнаружения и лечения опухолей
|
|
AU2003210802B2
(en)
|
2002-02-05 |
2009-09-10 |
Genentech Inc. |
Protein purification
|
|
US6869787B2
(en)
*
|
2002-02-27 |
2005-03-22 |
The United States Of America As Represented By The Secretary Of The Army |
Ricin vaccine and methods of making and using thereof
|
|
ES2401428T3
(es)
|
2002-04-10 |
2013-04-19 |
Genentech, Inc. |
Variantes de anticuerpos anti-HER2
|
|
MXPA04009809A
(es)
*
|
2002-04-11 |
2004-12-13 |
Amgen Inc |
Moleculas de tirosina cinasa del receptor her-2 y uso de las mismas.
|
|
NZ535925A
(en)
|
2002-04-16 |
2008-06-30 |
Genentech Inc |
An isolated antibody that binds to a particular polypeptide
|
|
UA77303C2
(en)
*
|
2002-06-14 |
2006-11-15 |
Pfizer |
Derivatives of thienopyridines substituted by benzocondensed heteroarylamide useful as therapeutic agents, pharmaceutical compositions and methods for their use
|
|
EP1532162B1
(de)
|
2002-06-28 |
2013-08-07 |
THE GOVERNMENT OF THE UNITED STATES OF AMERICA, as represented by THE SECRETARY, DEPARTMENT OF HEALTH AND HUMAN SERVICES |
Humanisierter anti-tag-72 cc49 zur diagnose und therapie humaner tumore
|
|
JP5069843B2
(ja)
|
2002-07-15 |
2012-11-07 |
ジェネンテック, インコーポレイテッド |
抗ErbB2抗体を用いる処置に応答性である腫瘍を同定するための方法
|
|
CA2496060C
(en)
|
2002-09-11 |
2015-08-04 |
Genentech, Inc. |
Protein purification by ion exchange chromatography
|
|
AU2002951853A0
(en)
*
|
2002-10-04 |
2002-10-24 |
Commonwealth Scientific And Industrial Research Organisation |
Crystal structure of erbb2 and uses thereof
|
|
US9701754B1
(en)
|
2002-10-23 |
2017-07-11 |
City Of Hope |
Covalent disulfide-linked diabodies and uses thereof
|
|
US20040258685A1
(en)
*
|
2002-11-21 |
2004-12-23 |
Genentech, Inc. |
Therapy of non-malignant diseases or disorders with anti-ErbB2 antibodies
|
|
US20040186160A1
(en)
*
|
2002-12-13 |
2004-09-23 |
Sugen, Inc. |
Hexahydro-cyclohepta-pyrrole oxindole as potent kinase inhibitors
|
|
CA2510850A1
(en)
*
|
2002-12-19 |
2004-07-08 |
Pfizer Inc. |
2-(1h-indazol-6-ylamino)-benzamide compounds as protein kinases inhibitors useful for the treatment of ophthalmic diseases
|
|
JP4764334B2
(ja)
|
2003-02-01 |
2011-08-31 |
タノックス インコーポレーテッド |
高親和性抗ヒトIgE抗体
|
|
ES2401330T3
(es)
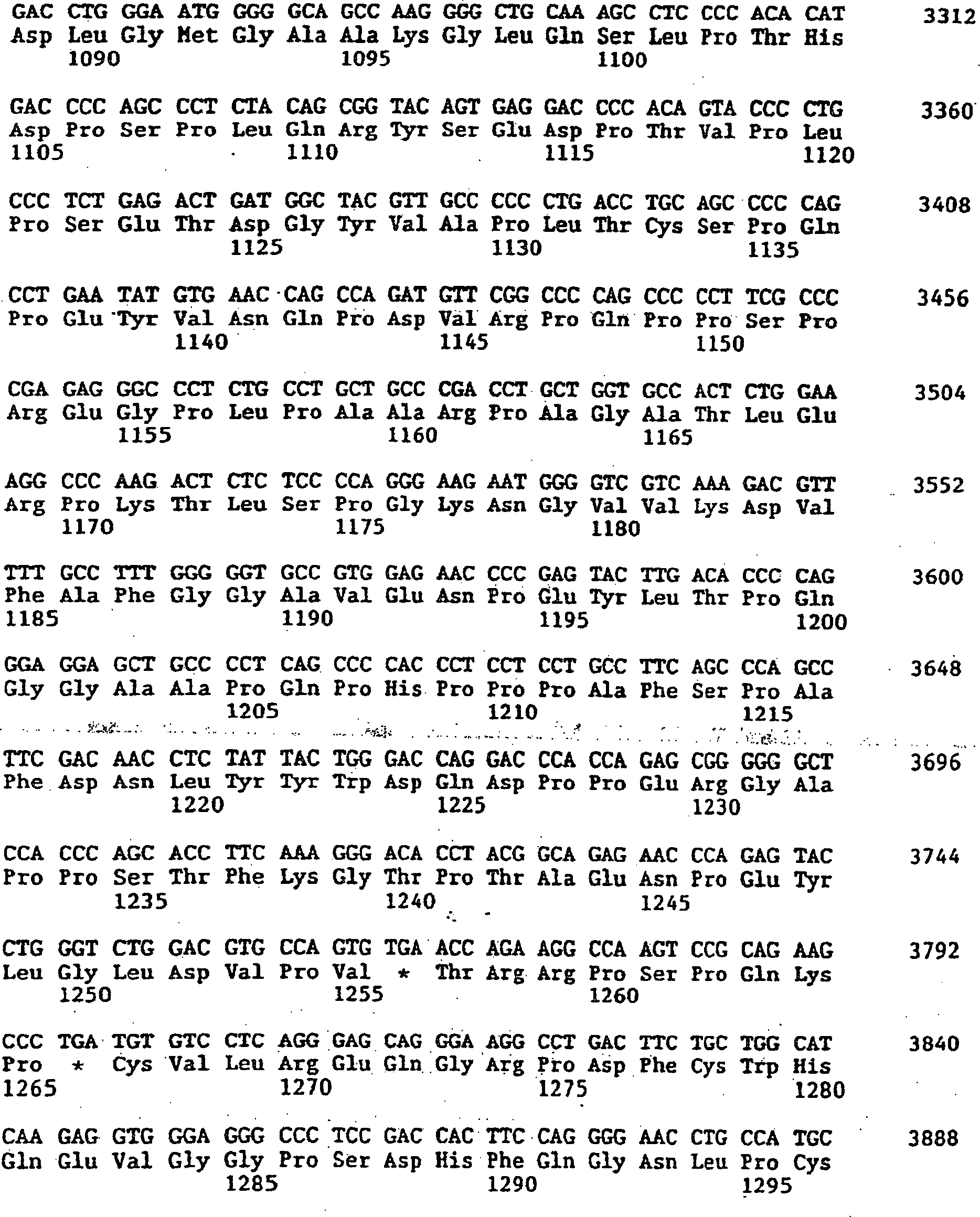
|
2003-02-26 |
2013-04-18 |
Sugen, Inc. |
Compuesto de heteroarilamino inhibidores de proteín quinasas
|
|
MXPA05009303A
(es)
*
|
2003-04-03 |
2005-10-05 |
Pfizer |
Formas de dosificacion y procedimientos de tratamiento que usan inhibidores del vegfr.
|
|
ES2349779T5
(es)
|
2003-04-04 |
2013-11-26 |
Genentech, Inc. |
Formulaciones de anticuerpos y de proteínas a concentración elevada
|
|
UA99933C2
(ru)
|
2003-04-09 |
2012-10-25 |
Дженентек, Инк. |
Лечение аутоиммунных заболеваний у пациента с неадекватным ответом на ингибитор tnf-альфа
|
|
US7425328B2
(en)
*
|
2003-04-22 |
2008-09-16 |
Purdue Pharma L.P. |
Tissue factor antibodies and uses thereof
|
|
US8088387B2
(en)
|
2003-10-10 |
2012-01-03 |
Immunogen Inc. |
Method of targeting specific cell populations using cell-binding agent maytansinoid conjugates linked via a non-cleavable linker, said conjugates, and methods of making said conjugates
|
|
RU2005136988A
(ru)
|
2003-05-30 |
2006-06-10 |
Дженентек, Инк. (Us) |
Лечение антителами против vegf
|
|
CA2526402A1
(en)
|
2003-06-05 |
2005-01-20 |
Genentech, Inc. |
Blys antagonists and uses thereof
|
|
CA2530980A1
(en)
*
|
2003-06-19 |
2005-01-20 |
Tanox, Inc. |
Tissue factor-specific antibodies for preventing or treating acute lung injury or acute respiratory distress syndrome
|
|
KR100835786B1
(ko)
|
2003-07-08 |
2008-06-09 |
제넨테크, 인크. |
Il-17a/f 이종 폴리펩티드 및 그의 치료 용도
|
|
JP4599355B2
(ja)
|
2003-07-28 |
2010-12-15 |
ジェネンテック, インコーポレイテッド |
プロテインaアフィニティークロマトグラフィーの間のプロテインaの浸出の低減
|
|
HN2004000285A
(es)
*
|
2003-08-04 |
2006-04-27 |
Pfizer Prod Inc |
ANTICUERPOS DIRIGIDOS A c-MET
|
|
MXPA06002296A
(es)
*
|
2003-08-29 |
2006-05-22 |
Pfizer |
Tienopiridina-fenilacetamidas y sus derivados utiles como nuevos agentes antiangiogenicos.
|
|
WO2005021594A2
(en)
*
|
2003-08-29 |
2005-03-10 |
The Government Of The United States Of America, As Represented By The Secretary Of The Department Of Health And Human Services |
Minimally immunogenic variants of sdr-grafted humanized antibody cc49 and their use
|
|
BRPI0414011A
(pt)
*
|
2003-08-29 |
2006-10-24 |
Pfizer |
naftalencarboxamidas e seus derivados úteis como novos agentes antiangiogênicos
|
|
AR045563A1
(es)
|
2003-09-10 |
2005-11-02 |
Warner Lambert Co |
Anticuerpos dirigidos a m-csf
|
|
ZA200603619B
(en)
|
2003-11-06 |
2008-10-29 |
Seattle Genetics Inc |
Monomethylvaline compounds capable of conjugation to ligands
|
|
JP4901478B2
(ja)
|
2003-11-17 |
2012-03-21 |
ジェネンテック, インコーポレイテッド |
造血系起源の腫瘍の治療のための組成物と方法
|
|
US7671072B2
(en)
*
|
2003-11-26 |
2010-03-02 |
Pfizer Inc. |
Aminopyrazole derivatives as GSK-3 inhibitors
|
|
US8298532B2
(en)
*
|
2004-01-16 |
2012-10-30 |
Regeneron Pharmaceuticals, Inc. |
Fusion polypeptides capable of activating receptors
|
|
DE602005018325D1
(de)
|
2004-02-19 |
2010-01-28 |
Genentech Inc |
Antikörper mit korrigierten cdr
|
|
BRPI0509580A
(pt)
*
|
2004-03-30 |
2007-11-27 |
Pfizer Prod Inc |
combinações de inibidores de transdução de sinal
|
|
ZA200608130B
(en)
|
2004-03-31 |
2008-12-31 |
Genentech Inc |
Humanized anti-TGF-beta antibodies
|
|
US20150017671A1
(en)
|
2004-04-16 |
2015-01-15 |
Yaping Shou |
Methods for detecting lp-pla2 activity and inhibition of lp-pla2 activity
|
|
KR20120064120A
(ko)
|
2004-06-01 |
2012-06-18 |
제넨테크, 인크. |
항체 약물 접합체 및 방법
|
|
BRPI0510915A
(pt)
|
2004-06-04 |
2007-11-13 |
Genentech Inc |
método para o tratamento da esclerose múltipla e artigo manufaturado
|
|
SV2006002143A
(es)
|
2004-06-16 |
2006-01-26 |
Genentech Inc |
Uso de un anticuerpo para el tratamiento del cancer resistente al platino
|
|
KR20070036130A
(ko)
*
|
2004-07-16 |
2007-04-02 |
화이자 프로덕츠 인코포레이티드 |
항-아이지에프-1알 항체를 사용하는 비-혈액학적악성종양에 대한 조합 치료
|
|
EP1771474B1
(de)
|
2004-07-20 |
2010-01-27 |
Genentech, Inc. |
Angiopoietin-like 4 protein hemmer kombinationen und deren verwendung
|
|
US8604185B2
(en)
|
2004-07-20 |
2013-12-10 |
Genentech, Inc. |
Inhibitors of angiopoietin-like 4 protein, combinations, and their use
|
|
NZ552946A
(en)
*
|
2004-08-26 |
2010-09-30 |
Pfizer |
Pyrazole-substituted aminoheteroaryl compounds as protein kinase inhibitors
|
|
JP2008510792A
(ja)
*
|
2004-08-26 |
2008-04-10 |
ファイザー・インク |
タンパク質チロシンキナーゼ阻害剤としてのアミノヘテロアリール化合物
|
|
CN101023064B
(zh)
*
|
2004-08-26 |
2011-02-16 |
辉瑞大药厂 |
作为蛋白激酶抑制剂的对映异构体纯的氨基杂芳基化合物
|
|
ATE432469T1
(de)
*
|
2004-09-21 |
2009-06-15 |
Us Gov Health & Human Serv |
Auf immunreaktion gegen boris basierendes verfahren für den nachweis von krebs
|
|
US20100111856A1
(en)
|
2004-09-23 |
2010-05-06 |
Herman Gill |
Zirconium-radiolabeled, cysteine engineered antibody conjugates
|
|
NZ580115A
(en)
|
2004-09-23 |
2010-10-29 |
Genentech Inc |
Cysteine engineered antibody light chains and conjugates
|
|
JO3000B1
(ar)
|
2004-10-20 |
2016-09-05 |
Genentech Inc |
مركبات أجسام مضادة .
|
|
US20060107555A1
(en)
*
|
2004-11-09 |
2006-05-25 |
Curtis Marc D |
Universal snow plow adapter
|
|
EP2230517A1
(de)
|
2005-01-07 |
2010-09-22 |
Diadexus, Inc. |
OVR110-Antikörperzusammensetzungen und Verwendungsverfahren dafür
|
|
CN102580084B
(zh)
*
|
2005-01-21 |
2016-11-23 |
健泰科生物技术公司 |
Her抗体的固定剂量给药
|
|
AU2006213659A1
(en)
*
|
2005-02-09 |
2006-08-17 |
Genentech, Inc. |
Inhibiting HER2 shedding with matrix metalloprotease antagonists
|
|
KR101289537B1
(ko)
|
2005-02-15 |
2013-07-31 |
듀크 유니버시티 |
항-cd19 항체 및 종양학에서 이의 용도
|
|
US20060263357A1
(en)
|
2005-05-05 |
2006-11-23 |
Tedder Thomas F |
Anti-CD19 antibody therapy for autoimmune disease
|
|
CN103251946A
(zh)
|
2005-02-23 |
2013-08-21 |
健泰科生物技术公司 |
使用her二聚化抑制剂在癌症患者中延长病情进展前时间或存活
|
|
US20060204505A1
(en)
*
|
2005-03-08 |
2006-09-14 |
Sliwkowski Mark X |
Methods for identifying tumors responsive to treatment with HER dimerization inhibitors (HDIs)
|
|
AU2006230563B8
(en)
|
2005-03-31 |
2010-06-17 |
Agensys, Inc. |
Antibodies and related molecules that bind to 161P2F10B proteins
|
|
NZ562234A
(en)
|
2005-04-26 |
2009-09-25 |
Pfizer |
P-cadherin antibodies
|
|
JP2006316040A
(ja)
|
2005-05-13 |
2006-11-24 |
Genentech Inc |
Herceptin(登録商標)補助療法
|
|
WO2006132788A2
(en)
|
2005-06-06 |
2006-12-14 |
Genentech, Inc. |
Transgenic models for different genes and their use for gene characterization
|
|
AU2006269422B2
(en)
|
2005-07-07 |
2012-12-06 |
Seagen Inc. |
Monomethylvaline compounds having phenylalanine side-chain modifications at the C-terminus
|
|
AU2006280321A1
(en)
|
2005-08-15 |
2007-02-22 |
Genentech, Inc. |
Gene disruptions, compositions and methods relating thereto
|
|
HUE025608T2
(en)
*
|
2005-09-07 |
2016-03-29 |
Amgen Fremont Inc |
Human monoclonal antibody against activin receptor-like kinase-1 (ALK-1)
|
|
WO2007035744A1
(en)
|
2005-09-20 |
2007-03-29 |
Osi Pharmaceuticals, Inc. |
Biological markers predictive of anti-cancer response to insulin-like growth factor-1 receptor kinase inhibitors
|
|
WO2007056227A2
(en)
|
2005-11-04 |
2007-05-18 |
Genentech, Inc. |
Use of complement pathway inhibitors to treat ocular diseases
|
|
MY149159A
(en)
|
2005-11-15 |
2013-07-31 |
Hoffmann La Roche |
Method for treating joint damage
|
|
AU2006335053A1
(en)
|
2005-11-21 |
2007-07-19 |
Genentech, Inc. |
Novel gene disruptions, compositions and methods relating thereto
|
|
CN105859886A
(zh)
|
2005-12-02 |
2016-08-17 |
健泰科生物技术公司 |
牵涉与il-22和il-22r结合的抗体的组合物和方法
|
|
ES2535856T3
(es)
|
2005-12-15 |
2015-05-18 |
Genentech, Inc. |
Métodos y composiciones para dirigirse a la poliubiquitina
|
|
US7625759B2
(en)
|
2005-12-19 |
2009-12-01 |
Genentech, Inc. |
Method for using BOC/CDO to modulate hedgehog signaling
|
|
DK1973950T3
(en)
|
2006-01-05 |
2014-12-15 |
Genentech Inc |
ANTI-EphB4 ANTIBODIES AND METHODS FOR USING SAME
|
|
PE20081186A1
(es)
*
|
2006-01-13 |
2008-09-24 |
Irm Llc |
Metodos y composiciones para el tratamiento de enfermedades alergicas
|
|
CA2637387A1
(en)
|
2006-01-18 |
2007-07-26 |
Simon Goodman |
Specific therapy using integrin ligands for treating cancer
|
|
WO2007114979A2
(en)
|
2006-02-17 |
2007-10-11 |
Genentech, Inc. |
Gene disruptons, compositions and methods relating thereto
|
|
EP2540741A1
(de)
|
2006-03-06 |
2013-01-02 |
Aeres Biomedical Limited |
Humanisierte Anti-CD22-Antikörper und ihre Verwendung bei der Behandlung von Krebs, Transplantationen und Autoimmunerkrankungen
|
|
AR059851A1
(es)
|
2006-03-16 |
2008-04-30 |
Genentech Inc |
Anticuerpos de la egfl7 y metodos de uso
|
|
US8940871B2
(en)
|
2006-03-20 |
2015-01-27 |
The Regents Of The University Of California |
Engineered anti-prostate stem cell antigen (PSCA) antibodies for cancer targeting
|
|
EP2389947A1
(de)
|
2006-03-23 |
2011-11-30 |
Novartis AG |
Antitumorzellenantigen-Antikörper-Therapeutika
|
|
WO2007126455A2
(en)
|
2006-04-05 |
2007-11-08 |
Genentech, Inc. |
Method for using boc/cdo to modulate hedgehog signaling
|
|
US20090288176A1
(en)
|
2006-04-19 |
2009-11-19 |
Genentech, Inc. |
Novel Gene Disruptions, Compositions and Methods Relating Thereto
|
|
RS20080525A
(en)
|
2006-05-09 |
2009-09-08 |
Pfizer Products Inc., |
Cycloalkylamino acid derivatives and pharmaceutical compositions thereof
|
|
NL2000613C2
(nl)
|
2006-05-11 |
2007-11-20 |
Pfizer Prod Inc |
Triazoolpyrazinederivaten.
|
|
RS53168B
(en)
|
2006-05-30 |
2014-06-30 |
Genentech Inc. |
Antibodies and Immunoconjugates and Their Use
|
|
AU2007254942B2
(en)
|
2006-06-02 |
2011-10-27 |
Aveo Pharmaceuticals, Inc. |
Hepatocyte growth factor (HGF) binding proteins
|
|
NZ573819A
(en)
|
2006-06-02 |
2011-09-30 |
Aveo Pharmaceuticals Inc |
Hepatocyte growth factor (hgf) binding proteins
|
|
FR2902799B1
(fr)
|
2006-06-27 |
2012-10-26 |
Millipore Corp |
Procede et unite de preparation d'un echantillon pour l'analyse microbiologique d'un liquide
|
|
RU2499001C2
(ru)
|
2006-06-30 |
2013-11-20 |
Ново Нордиск А/С |
Антитела к nkg2a и их применения
|
|
AU2007275654A1
(en)
|
2006-07-19 |
2008-01-24 |
The Trustees Of The University Of Pennsylvania |
WSX-1/p28 as a target for anti-inflammatory responses
|
|
EP2079483A4
(de)
|
2006-07-29 |
2010-10-20 |
Robert Lamar Bjork Jr |
Bispezifische monoklonale antikörper (spezifisch für cd3 und cd11b)-therapeutische arzneimittelsysteme
|
|
JP5244103B2
(ja)
|
2006-08-09 |
2013-07-24 |
ホームステッド クリニカル コーポレイション |
器官特異的蛋白質およびその使用方法
|
|
EP2423332A1
(de)
|
2006-08-25 |
2012-02-29 |
Oncotherapy Science, Inc. |
Prognosemarker und therapeutische Targets für Lungenkrebs
|
|
DK2066349T3
(da)
|
2006-09-08 |
2012-07-09 |
Medimmune Llc |
Humaniseret anti-cd19-antistoffer og anvendelse heraf i behandling af tumorer, transplantation og autoimmune sygdomme
|
|
EP2067043B1
(de)
|
2006-09-08 |
2013-07-17 |
University of Oxford |
Klinische diagnose von leberfibrose mit hilfe von inter-alpha-trypsin inhibitor heavy chain h4
|
|
US20080076139A1
(en)
|
2006-09-21 |
2008-03-27 |
Sharat Singh |
Methods and compositions for detecting the activation states of multiple signal transducers in rare circulating cells
|
|
RS53942B1
(en)
|
2006-10-27 |
2015-08-31 |
Genentech Inc. |
Antibodies and Immunoconjugates and Their Use
|
|
NZ576272A
(en)
|
2006-11-14 |
2012-01-12 |
Genentech Inc |
Modulators of neuronal regeneration
|
|
EP2121743B1
(de)
|
2006-11-22 |
2015-06-03 |
Bristol-Myers Squibb Company |
Gezielte therapeutika auf der basis von manipulierten proteinen für tyrosinkinaserezeptoren, einschliesslich igf-ir
|
|
AU2007325283B2
(en)
|
2006-11-27 |
2012-08-30 |
Diadexus, Inc. |
Ovr110 antibody compositions and methods of use
|
|
WO2008076960A2
(en)
|
2006-12-18 |
2008-06-26 |
Genentech, Inc. |
Antagonist anti-notch3 antibodies and their use in the prevention and treatment of notch3-related diseases
|
|
US8362217B2
(en)
|
2006-12-21 |
2013-01-29 |
Emd Millipore Corporation |
Purification of proteins
|
|
US8569464B2
(en)
|
2006-12-21 |
2013-10-29 |
Emd Millipore Corporation |
Purification of proteins
|
|
US20100267933A1
(en)
|
2006-12-21 |
2010-10-21 |
Moya Wilson |
Purification of proteins
|
|
EP2094303A1
(de)
*
|
2006-12-22 |
2009-09-02 |
Novelix Therapeutics Gmbh |
Behandlung von diabetes mit mindestens einem für epidermalen wachstumsfaktor-rezeptor-spezifischen antikörper oder ein derivat davon
|
|
WO2008087025A2
(en)
|
2007-01-18 |
2008-07-24 |
Merck Patent Gmbh |
Specific therapy and medicament using integrin ligands for treating cancer
|
|
BRPI0806403A2
(pt)
|
2007-02-09 |
2011-09-06 |
Genentech Inc |
anticorpo anti-robo4, usode um anticorpo e método de obtenção de imagem
|
|
KR101508397B1
(ko)
|
2007-02-22 |
2015-04-08 |
제넨테크, 인크. |
염증성 장 질환의 검출 방법
|
|
WO2008109440A2
(en)
|
2007-03-02 |
2008-09-12 |
Genentech, Inc. |
Predicting response to a her dimerisation inhibitor based on low her3 expression
|
|
US7960139B2
(en)
|
2007-03-23 |
2011-06-14 |
Academia Sinica |
Alkynyl sugar analogs for the labeling and visualization of glycoconjugates in cells
|
|
AU2008239594B2
(en)
|
2007-04-13 |
2013-10-24 |
Beth Israel Deaconess Medical Center |
Methods for treating cancer resistant to ErbB therapeutics
|
|
EP2703011A3
(de)
|
2007-05-07 |
2014-03-26 |
MedImmune, LLC |
Anti-Icos-Antikörper und ihre Verwendung bei der Behandlung von Krebs, Transplantationen und Autoimmunerkrankungen
|
|
WO2008141278A1
(en)
*
|
2007-05-11 |
2008-11-20 |
Centocor, Inc. |
Method for preparing antibody conjugates
|
|
ES2583377T3
(es)
|
2007-06-08 |
2016-09-20 |
Genentech, Inc. |
Marcadores de expresión génica de la resistencia tumoral al tratamiento con inhibidor de HER2
|
|
US9551033B2
(en)
|
2007-06-08 |
2017-01-24 |
Genentech, Inc. |
Gene expression markers of tumor resistance to HER2 inhibitor treatment
|
|
ES2751022T3
(es)
|
2007-07-09 |
2020-03-30 |
Genentech Inc |
Prevención de la reducción de enlaces disulfuro durante la producción recombinante de polipéptidos
|
|
US9845355B2
(en)
|
2007-07-16 |
2017-12-19 |
Genentech, Inc. |
Humanized anti-CD79b antibodies and immunoconjugates and methods of use
|
|
PL2474557T3
(pl)
|
2007-07-16 |
2015-02-27 |
Genentech Inc |
Przeciwciała anty- CD79b i immunokoniugaty i sposoby stosowania
|
|
EP2190478B1
(de)
|
2007-08-24 |
2016-03-23 |
Oncotherapy Science, Inc. |
Dkk1-onkogen als therapeutisches ziel für krebs und diagnostischer marker
|
|
US20120022128A1
(en)
|
2007-08-24 |
2012-01-26 |
Oncotherapy Science, Inc. |
PKIB and NAALADL2 for Target Genes of Prostate Cancer Therapy and Diagnosis
|
|
US20110152345A1
(en)
|
2007-08-24 |
2011-06-23 |
Oncotherapy Science, Inc. |
Ebi3, dlx5, nptx1 and cdkn3 for target genes of lung cancer therapy and diagnosis
|
|
ES2672769T3
(es)
|
2007-08-29 |
2018-06-18 |
Sanofi |
Anticuerpos anti-CXCR5 humanizados, derivados de los mismos y sus usos
|
|
US8940298B2
(en)
|
2007-09-04 |
2015-01-27 |
The Regents Of The University Of California |
High affinity anti-prostate stem cell antigen (PSCA) antibodies for cancer targeting and detection
|
|
JP5518711B2
(ja)
|
2007-09-07 |
2014-06-11 |
アジェンシス,インコーポレイテッド |
24p4c12タンパク質に結合する抗体および関連分子
|
|
MX342551B
(es)
|
2007-09-26 |
2016-10-04 |
Chugai Pharmaceutical Co Ltd |
Region constante de anticuerpo modificada.
|
|
US8691222B2
(en)
|
2007-10-02 |
2014-04-08 |
Genentech, Inc. |
NLRR-1 antagonists and uses thereof
|
|
EP2050764A1
(de)
|
2007-10-15 |
2009-04-22 |
sanofi-aventis |
Neues polyvalentes bispezifisches Antikörperformat und Verwendung
|
|
DK2233149T3
(en)
|
2007-10-16 |
2016-05-17 |
Zymogenetics Inc |
COMBINATION OF TRANSMEMBRANAKTIVATOR AND CALCIUM MODULATOR AND cyclophilin-LIGAND INTERAKTOR (TACI) AND ANTI-CD20 MEANS FOR TREATMENT OF AUTO-IMMUNE DISEASE
|
|
EP3441402A1
(de)
|
2007-10-30 |
2019-02-13 |
Genentech, Inc. |
Antikörperreinigung durch kationenaustauschchromatographie
|
|
CN104888193A
(zh)
|
2007-11-07 |
2015-09-09 |
健泰科生物技术公司 |
用于治疗微生物病症的组合物和方法
|
|
MX2010005244A
(es)
|
2007-11-12 |
2010-10-25 |
Theraclone Sciences Inc |
Composiciones y métodos para la terapia y el diagnóstico de influenza.
|
|
CA2706729A1
(en)
|
2007-11-29 |
2009-06-11 |
Genentech, Inc. |
Gene expression markers for inflammatory bowel disease
|
|
TWI468417B
(zh)
|
2007-11-30 |
2015-01-11 |
Genentech Inc |
抗-vegf抗體
|
|
CN110698561A
(zh)
|
2007-12-14 |
2020-01-17 |
诺沃—诺迪斯克有限公司 |
抗人nkg2d抗体及其用途
|
|
EP2235536A4
(de)
|
2007-12-20 |
2011-05-04 |
Lab Corp America Holdings |
Her-2-diagnoseverfahren
|
|
US8253725B2
(en)
*
|
2007-12-28 |
2012-08-28 |
St. Jude Medical, Atrial Fibrillation Division, Inc. |
Method and system for generating surface models of geometric structures
|
|
US7914785B2
(en)
|
2008-01-02 |
2011-03-29 |
Bergen Teknologieverforing As |
B-cell depleting agents, like anti-CD20 antibodies or fragments thereof for the treatment of chronic fatigue syndrome
|
|
EP2077281A1
(de)
|
2008-01-02 |
2009-07-08 |
Bergen Teknologioverforing AS |
Anti-CD20-Antikörper oder Fragmente davon zur Behandlung von chronischen Ermüdungssyndrom
|
|
AR070141A1
(es)
|
2008-01-23 |
2010-03-17 |
Glenmark Pharmaceuticals Sa |
Anticuerpos humanizados especificos para el factor von willebrand
|
|
MX2010007935A
(es)
|
2008-01-24 |
2010-08-23 |
Novo Nordisk As |
Anticuerpo monoclonal humanizado anti-nkg2a humano.
|
|
EP2238162A1
(de)
*
|
2008-01-24 |
2010-10-13 |
The Government of the United States of America as represented by The Secretary of the Department of Health and Human Services |
Induzierte internalisierung von oberflächenrezeptoren
|
|
TWI472339B
(zh)
|
2008-01-30 |
2015-02-11 |
Genentech Inc |
包含結合至her2結構域ii之抗體及其酸性變異體的組合物
|
|
RU2553566C2
(ru)
|
2008-01-31 |
2015-06-20 |
Дженентек, Инк. |
АНТИ-CD79b АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
|
|
AU2009213141A1
(en)
|
2008-02-14 |
2009-08-20 |
Bristol-Myers Squibb Company |
Targeted therapeutics based on engineered proteins that bind EGFR
|
|
ES2398618T3
(es)
|
2008-02-25 |
2013-03-20 |
Nestec S.A. |
Selección de fármacos para terapia del cáncer de mama utilizando matrices de anticuerpos
|
|
ES2542308T3
(es)
|
2008-03-10 |
2015-08-04 |
Theraclone Sciences, Inc. |
Composiciones y métodos para la terapia y diagnóstico de infecciones por citomegalovirus
|
|
ES2545977T3
(es)
|
2008-03-18 |
2015-09-17 |
Genentech, Inc. |
Combinaciones de un conjugado de anticuerpo-fármaco anti-HER2 y agentes quimioterapéuticos, y métodos de uso
|
|
ES2354661B1
(es)
|
2008-05-08 |
2012-02-01 |
Consejo Superior De Investigaciones Científicas (Csic) |
Método para generar anticuerpos monoclonales que reconocen antígenos de membrana de células progenitoras neurales, anticuerpos producidos por dicho método, y usos.
|
|
US8093018B2
(en)
|
2008-05-20 |
2012-01-10 |
Otsuka Pharmaceutical Co., Ltd. |
Antibody identifying an antigen-bound antibody and an antigen-unbound antibody, and method for preparing the same
|
|
EP2799448A1
(de)
|
2008-05-22 |
2014-11-05 |
Bristol-Myers Squibb Company |
Polyvalente Proteine mit Fibronectin-Gerüstdomänen
|
|
WO2009151514A1
(en)
|
2008-06-11 |
2009-12-17 |
Millipore Corporation |
Stirred tank bioreactor
|
|
BRPI0812682A2
(pt)
|
2008-06-16 |
2010-06-22 |
Genentech Inc |
tratamento de cáncer de mama metastático
|
|
DK2318832T3
(da)
|
2008-07-15 |
2014-01-20 |
Academia Sinica |
Glycan-arrays på PTFE-lignende aluminiumcoatede objektglas og relaterede fremgangsmåder
|
|
US20100029675A1
(en)
*
|
2008-07-25 |
2010-02-04 |
Hwang Soo-In |
Pyrimidine-2, 4-diamine JAK2 Kinase inhibiting anti-inflammation use
|
|
DK3604324T3
(da)
|
2008-08-14 |
2024-04-08 |
Genentech Inc |
Fremgangsmåder til at fjerne en kontaminant under anvendelse af ionbytningskromatografi med forskydning af iboende proteiner
|
|
CN102282172B
(zh)
|
2008-09-07 |
2014-02-19 |
台湾醣联生技医药股份有限公司 |
抗伸展的ⅰ型鞘糖脂抗体、其衍生物以及用途
|
|
AR073295A1
(es)
|
2008-09-16 |
2010-10-28 |
Genentech Inc |
Metodos para tratar la esclerosis multiple progresiva. articulo de fabricacion.
|
|
WO2010045495A2
(en)
|
2008-10-16 |
2010-04-22 |
University Of Pittsburgh-Of The Commonwealth System Of Higher Education |
Fully human antibodies to high molecular weight-melanoma associated antigen and uses thereof
|
|
KR20110081862A
(ko)
|
2008-10-22 |
2011-07-14 |
제넨테크, 인크. |
축삭 변성의 조절
|
|
AU2009308707A1
(en)
|
2008-10-31 |
2010-05-06 |
Biogen Idec Ma Inc. |
LIGHT targeting molecules and uses thereof
|
|
US20110293605A1
(en)
|
2008-11-12 |
2011-12-01 |
Hasige Sathish |
Antibody formulation
|
|
CA2742871C
(en)
|
2008-11-13 |
2018-10-23 |
Herb Lin |
Methods and compositions for regulating iron homeostasis by modulation of bmp-6
|
|
KR20110112301A
(ko)
|
2008-11-18 |
2011-10-12 |
메리맥 파마슈티컬즈, 인크. |
인간 혈청 알부민 링커 및 그 콘쥬게이트
|
|
HUE032693T2
(en)
|
2008-11-22 |
2017-10-30 |
Hoffmann La Roche |
Use of anti-vegf antibody in combination with chemotherapy to treat breast cancer
|
|
US8211434B2
(en)
|
2008-11-26 |
2012-07-03 |
Allergan, Inc. |
KLK-13 antibody inhibitor for treating dry eye
|
|
EP2438442B1
(de)
|
2008-12-01 |
2017-08-09 |
Laboratory Corporation of America Holdings |
Verfahren und tests zur messung von p95 und/oder p95-komlexen in einer probe und für p95 spezifische antikörper
|
|
SG10201708690SA
(en)
|
2008-12-09 |
2017-12-28 |
Genentech Inc |
Anti-pd-l1 antibodies and their use to enhance t-cell function
|
|
SG171446A1
(en)
|
2008-12-16 |
2011-07-28 |
Millipore Corp |
Stirred tank reactor and method
|
|
EP2358734A1
(de)
|
2008-12-16 |
2011-08-24 |
Millipore Corporation |
Aufreinigung von proteinen
|
|
JP2012512261A
(ja)
|
2008-12-17 |
2012-05-31 |
ジェネンテック, インコーポレイテッド |
C型肝炎ウイルス併用療法
|
|
WO2010075249A2
(en)
|
2008-12-22 |
2010-07-01 |
Genentech, Inc. |
A method for treating rheumatoid arthritis with b-cell antagonists
|
|
JP5746051B2
(ja)
|
2009-01-15 |
2015-07-08 |
ラボラトリー コーポレイション オブ アメリカ ホールディングス |
Her−3の測定による患者の反応を判定する方法
|
|
EP2393814A1
(de)
*
|
2009-02-09 |
2011-12-14 |
SuperGen, Inc. |
Pyrrolopyrimidinylverbindungen als axl-kinase-inhibitoren
|
|
EP3495000A1
(de)
|
2009-02-17 |
2019-06-12 |
Cornell Research Foundation, Inc. |
Verfahren und kits zur diagnose von krebs und vorhersage des therapeutischen werts
|
|
WO2010095031A2
(en)
|
2009-02-23 |
2010-08-26 |
Glenmark Pharmaceuticals S.A. |
Humanized antibodies that bind to cd19 and their uses
|
|
JP2012518657A
(ja)
|
2009-02-25 |
2012-08-16 |
オーエスアイ・ファーマシューティカルズ,エルエルシー |
併用抗癌治療
|
|
WO2010099137A2
(en)
|
2009-02-26 |
2010-09-02 |
Osi Pharmaceuticals, Inc. |
In situ methods for monitoring the emt status of tumor cells in vivo
|
|
TW201035088A
(en)
|
2009-02-27 |
2010-10-01 |
Supergen Inc |
Cyclopentathiophene/cyclohexathiophene DNA methyltransferase inhibitors
|
|
US8465912B2
(en)
|
2009-02-27 |
2013-06-18 |
OSI Pharmaceuticals, LLC |
Methods for the identification of agents that inhibit mesenchymal-like tumor cells or their formation
|
|
WO2010099138A2
(en)
|
2009-02-27 |
2010-09-02 |
Osi Pharmaceuticals, Inc. |
Methods for the identification of agents that inhibit mesenchymal-like tumor cells or their formation
|
|
EP2401614A1
(de)
|
2009-02-27 |
2012-01-04 |
OSI Pharmaceuticals, LLC |
Verfahren zur identifizierung von mesenchymähnlichen tumorzellen oder deren bildung hemmenden stoffen
|
|
WO2010106535A1
(en)
|
2009-03-15 |
2010-09-23 |
Technion Research And Development Foundation Ltd. |
Soluble hla complexes for use in disease diagnosis
|
|
SI3260136T1
(sl)
|
2009-03-17 |
2021-05-31 |
Theraclone Sciences, Inc. |
Humani imunodeficientni virus (HIV)-nevtralizirajoča protitelesa
|
|
MA33198B1
(fr)
|
2009-03-20 |
2012-04-02 |
Genentech Inc |
Anticorps anti-her di-spécifiques
|
|
CN102378767B
(zh)
|
2009-03-25 |
2015-01-14 |
健泰科生物技术公司 |
抗-fgfr3抗体及其使用方法
|
|
NZ595574A
(en)
|
2009-04-01 |
2013-11-29 |
Genentech Inc |
Anti-fcrh5 antibodies and immunoconjugates and methods of use
|
|
CA2752908A1
(en)
|
2009-04-01 |
2010-10-07 |
Genentech, Inc. |
Treatment of insulin-resistant disorders
|
|
US20100256340A1
(en)
|
2009-04-07 |
2010-10-07 |
Ulrich Brinkmann |
Trivalent, bispecific antibodies
|
|
US20100297127A1
(en)
|
2009-04-08 |
2010-11-25 |
Ghilardi Nico P |
Use of il-27 antagonists to treat lupus
|
|
US8753631B2
(en)
*
|
2009-05-01 |
2014-06-17 |
New York University |
Therapeutic agents for inducing platelet fragmentation and treating thromboembolic disorders
|
|
CN105866423A
(zh)
|
2009-05-14 |
2016-08-17 |
牛津大学之校长及学者 |
使用一组新型低丰度人类血浆蛋白生物标记对肝纤维化进行临床诊断
|
|
EP2432803A2
(de)
|
2009-05-20 |
2012-03-28 |
Theraclone Sciences, Inc. |
Zusammensetzungen und verfahren zur therapie und diagnose von grippe
|
|
US20120130146A1
(en)
|
2009-05-25 |
2012-05-24 |
Merck Patent Gmbh |
Continuous administration of cilengitide in cancer treatments
|
|
SG176073A1
(en)
|
2009-05-29 |
2011-12-29 |
Hoffmann La Roche |
Modulators for her2 signaling in her2 expressing patients with gastric cancer
|
|
US9676845B2
(en)
|
2009-06-16 |
2017-06-13 |
Hoffmann-La Roche, Inc. |
Bispecific antigen binding proteins
|
|
MX2011013748A
(es)
|
2009-06-23 |
2012-04-20 |
Alexion Pharma Inc |
Anticuerpos biespecificos que se unen a proteinas de complemento.
|
|
CN102471381A
(zh)
|
2009-07-07 |
2012-05-23 |
霍夫曼-拉罗奇有限公司 |
自身免疫性脱髓鞘疾病的诊断和治疗
|
|
JP5795311B2
(ja)
|
2009-07-15 |
2015-10-14 |
ネステク ソシエテ アノニム |
抗体ベースのアレイを使用する胃癌療法のための薬物選択
|
|
US20110033486A1
(en)
|
2009-07-20 |
2011-02-10 |
Abbas Alexander R |
Gene expression markers for crohn's disease
|
|
TW201106972A
(en)
|
2009-07-27 |
2011-03-01 |
Genentech Inc |
Combination treatments
|
|
SG178177A1
(en)
|
2009-07-31 |
2012-03-29 |
Genentech Inc |
Inhibition of tumor metastasis using bv8- or g-csf-antagonists
|
|
US20130017188A1
(en)
|
2009-07-31 |
2013-01-17 |
The Brigham And Women's Hospital, Inc. |
Modulation of sgk1 expression in th17 cells to modulate th17-mediated immune responses
|
|
US20110039300A1
(en)
|
2009-08-10 |
2011-02-17 |
Robert Bayer |
Antibodies with enhanced adcc functions
|
|
LT2464725T
(lt)
|
2009-08-11 |
2020-06-10 |
F. Hoffmann-La Roche Ag |
Baltymų gamyba ląstelių mitybinėje terpėje, kurioje nėra glutamino
|
|
US20110038871A1
(en)
|
2009-08-11 |
2011-02-17 |
Veena Viswanth |
Ccr2 inhibitors for treating conditions of the eye
|
|
WO2011019622A1
(en)
|
2009-08-14 |
2011-02-17 |
Genentech, Inc. |
Cell culture methods to make antibodies with enhanced adcc function
|
|
TW201431558A
(zh)
|
2009-08-15 |
2014-08-16 |
建南德克公司 |
用於治療先前治療過之乳癌之抗-血管新生療法
|
|
JP2013503846A
(ja)
|
2009-09-01 |
2013-02-04 |
ファイザー・インク |
ベンズイミダゾール誘導体
|
|
EP2473617B1
(de)
|
2009-09-01 |
2020-02-26 |
F.Hoffmann-La Roche Ag |
Verstärkte proteinreinigung durch modifizierte protein-a-elution
|
|
DK2473522T3
(en)
|
2009-09-02 |
2016-11-28 |
Genentech Inc |
Smoothened MUTANT AND METHODS OF USING THE SAME
|
|
NZ701769A
(en)
|
2009-09-16 |
2016-06-24 |
Genentech Inc |
Coiled coil and/or tether containing protein complexes and uses thereof
|
|
NZ599460A
(en)
|
2009-10-20 |
2014-07-25 |
Nestec Sa |
Proximity-mediated assays for detecting oncogenic fusion proteins
|
|
RU2539772C2
(ru)
|
2009-10-22 |
2015-01-27 |
Дженентек, Инк. |
Способы и композиции для модуляции гепсином стимулирующего макрофаги белка
|
|
KR20120105447A
(ko)
|
2009-10-22 |
2012-09-25 |
제넨테크, 인크. |
항-헵신 항체 및 그의 사용 방법
|
|
MX2012004638A
(es)
|
2009-10-22 |
2012-07-04 |
Genentech Inc |
Modulacion de degeneracion de axones.
|
|
WO2011056497A1
(en)
|
2009-10-26 |
2011-05-12 |
Genentech, Inc. |
Activin receptor type iib compositions and methods of use
|
|
WO2011056494A1
(en)
|
2009-10-26 |
2011-05-12 |
Genentech, Inc. |
Activin receptor-like kinase-1 antagonist and vegfr3 antagonist combinations
|
|
WO2011056502A1
(en)
|
2009-10-26 |
2011-05-12 |
Genentech, Inc. |
Bone morphogenetic protein receptor type ii compositions and methods of use
|
|
JP6007420B2
(ja)
|
2009-11-04 |
2016-10-12 |
ファブラス エルエルシー |
親和性成熟に基づく抗体最適化方法
|
|
ES2636971T3
(es)
|
2009-11-05 |
2017-10-10 |
F. Hoffmann-La Roche Ag |
Procedimientos y composición para la secreción de polipéptidos heterógenos
|
|
PE20121584A1
(es)
|
2009-11-30 |
2012-11-29 |
Genentech Inc |
Composiciones y metodos para el diagnostico y el tratamiento de tumores
|
|
US11377485B2
(en)
|
2009-12-02 |
2022-07-05 |
Academia Sinica |
Methods for modifying human antibodies by glycan engineering
|
|
US10087236B2
(en)
|
2009-12-02 |
2018-10-02 |
Academia Sinica |
Methods for modifying human antibodies by glycan engineering
|
|
CA2782333C
(en)
|
2009-12-02 |
2019-06-04 |
Imaginab, Inc. |
J591 minibodies and cys-diabodies for targeting human prostate specific membrane antigen (psma) and methods for their use
|
|
TWI505836B
(zh)
|
2009-12-11 |
2015-11-01 |
Genentech Inc |
抗-vegf-c抗體及其使用方法
|
|
SG181834A1
(en)
|
2009-12-21 |
2012-07-30 |
Genentech Inc |
Antibody formulation
|
|
PL2516465T3
(pl)
|
2009-12-23 |
2016-11-30 |
|
Przeciwciała anty-bv8 i ich zastosowania
|
|
ES2701626T3
(es)
|
2009-12-28 |
2019-02-25 |
Oncotherapy Science Inc |
Anticuerpos anti-CDH3 y sus usos
|
|
US20110159588A1
(en)
|
2009-12-30 |
2011-06-30 |
Kui Lin |
Methods for Modulating a PDGF-AA Mediated Biological Response
|
|
RU2573994C2
(ru)
|
2010-02-10 |
2016-01-27 |
Иммьюноджен, Инк |
Антитела против cd20 и их применение
|
|
ES2753748T3
(es)
|
2010-02-12 |
2020-04-14 |
Pfizer |
Sales y polimorfos de 8-fluoro-2-{4-[(metilamino}metil]fenil}-1,3,4,5-tetrahidro-6H-azepino[5,4,3-cd]indol-6-ona
|
|
MX2012008958A
(es)
|
2010-02-18 |
2012-08-23 |
Genentech Inc |
Antagonista de neurogulina y usos de los mismos para el tratamiento contra el cancer.
|
|
EP2539435A2
(de)
*
|
2010-02-23 |
2013-01-02 |
Corning Incorporated |
Modifizierte substrate für den schutz von peptidimmobilisierten oberflächen aus gammastrahlungsabbau
|
|
KR20180028561A
(ko)
|
2010-02-23 |
2018-03-16 |
제넨테크, 인크. |
난소암의 치료를 위한 항혈관신생 요법
|
|
KR20130004579A
(ko)
|
2010-02-23 |
2013-01-11 |
제넨테크, 인크. |
종양의 진단 및 치료를 위한 조성물 및 방법
|
|
CA2783656A1
(en)
|
2010-03-03 |
2011-09-09 |
OSI Pharmaceuticals, LLC |
Biological markers predictive of anti-cancer response to insulin-like growth factor-1 receptor kinase inhibitors
|
|
WO2011109584A2
(en)
|
2010-03-03 |
2011-09-09 |
OSI Pharmaceuticals, LLC |
Biological markers predictive of anti-cancer response to insulin-like growth factor-1 receptor kinase inhibitors
|
|
WO2011116396A2
(en)
|
2010-03-19 |
2011-09-22 |
The Board Of Trustees Of The Leland Stanford Junior University |
Hepatocyte growth factor fragments that function as potent met receptor agonists and antagonists
|
|
BR112012022044A2
(pt)
|
2010-03-24 |
2020-08-25 |
Genentech Inc |
''anticorpo,imunoconjugado,formulação farmacêutica,uso do anticorpo,método de tratamento,anticorpo biespecifico isolado e célula hospedeira''.
|
|
TW201138821A
(en)
|
2010-03-26 |
2011-11-16 |
Roche Glycart Ag |
Bispecific antibodies
|
|
WO2011130332A1
(en)
|
2010-04-12 |
2011-10-20 |
Academia Sinica |
Glycan arrays for high throughput screening of viruses
|
|
WO2011133931A1
(en)
|
2010-04-22 |
2011-10-27 |
Genentech, Inc. |
Use of il-27 antagonists for treating inflammatory bowel disease
|
|
CN107090045A
(zh)
|
2010-05-03 |
2017-08-25 |
霍夫曼-拉罗奇有限公司 |
用于肿瘤诊断和治疗的组合物和方法
|
|
EP2568976B1
(de)
|
2010-05-10 |
2015-09-30 |
Academia Sinica |
Zanamivir-phosphinat-kongenere mit antigrippewirkung und bestimmung der oseltamivir-empfänglichkeit von influenzaviren
|
|
SG10201804385YA
(en)
|
2010-05-17 |
2018-06-28 |
Emd Millipore Corp |
Stimulus responsive polymers for the purification of biomolecules
|
|
WO2011146568A1
(en)
|
2010-05-19 |
2011-11-24 |
Genentech, Inc. |
Predicting response to a her inhibitor
|
|
MY161534A
(en)
|
2010-05-25 |
2017-04-28 |
Genentech Inc |
Methods of purifying polypeptides
|
|
WO2011147834A1
(en)
|
2010-05-26 |
2011-12-01 |
Roche Glycart Ag |
Antibodies against cd19 and uses thereof
|
|
MX343604B
(es)
|
2010-05-28 |
2016-11-11 |
Genentech Inc |
Disminuir nivel de lactato e incrementar producción de polipéptidos por regulación a la baja de la expresión de lactato dehidrogenasa y piruvato dehidrogenasa quinasa.
|
|
WO2011153243A2
(en)
|
2010-06-02 |
2011-12-08 |
Genentech, Inc. |
Anti-angiogenesis therapy for treating gastric cancer
|
|
AU2011261362B2
(en)
|
2010-06-03 |
2016-06-09 |
Genentech, Inc. |
Immuno-pet imaging of antibodies and immunoconjugates and uses therefor
|
|
SG10201600791TA
(en)
|
2010-06-08 |
2016-03-30 |
Genentech Inc |
Cysteine engineered antibodies and conjugates
|
|
US20110311527A1
(en)
|
2010-06-16 |
2011-12-22 |
Allergan, Inc. |
IL23p19 ANTIBODY INHIBITOR FOR TREATING OCULAR AND OTHER CONDITIONS
|
|
EP2582727B8
(de)
|
2010-06-16 |
2017-04-19 |
University of Pittsburgh- Of the Commonwealth System of Higher Education |
Antikörper zu endoplasmin und deren verwendung
|
|
CN103080136B
(zh)
|
2010-06-18 |
2015-08-12 |
霍夫曼-拉罗奇有限公司 |
抗Axl抗体及使用方法
|
|
WO2011161119A1
(en)
|
2010-06-22 |
2011-12-29 |
F. Hoffmann-La Roche Ag |
Antibodies against insulin-like growth factor i receptor and uses thereof
|
|
WO2011161189A1
(en)
|
2010-06-24 |
2011-12-29 |
F. Hoffmann-La Roche Ag |
Anti-hepsin antibodies and methods of use
|
|
NZ605449A
(en)
|
2010-07-09 |
2015-03-27 |
Genentech Inc |
Anti-neuropilin antibodies and methods of use
|
|
CA2805338A1
(en)
|
2010-07-16 |
2012-01-19 |
Merck Patent Gmbh |
Peptide for use in the treatment of breast cancer and/or bone metastases
|
|
WO2012010582A1
(en)
|
2010-07-21 |
2012-01-26 |
Roche Glycart Ag |
Anti-cxcr5 antibodies and methods of use
|
|
JP2013538191A
(ja)
|
2010-07-23 |
2013-10-10 |
トラスティーズ オブ ボストン ユニバーシティ |
病的血管新生および腫瘍細胞侵襲性の阻害のための治療法としてならびに分子イメージングおよび標的化送達のための抗DEsupR阻害剤
|
|
BR112013002535A2
(pt)
|
2010-08-03 |
2019-09-24 |
Hoffmann La Roche |
biomarcadores de leucemia linfocítica crônica (cll)
|
|
RU2013106217A
(ru)
|
2010-08-05 |
2014-09-10 |
Ф. Хоффманн-Ля Рош Аг |
Гибридный белок из антитела против мнс и противовирусного цитокина
|
|
AU2011289275A1
(en)
|
2010-08-12 |
2013-02-21 |
Theraclone Sciences, Inc. |
Anti-hemagglutinin antibody compositions and methods of use thereof
|
|
EP2420250A1
(de)
|
2010-08-13 |
2012-02-22 |
Universitätsklinikum Münster |
Anti-Syndecan-4-Antikörper
|
|
MX2013001336A
(es)
|
2010-08-13 |
2013-03-08 |
Roche Glycart Ag |
Anticuerpos ani-tenascina c a2 y metodos de utilizacion.
|
|
AU2011288487B2
(en)
|
2010-08-13 |
2015-10-01 |
Roche Glycart Ag |
Anti-FAP antibodies and methods of use
|
|
CN103068846B9
(zh)
|
2010-08-24 |
2016-09-28 |
弗·哈夫曼-拉罗切有限公司 |
包含二硫键稳定性Fv片段的双特异性抗体
|
|
EP2609117B1
(de)
|
2010-08-25 |
2015-09-16 |
F.Hoffmann-La Roche Ag |
Antikörper gegen il-18r1 und ihre verwendung
|
|
ES2774369T3
(es)
|
2010-08-31 |
2020-07-20 |
Theraclone Science Int |
Anticuerpo de neutralización del virus de la inmunodeficiencia humana
|
|
DK2612151T3
(en)
|
2010-08-31 |
2017-10-02 |
Genentech Inc |
BIOMARKETS AND METHODS OF TREATMENT
|
|
WO2012028683A1
(en)
|
2010-09-02 |
2012-03-08 |
Novartis Ag |
Antibody gel system for sustained drug delivery
|
|
WO2012030512A1
(en)
|
2010-09-03 |
2012-03-08 |
Percivia Llc. |
Flow-through protein purification process
|
|
MX349622B
(es)
|
2010-09-08 |
2017-08-07 |
Halozyme Inc |
Metodos para evaluar e identificar o evolucionar proteinas terapeuticas condicionalmente activas.
|
|
AU2011312205B2
(en)
|
2010-10-05 |
2015-08-13 |
Curis, Inc. |
Mutant smoothened and methods of using the same
|
|
JP5802756B2
(ja)
|
2010-10-20 |
2015-11-04 |
ファイザー・インク |
スムーズンド受容体モジュレーターとしてのピリジン−2−誘導体
|
|
EP3214442A1
(de)
|
2010-10-25 |
2017-09-06 |
F. Hoffmann-La Roche AG |
Behandlung von gastrointestinalen entzündungen und psoriasis und asthmaentzündung und psoriasis a
|
|
JP6163429B2
(ja)
|
2010-11-10 |
2017-07-12 |
ジェネンテック, インコーポレイテッド |
神経疾患免疫治療のための方法及び組成物
|
|
WO2012071436A1
(en)
|
2010-11-24 |
2012-05-31 |
Genentech, Inc. |
Method of treating autoimmune inflammatory disorders using il-23r loss-of-function mutants
|
|
EP2643353A1
(de)
|
2010-11-24 |
2013-10-02 |
Novartis AG |
Multispezifische moleküle
|
|
WO2012075333A2
(en)
|
2010-12-02 |
2012-06-07 |
Prometheus Laboratories Inc. |
Her2delta16 peptides
|
|
NZ609493A
(en)
|
2010-12-16 |
2015-11-27 |
Genentech Inc |
Diagnosis and treatments relating to th2 inhibition
|
|
EA028744B1
(ru)
|
2010-12-20 |
2017-12-29 |
Дженентек, Инк. |
Антитела против мезотелина и иммуноконъюгаты
|
|
KR20130118925A
(ko)
|
2010-12-22 |
2013-10-30 |
제넨테크, 인크. |
항-pcsk9 항체 및 사용 방법
|
|
CN103384831B
(zh)
|
2010-12-23 |
2016-02-10 |
霍夫曼-拉罗奇有限公司 |
通过二价结合剂来检测多肽二聚体
|
|
CN103384828A
(zh)
|
2010-12-23 |
2013-11-06 |
雀巢产品技术援助有限公司 |
使用基于抗体的阵列进行恶性癌症疗法的药物选择
|
|
EP2655413B1
(de)
|
2010-12-23 |
2019-01-16 |
F.Hoffmann-La Roche Ag |
Polypeptid-polynukleotid-komplex und verwendung bei der gezielten effektorrest-bereitstellung
|
|
WO2012085113A1
(en)
|
2010-12-23 |
2012-06-28 |
Roche Diagnostics Gmbh |
Binding agent
|
|
ES2605493T3
(es)
|
2010-12-23 |
2017-03-14 |
F. Hoffmann-La Roche Ag |
Detección de un polipéptido modificado post-traduccionalmente mediante un agente ligante bivalente
|
|
WO2012092539A2
(en)
|
2010-12-31 |
2012-07-05 |
Takeda Pharmaceutical Company Limited |
Antibodies to dll4 and uses thereof
|
|
EP2672999A2
(de)
|
2011-02-10 |
2013-12-18 |
Roche Glycart AG |
Verbesserte immuntherapie
|
|
LT3489255T
(lt)
|
2011-02-10 |
2021-08-25 |
Roche Glycart Ag |
Mutantiniai interleukino-2 polipeptidai
|
|
EP2675478A4
(de)
|
2011-02-14 |
2015-06-10 |
Theraclone Sciences Inc |
Zusammensetzungen und verfahren zur therapie und diagnose von grippe
|
|
WO2012116040A1
(en)
|
2011-02-22 |
2012-08-30 |
OSI Pharmaceuticals, LLC |
Biological markers predictive of anti-cancer response to insulin-like growth factor-1 receptor kinase inhibitors in hepatocellular carcinoma
|
|
CA2825081A1
(en)
|
2011-02-28 |
2012-09-07 |
Birgit Bossenmaier |
Antigen binding proteins
|
|
CA2824824A1
(en)
|
2011-02-28 |
2012-09-07 |
F. Hoffmann-La Roche Ag |
Monovalent antigen binding proteins
|
|
EP2681245B1
(de)
|
2011-03-03 |
2018-05-09 |
Zymeworks Inc. |
Entwurf und konstrukte für ein multivalentes heteromultimeres gerüst
|
|
WO2012119989A2
(en)
|
2011-03-04 |
2012-09-13 |
Oryzon Genomics, S.A. |
Methods and antibodies for the diagnosis and treatment of cancer
|
|
JP2014518610A
(ja)
|
2011-03-09 |
2014-08-07 |
リチャード ジー. ペステル |
前立腺癌細胞系、遺伝子シグネチャー及びその使用
|
|
SG193402A1
(en)
|
2011-03-15 |
2013-10-30 |
Theraclone Sciences Inc |
Compositions and methods for the therapy and diagnosis of influenza
|
|
AR085911A1
(es)
|
2011-03-16 |
2013-11-06 |
Sanofi Sa |
Dosis terapeutica segura de una proteina similar a un anticuerpo con region v dual
|
|
MX354359B
(es)
|
2011-03-29 |
2018-02-28 |
Roche Glycart Ag |
Variantes de fragmento cristalizable (fc) de los anticuerpos.
|
|
CA2831732C
(en)
|
2011-03-31 |
2019-12-31 |
Genentech, Inc. |
Use of a monoclonal anti-beta7 antibody for treating gastrointestinal inflammatory disorders
|
|
RU2013143358A
(ru)
|
2011-04-07 |
2015-05-20 |
Дженентек, Инк. |
Анти-fgfr4 антитела и способы их применения
|
|
US9150644B2
(en)
|
2011-04-12 |
2015-10-06 |
The United States Of America, As Represented By The Secretary, Department Of Health And Human Services |
Human monoclonal antibodies that bind insulin-like growth factor (IGF) I and II
|
|
ES2724801T3
(es)
|
2011-04-19 |
2019-09-16 |
Pfizer |
Combinaciones de anticuerpos anti-4-1BB y anticuerpos inductores de ADCC para el tratamiento del cáncer
|
|
BR112013026423A2
(pt)
|
2011-04-20 |
2016-11-29 |
Roche Glycart Ag |
método e construtos para a passagem de pendente do ph da barreira sangue-cérebro
|
|
EP2702173A1
(de)
|
2011-04-25 |
2014-03-05 |
OSI Pharmaceuticals, LLC |
Verwendung von emt-gensignaturen bei der entdeckung von krebswirkstoffen, -diagnostika und -behandlungen
|
|
EA201892619A1
(ru)
|
2011-04-29 |
2019-04-30 |
Роше Гликарт Аг |
Иммуноконъюгаты, содержащие мутантные полипептиды интерлейкина-2
|
|
MX2013013054A
(es)
|
2011-05-12 |
2014-02-20 |
Genentech Inc |
Metodo de monitoreo de lc-ms/ms de reaccion multiple para detectar anticuerpos terapeuticos en muestras de animales utilizando peptidos de firma de estructura.
|
|
PE20140995A1
(es)
|
2011-05-16 |
2014-08-23 |
Genentech Inc |
Agonistas de fgfr1 y sus metodos de uso
|
|
BR112013032235A2
(pt)
|
2011-06-15 |
2016-11-22 |
Hoffmann La Roche |
anticorpos do receptor de epo anti-humano e métodos de uso
|
|
AR086823A1
(es)
|
2011-06-30 |
2014-01-22 |
Genentech Inc |
Formulaciones de anticuerpo anti-c-met, metodos
|
|
JP2013040160A
(ja)
|
2011-07-01 |
2013-02-28 |
Genentech Inc |
自己免疫疾患を治療するための抗cd83アゴニスト抗体の使用
|
|
CA3158257A1
(en)
|
2011-07-11 |
2013-01-17 |
Ichnos Sciences SA |
Antibodies that bind to ox40 and their uses
|
|
US9416132B2
(en)
|
2011-07-21 |
2016-08-16 |
Tolero Pharmaceuticals, Inc. |
Substituted imidazo[1,2-b]pyridazines as protein kinase inhibitors
|
|
US9120858B2
(en)
|
2011-07-22 |
2015-09-01 |
The Research Foundation Of State University Of New York |
Antibodies to the B12-transcobalamin receptor
|
|
WO2013015821A1
(en)
|
2011-07-22 |
2013-01-31 |
The Research Foundation Of State University Of New York |
Antibodies to the b12-transcobalamin receptor
|
|
US20130022551A1
(en)
|
2011-07-22 |
2013-01-24 |
Trustees Of Boston University |
DEspR ANTAGONISTS AND AGONISTS AS THERAPEUTICS
|
|
CA2842375A1
(en)
|
2011-08-17 |
2013-02-21 |
Erica Jackson |
Neuregulin antibodies and uses thereof
|
|
RU2014109985A
(ru)
|
2011-08-17 |
2015-09-27 |
Дженентек, Инк. |
Ингибирование ангиогенеза в рефрактерных опухолях
|
|
WO2013026839A1
(en)
|
2011-08-23 |
2013-02-28 |
Roche Glycart Ag |
Bispecific antibodies specific for t-cell activating antigens and a tumor antigen and methods of use
|
|
UA116192C2
(uk)
|
2011-08-23 |
2018-02-26 |
Рош Глікарт Аг |
Активуюча т-клітини біоспецифічна антигензв'язуюча молекула
|
|
US20130078250A1
(en)
|
2011-08-23 |
2013-03-28 |
Oliver Ast |
Bispecific t cell activating antigen binding molecules
|
|
LT2748202T
(lt)
|
2011-08-23 |
2018-09-25 |
Roche Glycart Ag |
Bispecifinės antigeną surišančios molekulės
|
|
BR112014003999A2
(pt)
|
2011-08-23 |
2017-06-13 |
Roche Glycart Ag |
anticorpo isolado que se liga a um epítopo próximo da membrana de mcsp humano, ácido nucleico isolado, célula hospedeira, método de produção de um anticorpo, imunoconjugado, formulação farmacêutica, uso do anticorpo, método de tratamento de indivíduos portadores de câncer, método de undução da lise celular em indivíduos e teste imuno-histoquímico de mcsp
|
|
US8822651B2
(en)
|
2011-08-30 |
2014-09-02 |
Theraclone Sciences, Inc. |
Human rhinovirus (HRV) antibodies
|
|
GB201212550D0
(en)
|
2012-07-13 |
2012-08-29 |
Novartis Ag |
B cell assay
|
|
EP2751562B1
(de)
|
2011-09-02 |
2015-09-16 |
Nestec S.A. |
Profilierung von signalwegproteinen zur bestimmung der therapeutischen wirksamkeit
|
|
MX2014003094A
(es)
|
2011-09-15 |
2014-04-25 |
Genentech Inc |
Metodos para promover diferenciacion.
|
|
GB201116092D0
(en)
|
2011-09-16 |
2011-11-02 |
Bioceros B V |
Antibodies and uses thereof
|
|
CN103930111A
(zh)
|
2011-09-19 |
2014-07-16 |
霍夫曼-拉罗奇有限公司 |
包含c-met拮抗剂和b-raf拮抗剂的组合治疗
|
|
SG2014014450A
(en)
|
2011-09-22 |
2014-09-26 |
Pfizer |
Pyrrolopyrimidine and purine derivatives
|
|
US9783613B2
(en)
|
2011-10-04 |
2017-10-10 |
Igem Therapeutics Limited |
IgE anti-HMW-MAA antibody
|
|
US9663573B2
(en)
|
2011-10-05 |
2017-05-30 |
Genentech, Inc. |
Methods of treating liver conditions using Notch2 antagonists
|
|
US9738727B2
(en)
|
2011-10-14 |
2017-08-22 |
Genentech, Inc. |
Anti-HtrA1 antibodies and methods of use
|
|
WO2013056148A2
(en)
|
2011-10-15 |
2013-04-18 |
Genentech, Inc. |
Methods of using scd1 antagonists
|
|
WO2013059531A1
(en)
|
2011-10-20 |
2013-04-25 |
Genentech, Inc. |
Anti-gcgr antibodies and uses thereof
|
|
WO2013063229A1
(en)
|
2011-10-25 |
2013-05-02 |
The Regents Of The University Of Michigan |
Her2 targeting agent treatment in non-her2-amplified cancers having her2 expressing cancer stem cells
|
|
SG11201401815XA
(en)
|
2011-10-28 |
2014-05-29 |
Genentech Inc |
Therapeutic combinations and methods of treating melanoma
|
|
SI3257564T1
(sl)
|
2011-11-02 |
2019-04-30 |
F. Hoffmann-La Roche Ag |
Izpiralna kromatografija s preobremenitvijo
|
|
CN104271599A
(zh)
|
2011-11-08 |
2015-01-07 |
辉瑞公司 |
使用抗m-csf抗体治疗炎性疾病的方法
|
|
RU2014124842A
(ru)
|
2011-11-21 |
2015-12-27 |
Дженентек, Инк. |
Очистка анти-с-мет антител
|
|
RU2014124530A
(ru)
|
2011-11-23 |
2015-12-27 |
Идженика, Инк. |
Антитела к cd98 и способы их применения
|
|
AR089028A1
(es)
|
2011-11-29 |
2014-07-23 |
Genentech Inc |
Composiciones y metodos para el analisis de cancer de prostata
|
|
AU2012346540C1
(en)
|
2011-11-30 |
2019-07-04 |
Genentech, Inc. |
ErbB3 mutations in cancer
|
|
EP2788024A1
(de)
|
2011-12-06 |
2014-10-15 |
F.Hoffmann-La Roche Ag |
Antikörper-formulierung
|
|
US9376715B2
(en)
|
2011-12-09 |
2016-06-28 |
Roche Molecular Systems, Inc |
Methods for detecting mutations in the catalytic subunit of the phosphoinositol-3 kinase (PIK3CA) gene
|
|
WO2013091903A1
(en)
|
2011-12-22 |
2013-06-27 |
Novo Nordisk A/S |
Anti-crac channel antibodies
|
|
CA2853955C
(en)
|
2011-12-22 |
2021-09-28 |
F. Hoffmann-La Roche Ag |
Expression vector organization, novel production cell generation methods and their use for the recombinant production of polypeptides
|
|
RU2648999C2
(ru)
|
2011-12-22 |
2018-03-29 |
Дженентек, Инк. |
Способы повышения эффективности этапов очистки белка, находящихся ниже по потоку, с использованием мембранной ионообменной хроматографии
|
|
WO2013092743A2
(en)
|
2011-12-22 |
2013-06-27 |
F. Hoffmann-La Roche Ag |
Expression vector element combinations, novel production cell generation methods and their use for the recombinant production of polypeptides
|
|
AR089434A1
(es)
|
2011-12-23 |
2014-08-20 |
Genentech Inc |
Procedimiento para preparar formulaciones con alta concentracion de proteinas
|
|
WO2013101771A2
(en)
|
2011-12-30 |
2013-07-04 |
Genentech, Inc. |
Compositions and method for treating autoimmune diseases
|
|
AU2013208003B2
(en)
|
2012-01-09 |
2017-12-14 |
The Scripps Research Institute |
Ultralong complementarity determining regions and uses thereof
|
|
CN104411717A
(zh)
|
2012-01-09 |
2015-03-11 |
斯克利普斯研究所 |
具有超长cdr3s的人源化抗体
|
|
WO2013109856A2
(en)
|
2012-01-18 |
2013-07-25 |
Genentech, Inc. |
Methods of using fgf19 modulators
|
|
JP6242813B2
(ja)
|
2012-01-18 |
2017-12-06 |
ジェネンテック, インコーポレイテッド |
抗lrp5抗体及び使用方法
|
|
WO2013113641A1
(en)
|
2012-01-31 |
2013-08-08 |
Roche Glycart Ag |
Use of nkp46 as a predictive biomarker for cancer treatment with adcc- enhanced antibodies
|
|
TW201334789A
(zh)
|
2012-01-31 |
2013-09-01 |
Genentech Inc |
抗ige抗體及其使用方法
|
|
MX2014009565A
(es)
|
2012-02-10 |
2014-11-10 |
Genentech Inc |
Anticuerpos monocatenarios y otros heteromultimeros.
|
|
CN113398268A
(zh)
|
2012-02-11 |
2021-09-17 |
霍夫曼-拉罗奇有限公司 |
R-spondin易位及其使用方法
|
|
WO2013120929A1
(en)
|
2012-02-15 |
2013-08-22 |
F. Hoffmann-La Roche Ag |
Fc-receptor based affinity chromatography
|
|
KR20140130455A
(ko)
|
2012-03-02 |
2014-11-10 |
로슈 글리카트 아게 |
Adcc-강화 항체를 사용한 암 치료용 예측 바이오마커
|
|
KR20170036142A
(ko)
|
2012-03-08 |
2017-03-31 |
할로자임, 아이엔씨 |
조건부 활성 항-표피 성장 인자 수용체 항체 및 이의 사용 방법
|
|
US9592289B2
(en)
|
2012-03-26 |
2017-03-14 |
Sanofi |
Stable IgG4 based binding agent formulations
|
|
AU2013240261A1
(en)
|
2012-03-27 |
2014-09-18 |
Genentech, Inc. |
Diagnosis and treatments relating to HER3 inhibitors
|
|
AR090549A1
(es)
|
2012-03-30 |
2014-11-19 |
Genentech Inc |
Anticuerpos anti-lgr5 e inmunoconjugados
|
|
WO2013152252A1
(en)
|
2012-04-06 |
2013-10-10 |
OSI Pharmaceuticals, LLC |
Combination anti-cancer therapy
|
|
US10130714B2
(en)
|
2012-04-14 |
2018-11-20 |
Academia Sinica |
Enhanced anti-influenza agents conjugated with anti-inflammatory activity
|
|
WO2013165940A1
(en)
|
2012-05-01 |
2013-11-07 |
Genentech, Inc. |
Anti-pmel17 antibodies and immunoconjugates
|
|
US20130336973A1
(en)
|
2012-05-10 |
2013-12-19 |
Zymeworks Inc. |
Heteromultimer Constructs of Immunoglobulin Heavy Chains with Mutations in the Fc Domain
|
|
WO2013170191A1
(en)
|
2012-05-11 |
2013-11-14 |
Genentech, Inc. |
Methods of using antagonists of nad biosynthesis from nicotinamide
|
|
WO2013173312A1
(en)
|
2012-05-14 |
2013-11-21 |
Pestell Richard G |
Using modulators of ccr5 for treating cancer
|
|
EP2852840B1
(de)
|
2012-05-23 |
2019-10-09 |
F.Hoffmann-La Roche Ag |
Auswahlverfahren für therapeutika
|
|
ES2666126T3
(es)
|
2012-06-08 |
2018-05-03 |
Glenmark Pharmaceuticals S.A. |
Anticuerpos anti-TrkA humanizados con sustituciones de aminoácidos
|
|
WO2013188855A1
(en)
|
2012-06-15 |
2013-12-19 |
Genentech, Inc. |
Anti-pcsk9 antibodies, formulations, dosing, and methods of use
|
|
MX2014014065A
(es)
|
2012-06-27 |
2015-02-04 |
Hoffmann La Roche |
Metodo para la seleccion y produccion de moleculas terapeuticas hechas a la medida, selectivas y multiespecificas que comprenden al menos dos diferentes entidades de direccionamiento y usos de las mismas.
|
|
KR20150023889A
(ko)
|
2012-06-27 |
2015-03-05 |
에프. 호프만-라 로슈 아게 |
2 개 이상의 상이한 결합 단위를 함유하는 맞춤-제작된 고도로 선별적이고 다중-특이적인 표적화 단위의 선별 및 제조 방법 및 이의 용도
|
|
RU2015100656A
(ru)
|
2012-06-27 |
2016-08-20 |
Ф. Хоффманн-Ля Рош Аг |
Способ получения конъюгатов fc-фрагмента антитела, включающих по меньшей мере одну связывающую группировку, которая специфически связывается с мишенью, и их применения
|
|
SG11201407420RA
(en)
|
2012-07-04 |
2015-02-27 |
Hoffmann La Roche |
Covalently linked antigen-antibody conjugates
|
|
RU2630664C2
(ru)
|
2012-07-04 |
2017-09-11 |
Ф. Хоффманн-Ля Рош Аг |
Антитела к теофиллину и способы их применения
|
|
RU2630296C2
(ru)
|
2012-07-04 |
2017-09-06 |
Ф. Хоффманн-Ля Рош Аг |
Антитела к биотину и способы их применения
|
|
CA3188124A1
(en)
|
2012-07-05 |
2014-01-09 |
Genentech, Inc. |
Expression and secretion system
|
|
IN2014DN10652A
(de)
|
2012-07-09 |
2015-09-11 |
Genentech Inc |
|
|
EA201590172A1
(ru)
|
2012-07-09 |
2015-09-30 |
Дженентек, Инк. |
ИММУНОКОНЪЮГАТЫ, СОДЕРЖАЩИЕ АНТИТЕЛА К CD79b
|
|
AU2013288929A1
(en)
|
2012-07-09 |
2014-12-04 |
Genentech, Inc. |
Immunoconjugates comprising anti-CD22 antibodies
|
|
PE20150325A1
(es)
|
2012-07-09 |
2015-03-05 |
Genentech Inc |
Inmunoconjugados que comprenden anticuerpos anti-cd22 y derivados de nemorrubicina.
|
|
WO2014009465A1
(en)
|
2012-07-13 |
2014-01-16 |
Roche Glycart Ag |
Bispecific anti-vegf/anti-ang-2 antibodies and their use in the treatment of ocular vascular diseases
|
|
CA2878640C
(en)
|
2012-07-13 |
2023-10-24 |
Zymeworks Inc. |
Multivalent heteromultimer scaffold design and constructs
|
|
CN103566377A
(zh)
|
2012-07-18 |
2014-02-12 |
上海博笛生物科技有限公司 |
癌症的靶向免疫治疗
|
|
MY175687A
(en)
|
2012-08-07 |
2020-07-06 |
Roche Glycart Ag |
Composition comprising two antibodies engineered to have reduced and increased effector function
|
|
CN104540848B
(zh)
|
2012-08-08 |
2019-05-31 |
罗切格利卡特公司 |
白介素-10融合蛋白及其用途
|
|
WO2014023709A1
(en)
|
2012-08-09 |
2014-02-13 |
Roche Glycart Ag |
Asgpr antibodies and uses thereof
|
|
AU2013306098A1
(en)
|
2012-08-18 |
2015-02-12 |
Academia Sinica |
Cell-permeable probes for identification and imaging of sialidases
|
|
EP2888238A4
(de)
|
2012-08-21 |
2016-01-27 |
Academia Sinica |
Benzocyclooctynverbindungen und verwendungen davon
|
|
US20150202287A1
(en)
|
2012-08-30 |
2015-07-23 |
Merrimack Pharmaceuticals, Inc. |
Combination therapies comprising anti-erbb3 agents
|
|
CN104619715B
(zh)
|
2012-09-14 |
2018-06-05 |
弗·哈夫曼-拉罗切有限公司 |
包含至少两个不同实体的分子的生产和选择方法及其用途
|
|
ES2738305T3
(es)
|
2012-10-05 |
2020-01-21 |
Hoffmann La Roche |
Procedimientos para diagnosticar y tratar enfermedades inflamatorias intestinales
|
|
EP2904016B1
(de)
|
2012-10-08 |
2018-11-14 |
Roche Glycart AG |
Fc-freie antikörper mit zwei fab-fragmenten sowie verwendungsverfahren dafür
|
|
CA2887129A1
(en)
|
2012-10-09 |
2014-04-17 |
Igenica, Inc. |
Anti-c16orf54 antibodies and methods of use thereof
|
|
ES2644758T3
(es)
|
2012-10-16 |
2017-11-30 |
Tolero Pharmaceuticals, Inc. |
Moduladores de PKM2 y métodos para su uso
|
|
EP2914621B1
(de)
|
2012-11-05 |
2023-06-07 |
Foundation Medicine, Inc. |
Neuartige ntrk1-fusionsmoleküle und verwendungen davon
|
|
AR093378A1
(es)
|
2012-11-08 |
2015-06-03 |
Hoffmann La Roche |
PROTEINAS LIGANTES DE ANTIGENO HER3 DE UNION A LA HORQUILLA b DE HER3
|
|
EA201892509A1
(ru)
|
2012-11-13 |
2019-04-30 |
Дженентек, Инк. |
Антитела к гемагглютинину и способы применения
|
|
KR20150084046A
(ko)
|
2012-11-15 |
2015-07-21 |
제넨테크, 인크. |
이온 강도-매개 pH 구배 이온 교환 크로마토그래피
|
|
MX363188B
(es)
|
2012-11-30 |
2019-03-13 |
Hoffmann La Roche |
Identificación de pacientes con necesidad de coterapia del inhibidor de pd-l1.
|
|
US9260426B2
(en)
|
2012-12-14 |
2016-02-16 |
Arrien Pharmaceuticals Llc |
Substituted 1H-pyrrolo [2, 3-b] pyridine and 1H-pyrazolo [3, 4-b] pyridine derivatives as salt inducible kinase 2 (SIK2) inhibitors
|
|
AU2013371957B2
(en)
|
2013-01-02 |
2018-10-25 |
Ichnos Sciences SA |
Antibodies that bind to TL1A and their uses
|
|
CA2898326C
(en)
|
2013-01-18 |
2022-05-17 |
Foundation Medicine, Inc. |
Methods of treating cholangiocarcinoma
|
|
WO2014114595A1
(en)
|
2013-01-23 |
2014-07-31 |
Roche Glycart Ag |
Predictive biomarker for cancer treatment with adcc-enhanced antibodies
|
|
WO2014116749A1
(en)
|
2013-01-23 |
2014-07-31 |
Genentech, Inc. |
Anti-hcv antibodies and methods of using thereof
|
|
CA2900097A1
(en)
|
2013-02-22 |
2014-08-28 |
F. Hoffmann-La Roche Ag |
Methods of treating cancer and preventing drug resistance
|
|
US20140242083A1
(en)
|
2013-02-26 |
2014-08-28 |
Roche Glycart Ag |
Anti-mcsp antibodies
|
|
JP2016512421A
(ja)
|
2013-02-26 |
2016-04-28 |
ロシュ グリクアート アーゲー |
二重特異性t細胞活性化抗原結合分子
|
|
EP2961771B1
(de)
|
2013-02-26 |
2020-01-01 |
Roche Glycart AG |
Bispezifische antigenbindende moleküle zur t-zellen-aktivierung spezifisch auf cd3 und cea
|
|
WO2014131694A1
(en)
|
2013-02-26 |
2014-09-04 |
Roche Glycart Ag |
Bispecific t cell activating antigen binding molecules
|
|
EP2964260A2
(de)
|
2013-03-06 |
2016-01-13 |
F. Hoffmann-La Roche AG |
Verfahren zur behandlung und prävention einer antikrebsmittelresistenz
|
|
PT2968466T
(pt)
|
2013-03-13 |
2018-10-22 |
Hoffmann La Roche |
Formulações de oxidação reduzida
|
|
AR095399A1
(es)
|
2013-03-13 |
2015-10-14 |
Genentech Inc |
Formulaciones con oxidación reducida, método
|
|
SI2968467T1
(sl)
|
2013-03-13 |
2020-11-30 |
F. Hoffmann-La Roche Ag |
Pripravki z zmanjšano oksidacijo
|
|
CA2906057A1
(en)
|
2013-03-13 |
2014-10-02 |
Genentech, Inc. |
Antibody formulations
|
|
US20140314778A1
(en)
|
2013-03-13 |
2014-10-23 |
Genentech, Inc. |
Formulations with reduced oxidation
|
|
US9562099B2
(en)
|
2013-03-14 |
2017-02-07 |
Genentech, Inc. |
Anti-B7-H4 antibodies and immunoconjugates
|
|
WO2014151871A2
(en)
|
2013-03-14 |
2014-09-25 |
Tolero Pharmaceuticals, Inc. |
Jak2 and alk2 inhibitors and methods for their use
|
|
CN105307683A
(zh)
|
2013-03-14 |
2016-02-03 |
基因泰克公司 |
治疗癌症和预防癌症药物抗性的方法
|
|
BR112015022576A2
(pt)
|
2013-03-14 |
2017-10-24 |
Genentech Inc |
produto farmacêutico e seu uso, kit e método para tratar uma disfunção hiperproliferativa
|
|
JP6436965B2
(ja)
|
2013-03-14 |
2018-12-12 |
ジェネンテック, インコーポレイテッド |
抗b7−h4抗体及びイムノコンジュゲート
|
|
CA2903589A1
(en)
|
2013-03-15 |
2014-09-18 |
Genentech, Inc. |
Cell culture media and methods of antibody production
|
|
US20140283157A1
(en)
|
2013-03-15 |
2014-09-18 |
Diadexus, Inc. |
Lipoprotein-associated phospholipase a2 antibody compositions and methods of use
|
|
CN105143265A
(zh)
|
2013-03-15 |
2015-12-09 |
豪夫迈·罗氏有限公司 |
抗CRTh2抗体及其用途
|
|
US9598485B2
(en)
|
2013-03-15 |
2017-03-21 |
Ac Immune S.A. |
Anti-tau antibodies and methods of use
|
|
BR112015023203A8
(pt)
|
2013-03-15 |
2018-01-23 |
Constellation Pharmaceuticals Inc |
métodos para tratamento de câncer, método para aumentar a eficiência de um tratamento de câncer, método para retardar e/ou prevenir o desenvolvimento de câncer, método para tratar um indivíduo com câncer, método para aumentar a sensibilidade para um agente de terapia para câncer, método para estender um período de sensibilidade e método para estender a duração da resposta para uma terapia para câncer.
|
|
KR20150128707A
(ko)
|
2013-03-15 |
2015-11-18 |
제넨테크, 인크. |
간암의 진단 및 치료를 위한 조성물 및 방법
|
|
BR112015023120A2
(pt)
|
2013-03-15 |
2017-11-21 |
Genentech Inc |
método para identificar um indivíduo com uma doença ou disfunção, método para prever a responsividade de um indivíduo com uma doença ou disfunção, método para determinar a probabilidade de que um indivíduo com uma doença ou disfunção exibirá benefício do tratamento, método para selecionar uma terapia, usos de um antagonista de ligação do eixo pd-l1, ensaio para identificar um indivíduo com uma doença, kit de diagnóstico, método para avaliar uma resposta ao tratamento e método para monitorar a resposta de um indivíduo tratado
|
|
JP6591395B2
(ja)
|
2013-03-15 |
2019-10-16 |
ジェネンテック, インコーポレイテッド |
抗酸化剤を含む細胞培養組成物およびポリペプチド産生のための方法
|
|
ES2687282T3
(es)
|
2013-03-18 |
2018-10-24 |
Biocerox Products B.V. |
Anticuerpos humanizados ANTI-CD134 (OX40) y sus usos
|
|
CA2904095A1
(en)
|
2013-03-27 |
2014-10-02 |
Genentech, Inc. |
Use of biomarkers for assessing treatment of gastrointestinal inflammatory disorders with beta7 integrin antagonists
|
|
US20160053023A1
(en)
|
2013-04-09 |
2016-02-25 |
Annexon, Inc. |
Methods of treatment for neuromyelitis optica
|
|
US9206188B2
(en)
|
2013-04-18 |
2015-12-08 |
Arrien Pharmaceuticals Llc |
Substituted pyrrolo[2,3-b]pyridines as ITK and JAK inhibitors
|
|
CA2910945A1
(en)
|
2013-05-08 |
2014-11-13 |
Zymeworks Inc. |
Bispecific her2 and her3 antigen binding constructs
|
|
JP6612214B2
(ja)
|
2013-05-20 |
2019-11-27 |
ジェネンテック, インコーポレイテッド |
抗トランスフェリン受容体抗体及び使用方法
|
|
KR20160013163A
(ko)
|
2013-05-24 |
2016-02-03 |
네스텍 소시에테아노님 |
과민성 대장 증후군 진단을 예측하기 위한 경로 특이적 검정법
|
|
EP3013365B1
(de)
|
2013-06-26 |
2019-06-05 |
Academia Sinica |
Rm2-antigene und verwendung davon
|
|
WO2014210564A1
(en)
|
2013-06-27 |
2014-12-31 |
Academia Sinica |
Glycan conjugates and use thereof
|
|
MX2015017341A
(es)
|
2013-07-09 |
2016-07-06 |
Anexxon Inc |
Anticuerpos anti-factor del complemento c1q y uso de los mismos.
|
|
SG11201600221YA
(en)
|
2013-07-12 |
2016-02-26 |
Genentech Inc |
Elucidation of ion exchange chromatography input optimization
|
|
WO2015009831A2
(en)
*
|
2013-07-17 |
2015-01-22 |
Foundation Medicine, Inc. |
Methods of treating urothelial carcinomas
|
|
EP3022224A2
(de)
|
2013-07-18 |
2016-05-25 |
Fabrus, Inc. |
Antikörper mit ultralangen komplementaritätsbestimmenden regionen
|
|
AU2014290361B2
(en)
|
2013-07-18 |
2019-04-18 |
Taurus Biosciences, Llc |
Humanized antibodies with ultralong complementarity determining regions
|
|
EA201690213A1
(ru)
|
2013-08-12 |
2016-07-29 |
Дженентек, Инк. |
Композиции и способ лечения связанных с комплементом состояний
|
|
KR20160050062A
(ko)
|
2013-09-05 |
2016-05-10 |
제넨테크, 인크. |
크로마토그래피 재사용 방법
|
|
CN105682666B
(zh)
|
2013-09-06 |
2021-06-01 |
中央研究院 |
使用醣脂激活人类iNKT细胞
|
|
AU2014318545A1
(en)
|
2013-09-12 |
2016-03-24 |
Halozyme, Inc. |
Modified anti-epidermal growth factor receptor antibodies and methods of use thereof
|
|
SG11201601823TA
(en)
|
2013-09-13 |
2016-04-28 |
Genentech Inc |
Methods and compositions comprising purified recombinant polypeptides
|
|
RU2016107435A
(ru)
|
2013-09-13 |
2017-10-18 |
Дженентек, Инк. |
Композиции и способы обнаружения и количественного определения белка клеток-хозяев в клеточных линиях и рекомбинантные полипептидные продукты
|
|
MX2016003248A
(es)
|
2013-09-17 |
2016-06-07 |
Genentech Inc |
Metodos de uso de anticuerpos anti-lgr5.
|
|
UA122478C2
(uk)
|
2013-09-27 |
2020-11-25 |
Дженентек, Інк. |
Водна фармацевтична композиція, яка містить моноклональне антитіло до pd-l1
|
|
WO2015044083A1
(en)
|
2013-09-27 |
2015-04-02 |
F. Hoffmann-La Roche Ag |
Thermus thermophilus slyd fkbp domain specific antibodies
|
|
US9567643B2
(en)
|
2013-10-04 |
2017-02-14 |
Aptose Biosciences Inc. |
Compositions and methods for treating cancers
|
|
BR112016007635A2
(pt)
|
2013-10-11 |
2017-09-12 |
Genentech Inc |
inibidores de nsp4 e métodos de uso
|
|
MX2016003593A
(es)
|
2013-10-11 |
2016-06-02 |
Hoffmann La Roche |
Anticuerpos de cadena ligera variable comun intercambiada de dominio multiespecifico.
|
|
CA2925598A1
(en)
|
2013-10-18 |
2015-04-23 |
Genentech, Inc. |
Anti-rspo antibodies and methods of use
|
|
MX2016005159A
(es)
|
2013-10-23 |
2016-07-05 |
Genentech Inc |
Metodos de diagnostico y tratamiento de trastornos eosinofilicos.
|
|
WO2015073721A1
(en)
|
2013-11-13 |
2015-05-21 |
Zymeworks Inc. |
Monovalent antigen binding constructs targeting egfr and/or her2 and uses thereof
|
|
SI3071597T1
(sl)
|
2013-11-21 |
2020-11-30 |
F. Hoffmann-La Roche Ag |
Anti alfa-sinukleinska protitelesa in postopki uporabe
|
|
UA115388C2
(uk)
|
2013-11-21 |
2017-10-25 |
Пфайзер Інк. |
2,6-заміщені пуринові похідні та їх застосування в лікуванні проліферативних захворювань
|
|
CA2931356A1
(en)
|
2013-11-27 |
2015-06-04 |
Zymeworks Inc. |
Bispecific antigen-binding constructs targeting her2
|
|
CN114044825A
(zh)
|
2013-12-09 |
2022-02-15 |
爱乐科斯公司 |
抗Siglec-8抗体及其使用方法
|
|
CA2931340A1
(en)
|
2013-12-13 |
2015-06-18 |
Genentech, Inc. |
Anti-cd33 antibodies and immunoconjugates
|
|
US20150190506A1
(en)
|
2013-12-17 |
2015-07-09 |
Genentech, Inc. |
Combination therapy comprising ox40 binding agonists and pd-1 axis binding antagonists
|
|
US20150210772A1
(en)
|
2013-12-17 |
2015-07-30 |
Genentech, Inc. |
Methods of treating cancer using pd-1 axis binding antagonists and an anti-cd20 antibody
|
|
AU2014364601A1
(en)
|
2013-12-17 |
2016-07-07 |
Genentech, Inc. |
Methods of treating HER2-positive cancers using PD-1 axis binding antagonists and anti-HER2 antibodies
|
|
PE20210107A1
(es)
|
2013-12-17 |
2021-01-19 |
Genentech Inc |
Anticuerpos anti-cd3 y metodos de uso
|
|
AU2014368696A1
(en)
|
2013-12-20 |
2016-06-02 |
F. Hoffmann-La Roche Ag |
Humanized anti-Tau(pS422) antibodies and methods of use
|
|
TWI728373B
(zh)
|
2013-12-23 |
2021-05-21 |
美商建南德克公司 |
抗體及使用方法
|
|
KR102278429B1
(ko)
|
2014-01-03 |
2021-07-16 |
에프. 호프만-라 로슈 아게 |
공유 연결된 폴리펩티드 독소-항체 콘쥬게이트
|
|
CN105873615B
(zh)
|
2014-01-03 |
2020-12-25 |
豪夫迈·罗氏有限公司 |
共价连接的helicar-抗helicar抗体缀合物及其用途
|
|
KR20160104628A
(ko)
|
2014-01-03 |
2016-09-05 |
에프. 호프만-라 로슈 아게 |
이중특이성 항-합텐/항-혈액뇌장벽 수용체 항체, 그의 복합체 및 혈액뇌장벽 셔틀로서 그의 용도
|
|
CA2932547C
(en)
|
2014-01-06 |
2023-05-23 |
F. Hoffmann-La Roche Ag |
Monovalent blood brain barrier shuttle modules
|
|
JP2017503803A
(ja)
|
2014-01-10 |
2017-02-02 |
シャンハイ バーディー バイオテック インコーポレイテッド |
Egfr発現腫瘍を処置するための化合物及び組成物
|
|
WO2016114819A1
(en)
|
2015-01-16 |
2016-07-21 |
Academia Sinica |
Compositions and methods for treatment and detection of cancers
|
|
EP3094352B1
(de)
|
2014-01-16 |
2020-09-23 |
Academia Sinica |
Zusammensetzungen und verfahren zur behandlung und zum nachweis von krebs
|
|
US10150818B2
(en)
|
2014-01-16 |
2018-12-11 |
Academia Sinica |
Compositions and methods for treatment and detection of cancers
|
|
JOP20200094A1
(ar)
|
2014-01-24 |
2017-06-16 |
Dana Farber Cancer Inst Inc |
جزيئات جسم مضاد لـ pd-1 واستخداماتها
|
|
DK3097122T3
(da)
|
2014-01-24 |
2020-08-10 |
Ngm Biopharmaceuticals Inc |
Antistoffer, der binder beta-klotho-domæne 2, og fremgangsmåder til anvendelse deraf
|
|
KR20160111469A
(ko)
|
2014-01-24 |
2016-09-26 |
제넨테크, 인크. |
항-steap1 항체 및 면역접합체를 사용하는 방법
|
|
WO2015116902A1
(en)
|
2014-01-31 |
2015-08-06 |
Genentech, Inc. |
G-protein coupled receptors in hedgehog signaling
|
|
JOP20200096A1
(ar)
|
2014-01-31 |
2017-06-16 |
Children’S Medical Center Corp |
جزيئات جسم مضاد لـ tim-3 واستخداماتها
|
|
CA2937539A1
(en)
|
2014-02-04 |
2015-08-13 |
Genentech, Inc. |
Mutant smoothened and methods of using the same
|
|
TWI705824B
(zh)
|
2014-02-08 |
2020-10-01 |
美商建南德克公司 |
治療阿茲海默症之方法
|
|
ES2873248T3
(es)
|
2014-02-08 |
2021-11-03 |
Hoffmann La Roche |
Métodos para tratar la enfermedad de Alzheimer
|
|
SG10201808259TA
(en)
|
2014-02-12 |
2018-10-30 |
Genentech Inc |
Anti-jagged1 antibodies and methods of use
|
|
EP3107574A2
(de)
|
2014-02-21 |
2016-12-28 |
F. Hoffmann-La Roche AG |
Anti-il-13/il-17 bispezifische antikörper und verwendungen davon
|
|
DK3110446T3
(da)
|
2014-02-28 |
2022-02-28 |
Allakos Inc |
Fremgangsmåder og sammensætninger til behandling af Siglec-8-associerede sygdomme
|
|
KR20220126813A
(ko)
|
2014-03-14 |
2022-09-16 |
노파르티스 아게 |
Lag-3에 대한 항체 분자 및 그의 용도
|
|
CN106103730B
(zh)
|
2014-03-14 |
2021-06-08 |
豪夫迈·罗氏有限公司 |
用于分泌异源多肽的方法和组合物
|
|
EP3593812A3
(de)
|
2014-03-15 |
2020-05-27 |
Novartis AG |
Behandlung von krebs mithilfe eines chimären antigenrezeptors
|
|
WO2015140591A1
(en)
|
2014-03-21 |
2015-09-24 |
Nordlandssykehuset Hf |
Anti-cd14 antibodies and uses thereof
|
|
JP2017516458A
(ja)
|
2014-03-24 |
2017-06-22 |
ジェネンテック, インコーポレイテッド |
c−met拮抗剤による癌治療及びc−met拮抗剤のHGF発現との相関
|
|
AU2015235986B2
(en)
|
2014-03-27 |
2020-12-03 |
Genentech, Inc. |
Methods for diagnosing and treating inflammatory bowel disease
|
|
TWI687428B
(zh)
|
2014-03-27 |
2020-03-11 |
中央研究院 |
反應性標記化合物及其用途
|
|
KR20160145624A
(ko)
|
2014-03-31 |
2016-12-20 |
제넨테크, 인크. |
항-ox40 항체 및 사용 방법
|
|
EP3126386A1
(de)
|
2014-03-31 |
2017-02-08 |
F. Hoffmann-La Roche AG |
Kombinationstherapie mit antiangiogenesewirkstoffen und ox40-bindenden agonisten
|
|
WO2015155624A1
(en)
|
2014-04-10 |
2015-10-15 |
Pfizer Inc. |
Dihydropyrrolopyrimidine derivatives
|
|
JP6649895B2
(ja)
|
2014-04-18 |
2020-02-19 |
アクセルロン ファーマ, インコーポレイテッド |
赤血球レベルを増加させ、そして鎌状赤血球症を処置するための方法
|
|
WO2015164615A1
(en)
|
2014-04-24 |
2015-10-29 |
University Of Oslo |
Anti-gluten antibodies and uses thereof
|
|
EP3804745A1
(de)
|
2014-04-25 |
2021-04-14 |
The Brigham and Women's Hospital, Inc. |
Verfahren zur manipulation von alpha-fetoprotein (afp)
|
|
PL3137460T3
(pl)
|
2014-04-30 |
2020-04-30 |
Pfizer Inc. |
Pochodne diheterocyklu połączonego cykloalkilem
|
|
MA39934A
(fr)
|
2014-05-01 |
2017-03-08 |
Hoffmann La Roche |
Variants d'anticorps anti-facteur d et leurs utilisations
|
|
US11474101B2
(en)
|
2014-05-08 |
2022-10-18 |
Novodiax, Inc. |
Direct immunohistochemistry assay
|
|
RU2016150370A
(ru)
|
2014-05-22 |
2018-06-26 |
Дженентек, Инк. |
Антитела и иммуноконъюгаты против GPC3
|
|
WO2015179835A2
(en)
|
2014-05-23 |
2015-11-26 |
Genentech, Inc. |
Mit biomarkers and methods using the same
|
|
AU2015267052A1
(en)
|
2014-05-27 |
2016-12-15 |
Academia Sinica |
Compositions and methods relating to universal glycoforms for enhanced antibody efficacy
|
|
KR20220151036A
(ko)
|
2014-05-27 |
2022-11-11 |
아카데미아 시니카 |
항-cd20 글리코항체 및 이의 용도
|
|
AU2015267045B2
(en)
|
2014-05-27 |
2021-02-25 |
Academia Sinica |
Anti-HER2 glycoantibodies and uses thereof
|
|
US10118969B2
(en)
|
2014-05-27 |
2018-11-06 |
Academia Sinica |
Compositions and methods relating to universal glycoforms for enhanced antibody efficacy
|
|
US11332523B2
(en)
|
2014-05-28 |
2022-05-17 |
Academia Sinica |
Anti-TNF-alpha glycoantibodies and uses thereof
|
|
EP3155015A1
(de)
|
2014-06-11 |
2017-04-19 |
F. Hoffmann-La Roche AG |
Anti-lgr5-antikörper und verwendungen davon
|
|
TN2016000553A1
(en)
|
2014-06-13 |
2018-04-04 |
Acceleron Pharma Inc |
Methods and compositions for treating ulcers
|
|
US20230190750A1
(en)
|
2014-06-13 |
2023-06-22 |
Genentech, Inc. |
Methods of treating and preventing cancer drug resistance
|
|
AR100978A1
(es)
|
2014-06-26 |
2016-11-16 |
Hoffmann La Roche |
LANZADERAS CEREBRALES DE ANTICUERPO HUMANIZADO ANTI-Tau(pS422) Y USOS DE LAS MISMAS
|
|
EP3164419A1
(de)
|
2014-06-26 |
2017-05-10 |
F. Hoffmann-La Roche AG |
Anti-brdu-antikörper und verfahren zur verwendung
|
|
WO2016001789A1
(en)
|
2014-06-30 |
2016-01-07 |
Pfizer Inc. |
Pyrimidine derivatives as pi3k inhibitors for use in the treatment of cancer
|
|
JP6694400B2
(ja)
|
2014-07-03 |
2020-05-13 |
ジェネンテック, インコーポレイテッド |
ポリペプチド発現系
|
|
ES2903029T3
(es)
|
2014-07-03 |
2022-03-30 |
Univ Yale |
La inhibición de DICKKOPF2 (DKK2) suprime la formación de tumores
|
|
WO2016004876A1
(en)
|
2014-07-09 |
2016-01-14 |
Shanghai Birdie Biotech, Inc. |
Anti-pd-l1 combinations for treating tumors
|
|
CN105233291A
(zh)
|
2014-07-09 |
2016-01-13 |
博笛生物科技有限公司 |
用于治疗癌症的联合治疗组合物和联合治疗方法
|
|
CN105440135A
(zh)
|
2014-09-01 |
2016-03-30 |
博笛生物科技有限公司 |
用于治疗肿瘤的抗-pd-l1结合物
|
|
RU2017103289A
(ru)
|
2014-07-11 |
2018-08-14 |
Дженентек, Инк. |
Ингибирование пути notch
|
|
EP3166974A1
(de)
|
2014-07-11 |
2017-05-17 |
Genentech, Inc. |
Anti-pd-l1-antikörper und diagnostische verwendungen davon
|
|
JP2017528433A
(ja)
|
2014-07-21 |
2017-09-28 |
ノバルティス アーゲー |
低い免疫増強用量のmTOR阻害剤とCARの組み合わせ
|
|
MX2017001008A
(es)
|
2014-07-21 |
2017-08-02 |
Novartis Ag |
Tratamiento de cancer utilizando un receptor quimerico de antigeno cd33.
|
|
MY181834A
(en)
|
2014-07-21 |
2021-01-08 |
Novartis Ag |
Treatment of cancer using humanized anti-bcma chimeric antigen receptor
|
|
US11542488B2
(en)
|
2014-07-21 |
2023-01-03 |
Novartis Ag |
Sortase synthesized chimeric antigen receptors
|
|
EP3174546B1
(de)
|
2014-07-31 |
2019-10-30 |
Novartis AG |
Teilmengenoptimierte chimäre antigenrezeptorhaltige t-zellen
|
|
NZ766556A
(en)
|
2014-08-04 |
2024-02-23 |
Hoffmann La Roche |
Bispecific t cell activating antigen binding molecules
|
|
US20170240631A1
(en)
|
2014-08-08 |
2017-08-24 |
Alector Llc |
Anti-trem2 antibodies and methods of use thereof
|
|
WO2016025880A1
(en)
|
2014-08-14 |
2016-02-18 |
Novartis Ag |
Treatment of cancer using gfr alpha-4 chimeric antigen receptor
|
|
MY189028A
(en)
|
2014-08-19 |
2022-01-20 |
Novartis Ag |
Anti-cd123 chimeric antigen receptor (car) for use in cancer treatment
|
|
RU2764074C2
(ru)
|
2014-08-28 |
2022-01-13 |
Байоатла, Ллк |
Условно активные химерные антигенные рецепторы для модифицированных т-клеток
|
|
HUE043847T2
(hu)
|
2014-08-28 |
2019-09-30 |
Halozyme Inc |
Hialuronán-lebontó enzimmel és egy immun checkpoint inhibitorral végzett kombinációs terápia
|
|
CN107001404B
(zh)
|
2014-09-08 |
2021-06-29 |
中央研究院 |
使用醣脂激活人类iNKT细胞
|
|
CN113698488A
(zh)
|
2014-09-12 |
2021-11-26 |
基因泰克公司 |
抗-b7-h4抗体及免疫缀合物
|
|
AU2015314826A1
(en)
|
2014-09-12 |
2017-03-02 |
Genentech, Inc. |
Cysteine engineered antibodies and conjugates
|
|
MA40576B1
(fr)
|
2014-09-12 |
2020-11-30 |
Genentech Inc |
Anticorps et immunoconjugués anti-her2
|
|
AU2015314744A1
(en)
|
2014-09-12 |
2017-03-02 |
Genentech, Inc. |
Anti-CLL-1 antibodies and immunoconjugates
|
|
EP3193932B1
(de)
|
2014-09-15 |
2023-04-26 |
F. Hoffmann-La Roche AG |
Antikörperformulierungen
|
|
EP3197500A1
(de)
|
2014-09-17 |
2017-08-02 |
Genentech, Inc. |
Immunkonjugate mit anti-her2-antikörpern und pyrrolobenzodiazepinen
|
|
BR112017005390A2
(pt)
|
2014-09-17 |
2017-12-12 |
Novartis Ag |
células citotóxicas alvo com receptores quiméricos para imunoterapia adotiva
|
|
PL3262071T3
(pl)
|
2014-09-23 |
2020-08-10 |
F. Hoffmann-La Roche Ag |
Sposób stosowania immunokoniugatów anty-CD79b
|
|
US9988452B2
(en)
|
2014-10-14 |
2018-06-05 |
Novartis Ag |
Antibody molecules to PD-L1 and uses thereof
|
|
US9732148B2
(en)
|
2014-10-16 |
2017-08-15 |
Genentech, Inc. |
Anti-α-synuclein antibodies and methods of use
|
|
CA2966523A1
(en)
|
2014-11-03 |
2016-05-12 |
Genentech, Inc. |
Assays for detecting t cell immune subsets and methods of use thereof
|
|
US20160160290A1
(en)
|
2014-11-03 |
2016-06-09 |
Genentech, Inc. |
Methods and biomarkers for predicting efficacy and evaluation of an ox40 agonist treatment
|
|
KR102626877B1
(ko)
|
2014-11-05 |
2024-01-19 |
애넥슨, 인코포레이티드 |
인간화 항-보체 인자 c1q 항체 및 이의 용도
|
|
RU2739500C2
(ru)
|
2014-11-05 |
2020-12-25 |
Дженентек, Инк. |
Способы получения двуцепочечных белков в бактериях
|
|
AU2015342961B2
(en)
|
2014-11-05 |
2021-08-12 |
Genentech, Inc. |
Methods of producing two chain proteins in bacteria
|
|
BR112017008666A2
(pt)
|
2014-11-05 |
2018-01-30 |
Genentech, Inc. |
anticorpos anti-fgfr2/3 e métodos de uso dos mesmos
|
|
WO2016073157A1
(en)
|
2014-11-06 |
2016-05-12 |
Genentech, Inc. |
Anti-ang2 antibodies and methods of use thereof
|
|
SG11201703376QA
(en)
|
2014-11-06 |
2017-05-30 |
Genentech Inc |
Combination therapy comprising ox40 binding agonists and tigit inhibitors
|
|
CN107172879B
(zh)
|
2014-11-10 |
2021-11-05 |
豪夫迈·罗氏有限公司 |
抗白细胞介素-33抗体及其用途
|
|
CN107105632A
(zh)
|
2014-11-10 |
2017-08-29 |
豪夫迈·罗氏有限公司 |
肾病动物模型及其治疗剂
|
|
MY191428A
(en)
|
2014-11-14 |
2022-06-27 |
Hoffmann La Roche |
Antigen binding molecules comprising a tnf family ligand trimer
|
|
CN106999583A
(zh)
|
2014-11-17 |
2017-08-01 |
豪夫迈·罗氏有限公司 |
包含ox40结合激动剂和pd‑1轴结合拮抗剂的组合疗法
|
|
CN107257805A
(zh)
|
2014-11-19 |
2017-10-17 |
雀巢产品技术援助有限公司 |
抗血清素、色氨酸和犬尿氨酸代谢产物的抗体及其用途
|
|
EP3221361B1
(de)
|
2014-11-19 |
2021-04-21 |
Genentech, Inc. |
Multispezifische anti-transferrin-rezeptor- / anti-bace1-antikörper und verfahren zur verwendung
|
|
EP3845565A3
(de)
|
2014-11-19 |
2021-09-08 |
Genentech, Inc. |
Antikörper gegen bace1 und verwendung davon zur immuntherapie bei neuronalen erkrankungen
|
|
JP6779876B2
(ja)
|
2014-11-19 |
2020-11-04 |
ジェネンテック, インコーポレイテッド |
抗トランスフェリン受容体抗体及びその使用方法
|
|
CA2968162A1
(en)
|
2014-11-20 |
2016-05-26 |
F. Hoffmann-La Roche Ag |
Common light chains and methods of use
|
|
SI3789402T1
(sl)
|
2014-11-20 |
2022-10-28 |
F. Hoffmann-La Roche Ag |
Kombinirano zdravljenje z bispecifičnimi molekulami, ki vežejo antigen in aktivirajo celice T, ter antagonisti za vezavo osi PD-1
|
|
EP3227341A1
(de)
|
2014-12-02 |
2017-10-11 |
CeMM - Forschungszentrum für Molekulare Medizin GmbH |
Anti-mutante calreticulin-antikörper und deren verwendung bei der diagnose und therapie von myeloiden malignomen
|
|
WO2016087416A1
(en)
|
2014-12-03 |
2016-06-09 |
F. Hoffmann-La Roche Ag |
Multispecific antibodies
|
|
WO2016090034A2
(en)
|
2014-12-03 |
2016-06-09 |
Novartis Ag |
Methods for b cell preconditioning in car therapy
|
|
MA41119A
(fr)
|
2014-12-03 |
2017-10-10 |
Acceleron Pharma Inc |
Méthodes de traitement de syndromes myélodysplasiques et d'anémie sidéroblastique
|
|
LT3227336T
(lt)
|
2014-12-05 |
2019-09-25 |
F. Hoffmann-La Roche Ag |
Anti-cd79b antikūnai ir jų naudojimo būdai
|
|
KR20170085595A
(ko)
|
2014-12-10 |
2017-07-24 |
제넨테크, 인크. |
혈뇌 장벽 수용체 항체 및 사용 방법
|
|
US20160168237A1
(en)
|
2014-12-12 |
2016-06-16 |
Alexion Pharmaceuticals, Inc. |
Method for treating a complement mediated disorder caused by an infectious agent in a patient
|
|
ES2746839T3
(es)
|
2014-12-18 |
2020-03-09 |
Pfizer |
Derivados de pirimidina y triazina y su uso como inhibidores de AXL
|
|
AU2015365167B2
(en)
|
2014-12-19 |
2021-07-29 |
Chugai Seiyaku Kabushiki Kaisha |
Anti-C5 antibodies and methods of use
|
|
EP3034130B1
(de)
|
2014-12-19 |
2019-12-04 |
Althia Health, S.L. |
Monoklonaler Antikörper zur Diagnose, Behandlung und/oder Prävention von Hirntumoren und Hirnverletzungen
|
|
SG10201906471PA
(en)
|
2015-01-14 |
2019-09-27 |
Brigham & Womens Hospital Inc |
Treatment of cancer with anti-lap monoclonal antibodies
|
|
US10495645B2
(en)
|
2015-01-16 |
2019-12-03 |
Academia Sinica |
Cancer markers and methods of use thereof
|
|
US9975965B2
(en)
|
2015-01-16 |
2018-05-22 |
Academia Sinica |
Compositions and methods for treatment and detection of cancers
|
|
JP2018511557A
(ja)
|
2015-01-22 |
2018-04-26 |
中外製薬株式会社 |
2種以上の抗c5抗体の組み合わせおよび使用方法
|
|
KR20170104617A
(ko)
|
2015-01-24 |
2017-09-15 |
아카데미아 시니카 |
신규한 글리칸 콘주게이트 및 이를 사용하는 방법
|
|
KR102630294B1
(ko)
|
2015-01-24 |
2024-01-26 |
아카데미아 시니카 |
암 마커 및 이를 사용하는 방법
|
|
JP2018506275A
(ja)
|
2015-01-28 |
2018-03-08 |
ジェネンテック, インコーポレイテッド |
多発性硬化症の遺伝子発現マーカー及び治療
|
|
TWI717333B
(zh)
|
2015-01-30 |
2021-02-01 |
中央研究院 |
增進抗體功效之通用糖型組合物及方法
|
|
JP2018512597A
(ja)
|
2015-02-04 |
2018-05-17 |
ジェネンテック, インコーポレイテッド |
突然変異体スムースンド及びその使用方法
|
|
CN114773469A
(zh)
|
2015-02-05 |
2022-07-22 |
中外制药株式会社 |
包含离子浓度依赖性的抗原结合结构域的抗体,fc区变体,il-8-结合抗体及其应用
|
|
CN107810192A
(zh)
|
2015-02-23 |
2018-03-16 |
海鸥治疗简易股份公司 |
非天然的脑信号蛋白3及其医药用途
|
|
CN113209289A
(zh)
|
2015-02-26 |
2021-08-06 |
豪夫迈·罗氏有限公司 |
治疗Crohn病的整联蛋白β7拮抗剂和方法
|
|
MX2017011189A
(es)
|
2015-03-06 |
2018-01-23 |
Genentech Inc |
Dsba y dsbc ultrapurificado y métodos para elaborarlos y utilizarlos.
|
|
AU2016233398A1
(en)
|
2015-03-16 |
2017-09-07 |
F. Hoffmann-La Roche Ag |
Methods of detecting and quantifying IL-13 and uses in diagnosing and treating Th2-associated diseases
|
|
WO2016145536A1
(en)
|
2015-03-18 |
2016-09-22 |
Immunobiochem Corporation |
Conjugates for the treatment of cancer targeted at intracellular tumor-associated antigens
|
|
WO2016146833A1
(en)
|
2015-03-19 |
2016-09-22 |
F. Hoffmann-La Roche Ag |
Biomarkers for nad(+)-diphthamide adp ribosyltransferase resistance
|
|
MA41919A
(fr)
|
2015-04-06 |
2018-02-13 |
Acceleron Pharma Inc |
Hétéromultimères alk4:actriib et leurs utilisations
|
|
CN114736307A
(zh)
|
2015-04-06 |
2022-07-12 |
阿塞勒隆制药公司 |
TGF-β超家族I型和II型受体异多聚体及其用途
|
|
ES2899227T3
(es)
|
2015-04-07 |
2022-03-10 |
Alector Llc |
Anticuerpos anti sortilina y métodos de uso de los mismos
|
|
CN107709364A
(zh)
|
2015-04-07 |
2018-02-16 |
豪夫迈·罗氏有限公司 |
具有激动剂活性的抗原结合复合体及使用方法
|
|
SI3280729T1
(sl)
|
2015-04-08 |
2022-09-30 |
Novartis Ag |
Terapije CD20, terapije CD22 in kombinacija terapij s celico, ki izraža himerni antigenski receptor CD19 (CAR)
|
|
US9901574B2
(en)
|
2015-04-20 |
2018-02-27 |
Tolero Pharmaceuticals, Inc. |
Predicting response to alvocidib by mitochondrial profiling
|
|
CN113552350A
(zh)
|
2015-04-21 |
2021-10-26 |
基因泰克公司 |
用于前列腺癌分析的组合物和方法
|
|
GB201506870D0
(en)
|
2015-04-22 |
2015-06-03 |
Ucb Biopharma Sprl |
Method
|
|
WO2016172583A1
(en)
|
2015-04-23 |
2016-10-27 |
Novartis Ag |
Treatment of cancer using chimeric antigen receptor and protein kinase a blocker
|
|
JP7044553B2
(ja)
|
2015-04-24 |
2022-03-30 |
ジェネンテック, インコーポレイテッド |
結合ポリペプチドを含む細菌を特定する方法
|
|
JP2018520642A
(ja)
|
2015-05-01 |
2018-08-02 |
ジェネンテック, インコーポレイテッド |
マスク抗cd3抗体及びその使用方法
|
|
CN107709344B
(zh)
|
2015-05-01 |
2022-07-15 |
共晶制药股份有限公司 |
用于治疗黄病毒科病毒和癌症的核苷类似物
|
|
CN116196414A
(zh)
|
2015-05-11 |
2023-06-02 |
豪夫迈·罗氏有限公司 |
治疗狼疮性肾炎的组合物和方法
|
|
IL295002A
(en)
|
2015-05-12 |
2022-09-01 |
Genentech Inc |
Therapeutic and diagnostic methods for cancer containing a pd–l1 binding antagonist
|
|
CN111349118B
(zh)
|
2015-05-18 |
2023-08-22 |
住友制药肿瘤公司 |
具有增加的生物利用度的阿伏西地前药
|
|
ES2823033T3
(es)
|
2015-05-28 |
2021-05-05 |
Genentech Inc |
Ensayo basado en células para detectar homodímeros anti-CD3
|
|
WO2016196343A1
(en)
|
2015-05-29 |
2016-12-08 |
Genentech, Inc. |
Humanized anti-ebola virus glycoprotein antibodies and methods of use
|
|
EP3303619B1
(de)
|
2015-05-29 |
2020-06-10 |
H. Hoffnabb-La Roche Ag |
Pd-l1-promotormethylierung bei krebs
|
|
KR20180012753A
(ko)
|
2015-05-29 |
2018-02-06 |
제넨테크, 인크. |
암에 대한 치료 및 진단 방법
|
|
KR20180011117A
(ko)
|
2015-05-31 |
2018-01-31 |
큐어제닉스 코포레이션 |
면역 요법용 복합 조성물
|
|
JP2018516933A
(ja)
|
2015-06-02 |
2018-06-28 |
ジェネンテック, インコーポレイテッド |
抗il−34抗体を使用して神経学的疾患を治療するための組成物及び方法
|
|
SG10201911349YA
(en)
|
2015-06-05 |
2020-01-30 |
Genentech Inc |
Anti-tau antibodies and methods of use
|
|
KR20180025888A
(ko)
|
2015-06-08 |
2018-03-09 |
제넨테크, 인크. |
항-ox40 항체 및 pd-1 축 결합 길항제를 사용하여 암을 치료하는 방법
|
|
AU2016274585A1
(en)
|
2015-06-08 |
2017-12-14 |
Genentech, Inc. |
Methods of treating cancer using anti-OX40 antibodies
|
|
US11174313B2
(en)
|
2015-06-12 |
2021-11-16 |
Alector Llc |
Anti-CD33 antibodies and methods of use thereof
|
|
CA2988982A1
(en)
|
2015-06-12 |
2016-12-15 |
Alector Llc |
Anti-cd33 antibodies and methods of use thereof
|
|
US10017577B2
(en)
|
2015-06-15 |
2018-07-10 |
Genentech, Inc. |
Antibodies and immunoconjugates
|
|
PE20180330A1
(es)
|
2015-06-16 |
2018-02-13 |
Genentech Inc |
Anticuerpos madurados por afinidad y humanizados para fcrh5 y metodos para su uso
|
|
CN107847568B
(zh)
|
2015-06-16 |
2022-12-20 |
豪夫迈·罗氏有限公司 |
抗cll-1抗体和使用方法
|
|
WO2016204966A1
(en)
|
2015-06-16 |
2016-12-22 |
Genentech, Inc. |
Anti-cd3 antibodies and methods of use
|
|
KR20180018538A
(ko)
|
2015-06-17 |
2018-02-21 |
제넨테크, 인크. |
Pd-1 축 결합 길항제 및 탁산을 사용하여 국소적 진행성 또는 전이성 유방암을 치료하는 방법
|
|
JP2018524312A
(ja)
|
2015-06-17 |
2018-08-30 |
ジェネンテック, インコーポレイテッド |
抗her2抗体及び使用方法
|
|
WO2016205567A1
(en)
|
2015-06-17 |
2016-12-22 |
Allakos Inc. |
Methods and compositions for treating fibrotic diseases
|
|
EP3313877B1
(de)
|
2015-06-24 |
2020-06-03 |
H. Hoffnabb-La Roche Ag |
Humanisierte anti-tau(ps422)-antikörper und verfahren zur verwendung
|
|
EP3514174B1
(de)
|
2015-06-29 |
2021-03-31 |
Ventana Medical Systems, Inc. |
Materialien und verfahren zur durchführung histochemischer tests für menschliches pro-epiregulin und amphiregulin
|
|
CN108473573A
(zh)
|
2015-06-29 |
2018-08-31 |
豪夫迈·罗氏有限公司 |
Ii型抗cd20抗体用于器官移植中
|
|
WO2017009751A1
(en)
|
2015-07-15 |
2017-01-19 |
Pfizer Inc. |
Pyrimidine derivatives
|
|
PL3317301T3
(pl)
|
2015-07-29 |
2021-11-15 |
Novartis Ag |
Terapie skojarzone zawierające cząsteczki przeciwciał przeciw lag-3
|
|
EP3878465A1
(de)
|
2015-07-29 |
2021-09-15 |
Novartis AG |
Kombinationstherapien mit antikörpermolekülen gegen tim-3
|
|
CA2993659A1
(en)
|
2015-08-03 |
2017-02-09 |
Tolero Pharmaceuticals, Inc. |
Combination therapies for treatment of cancer
|
|
EP4218792A1
(de)
|
2015-08-04 |
2023-08-02 |
Acceleron Pharma Inc. |
Zusammensetzung zur behandlung von myeloproliferativen erkrankungen
|
|
TW202340452A
(zh)
|
2015-08-04 |
2023-10-16 |
美商再生元醫藥公司 |
補充牛磺酸之細胞培養基及用法
|
|
EP4137158A1
(de)
|
2015-08-07 |
2023-02-22 |
Imaginab, Inc. |
Gegen moleküle gerichtete antigenbindende konstrukte
|
|
CN105384825B
(zh)
|
2015-08-11 |
2018-06-01 |
南京传奇生物科技有限公司 |
一种基于单域抗体的双特异性嵌合抗原受体及其应用
|
|
EP3341411A1
(de)
|
2015-08-28 |
2018-07-04 |
Alector LLC |
Anti-siglec-7-antikörper und verfahren zur verwendung davon
|
|
CN108026180B
(zh)
|
2015-08-28 |
2022-06-07 |
豪夫迈·罗氏有限公司 |
抗羟腐胺赖氨酸抗体及其用途
|
|
WO2017041027A1
(en)
|
2015-09-04 |
2017-03-09 |
Obi Pharma, Inc. |
Glycan arrays and method of use
|
|
US20170073399A1
(en)
|
2015-09-11 |
2017-03-16 |
Alexion Pharmaceuticals, Inc. |
Recombinant glycosylated eculizumab and eculizumab variants
|
|
CA2993423C
(en)
|
2015-09-18 |
2024-03-12 |
Chugai Seiyaku Kabushiki Kaisha |
Il-8-binding antibodies and uses thereof
|
|
CA2999369C
(en)
|
2015-09-22 |
2023-11-07 |
Spring Bioscience Corporation |
Anti-ox40 antibodies and diagnostic uses thereof
|
|
AU2016326666B2
(en)
|
2015-09-23 |
2023-06-15 |
Genentech, Inc. |
Optimized variants of anti-VEGF antibodies
|
|
US10954300B2
(en)
|
2015-09-28 |
2021-03-23 |
The Trustees Of Columbia University In The City Of New York |
Use of pentoxifylline with immune checkpoint-blockade therapies for the treatment of melanoma
|
|
WO2017058859A1
(en)
|
2015-09-29 |
2017-04-06 |
Celgene Corporation |
Pd-1 binding proteins and methods of use thereof
|
|
AR106188A1
(es)
|
2015-10-01 |
2017-12-20 |
Hoffmann La Roche |
Anticuerpos anti-cd19 humano humanizados y métodos de utilización
|
|
AR106199A1
(es)
|
2015-10-02 |
2017-12-20 |
Hoffmann La Roche |
Moléculas de unión a antígeno biespecíficas activadoras de células t
|
|
WO2017055393A1
(en)
|
2015-10-02 |
2017-04-06 |
F. Hoffmann-La Roche Ag |
Anti-cd3xtim-3 bispecific t cell activating antigen binding molecules
|
|
EP3356407B1
(de)
|
2015-10-02 |
2021-11-03 |
F. Hoffmann-La Roche AG |
Bispezifische anti-cd19xcd3-t-zell-aktivierende antigenbindende moleküle
|
|
US20180282410A1
(en)
|
2015-10-02 |
2018-10-04 |
Hoffmann-La Roche Inc. |
Anti-cd3xrob04 bispecific t cell activating antigen binding molecules
|
|
CR20180162A
(es)
|
2015-10-02 |
2018-05-25 |
Hoffmann La Roche |
Moléculas biespecíficas de unión a antígeno activadoras de células t
|
|
MA43345A
(fr)
|
2015-10-02 |
2018-08-08 |
Hoffmann La Roche |
Conjugués anticorps-médicaments de pyrrolobenzodiazépine et méthodes d'utilisation
|
|
KR102146319B1
(ko)
|
2015-10-02 |
2020-08-25 |
에프. 호프만-라 로슈 아게 |
Pd1 및 tim3에 특이적인 이중특이성 항체
|
|
BR112018002570A2
(pt)
|
2015-10-02 |
2018-10-16 |
Hoffmann La Roche |
molécula de ligação ao antígeno biespecífica, anticorpo biespecífico, polinucleotídeos, anticorpo que se liga especificamente ao ox40, composição farmacêutica e método para inibir o crescimento de células tumorais em um indivíduo
|
|
WO2017055385A1
(en)
|
2015-10-02 |
2017-04-06 |
F. Hoffmann-La Roche Ag |
Anti-cd3xgd2 bispecific t cell activating antigen binding molecules
|
|
DK3356404T3
(da)
|
2015-10-02 |
2021-10-25 |
Hoffmann La Roche |
Anti-pd1-antistoffer og fremgangsmåder til anvendelse
|
|
WO2017055392A1
(en)
|
2015-10-02 |
2017-04-06 |
F. Hoffmann-La Roche Ag |
Anti-cd3xcd44v6 bispecific t cell activating antigen binding molecules
|
|
CN108026179A
(zh)
|
2015-10-02 |
2018-05-11 |
豪夫迈·罗氏有限公司 |
结合间皮素和cd3的双特异性t细胞活化性抗原结合分子
|
|
JP2018529747A
(ja)
|
2015-10-06 |
2018-10-11 |
ジェネンテック, インコーポレイテッド |
多発性硬化症を治療するための方法
|
|
AU2016334051B2
(en)
|
2015-10-06 |
2023-10-26 |
Alector Llc |
Anti-TREM2 antibodies and methods of use thereof
|
|
WO2017060144A1
(en)
|
2015-10-07 |
2017-04-13 |
F. Hoffmann-La Roche Ag |
Bispecific antibodies with tetravalency for a costimulatory tnf receptor
|
|
WO2017062649A1
(en)
|
2015-10-07 |
2017-04-13 |
Alexion Pharmaceuticals, Inc. |
A method for treating age-related macular degeneration in a patient
|
|
MA43354A
(fr)
|
2015-10-16 |
2018-08-22 |
Genentech Inc |
Conjugués médicamenteux à pont disulfure encombré
|
|
MA45326A
(fr)
|
2015-10-20 |
2018-08-29 |
Genentech Inc |
Conjugués calichéamicine-anticorps-médicament et procédés d'utilisation
|
|
US10604577B2
(en)
|
2015-10-22 |
2020-03-31 |
Allakos Inc. |
Methods and compositions for treating systemic mastocytosis
|
|
EP3365442B8
(de)
|
2015-10-23 |
2022-06-08 |
Fred Hutchinson Cancer Center |
Verfahren zur herstellung chemisch induzierter dimerisierungsproteinsysteme zur regulierung zellulärer ereignisse
|
|
JP6921067B2
(ja)
|
2015-10-28 |
2021-08-18 |
イエール ユニバーシティ |
ヒト化抗Dkk2抗体およびその使用方法
|
|
WO2017072210A1
(en)
|
2015-10-29 |
2017-05-04 |
F. Hoffmann-La Roche Ag |
Anti-variant fc-region antibodies and methods of use
|
|
EP3184547A1
(de)
|
2015-10-29 |
2017-06-28 |
F. Hoffmann-La Roche AG |
Anti-tpbg-antikörper und verfahren zur verwendung
|
|
CN116003596A
(zh)
|
2015-10-29 |
2023-04-25 |
艾利妥 |
抗siglec-9抗体及其使用方法
|
|
US10654932B2
(en)
|
2015-10-30 |
2020-05-19 |
Genentech, Inc. |
Anti-factor D antibody variant conjugates and uses thereof
|
|
KR102440160B1
(ko)
|
2015-10-30 |
2022-09-02 |
제넨테크, 인크. |
항-HtrA1 항체 및 이의 사용 방법
|
|
TW201730211A
(zh)
|
2015-10-30 |
2017-09-01 |
建南德克公司 |
抗因子d抗體及結合物
|
|
WO2017079768A1
(en)
|
2015-11-08 |
2017-05-11 |
Genentech, Inc. |
Methods of screening for multispecific antibodies
|
|
CN106729743B
(zh)
|
2015-11-23 |
2021-09-21 |
四川科伦博泰生物医药股份有限公司 |
抗ErbB2抗体-药物偶联物及其组合物、制备方法和应用
|
|
AU2016359695A1
(en)
|
2015-11-23 |
2018-06-14 |
Acceleron Pharma Inc. |
Methods for treating eye disorders
|
|
CN108601752A
(zh)
|
2015-12-03 |
2018-09-28 |
安吉奥斯医药品有限公司 |
用于治疗mtap缺失型癌症的mat2a抑制剂
|
|
EP3178848A1
(de)
|
2015-12-09 |
2017-06-14 |
F. Hoffmann-La Roche AG |
Type ii anti-cd20 antikörper zur verringerung der bildung von antikörpern gegen medikamente
|
|
AU2016368469B2
(en)
|
2015-12-09 |
2023-11-02 |
F. Hoffmann-La Roche Ag |
Type II anti-CD20 antibody for reducing formation of anti-drug antibodies
|
|
EP3390441B1
(de)
|
2015-12-15 |
2021-08-25 |
Gilead Sciences, Inc. |
Antikörper zur neutralisierung des humanen immundefizienzvirus
|
|
KR20180094977A
(ko)
|
2015-12-17 |
2018-08-24 |
노파르티스 아게 |
c-Met 억제제와 PD-1에 대한 항체 분자의 조합물 및 그의 용도
|
|
AU2016369537B2
(en)
|
2015-12-17 |
2024-03-14 |
Novartis Ag |
Antibody molecules to PD-1 and uses thereof
|
|
KR102467124B1
(ko)
|
2015-12-18 |
2022-11-15 |
추가이 세이야쿠 가부시키가이샤 |
항-c5 항체 및 사용 방법
|
|
SG10202103844WA
(en)
|
2015-12-30 |
2021-06-29 |
Genentech Inc |
Use of tryptophan derivatives for protein formulations
|
|
AU2016380988B2
(en)
|
2015-12-30 |
2022-07-21 |
Genentech, Inc. |
Formulations with reduced degradation of polysorbate
|
|
WO2017118307A1
(zh)
|
2016-01-05 |
2017-07-13 |
江苏恒瑞医药股份有限公司 |
Pcsk9抗体、其抗原结合片段及其医药用途
|
|
EP3862365A1
(de)
|
2016-01-08 |
2021-08-11 |
F. Hoffmann-La Roche AG |
Verfahren zur behandlung von cea-positiven karzinomen unter verwendung von antagonisten mit pd-1-achsen-bindung und bispezifischen anti-cea-/anti-cd3-antikörpern
|
|
CN108602883A
(zh)
|
2016-01-20 |
2018-09-28 |
基因泰克公司 |
用于阿尔茨海默氏病的高剂量治疗
|
|
WO2017125897A1
(en)
|
2016-01-21 |
2017-07-27 |
Novartis Ag |
Multispecific molecules targeting cll-1
|
|
US11513127B2
(en)
|
2016-01-25 |
2022-11-29 |
Genentech, Inc. |
Methods for assaying T-cell dependent bispecific antibodies
|
|
CN109071625A
(zh)
|
2016-02-04 |
2018-12-21 |
柯瑞斯公司 |
平滑化突变体和其使用方法
|
|
US10982136B2
(en)
|
2016-02-26 |
2021-04-20 |
The Regents Of The University Of California |
Ligand-sensitized lanthanide nanocrystals as ultraviolet downconverters
|
|
AU2017225854B2
(en)
|
2016-02-29 |
2020-11-19 |
Foundation Medicine, Inc. |
Therapeutic and diagnostic methods for cancer
|
|
WO2017152102A2
(en)
|
2016-03-04 |
2017-09-08 |
Alector Llc |
Anti-trem1 antibodies and methods of use thereof
|
|
CA3016287A1
(en)
|
2016-03-04 |
2017-09-08 |
Novartis Ag |
Cells expressing multiple chimeric antigen receptor (car) molecules and uses therefore
|
|
EP3216458A1
(de)
|
2016-03-07 |
2017-09-13 |
Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. |
Modifizierter vaskulärer endothelialen wachstumsfaktor a (vegf-a) und dessen medizinische verwendung
|
|
AU2017231749A1
(en)
|
2016-03-08 |
2018-09-20 |
Academia Sinica |
Methods for modular synthesis of N-glycans and arrays thereof
|
|
JP6430025B2
(ja)
|
2016-03-15 |
2018-11-28 |
中外製薬株式会社 |
Pd−1系結合アンタゴニストおよび抗gpc3抗体を使用して癌を治療する方法
|
|
WO2017161206A1
(en)
|
2016-03-16 |
2017-09-21 |
Halozyme, Inc. |
Conjugates containing conditionally active antibodies or antigen-binding fragments thereof, and methods of use
|
|
CR20180453A
(es)
|
2016-03-22 |
2018-12-05 |
Hoffmann La Roche |
Moleculas biespecíficas de células t activadas por proteasas
|
|
JP7015244B2
(ja)
|
2016-03-22 |
2022-02-02 |
エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト |
プロテアーゼ活性化t細胞二重特異性分子
|
|
WO2017165683A1
(en)
|
2016-03-23 |
2017-09-28 |
Novartis Ag |
Cell secreted minibodies and uses thereof
|
|
EP4273551A3
(de)
|
2016-03-25 |
2024-01-17 |
F. Hoffmann-La Roche AG |
Multiplex-gesamtantikörper- und antikörper-konjugierter arzneimittelquantifizierungstest
|
|
EP3231813A1
(de)
|
2016-03-29 |
2017-10-18 |
F. Hoffmann-La Roche AG |
Trimere kostimulatorische tnf-familien-ligandenhaltige antigenbindende moleküle
|
|
CN109311995A
(zh)
|
2016-03-29 |
2019-02-05 |
台湾浩鼎生技股份有限公司 |
抗体、药物组合物和方法
|
|
US10980894B2
(en)
|
2016-03-29 |
2021-04-20 |
Obi Pharma, Inc. |
Antibodies, pharmaceutical compositions and methods
|
|
EP3865511A1
(de)
|
2016-04-14 |
2021-08-18 |
F. Hoffmann-La Roche AG |
Anti-rspo3-antikörper und verfahren zur verwendung
|
|
AU2017248766A1
(en)
|
2016-04-15 |
2018-11-01 |
Genentech, Inc. |
Methods for monitoring and treating cancer
|
|
MX2018012492A
(es)
|
2016-04-15 |
2019-06-06 |
Genentech Inc |
Métodos para monitorear y tratar el cáncer.
|
|
PL3443096T3
(pl)
|
2016-04-15 |
2023-06-19 |
Novartis Ag |
Kompozycje i sposoby do selektywnej ekspresji chimerycznych receptorów antygenowych
|
|
EP3443012A4
(de)
|
2016-04-15 |
2019-09-11 |
Bioatla, LLC |
Anti-axl-antikörper, antikörperfragmente und deren immunkonjugate und verwendungen davon
|
|
KR20180128496A
(ko)
|
2016-04-22 |
2018-12-03 |
오비아이 파머 인코퍼레이티드 |
글로보 계열 항원을 통한 면역 활성화 또는 면역 조정에 의한 암 면역요법
|
|
AU2017259869A1
(en)
|
2016-05-02 |
2018-09-27 |
F. Hoffmann-La Roche Ag |
The contorsbody - a single chain target binder
|
|
WO2017194554A1
(en)
|
2016-05-10 |
2017-11-16 |
Inserm (Institut National De La Sante Et De La Recherche Medicale) |
Combinations therapies for the treatment of cancer
|
|
JP7285076B2
(ja)
|
2016-05-11 |
2023-06-01 |
エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト |
Tnfファミリーリガンドトリマーとテネイシン結合部分とを含む抗原結合分子
|
|
JP7089483B2
(ja)
|
2016-05-11 |
2022-06-22 |
エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト |
修飾された抗テネイシン抗体及び使用方法
|
|
EP3243836A1
(de)
|
2016-05-11 |
2017-11-15 |
F. Hoffmann-La Roche AG |
C-terminal-fusionierte antigenbindende moleküle mit ligandentrimer der tnf-familie
|
|
EP3243832A1
(de)
|
2016-05-13 |
2017-11-15 |
F. Hoffmann-La Roche AG |
Antigenbindende moleküle mit einem ligandentrimer der tnf-familie und pd1-bindungsteil
|
|
RS63698B1
(sr)
|
2016-05-13 |
2022-11-30 |
Bioatla Inc |
Anti-ror2 antitela, fragmenti antitela, njihovi imunokonjugati i njihove upotrebe
|
|
KR20190007026A
(ko)
|
2016-05-17 |
2019-01-21 |
제넨테크, 인크. |
면역요법에서의 진단 및 사용을 위한 기질 유전자 특질
|
|
ES2858151T3
(es)
|
2016-05-20 |
2021-09-29 |
Hoffmann La Roche |
Conjugados de PROTAC-anticuerpo y procedimientos de uso
|
|
EP3465221B1
(de)
|
2016-05-27 |
2020-07-22 |
H. Hoffnabb-La Roche Ag |
Bioanalytisches verfahren zur charakterisierung von ortsspezifischen antikörper-wirkstoff-konjugaten
|
|
CN110603266A
(zh)
|
2016-06-02 |
2019-12-20 |
豪夫迈·罗氏有限公司 |
用于治疗癌症的ii型抗cd20抗体和抗cd20/cd3双特异性抗体
|
|
EP3252078A1
(de)
|
2016-06-02 |
2017-12-06 |
F. Hoffmann-La Roche AG |
Typ ii anti-cd20 antikörper und anti-cd20/cd3 bispecific antikörper zur behandlung von krebs
|
|
US10851159B2
(en)
|
2016-06-02 |
2020-12-01 |
Bloom Diagnostics Ag |
Antibodies that bind to human anti-Müllerian hormone (AMH) and their uses
|
|
EP3464375A2
(de)
|
2016-06-02 |
2019-04-10 |
Novartis AG |
Therapeutische schemata für chimäre antigenrezeptor(car)-exprimierende zellen
|
|
JP7043425B2
(ja)
|
2016-06-06 |
2022-03-29 |
ジェネンテック, インコーポレイテッド |
シルベストロール抗体-薬物コンジュゲート及び使用方法
|
|
CN109563124A
(zh)
|
2016-06-17 |
2019-04-02 |
豪夫迈·罗氏有限公司 |
多特异性抗体的纯化
|
|
EP3475298A1
(de)
|
2016-06-24 |
2019-05-01 |
H. Hoffnabb-La Roche Ag |
Multispezifische anti-polyubiquitin-antikörper
|
|
WO2018011691A1
(en)
|
2016-07-12 |
2018-01-18 |
Nestec S.A. |
Competitive immunoassay methods
|
|
EP3484516A4
(de)
|
2016-07-14 |
2020-03-18 |
Fred Hutchinson Cancer Research Center |
Mehrere bispezifische bindungsdomänenkonstrukte mit unterschiedlicher epitopbindung zur behandlung von krebs
|
|
PT3496739T
(pt)
|
2016-07-15 |
2021-06-21 |
Acceleron Pharma Inc |
Composições compreendendo polipéptidos actriia para uso no tratamento de hipertensão pulmonar
|
|
AU2017295886C1
(en)
|
2016-07-15 |
2024-01-25 |
Novartis Ag |
Treatment and prevention of cytokine release syndrome using a chimeric antigen receptor in combination with a kinase inhibitor
|
|
WO2018014260A1
(en)
|
2016-07-20 |
2018-01-25 |
Nanjing Legend Biotech Co., Ltd. |
Multispecific antigen binding proteins and methods of use thereof
|
|
KR20190040972A
(ko)
|
2016-07-27 |
2019-04-19 |
악셀레론 파마 인코포레이티드 |
골섬유증 치료 방법 및 조성물
|
|
CN110072545A
(zh)
|
2016-07-27 |
2019-07-30 |
台湾浩鼎生技股份有限公司 |
免疫原性/治疗性聚糖组合物及其用途
|
|
CA3032054A1
(en)
|
2016-07-28 |
2018-02-01 |
Novartis Ag |
Combination therapies of chimeric antigen receptors and pd-1 inhibitors
|
|
JP7121724B2
(ja)
|
2016-07-29 |
2022-08-18 |
オービーアイ ファーマ,インコーポレイテッド |
ヒト抗体、医薬組成物及び方法
|
|
MX2018015721A
(es)
|
2016-07-29 |
2019-05-27 |
Chugai Pharmaceutical Co Ltd |
Anticuerpos biespecificos que exhiben actividad de funcion de cofactor fviii alternativa mejorada.
|
|
CN110267677A
(zh)
|
2016-08-01 |
2019-09-20 |
诺华股份有限公司 |
使用与原m2巨噬细胞分子抑制剂组合的嵌合抗原受体治疗癌症
|
|
JP2019530434A
(ja)
|
2016-08-05 |
2019-10-24 |
ジェネンテック, インコーポレイテッド |
アゴニスト活性を有する多価及び多重エピトープ抗体ならびに使用方法
|
|
SG11201801024XA
(en)
|
2016-08-05 |
2018-05-30 |
Chugai Pharmaceutical Co Ltd |
Therapeutic or preventive compositions for il-8-related diseases
|
|
WO2018029124A1
(en)
|
2016-08-08 |
2018-02-15 |
F. Hoffmann-La Roche Ag |
Therapeutic and diagnostic methods for cancer
|
|
CN109689111B
(zh)
|
2016-08-11 |
2024-04-05 |
基因泰克公司 |
吡咯并苯并二氮杂䓬前药及其抗体缀合物
|
|
CN115598231A
(zh)
|
2016-08-15 |
2023-01-13 |
豪夫迈·罗氏有限公司(Ch) |
定量包含非离子表面活性剂和多肽的组合物中非离子表面活性剂的层析方法
|
|
CN109963868B
(zh)
|
2016-08-22 |
2023-11-14 |
醣基生医股份有限公司 |
抗体、结合片段及使用方法
|
|
WO2018044812A2
(en)
|
2016-08-29 |
2018-03-08 |
Fred Hutchinson Cancer Research Center |
Chelating platform for delivery of radionuclides
|
|
SG11201901435UA
(en)
|
2016-08-31 |
2019-03-28 |
Oncotherapy Science Inc |
Monoclonal antibody against melk and utilization thereof
|
|
JP7018210B2
(ja)
|
2016-09-06 |
2022-02-10 |
ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア |
ヒドロキシピリドネートアクチニド/ランタニド体外除去剤の製剤
|
|
EP3510046A4
(de)
|
2016-09-07 |
2020-05-06 |
The Regents of the University of California |
Antikörper gegen oxidationsspezifische epitope
|
|
SG10201607778XA
(en)
|
2016-09-16 |
2018-04-27 |
Chugai Pharmaceutical Co Ltd |
Anti-Dengue Virus Antibodies, Polypeptides Containing Variant Fc Regions, And Methods Of Use
|
|
JP2019534859A
(ja)
|
2016-09-19 |
2019-12-05 |
セルジーン コーポレイション |
Pd−1結合タンパク質を使用して白斑を治療する方法
|
|
SG11201901950TA
(en)
|
2016-09-19 |
2019-04-29 |
Celgene Corp |
Methods of treating immune disorders using pd-1 binding proteins
|
|
WO2018050878A1
(en)
|
2016-09-19 |
2018-03-22 |
F. Hoffmann-La Roche Ag |
Complement factor based affinity chromatography
|
|
JOP20190009A1
(ar)
|
2016-09-21 |
2019-01-27 |
Alx Oncology Inc |
أجسام مضادة ضد بروتين ألفا منظم للإشارات وطرق استخدامها
|
|
UA124269C2
(uk)
|
2016-09-23 |
2021-08-18 |
Дженентек, Інк. |
Застосування антагоністу il-13 для лікування атопічного дерматиту
|
|
CN109843926B
(zh)
|
2016-09-30 |
2023-01-20 |
豪夫迈·罗氏有限公司 |
针对cd3的双特异性抗体
|
|
AU2017340504A1
(en)
|
2016-10-05 |
2019-04-11 |
Acceleron Pharma, Inc. |
Compositions and method for treating kidney disease
|
|
EP3522933B1
(de)
|
2016-10-05 |
2021-12-15 |
F. Hoffmann-La Roche AG |
Verfahren zur herstellung von antikörperarzneimittelkonjugaten
|
|
TWI762516B
(zh)
|
2016-10-06 |
2022-05-01 |
日商腫瘤療法 科學股份有限公司 |
針對fzd10之單株抗體及其用途
|
|
KR20190072528A
(ko)
|
2016-10-06 |
2019-06-25 |
제넨테크, 인크. |
암에 대한 치료 및 진단 방법
|
|
CA3039646A1
(en)
|
2016-10-07 |
2018-04-12 |
Novartis Ag |
Chimeric antigen receptors for the treatment of cancer
|
|
WO2018068201A1
(en)
|
2016-10-11 |
2018-04-19 |
Nanjing Legend Biotech Co., Ltd. |
Single-domain antibodies and variants thereof against ctla-4
|
|
ES2888904T3
(es)
|
2016-10-19 |
2022-01-10 |
Alexion Pharma Inc |
Un método de cuantificación de C5a sin unir en una muestra
|
|
EP3529618B1
(de)
|
2016-10-19 |
2020-12-02 |
Alexion Pharmaceuticals, Inc. |
Verfahren zur quantifizierung von ungebundenem c5 in einer probe
|
|
EP3532496A1
(de)
|
2016-10-28 |
2019-09-04 |
Banyan Biomarkers, Inc. |
Antikörper gegen ubiquitin c-terminale hydrolase l1 (uch-l1) und gliales fibrilläres saures protein (gfap) und verwandte verfahren
|
|
EP3532091A2
(de)
|
2016-10-29 |
2019-09-04 |
H. Hoffnabb-La Roche Ag |
Anti-mic-antikörper und verfahren zur verwendung
|
|
CA3042435A1
(en)
|
2016-11-15 |
2018-05-24 |
Genentech, Inc. |
Dosing for treatment with anti-cd20/anti-cd3 bispecific antibodies
|
|
US11279694B2
(en)
|
2016-11-18 |
2022-03-22 |
Sumitomo Dainippon Pharma Oncology, Inc. |
Alvocidib prodrugs and their use as protein kinase inhibitors
|
|
TW201829463A
(zh)
|
2016-11-18 |
2018-08-16 |
瑞士商赫孚孟拉羅股份公司 |
抗hla-g抗體及其用途
|
|
JOP20190100A1
(ar)
|
2016-11-19 |
2019-05-01 |
Potenza Therapeutics Inc |
بروتينات ربط مولد ضد مضاد لـ gitr وطرق استخدامها
|
|
CA3044274A1
(en)
|
2016-11-21 |
2018-05-24 |
Obi Pharma, Inc. |
Conjugated biological molecules, pharmaceutical compositions and methods
|
|
WO2018106781A1
(en)
|
2016-12-07 |
2018-06-14 |
Genentech, Inc |
Anti-tau antibodies and methods of use
|
|
WO2018106776A2
(en)
|
2016-12-07 |
2018-06-14 |
Genentech, Inc. |
Anti-tau antibodies and methods of use
|
|
CN110114674B
(zh)
|
2016-12-13 |
2023-05-09 |
豪夫迈·罗氏有限公司 |
确定肿瘤样品中存在靶抗原的方法
|
|
MX2019007332A
(es)
|
2016-12-19 |
2019-11-18 |
Tolero Pharmaceuticals Inc |
Péptidos indicadores y métodos para caracterizar sensibilidad.
|
|
TWI829628B
(zh)
|
2016-12-19 |
2024-01-21 |
瑞士商赫孚孟拉羅股份公司 |
與靶向4-1bb (cd137)促效劑併用之組合療法
|
|
CA3039446A1
(en)
|
2016-12-20 |
2018-06-28 |
F. Hoffmann-La Roche Ag |
Combination therapy of anti-cd20/anti-cd3 bispecific antibodies and 4-1bb (cd137) agonists
|
|
JOP20190134A1
(ar)
|
2016-12-23 |
2019-06-02 |
Potenza Therapeutics Inc |
بروتينات رابطة لمولد ضد مضادة لنيوروبيلين وطرق استخدامها
|
|
RU2019123613A
(ru)
|
2017-01-03 |
2021-02-05 |
Ф. Хоффманн-Ля Рош Аг |
Биспецифические антигенсвязывающие молекулы, содержащие антитело к4-1вв, клон 20н4.9
|
|
US20180230218A1
(en)
|
2017-01-04 |
2018-08-16 |
Immunogen, Inc. |
Met antibodies and immunoconjugates and uses thereof
|
|
WO2018127791A2
(en)
|
2017-01-06 |
2018-07-12 |
Biosion, Inc. |
Erbb2 antibodies and uses therefore
|
|
EP4043485A1
(de)
|
2017-01-26 |
2022-08-17 |
Novartis AG |
Cd28-zusammensetzungen und verfahren für chimäre antigenrezeptortherapie
|
|
US11266745B2
(en)
|
2017-02-08 |
2022-03-08 |
Imaginab, Inc. |
Extension sequences for diabodies
|
|
JP6995127B2
(ja)
|
2017-02-10 |
2022-02-04 |
ジェネンテック, インコーポレイテッド |
抗トリプターゼ抗体、その組成物、及びその使用
|
|
WO2018152496A1
(en)
|
2017-02-17 |
2018-08-23 |
The Usa, As Represented By The Secretary, Dept. Of Health And Human Services |
Compositions and methods for the diagnosis and treatment of zika virus infection
|
|
EP3589647A1
(de)
|
2017-02-28 |
2020-01-08 |
Novartis AG |
Shp-inhibitor-zusammensetzungen und verwendungen zur chimären antigenrezeptortherapie
|
|
CA3052670A1
(en)
|
2017-03-01 |
2018-09-07 |
Genentech, Inc. |
Diagnostic and therapeutic methods for cancer
|
|
CN110382529B
(zh)
|
2017-03-02 |
2024-03-08 |
诺华股份有限公司 |
工程化的异源二聚体蛋白质
|
|
AR111190A1
(es)
|
2017-03-22 |
2019-06-12 |
Genentech Inc |
Composiciones en hidrogel de prodrogas entrecruzadas de ácido hialurónico y métodos relacionados
|
|
TWI808963B
(zh)
|
2017-03-22 |
2023-07-21 |
法商賽諾菲公司 |
使用人類化抗cxcr5抗體治療狼瘡
|
|
JP7227151B2
(ja)
|
2017-03-22 |
2023-02-21 |
ジェネンテック, インコーポレイテッド |
眼障害の治療のために最適化された抗体組成物
|
|
AU2018241624B2
(en)
|
2017-03-27 |
2024-01-25 |
F. Hoffmann-La Roche Ag |
Improved antigen binding receptors
|
|
MX2019011656A
(es)
|
2017-03-27 |
2019-12-02 |
Hoffmann La Roche |
Formatos mejorados de receptor de union a antigeno.
|
|
AU2018244224A1
(en)
|
2017-03-28 |
2019-09-19 |
Genentech, Inc. |
Methods of treating neurodegenerative diseases
|
|
EP3601346A1
(de)
|
2017-03-29 |
2020-02-05 |
H. Hoffnabb-La Roche Ag |
Bispezifische antigenbindemoleküle für einen co-stimulierenden tnf-rezeptor
|
|
CN110573528B
(zh)
|
2017-03-29 |
2023-06-09 |
豪夫迈·罗氏有限公司 |
针对共刺激性tnf受体的双特异性抗原结合分子
|
|
WO2018178074A1
(en)
|
2017-03-29 |
2018-10-04 |
F. Hoffmann-La Roche Ag |
Trimeric antigen binding molecules specific for a costimulatory tnf receptor
|
|
JOP20190203A1
(ar)
|
2017-03-30 |
2019-09-03 |
Potenza Therapeutics Inc |
بروتينات رابطة لمولد ضد مضادة لـ tigit وطرق استخدامها
|
|
CN110382525B
(zh)
|
2017-04-03 |
2023-10-20 |
豪夫迈·罗氏有限公司 |
免疫缀合物
|
|
JP7247101B2
(ja)
|
2017-04-03 |
2023-03-28 |
エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト |
Steap-1に結合する抗体
|
|
CA3053357A1
(en)
|
2017-04-03 |
2018-10-11 |
F. Hoffmann-La Roche Ag |
Immunoconjugates of an anti-pd-1 antibody with a mutant il-2 or with il-15
|
|
MX2019011907A
(es)
|
2017-04-04 |
2020-01-09 |
Hoffmann La Roche |
Nuevas moleculas de union a antigeno biespecificas capaces de unirse especificamente a cd40 y a fap.
|
|
KR102408873B1
(ko)
|
2017-04-05 |
2022-06-15 |
에프. 호프만-라 로슈 아게 |
Pd1 및 lag3에 특이적으로 결합하는 이중특이적 항체
|
|
PL3606954T3
(pl)
|
2017-04-05 |
2022-10-17 |
F. Hoffmann-La Roche Ag |
Przeciwciała anty-LAG3
|
|
RU2665790C1
(ru)
|
2017-04-17 |
2018-09-04 |
Закрытое Акционерное Общество "Биокад" |
Моноклональное антитело к pd-l1
|
|
CN108728444A
(zh)
|
2017-04-18 |
2018-11-02 |
长春华普生物技术股份有限公司 |
免疫调节性多核苷酸及其应用
|
|
PE20200150A1
(es)
|
2017-04-21 |
2020-01-17 |
Genentech Inc |
Uso de antagonistas de klk5 para el tratamiento de una enfermedad
|
|
EP3615569A1
(de)
|
2017-04-25 |
2020-03-04 |
The U.S.A. As Represented By The Secretary, Department Of Health And Human Services |
Antikörper und verfahren zur diagnose und behandlung von epstein-barr-virus-infektionen
|
|
US20200055948A1
(en)
|
2017-04-28 |
2020-02-20 |
Novartis Ag |
Cells expressing a bcma-targeting chimeric antigen receptor, and combination therapy with a gamma secretase inhibitor
|
|
US20200179511A1
(en)
|
2017-04-28 |
2020-06-11 |
Novartis Ag |
Bcma-targeting agent, and combination therapy with a gamma secretase inhibitor
|
|
MX2019013137A
(es)
|
2017-05-05 |
2020-07-14 |
Allakos Inc |
Metodos y composiciones para tratar enfermedades oculares alergicas.
|
|
US11168129B2
(en)
|
2017-05-15 |
2021-11-09 |
University Of Rochester |
Broadly neutralizing anti-influenza human monoclonal antibody and uses thereof
|
|
WO2018213316A1
(en)
|
2017-05-16 |
2018-11-22 |
Alector Llc |
Anti-siglec-5 antibodies and methods of use thereof
|
|
EP3630830A1
(de)
|
2017-05-23 |
2020-04-08 |
Helmholtz Zentrum München - Deutsches Forschungszentrum für Gesundheit und Umwelt (GmbH) |
Neuer cd73-antikörper, herstellung und verwendungen davon
|
|
EP3409322A1
(de)
|
2017-06-01 |
2018-12-05 |
F. Hoffmann-La Roche AG |
Behandlungsverfahren
|
|
EP3641812A1
(de)
|
2017-06-22 |
2020-04-29 |
Novartis AG |
Antikörpermoleküle gegen cd73 und verwendungen davon
|
|
WO2019000223A1
(en)
|
2017-06-27 |
2019-01-03 |
Nanjing Legend Biotech Co., Ltd. |
ENABLERS OF IMMUNE EFFECTOR CELLS OF CHIMERIC ANTIBODIES AND METHODS OF USE THEREOF
|
|
CN111050791A
(zh)
|
2017-06-27 |
2020-04-21 |
诺华股份有限公司 |
用于抗tim-3抗体的给药方案及其用途
|
|
CA3064966A1
(en)
|
2017-06-30 |
2019-01-03 |
Zymeworks Inc. |
Stabilized chimeric fabs
|
|
JP7402521B2
(ja)
|
2017-07-11 |
2023-12-21 |
コンパス セラピューティクス リミテッド ライアビリティ カンパニー |
ヒトcd137に結合するアゴニスト性抗体およびその使用
|
|
CN111094334A
(zh)
|
2017-07-19 |
2020-05-01 |
美国卫生与公众服务部 |
用于诊断和治疗乙肝病毒感染的抗体和方法
|
|
CA3070095A1
(en)
|
2017-07-20 |
2019-01-24 |
Novartis Ag |
Dosage regimens of anti-lag-3 antibodies and uses thereof
|
|
TWI823859B
(zh)
|
2017-07-21 |
2023-12-01 |
美商建南德克公司 |
癌症之治療及診斷方法
|
|
AU2018308364C1
(en)
|
2017-07-26 |
2023-02-16 |
Forty Seven, Inc. |
Anti-SIRP-alpha antibodies and related methods
|
|
WO2019020745A1
(en)
|
2017-07-28 |
2019-01-31 |
F. Hoffmann-La Roche Ag |
BISPECIFIC ANTIBODY FORMULATION
|
|
JP2020533948A
(ja)
|
2017-08-03 |
2020-11-26 |
アレクトル エルエルシー |
抗trem2抗体及びその使用方法
|
|
KR20200033798A
(ko)
|
2017-08-03 |
2020-03-30 |
알렉터 엘엘씨 |
항-cd33 항체 및 이의 이용 방법
|
|
CA3070297A1
(en)
|
2017-08-11 |
2019-02-14 |
Genentech, Inc. |
Anti-cd8 antibodies and uses thereof
|
|
WO2019055579A1
(en)
|
2017-09-12 |
2019-03-21 |
Tolero Pharmaceuticals, Inc. |
TREATMENT REGIME FOR CANCERS THAT ARE INSENSITIVE TO BCL-2 INHIBITORS USING THE MCL-1 ALVOCIDIB INHIBITOR
|
|
WO2019059411A1
(en)
|
2017-09-20 |
2019-03-28 |
Chugai Seiyaku Kabushiki Kaisha |
DOSAGE FOR POLYTHERAPY USING PD-1 AXIS BINDING ANTAGONISTS AND GPC3 TARGETING AGENT
|
|
EP3690050A4
(de)
|
2017-09-29 |
2021-06-16 |
Chugai Seiyaku Kabushiki Kaisha |
Multispezifisches antigenbindendes molekül mit blutgerinnungsfaktor viii (fviii)-cofaktorfunktionssubstituierender aktivität und pharmazeutische formulierung mit diesem molekül als wirkstoff
|
|
RU2698048C2
(ru)
|
2017-10-03 |
2019-08-21 |
Закрытое Акционерное Общество "Биокад" |
МОНОКЛОНАЛЬНОЕ АНТИТЕЛО К IL-5Rα
|
|
EA039662B1
(ru)
|
2017-10-03 |
2022-02-24 |
Закрытое Акционерное Общество "Биокад" |
Антитела, специфичные к cd47 и pd-l1
|
|
US20200237766A1
(en)
|
2017-10-13 |
2020-07-30 |
Tolero Pharmaceuticals, Inc. |
Pkm2 activators in combination with reactive oxygen species for treatment of cancer
|
|
TW201932142A
(zh)
|
2017-10-20 |
2019-08-16 |
瑞士商赫孚孟拉羅股份公司 |
自單特異性抗體產生多特異性抗體之方法
|
|
MX2020004100A
(es)
|
2017-10-30 |
2020-07-24 |
Hoffmann La Roche |
Metodo para generacion in vivo de anticuerpos multiespecificos a partir de anticuerpos monoespecificos.
|
|
WO2019089753A2
(en)
|
2017-10-31 |
2019-05-09 |
Compass Therapeutics Llc |
Cd137 antibodies and pd-1 antagonists and uses thereof
|
|
WO2019086499A1
(en)
|
2017-11-01 |
2019-05-09 |
F. Hoffmann-La Roche Ag |
Novel tnf family ligand trimer-containing antigen binding molecules
|
|
JP2021500930A
(ja)
|
2017-11-01 |
2021-01-14 |
エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft |
Compボディ−多価標的結合物質
|
|
EP3704155A2
(de)
|
2017-11-01 |
2020-09-09 |
F. Hoffmann-La Roche AG |
Kombinationstherapie mit gezielten ox40-agonisten
|
|
KR20200079492A
(ko)
|
2017-11-01 |
2020-07-03 |
에프. 호프만-라 로슈 아게 |
이중특이성 2+1 컨터체
|
|
AU2018358904A1
(en)
|
2017-11-01 |
2020-04-16 |
F. Hoffmann-La Roche Ag |
TriFab-contorsbody
|
|
AU2018359967A1
(en)
|
2017-11-06 |
2020-04-23 |
Genentech, Inc. |
Diagnostic and therapeutic methods for cancer
|
|
CN111655288A
(zh)
|
2017-11-16 |
2020-09-11 |
诺华股份有限公司 |
组合疗法
|
|
EP3713961A2
(de)
|
2017-11-20 |
2020-09-30 |
Compass Therapeutics LLC |
Cd137-antikörper und tumorantigenbindende antikörper sowie deren verwendung
|
|
CN111212660A
(zh)
|
2017-12-14 |
2020-05-29 |
豪夫迈·罗氏有限公司 |
Cea cd3双特异性抗体和pd-1轴结合拮抗剂在治疗癌症的剂量方案中的用途
|
|
EP3502140A1
(de)
|
2017-12-21 |
2019-06-26 |
F. Hoffmann-La Roche AG |
Kombinationstherapie von tumorabgezielten icos-agonisten mit t-zellenbispezifischen molekülen
|
|
WO2019122046A1
(en)
|
2017-12-21 |
2019-06-27 |
F. Hoffmann-La Roche Ag |
Universal reporter cell assay for specificity test of novel antigen binding moieties
|
|
CN111492243A
(zh)
|
2017-12-21 |
2020-08-04 |
豪夫迈·罗氏有限公司 |
用于新颖抗原结合模块的特异性测试的car-t细胞测定法
|
|
CN111527107A
(zh)
|
2017-12-21 |
2020-08-11 |
豪夫迈·罗氏有限公司 |
结合hla-a2/wt1的抗体
|
|
WO2019126472A1
(en)
|
2017-12-22 |
2019-06-27 |
Genentech, Inc. |
Use of pilra binding agents for treatment of a disease
|
|
US11905327B2
(en)
|
2017-12-28 |
2024-02-20 |
Nanjing Legend Biotech Co., Ltd. |
Single-domain antibodies and variants thereof against TIGIT
|
|
KR20200104886A
(ko)
|
2017-12-28 |
2020-09-04 |
난징 레전드 바이오테크 씨오., 엘티디. |
Pd-l1에 대한 항체 및 변이체
|
|
US11440957B2
(en)
|
2017-12-29 |
2022-09-13 |
Alector Llc |
Anti-TMEM106B antibodies and methods of use thereof
|
|
EP3731864A1
(de)
|
2017-12-29 |
2020-11-04 |
F. Hoffmann-La Roche SA |
Anti-vegf-antikörper und verfahren zur verwendung
|
|
SG11202004233UA
(en)
|
2018-01-15 |
2020-06-29 |
Nanjing Legend Biotech Co Ltd |
Single-domain antibodies and variants thereof against pd-1
|
|
US20200339686A1
(en)
|
2018-01-16 |
2020-10-29 |
Lakepharma, Inc. |
Bispecific antibody that binds cd3 and another target
|
|
WO2019152715A1
(en)
|
2018-01-31 |
2019-08-08 |
Alector Llc |
Anti-ms4a4a antibodies and methods of use thereof
|
|
EP3746480A1
(de)
|
2018-01-31 |
2020-12-09 |
F. Hoffmann-La Roche AG |
Bispezifische antikörper mit einer antigenbindestelle, die an lag3 bindet
|
|
CN111630063A
(zh)
|
2018-01-31 |
2020-09-04 |
豪夫迈·罗氏有限公司 |
稳定化的免疫球蛋白结构域
|
|
WO2019152660A1
(en)
|
2018-01-31 |
2019-08-08 |
Novartis Ag |
Combination therapy using a chimeric antigen receptor
|
|
MA51793A
(fr)
|
2018-02-08 |
2020-12-16 |
Hoffmann La Roche |
Molécules bispécifiques de liaison à l'antigène et procédés d'utilisation
|
|
JP7418337B2
(ja)
|
2018-02-09 |
2024-01-19 |
ジェネンテック, インコーポレイテッド |
マスト細胞媒介性炎症性疾患の治療法及び診断法
|
|
TWI829667B
(zh)
|
2018-02-09 |
2024-01-21 |
瑞士商赫孚孟拉羅股份公司 |
結合gprc5d之抗體
|
|
TW202000702A
(zh)
|
2018-02-26 |
2020-01-01 |
美商建南德克公司 |
用於抗tigit拮抗劑抗體及抗pd-l1拮抗劑抗體治療之投藥
|
|
EP3759491A1
(de)
|
2018-03-01 |
2021-01-06 |
H. Hoffnabb-La Roche Ag |
Spezifizitätstests für neuartige zielantigenbindende gruppen
|
|
EP3765489A1
(de)
|
2018-03-13 |
2021-01-20 |
F. Hoffmann-La Roche AG |
Therapeutische kombination von 4-1 bb-agonisten mit anti-cd20-antikörpern
|
|
TW202003561A
(zh)
|
2018-03-13 |
2020-01-16 |
瑞士商赫孚孟拉羅股份公司 |
使用靶向4-1bb (cd137)之促效劑的組合療法
|
|
RU2020128013A
(ru)
|
2018-03-14 |
2022-04-15 |
Бейцзин Сюаньи Фармасайенсиз Ко., Лтд. |
Антитела против клаудина 18.2
|
|
US20200040103A1
(en)
|
2018-03-14 |
2020-02-06 |
Genentech, Inc. |
Anti-klk5 antibodies and methods of use
|
|
CN112119090B
(zh)
|
2018-03-15 |
2023-01-13 |
中外制药株式会社 |
对寨卡病毒具有交叉反应性的抗登革热病毒抗体及使用方法
|
|
WO2019183266A1
(en)
|
2018-03-21 |
2019-09-26 |
ALX Oncology Inc. |
Antibodies against signal-regulatory protein alpha and methods of use
|
|
CN111936625A
(zh)
|
2018-03-29 |
2020-11-13 |
豪夫迈·罗氏有限公司 |
调节哺乳动物细胞中的生乳活性
|
|
JP7104458B2
(ja)
|
2018-04-02 |
2022-07-21 |
上海博威生物医薬有限公司 |
リンパ球活性化遺伝子-3(lag-3)結合抗体およびその使用
|
|
JP2021520209A
(ja)
|
2018-04-04 |
2021-08-19 |
エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト |
癌患者における腫瘍抗原を検出するための診断アッセイ
|
|
TW202011029A
(zh)
|
2018-04-04 |
2020-03-16 |
美商建南德克公司 |
偵測及定量fgf21之方法
|
|
JP7394067B2
(ja)
|
2018-04-04 |
2023-12-07 |
エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト |
がん患者における腫瘍抗原を検出するための診断アッセイ
|
|
EP3774883A1
(de)
|
2018-04-05 |
2021-02-17 |
Gilead Sciences, Inc. |
Antikörper und fragmente davon, die hepatitis-b-virus-protein x binden
|
|
TW202012440A
(zh)
|
2018-04-13 |
2020-04-01 |
瑞士商赫孚孟拉羅股份公司 |
包含4-1bbl之靶向her2的抗原結合分子
|
|
US20210147547A1
(en)
|
2018-04-13 |
2021-05-20 |
Novartis Ag |
Dosage Regimens For Anti-Pd-L1 Antibodies And Uses Thereof
|
|
AR115052A1
(es)
|
2018-04-18 |
2020-11-25 |
Hoffmann La Roche |
Anticuerpos multiespecíficos y utilización de los mismos
|
|
AR114789A1
(es)
|
2018-04-18 |
2020-10-14 |
Hoffmann La Roche |
Anticuerpos anti-hla-g y uso de los mismos
|
|
US20210047405A1
(en)
|
2018-04-27 |
2021-02-18 |
Novartis Ag |
Car t cell therapies with enhanced efficacy
|
|
US20210171610A1
(en)
|
2018-05-02 |
2021-06-10 |
The U.S.A., As Represented By The Secretary, Department Of Health And Human Services |
Antibodies and methods for the diagnosis, prevention, and treatment of epstein barr virus infection
|
|
US11958895B2
(en)
|
2018-05-03 |
2024-04-16 |
University Of Rochester |
Anti-influenza neuraminidase monoclonal antibodies and uses thereof
|
|
AU2019271149B2
(en)
|
2018-05-14 |
2023-07-13 |
Werewolf Therapeutics, Inc. |
Activatable interleukin 12 polypeptides and methods of use thereof
|
|
ES2955511T3
(es)
|
2018-05-14 |
2023-12-04 |
Werewolf Therapeutics Inc |
Polipéptidos de interleucina 2 activables y métodos de uso de los mismos
|
|
WO2019219721A1
(en)
|
2018-05-18 |
2019-11-21 |
F. Hoffmann-La Roche Ag |
Targeted intracellular delivery of large nucleic acids
|
|
WO2019226617A1
(en)
|
2018-05-21 |
2019-11-28 |
Compass Therapeutics Llc |
Compositions and methods for enhancing the killing of target cells by nk cells
|
|
WO2019226658A1
(en)
|
2018-05-21 |
2019-11-28 |
Compass Therapeutics Llc |
Multispecific antigen-binding compositions and methods of use
|
|
EP3801769A1
(de)
|
2018-05-25 |
2021-04-14 |
Novartis AG |
Kombinationstherapie mit therapien mit chimärem antigen-rezeptor (car)
|
|
MX2020011828A
(es)
|
2018-05-25 |
2021-02-09 |
Alector Llc |
Anticuerpos anti proteina alfa reguladora de se?ales (sirpa) y metodos de uso de los mismos.
|
|
WO2019232244A2
(en)
|
2018-05-31 |
2019-12-05 |
Novartis Ag |
Antibody molecules to cd73 and uses thereof
|
|
WO2019235426A1
(ja)
|
2018-06-04 |
2019-12-12 |
中外製薬株式会社 |
細胞質内での半減期が変化した抗原結合分子
|
|
WO2019236965A1
(en)
|
2018-06-08 |
2019-12-12 |
Alector Llc |
Anti-siglec-7 antibodies and methods of use thereof
|
|
JP7438988B2
(ja)
|
2018-06-13 |
2024-02-27 |
ノバルティス アーゲー |
Bcmaキメラ抗原受容体及びその使用
|
|
MX2020013798A
(es)
|
2018-06-19 |
2021-08-11 |
Atarga Llc |
Moléculas de anticuerpo de componente de complemento 5 y sus usos.
|
|
US20200030443A1
(en)
|
2018-06-23 |
2020-01-30 |
Genentech, Inc. |
Methods of treating lung cancer with a pd-1 axis binding antagonist, a platinum agent, and a topoisomerase ii inhibitor
|
|
TW202035444A
(zh)
|
2018-06-27 |
2020-10-01 |
台灣浩鼎生技股份有限公司 |
用於糖蛋白工程的糖苷合成酶變體及其使用方法
|
|
JP2021529520A
(ja)
|
2018-06-29 |
2021-11-04 |
アレクトル エルエルシー |
抗sirp−ベータ1抗体及びその使用方法
|
|
JP2021528988A
(ja)
|
2018-07-04 |
2021-10-28 |
エフ・ホフマン−ラ・ロシュ・アクチェンゲゼルシャフト |
新規の二重特異性アゴニスト4−1bb抗原結合分子
|
|
WO2020014306A1
(en)
|
2018-07-10 |
2020-01-16 |
Immunogen, Inc. |
Met antibodies and immunoconjugates and uses thereof
|
|
AR116109A1
(es)
|
2018-07-10 |
2021-03-31 |
Novartis Ag |
Derivados de 3-(5-amino-1-oxoisoindolin-2-il)piperidina-2,6-diona y usos de los mismos
|
|
ES2940311T3
(es)
|
2018-07-13 |
2023-05-05 |
Alector Llc |
Anticuerpos anti-sortilina y métodos de uso de los mismos
|
|
KR20210034622A
(ko)
|
2018-07-18 |
2021-03-30 |
제넨테크, 인크. |
Pd-1 축 결합 길항제, 항 대사제, 및 백금 제제를 이용한 폐암 치료 방법
|
|
JP7072715B2
(ja)
|
2018-07-20 |
2022-05-20 |
サーフィス オンコロジー インコーポレイテッド |
抗cd112r組成物及び方法
|
|
WO2020021465A1
(en)
|
2018-07-25 |
2020-01-30 |
Advanced Accelerator Applications (Italy) S.R.L. |
Method of treatment of neuroendocrine tumors
|
|
WO2020023910A1
(en)
|
2018-07-26 |
2020-01-30 |
Tolero Pharmaceuticals, Inc. |
Methods for treating diseases associated with abnormal acvr1 expression and acvr1 inhibitors for use in the same
|
|
MX2021000933A
(es)
|
2018-07-27 |
2021-05-27 |
Alector Llc |
Anticuerpos anti-siglec-5 y métodos para su uso.
|
|
KR20210040989A
(ko)
|
2018-08-03 |
2021-04-14 |
추가이 세이야쿠 가부시키가이샤 |
서로 연결된 2개의 항원 결합 도메인을 포함하는 항원 결합 분자
|
|
JP2021533149A
(ja)
|
2018-08-08 |
2021-12-02 |
ジェネンテック, インコーポレイテッド |
タンパク質製剤のためのトリプトファン誘導体及びl−メチオニンの使用
|
|
EA202190451A1
(ru)
|
2018-08-10 |
2021-07-13 |
Чугаи Сейяку Кабусики Кайся |
Анти-cd137 антигенсвязывающие молекулы и их применение
|
|
TW202021618A
(zh)
|
2018-08-17 |
2020-06-16 |
美商23與我有限公司 |
抗il1rap抗體及其使用方法
|
|
US11548938B2
(en)
|
2018-08-21 |
2023-01-10 |
Quidel Corporation |
DbpA antibodies and uses thereof
|
|
JP2021534196A
(ja)
|
2018-08-23 |
2021-12-09 |
シージェン インコーポレイテッド |
抗tigit抗体
|
|
MX2021002299A
(es)
|
2018-08-31 |
2021-04-28 |
Alector Llc |
Anticuerpos de anti-cd33 y metodos para usarlos.
|
|
GB201814281D0
(en)
|
2018-09-03 |
2018-10-17 |
Femtogenix Ltd |
Cytotoxic agents
|
|
AR114732A1
(es)
|
2018-09-18 |
2020-10-07 |
Hoffmann La Roche |
Utilización de un inhibidor de catepsina s contra la formación de anticuerpos antifármaco
|
|
JP2022501332A
(ja)
|
2018-09-19 |
2022-01-06 |
ジェネンテック, インコーポレイテッド |
膀胱がんの治療方法および診断方法
|
|
ES2955032T3
(es)
|
2018-09-21 |
2023-11-28 |
Hoffmann La Roche |
Métodos de diagnóstico para el cáncer de mama triple negativo
|
|
WO2020069398A1
(en)
|
2018-09-27 |
2020-04-02 |
Akrevia Therapeutics Inc. |
Masked cytokine polypeptides
|
|
CN112839957A
(zh)
|
2018-09-28 |
2021-05-25 |
协和麒麟株式会社 |
Il-36抗体及其用途
|
|
CN112654641A
(zh)
|
2018-10-01 |
2021-04-13 |
豪夫迈·罗氏有限公司 |
具有与cd40的三价结合的双特异性抗原结合分子
|
|
WO2020070041A1
(en)
|
2018-10-01 |
2020-04-09 |
F. Hoffmann-La Roche Ag |
Bispecific antigen binding molecules comprising anti-fap clone 212
|
|
TW202028244A
(zh)
|
2018-10-09 |
2020-08-01 |
美商建南德克公司 |
用於確定突觸形成之方法及系統
|
|
WO2020081767A1
(en)
|
2018-10-18 |
2020-04-23 |
Genentech, Inc. |
Diagnostic and therapeutic methods for sarcomatoid kidney cancer
|
|
CN113056287A
(zh)
|
2018-10-24 |
2021-06-29 |
豪夫迈·罗氏有限公司 |
缀合的化学降解诱导剂及使用方法
|
|
RU2724469C2
(ru)
|
2018-10-31 |
2020-06-23 |
Закрытое Акционерное Общество "Биокад" |
Моноклональное антитело, которое специфически связывается с cd20
|
|
JP2022506156A
(ja)
|
2018-11-05 |
2022-01-17 |
ジェネンテック, インコーポレイテッド |
原核宿主細胞における2鎖タンパク質の産生方法
|
|
MX2021005594A
(es)
|
2018-11-13 |
2021-10-22 |
Compass Therapeutics Llc |
Constructos multiespecificos de union contra moleculas de puntos de control y usos de los mismos.
|
|
EP3884276A2
(de)
|
2018-11-23 |
2021-09-29 |
Katholieke Universiteit Leuven |
Vorhersage einer behandlungsreaktion bei entzündlichen darmerkrankungen
|
|
US11034710B2
(en)
|
2018-12-04 |
2021-06-15 |
Sumitomo Dainippon Pharma Oncology, Inc. |
CDK9 inhibitors and polymorphs thereof for use as agents for treatment of cancer
|
|
WO2020117257A1
(en)
|
2018-12-06 |
2020-06-11 |
Genentech, Inc. |
Combination therapy of diffuse large b-cell lymphoma comprising an anti-cd79b immunoconjugates, an alkylating agent and an anti-cd20 antibody
|
|
EP3894427A1
(de)
|
2018-12-10 |
2021-10-20 |
Genentech, Inc. |
Photovernetzende peptide zur stellenspezifischen konjugation an fc-haltige proteine
|
|
AU2019402163A1
(en)
|
2018-12-20 |
2021-07-08 |
Kyowa Kirin Co., Ltd. |
Fn14 antibodies and uses thereof
|
|
MX2021007392A
(es)
|
2018-12-20 |
2021-08-24 |
Novartis Ag |
Regimen de dosificacion y combinacion farmaceutica que comprende derivados de 3-(1-oxoisoindolin-2-il)piperidina-2,6-diona.
|
|
WO2020128894A1
(en)
|
2018-12-20 |
2020-06-25 |
Novartis Ag |
Combinations of a hdm2-p53 interaction inhibitor and a bcl2 inhibitor and their use for treating cancer
|
|
AR117327A1
(es)
|
2018-12-20 |
2021-07-28 |
23Andme Inc |
Anticuerpos anti-cd96 y métodos de uso de estos
|
|
CA3123493A1
(en)
|
2018-12-21 |
2020-06-25 |
F. Hoffmann-La Roche Ag |
Tumor-targeted agonistic cd28 antigen binding molecules
|
|
KR20210107721A
(ko)
|
2018-12-21 |
2021-09-01 |
23앤드미 인코포레이티드 |
항-il-36 항체 및 이의 사용 방법
|
|
SG11202106116QA
(en)
|
2018-12-21 |
2021-07-29 |
Genentech Inc |
Methods of producing polypeptides using a cell line resistant to apoptosis
|
|
WO2020127628A1
(en)
|
2018-12-21 |
2020-06-25 |
F. Hoffmann-La Roche Ag |
Tumor-targeted superagonistic cd28 antigen binding molecules
|
|
PE20211603A1
(es)
|
2018-12-21 |
2021-08-18 |
Hoffmann La Roche |
Anticuerpos que se unen a cd3
|
|
KR20210141447A
(ko)
|
2018-12-26 |
2021-11-23 |
실리오 디벨럽먼트, 인크. |
항-ctla4 항체 및 이의 사용 방법
|
|
WO2020141145A1
(en)
|
2018-12-30 |
2020-07-09 |
F. Hoffmann-La Roche Ag |
Anti-rabbit cd19 antibodies and methods of use
|
|
MX2021008434A
(es)
|
2019-01-14 |
2021-09-23 |
Genentech Inc |
Metodos para tratar el cancer con un antagonista de union al eje de pd-1 y una vacuna de arn.
|
|
EP3915581A4
(de)
|
2019-01-24 |
2023-03-22 |
Chugai Seiyaku Kabushiki Kaisha |
Neuartige krebsantigene und antikörper dieser antigene
|
|
GB201901197D0
(en)
|
2019-01-29 |
2019-03-20 |
Femtogenix Ltd |
G-A Crosslinking cytotoxic agents
|
|
CA3127502A1
(en)
|
2019-02-12 |
2020-08-20 |
Sumitomo Dainippon Pharma Oncology, Inc. |
Formulations comprising heterocyclic protein kinase inhibitors
|
|
MX2021009763A
(es)
|
2019-02-15 |
2021-09-08 |
Novartis Ag |
Derivados de 3-(1-oxo-5-(piperidin-4-il)isoindolin-2-il)piperidina -2,6-diona y usos de los mismos.
|
|
EP3924055B1
(de)
|
2019-02-15 |
2024-04-03 |
Novartis AG |
Substituierte 3-(1-oxoisoindolin-2-yl)piperidin-2,6-dion-derivate und verwendungen davon
|
|
US10871640B2
(en)
|
2019-02-15 |
2020-12-22 |
Perkinelmer Cellular Technologies Germany Gmbh |
Methods and systems for automated imaging of three-dimensional objects
|
|
WO2020169698A1
(en)
|
2019-02-21 |
2020-08-27 |
F. Hoffmann-La Roche Ag |
Sensitization of cancer cells to tnf by bet inhibition
|
|
WO2020172553A1
(en)
|
2019-02-22 |
2020-08-27 |
Novartis Ag |
Combination therapies of egfrviii chimeric antigen receptors and pd-1 inhibitors
|
|
MX2021010313A
(es)
|
2019-02-27 |
2021-09-23 |
Genentech Inc |
Dosificacion para el tratamiento con anticuerpos anti-tigit y anti-cd20 o anti-cd38.
|
|
AU2020238811A1
(en)
|
2019-03-08 |
2021-07-22 |
Genentech, Inc. |
Methods for detecting and quantifying membrane-associated proteins on extracellular vesicles
|
|
US20220184223A1
(en)
|
2019-03-13 |
2022-06-16 |
Merck Patent Gmbh |
Process for the preparation of lipidated proteinaceous structures
|
|
CA3130446A1
(en)
|
2019-03-14 |
2020-09-17 |
Genentech, Inc. |
Treatment of cancer with her2xcd3 bispecific antibodies in combination with anti-her2 mab
|
|
JP2022525149A
(ja)
|
2019-03-20 |
2022-05-11 |
スミトモ ダイニッポン ファーマ オンコロジー, インコーポレイテッド |
ベネトクラクスが失敗した急性骨髄性白血病(aml)の処置
|
|
US11712433B2
(en)
|
2019-03-22 |
2023-08-01 |
Sumitomo Pharma Oncology, Inc. |
Compositions comprising PKM2 modulators and methods of treatment using the same
|
|
CA3135430A1
(en)
|
2019-03-29 |
2020-10-08 |
Atarga, Llc |
Anti fgf23 antibody
|
|
WO2020208049A1
(en)
|
2019-04-12 |
2020-10-15 |
F. Hoffmann-La Roche Ag |
Bispecific antigen binding molecules comprising lipocalin muteins
|
|
EP3953386A1
(de)
|
2019-04-12 |
2022-02-16 |
F. Hoffmann-La Roche AG |
Behandlung von krebs mit einem cea-cd3-bispezifischen antikörper und einem wnt-signalinhibitor
|
|
AU2020258480A1
(en)
|
2019-04-19 |
2021-10-21 |
Genentech, Inc. |
Anti-mertk antibodies and their methods of use
|
|
KR20220004087A
(ko)
|
2019-04-19 |
2022-01-11 |
추가이 세이야쿠 가부시키가이샤 |
항체 개변 부위 인식 키메라 수용체
|
|
RU2734432C1
(ru)
|
2019-04-23 |
2020-10-16 |
Закрытое Акционерное Общество "Биокад" |
Моноклональное антитело, которое специфически связывается с GITR
|
|
WO2020226986A2
(en)
|
2019-05-03 |
2020-11-12 |
Genentech, Inc. |
Methods of treating cancer with an anti-pd-l1 antibody
|
|
KR20220006519A
(ko)
|
2019-05-10 |
2022-01-17 |
다케다 야쿠힌 고교 가부시키가이샤 |
항체 약물 접합체
|
|
JP2022532217A
(ja)
|
2019-05-14 |
2022-07-13 |
ウェアウルフ セラピューティクス, インコーポレイテッド |
分離部分及びその使用方法
|
|
AU2020275415A1
(en)
|
2019-05-14 |
2021-11-25 |
Genentech, Inc. |
Methods of using anti-CD79B immunoconjugates to treat follicular lymphoma
|
|
WO2020232295A1
(en)
|
2019-05-16 |
2020-11-19 |
Procisedx Inc. |
An assay method for the detection of vcam-1 and alpha-2-macroglobulin in blood
|
|
JP2022532381A
(ja)
|
2019-05-16 |
2022-07-14 |
プロサイセデクス インコーポレイティド |
Vcam-1及びカルプロテクチンのための分析検出方法
|
|
JP2022534227A
(ja)
|
2019-05-23 |
2022-07-28 |
プロサイセデクス インコーポレイティド |
ヒト血清アルブミン、ビタミンd、c反応性タンパク質、及び抗トランスグルタミナーゼ自己抗体の検出のためのアッセイ方法
|
|
AR119264A1
(es)
|
2019-06-05 |
2021-12-09 |
Genentech Inc |
Método para reutilización de cromatografía
|
|
JP2022535125A
(ja)
|
2019-06-06 |
2022-08-04 |
プロサイセデクス インコーポレイティド |
血中ヘモグロビンA1C(HbA1c)の検出
|
|
CA3140023A1
(en)
|
2019-06-11 |
2020-12-17 |
Alector Llc |
Anti-sortilin antibodies for use in therapy
|
|
JP2022540764A
(ja)
|
2019-06-25 |
2022-09-20 |
プロサイセデクス インコーポレイティド |
抗TNFα生物製剤および抗薬剤抗体の検出
|
|
CA3141378A1
(en)
|
2019-06-26 |
2020-12-30 |
F. Hoffmann-La Roche Ag |
Fusion of an antibody binding cea and 4-1bbl
|
|
CN114531878A
(zh)
|
2019-06-27 |
2022-05-24 |
豪夫迈·罗氏有限公司 |
新颖icos抗体及包含它们的肿瘤靶向抗原结合分子
|
|
KR20220027940A
(ko)
|
2019-06-28 |
2022-03-08 |
제넨테크, 인크. |
액체 단백질 제제의 안정화를 위한 조성물 및 방법
|
|
TW202115115A
(zh)
|
2019-07-02 |
2021-04-16 |
瑞士商赫孚孟拉羅股份公司 |
免疫結合物
|
|
AR119382A1
(es)
|
2019-07-12 |
2021-12-15 |
Hoffmann La Roche |
Anticuerpos de pre-direccionamiento y métodos de uso
|
|
CN114341187A
(zh)
|
2019-07-12 |
2022-04-12 |
中外制药株式会社 |
抗突变型fgfr3抗体及其用途
|
|
AR119393A1
(es)
|
2019-07-15 |
2021-12-15 |
Hoffmann La Roche |
Anticuerpos que se unen a nkg2d
|
|
JP2022540806A
(ja)
|
2019-07-19 |
2022-09-20 |
オンコレスポンス,インク. |
免疫調節抗体およびその使用方法
|
|
CA3145885A1
(en)
|
2019-07-31 |
2021-02-04 |
Jeonghoon Sun |
Anti-ms4a4a antibodies and methods of use thereof
|
|
JP2022543551A
(ja)
|
2019-07-31 |
2022-10-13 |
エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト |
Gprc5dに結合する抗体
|
|
CR20220019A
(es)
|
2019-07-31 |
2022-02-11 |
Hoffmann La Roche |
Anticuerpos que se fijan a gprc5d
|
|
CN114340675A
(zh)
|
2019-09-12 |
2022-04-12 |
豪夫迈·罗氏有限公司 |
治疗狼疮性肾炎的组合物和方法
|
|
PE20221906A1
(es)
|
2019-09-18 |
2022-12-23 |
Genentech Inc |
Anticuerpos anti-klk7, anticuerpos anti-klk5, anticuerpos multiespecificos anti-klk5/klk7 y metodos de uso
|
|
CR20220149A
(es)
|
2019-09-20 |
2022-05-23 |
Genentech Inc |
Dosis para anticuerpos anti-triptasa
|
|
JP2022548978A
(ja)
|
2019-09-27 |
2022-11-22 |
ジェネンテック, インコーポレイテッド |
薬抗tigit及び抗pd-l1アンタゴニスト抗体を用いた処置のための投薬
|
|
US20220281997A1
(en)
|
2019-09-27 |
2022-09-08 |
Nanjing GenScript Biotech Co., Ltd. |
Anti-VHH Domain Antibodies and Use Thereof
|
|
JP7413519B2
(ja)
|
2019-10-18 |
2024-01-15 |
ジェネンテック, インコーポレイテッド |
びまん性大細胞型b細胞リンパ腫を処置するための抗cd79b免疫抱合体の使用方法
|
|
JP2022553306A
(ja)
|
2019-10-21 |
2022-12-22 |
ノバルティス アーゲー |
Tim-3阻害剤およびその使用
|
|
EP4048281A1
(de)
|
2019-10-21 |
2022-08-31 |
Novartis AG |
Kombinationstherapien mit venetoclax und tim-3-inhibitoren
|
|
WO2021089513A1
(en)
|
2019-11-05 |
2021-05-14 |
F. Hoffmann-La Roche Ag |
Treatment of cancer using a hla-a2/wt1 x cd3 bispecific antibody and lenalidomide
|
|
IL292458A
(en)
|
2019-11-06 |
2022-06-01 |
Genentech Inc |
Diagnostic and treatment methods for the treatment of hematological cancer
|
|
KR20220105664A
(ko)
|
2019-11-26 |
2022-07-27 |
노파르티스 아게 |
Bcma 및 cd19에 결합하는 키메라 항원 수용체 및 이의 용도
|
|
MX2022006073A
(es)
|
2019-12-05 |
2022-08-04 |
Alector Llc |
Metodos para utilizar anticuerpos anti-trem2.
|
|
BR112022011337A2
(pt)
|
2019-12-12 |
2022-08-23 |
Alector Llc |
Método para tratar e/ou retardar a progressão de uma doença ou lesão em um indivíduo
|
|
AU2020403145A1
(en)
|
2019-12-13 |
2022-07-07 |
Genentech, Inc. |
Anti-Ly6G6D antibodies and methods of use
|
|
TW202136303A
(zh)
|
2019-12-13 |
2021-10-01 |
美商阿列克特有限責任公司 |
抗mertk抗體及其使用方法
|
|
US20210230278A1
(en)
|
2019-12-18 |
2021-07-29 |
Hoffmann-La Roche Inc. |
Antibodies binding to HLA-A2/MAGE-A4
|
|
AU2020406350A1
(en)
|
2019-12-20 |
2022-08-11 |
Novartis Ag |
Uses of anti-TGF-beta antibodies and checkpoint inhibitors for the treatment of proliferative diseases
|
|
AU2020412609A1
(en)
|
2019-12-23 |
2022-06-16 |
Genentech, Inc. |
Apolipoprotein L1-specific antibodies and methods of use
|
|
AU2019479791A1
(en)
|
2019-12-27 |
2022-07-14 |
Chugai Seiyaku Kabushiki Kaisha |
Anti-CTLA-4 antibody and use thereof
|
|
KR20220107251A
(ko)
|
2020-01-09 |
2022-08-02 |
에프. 호프만-라 로슈 아게 |
새로운 4-1bbl 삼량체-함유 항원 결합 분자
|
|
CN110818795B
(zh)
|
2020-01-10 |
2020-04-24 |
上海复宏汉霖生物技术股份有限公司 |
抗tigit抗体和使用方法
|
|
US20230058489A1
(en)
|
2020-01-17 |
2023-02-23 |
Novartis Ag |
Combination comprising a tim-3 inhibitor and a hypomethylating agent for use in treating myelodysplastic syndrome or chronic myelomonocytic leukemia
|
|
EP4090762A1
(de)
|
2020-01-17 |
2022-11-23 |
Becton, Dickinson and Company |
Methoden und zusammensetzungen für einzelzellsekretomik
|
|
WO2022050954A1
(en)
|
2020-09-04 |
2022-03-10 |
Genentech, Inc. |
Dosing for treatment with anti-tigit and anti-pd-l1 antagonist antibodies
|
|
WO2021194481A1
(en)
|
2020-03-24 |
2021-09-30 |
Genentech, Inc. |
Dosing for treatment with anti-tigit and anti-pd-l1 antagonist antibodies
|
|
WO2021155295A1
(en)
|
2020-01-31 |
2021-08-05 |
The Cleveland Clinic Foundation |
Anti-müllerian hormone receptor 2 antibodies and methods of use
|
|
WO2021155006A1
(en)
|
2020-01-31 |
2021-08-05 |
Les Laboratoires Servier Sas |
Inhibitors of cyclin-dependent kinases and uses thereof
|
|
EP4096708A1
(de)
|
2020-01-31 |
2022-12-07 |
Genentech, Inc. |
Verfahren zur induktion neoepitopspezifischer t-zellen mit einem pd-1-achsenbindenden antagonisten und einem rna-impfstoff
|
|
AU2021220887A1
(en)
|
2020-02-10 |
2022-09-29 |
Shanghai Escugen Biotechnology Co., Ltd. |
CLDN18.2 antibody and use thereof
|
|
CA3167349A1
(en)
|
2020-02-10 |
2021-08-19 |
Qing Zhou |
Claudin 18.2 antibody and use thereof
|
|
TW202144395A
(zh)
|
2020-02-12 |
2021-12-01 |
日商中外製藥股份有限公司 |
用於癌症之治療的抗cd137抗原結合分子
|
|
CA3167851A1
(en)
|
2020-02-24 |
2021-09-02 |
Francesca CIGNARELLA |
Methods of use of anti-trem2 antibodies
|
|
IL295878A
(en)
|
2020-02-27 |
2022-10-01 |
Novartis Ag |
Methods for producing cells expressing a chimeric antigen receptor
|
|
IL296256A
(en)
|
2020-03-13 |
2022-11-01 |
Genentech Inc |
Antibodies against interleukin-33 and uses thereof
|
|
CN117510630A
(zh)
|
2020-03-19 |
2024-02-06 |
基因泰克公司 |
同种型选择性抗TGF-β抗体及使用方法
|
|
US11365239B2
(en)
|
2020-03-20 |
2022-06-21 |
Tsb Therapeutics (Beijing) Co., Ltd. |
Anti-SARS-COV-2 antibodies and uses thereof
|
|
WO2021194913A1
(en)
|
2020-03-24 |
2021-09-30 |
Genentech, Inc. |
Tie2-binding agents and methods of use
|
|
EP4127153A2
(de)
|
2020-03-26 |
2023-02-08 |
Genentech, Inc. |
Modifizierte säugetierzellen mit reduzierten wirtszellproteinen
|
|
CA3173519A1
(en)
|
2020-03-31 |
2021-10-07 |
Vishnu Priyanka Reddy CHICHILI |
Method for producing multispecific antigen-binding molecules
|
|
EP4126937A1
(de)
|
2020-03-31 |
2023-02-08 |
Alector LLC |
Anti-mertk-antikörper und verfahren zur verwendung davon
|
|
AR121706A1
(es)
|
2020-04-01 |
2022-06-29 |
Hoffmann La Roche |
Moléculas de unión a antígeno biespecíficas dirigidas a ox40 y fap
|
|
CA3170570A1
(en)
|
2020-04-01 |
2021-10-07 |
James J. KOBIE |
Monoclonal antibodies against the hemagglutinin (ha) and neuraminidase (na) of influenza h3n2 viruses
|
|
MX2022012182A
(es)
|
2020-04-03 |
2022-12-08 |
Alector Llc |
Metodos de uso de anticuerpos anti-trem2.
|
|
WO2021202959A1
(en)
|
2020-04-03 |
2021-10-07 |
Genentech, Inc. |
Therapeutic and diagnostic methods for cancer
|
|
EP4133075A1
(de)
|
2020-04-09 |
2023-02-15 |
Technische Universität München |
Gezielte abgabe eines inhibitors von mir-21 an makrophagen zur behandlung von lungenfibrose
|
|
CA3180222A1
(en)
|
2020-04-15 |
2021-10-21 |
Voyager Therapeutics, Inc. |
Tau binding compounds
|
|
US20230192795A1
(en)
|
2020-04-15 |
2023-06-22 |
Hoffmann-La Roche Inc. |
Immunoconjugates
|
|
WO2021214277A1
(en)
|
2020-04-24 |
2021-10-28 |
F. Hoffmann-La Roche Ag |
Enzyme and pathway modulation with sulfhydryl compounds and their derivatives
|
|
IL297541A
(en)
|
2020-04-24 |
2022-12-01 |
Genentech Inc |
Methods for using anti-cd79b immunoconjugates
|
|
WO2021222181A2
(en)
|
2020-04-27 |
2021-11-04 |
The Regents Of The University Of California |
Isoform-independent antibodies to lipoprotein(a)
|
|
WO2021222167A1
(en)
|
2020-04-28 |
2021-11-04 |
Genentech, Inc. |
Methods and compositions for non-small cell lung cancer immunotherapy
|
|
SG11202112792WA
(en)
|
2020-04-28 |
2021-12-30 |
Univ Rockefeller |
Neutralizing anti-sars-cov-2 antibodies and methods of use thereof
|
|
WO2021222533A1
(en)
|
2020-04-30 |
2021-11-04 |
Procisedx Inc. |
Methods of detecting antibodies to sars-cov-2
|
|
EP4146283A1
(de)
|
2020-05-03 |
2023-03-15 |
Levena (Suzhou) Biopharma Co., Ltd. |
Antikörper-wirkstoff-konjugate (adcs) mit einem anti-trop-2-antikörper, zusammensetzungen mit solchen adcs sowie verfahren zur herstellung und verwendung davon
|
|
EP4149964A2
(de)
|
2020-05-15 |
2023-03-22 |
Apogenix AG |
Multispezifische immunmodulatoren
|
|
AU2021281417A1
(en)
|
2020-05-29 |
2022-12-08 |
23Andme, Inc. |
Anti-CD200R1 antibodies and methods of use thereof
|
|
AR122569A1
(es)
|
2020-06-08 |
2022-09-21 |
Hoffmann La Roche |
Anticuerpos anti-vhb y métodos de uso
|
|
BR112022025227A2
(pt)
|
2020-06-11 |
2023-01-03 |
Genentech Inc |
Conjugados, composição farmacêutica, formulação líquida, métodos para preparar um conjugado, para aumentar a estabilidade, para tratar um indivíduo, para entregar um polipeptídeo de ligação, para entregar um peptídeo curto, para entregar um agente biologicamente ativo, método para reduzir a conjugação lipídio-proteína-esqueleto e método para aumentar a atividade biológica, uso do conjugado e sistema ou kit
|
|
WO2021252977A1
(en)
|
2020-06-12 |
2021-12-16 |
Genentech, Inc. |
Methods and compositions for cancer immunotherapy
|
|
KR20230025691A
(ko)
|
2020-06-16 |
2023-02-22 |
제넨테크, 인크. |
삼중 음성 유방암을 치료하기 위한 방법과 조성물
|
|
KR20230024368A
(ko)
|
2020-06-18 |
2023-02-20 |
제넨테크, 인크. |
항-tigit 항체 및 pd-1 축 결합 길항제를 사용한 치료
|
|
WO2021255146A1
(en)
|
2020-06-19 |
2021-12-23 |
F. Hoffmann-La Roche Ag |
Antibodies binding to cd3 and cea
|
|
AU2021291011A1
(en)
|
2020-06-19 |
2023-01-05 |
F. Hoffmann-La Roche Ag |
Antibodies binding to CD3 and CD19
|
|
WO2021255143A1
(en)
|
2020-06-19 |
2021-12-23 |
F. Hoffmann-La Roche Ag |
Antibodies binding to cd3 and folr1
|
|
IL296429A
(en)
|
2020-06-19 |
2022-11-01 |
Hoffmann La Roche |
Protease-activated t-cell bispecific antibodies
|
|
TW202216766A
(zh)
|
2020-06-19 |
2022-05-01 |
瑞士商赫孚孟拉羅股份公司 |
與cd3結合之抗體
|
|
WO2021259880A1
(en)
|
2020-06-22 |
2021-12-30 |
Almirall, S.A. |
Anti-il-36 antibodies and methods of use thereof
|
|
JP2023531676A
(ja)
|
2020-06-23 |
2023-07-25 |
ノバルティス アーゲー |
3-(1-オキソイソインドリン-2-イル)ピぺリジン-2,6-ジオン誘導体を含む投与レジメン
|
|
EP4168448A1
(de)
|
2020-06-23 |
2023-04-26 |
F. Hoffmann-La Roche AG |
Gegen her2 gerichtete agonistische cd28-antigenbindende moleküle
|
|
JP2023533217A
(ja)
|
2020-06-24 |
2023-08-02 |
ジェネンテック, インコーポレイテッド |
アポトーシス耐性細胞株
|
|
EP4172203A1
(de)
|
2020-06-25 |
2023-05-03 |
F. Hoffmann-La Roche AG |
Anti-cd3/anti-cd28 bispezifische antigenbindende moleküle
|
|
MX2023000339A
(es)
|
2020-07-10 |
2023-02-09 |
Hoffmann La Roche |
Anticuerpos que se unen a celulas cancerosas y dirigen radionucleotidos a dichas celulas.
|
|
CN115812149A
(zh)
|
2020-07-13 |
2023-03-17 |
基因泰克公司 |
用于预测多肽免疫原性的基于细胞的方法
|
|
TW202216761A
(zh)
|
2020-07-16 |
2022-05-01 |
瑞士商諾華公司 |
抗β細胞素抗體、其片段及多特異性結合分子
|
|
PE20231300A1
(es)
|
2020-07-17 |
2023-08-24 |
Genentech Inc |
Anticuerpos anti-notch2 y metodos de uso
|
|
MX2023000888A
(es)
|
2020-07-21 |
2023-02-22 |
Genentech Inc |
Inductores quimicos de degradacion conjugados con anticuerpo de brm y metodos de estos.
|
|
GB2597532A
(en)
|
2020-07-28 |
2022-02-02 |
Femtogenix Ltd |
Cytotoxic compounds
|
|
WO2022026592A2
(en)
|
2020-07-28 |
2022-02-03 |
Celltas Bio, Inc. |
Antibody molecules to coronavirus and uses thereof
|
|
CN116134027A
(zh)
|
2020-08-03 |
2023-05-16 |
诺华股份有限公司 |
杂芳基取代的3-(1-氧代异吲哚啉-2-基)哌啶-2,6-二酮衍生物及其用途
|
|
WO2022031948A1
(en)
|
2020-08-07 |
2022-02-10 |
Genentech, Inc. |
T cell-based methods for predicting polypeptide immunogenicity
|
|
CA3192344A1
(en)
|
2020-08-28 |
2022-03-03 |
Genentech, Inc. |
Crispr/cas9 multiplex knockout of host cell proteins
|
|
WO2022043558A1
(en)
|
2020-08-31 |
2022-03-03 |
Advanced Accelerator Applications International Sa |
Method of treating psma-expressing cancers
|
|
EP4204021A1
(de)
|
2020-08-31 |
2023-07-05 |
Advanced Accelerator Applications International S.A. |
Verfahren zur behandlung von psma-exprimierenden krebsarten
|
|
WO2022053715A1
(en)
|
2020-09-14 |
2022-03-17 |
Ichnos Sciences SA |
Antibodies that bind to il1rap and uses thereof
|
|
CN116322691A
(zh)
|
2020-09-24 |
2023-06-23 |
豪夫迈·罗氏有限公司 |
T细胞双特异性抗体相关不良反应的预防或减轻
|
|
CN116406291A
(zh)
|
2020-10-05 |
2023-07-07 |
基因泰克公司 |
用抗fcrh5/抗cd3双特异性抗体进行治疗的给药
|
|
EP4232040A1
(de)
|
2020-10-20 |
2023-08-30 |
F. Hoffmann-La Roche AG |
Kombinationstherapie aus pd-1-achsenbindenden antagonisten und lrrk2-inhibitoren
|
|
AR123855A1
(es)
|
2020-10-20 |
2023-01-18 |
Genentech Inc |
Anticuerpos anti-mertk conjugados con peg y métodos de uso
|
|
TW202233672A
(zh)
|
2020-10-22 |
2022-09-01 |
美商健生生物科技公司 |
包括類δ配體3(DLL3)抗原結合區之蛋白質及其用途
|
|
WO2022093981A1
(en)
|
2020-10-28 |
2022-05-05 |
Genentech, Inc. |
Combination therapy comprising ptpn22 inhibitors and pd-l1 binding antagonists
|
|
JP2023549062A
(ja)
|
2020-10-30 |
2023-11-22 |
エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト |
CEA CD3二重特異性抗体及びTGFβシグナル伝達阻害剤を使用したがんの治療
|
|
CA3196539A1
(en)
|
2020-11-04 |
2022-05-12 |
Chi-Chung Li |
Dosing for treatment with anti-cd20/anti-cd3 bispecific antibodies
|
|
CA3196076A1
(en)
|
2020-11-04 |
2022-05-12 |
Chi-Chung Li |
Subcutaneous dosing of anti-cd20/anti-cd3 bispecific antibodies
|
|
WO2022098870A1
(en)
|
2020-11-04 |
2022-05-12 |
The Rockefeller University |
Neutralizing anti-sars-cov-2 antibodies
|
|
AU2021374594A1
(en)
|
2020-11-04 |
2023-06-01 |
Genentech, Inc. |
Dosing for treatment with anti-cd20/anti-cd3 bispecific antibodies and anti-cd79b antibody drug conjugates
|
|
CN116472288A
(zh)
|
2020-11-06 |
2023-07-21 |
诺华股份有限公司 |
抗体Fc变体
|
|
MX2023004941A
(es)
|
2020-11-08 |
2023-07-12 |
Seagen Inc |
Conjugado de anticuerpo y fármaco para terapia de combinación con inhibidor de células inmunitarias.
|
|
TW202233251A
(zh)
|
2020-11-09 |
2022-09-01 |
日商武田藥品工業股份有限公司 |
抗體藥物綴合物
|
|
JP2023547523A
(ja)
|
2020-11-10 |
2023-11-10 |
エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト |
T細胞係合剤関連の有害作用の防止又は軽減
|
|
EP4243857A1
(de)
|
2020-11-13 |
2023-09-20 |
Novartis AG |
Kombinationstherapien mit zellen zur expression des chimären antigenrezeptors (car)
|
|
PE20231556A1
(es)
|
2020-11-16 |
2023-10-03 |
Hoffmann La Roche |
Glucoformas de fab ricas en manosa
|
|
CN117916261A
(zh)
|
2020-11-16 |
2024-04-19 |
豪夫迈·罗氏有限公司 |
与靶向fap的cd40激动剂的组合疗法
|
|
WO2022120352A1
(en)
|
2020-12-02 |
2022-06-09 |
Alector Llc |
Methods of use of anti-sortilin antibodies
|
|
MX2023006480A
(es)
|
2020-12-04 |
2023-06-19 |
Hoffmann La Roche |
Polipeptidos de interleucina-2 mutante dependientes del ph.
|
|
MX2023006650A
(es)
|
2020-12-07 |
2023-06-21 |
UCB Biopharma SRL |
Anticuerpos multiespecificos y combinaciones de anticuerpos.
|
|
CN116802211A
(zh)
|
2020-12-07 |
2023-09-22 |
Ucb生物制药有限责任公司 |
针对白介素-22的抗体
|
|
JP7326584B2
(ja)
|
2020-12-17 |
2023-08-15 |
エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト |
抗hla-g抗体及びその使用
|
|
EP4271482A2
(de)
|
2020-12-31 |
2023-11-08 |
Alamar Biosciences, Inc. |
Bindemoleküle mit hoher affinität und/oder spezifität sowie verfahren zur herstellung und verwendung davon
|
|
CN116829598A
(zh)
|
2021-01-06 |
2023-09-29 |
豪夫迈·罗氏有限公司 |
采用pd1-lag3双特异性抗体和cd20 t细胞双特异性抗体的组合疗法
|
|
EP4277705A1
(de)
|
2021-01-12 |
2023-11-22 |
F. Hoffmann-La Roche AG |
An krebszellen bindende geteilte antikörper und target-radionuklide an diese zellen
|
|
CA3204291A1
(en)
|
2021-01-13 |
2022-07-21 |
F. Hoffmann-La Roche Ag |
Combination therapy
|
|
EP4277926A1
(de)
|
2021-01-15 |
2023-11-22 |
The Rockefeller University |
Neutralisierende anti-sars-cov-2-antikörper
|
|
KR20230147624A
(ko)
|
2021-01-20 |
2023-10-23 |
온코리스폰스 인크. |
면역조절 항체 및 이의 용도
|
|
KR20230147092A
(ko)
|
2021-01-22 |
2023-10-20 |
바이원큐어 테라퓨틱스, 인크. |
항-her-2/trop-2 작제물 및 이의 용도
|
|
WO2022162569A1
(en)
|
2021-01-29 |
2022-08-04 |
Novartis Ag |
Dosage regimes for anti-cd73 and anti-entpd2 antibodies and uses thereof
|
|
WO2022187270A1
(en)
|
2021-03-01 |
2022-09-09 |
Xilio Development, Inc. |
Combination of ctla4 and pd1/pdl1 antibodies for treating cancer
|
|
CA3209364A1
(en)
|
2021-03-01 |
2022-09-09 |
Jennifer O'neil |
Combination of masked ctla4 and pd1/pdl1 antibodies for treating cancer
|
|
WO2022184082A1
(en)
|
2021-03-03 |
2022-09-09 |
Sorrento Therapeutics, Inc. |
Antibody-drug conjugates comprising an anti-bcma antibody
|
|
WO2022192647A1
(en)
|
2021-03-12 |
2022-09-15 |
Genentech, Inc. |
Anti-klk7 antibodies, anti-klk5 antibodies, multispecific anti-klk5/klk7 antibodies, and methods of use
|
|
WO2022198192A1
(en)
|
2021-03-15 |
2022-09-22 |
Genentech, Inc. |
Compositions and methods of treating lupus nephritis
|
|
WO2022197947A1
(en)
|
2021-03-18 |
2022-09-22 |
Alector Llc |
Anti-tmem106b antibodies and methods of use thereof
|
|
WO2022197877A1
(en)
|
2021-03-19 |
2022-09-22 |
Genentech, Inc. |
Methods and compositions for time delayed bio-orthogonal release of cytotoxic agents
|
|
WO2022204274A1
(en)
|
2021-03-23 |
2022-09-29 |
Alector Llc |
Anti-tmem106b antibodies for treating and preventing coronavirus infections
|
|
GB202104104D0
(en)
|
2021-03-24 |
2021-05-05 |
Liliumx Ltd |
Platform and method
|
|
WO2022201122A1
(en)
|
2021-03-26 |
2022-09-29 |
Janssen Biotech, Inc. |
Humanized antibodies against paired helical filament tau and uses thereof
|
|
JP2024512709A
(ja)
|
2021-03-30 |
2024-03-19 |
エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト |
プロテアーゼ活性化ポリペプチド
|
|
TW202304979A
(zh)
|
2021-04-07 |
2023-02-01 |
瑞士商諾華公司 |
抗TGFβ抗體及其他治療劑用於治療增殖性疾病之用途
|
|
TW202304999A
(zh)
|
2021-04-09 |
2023-02-01 |
美商思進公司 |
以抗tigit抗體治療癌症之方法
|
|
AR125344A1
(es)
|
2021-04-15 |
2023-07-05 |
Chugai Pharmaceutical Co Ltd |
Anticuerpo anti-c1s
|
|
JP2024514222A
(ja)
|
2021-04-19 |
2024-03-28 |
ジェネンテック, インコーポレイテッド |
改変された哺乳動物細胞
|
|
JP2024514281A
(ja)
|
2021-04-23 |
2024-04-01 |
エフ・ホフマン-ラ・ロシュ・アクチェンゲゼルシャフト |
Nk細胞係合剤関連の有害作用の防止または軽減
|
|
AU2021443863A1
(en)
|
2021-04-30 |
2023-10-26 |
F. Hoffmann-La Roche Ag |
Dosing for treatment with anti-cd20/anti-cd3 bispecific antibody
|
|
KR20240005691A
(ko)
|
2021-04-30 |
2024-01-12 |
에프. 호프만-라 로슈 아게 |
항-cd20/항-cd3 이중특이적 항체 및 항-cd79b 항체 약물 접합체를 이용한 병용 치료를 위한 투약
|
|
KR20240004694A
(ko)
|
2021-05-03 |
2024-01-11 |
유씨비 바이오파마 에스알엘 |
항체
|
|
EP4334343A2
(de)
|
2021-05-06 |
2024-03-13 |
The Rockefeller University |
Neutralisierende anti-sars-cov-2-antikörper und verfahren zur verwendung davon
|
|
CA3218170A1
(en)
|
2021-05-12 |
2022-11-17 |
Jamie Harue HIRATA |
Methods of using anti-cd79b immunoconjugates to treat diffuse large b-cell lymphoma
|
|
WO2022241082A1
(en)
|
2021-05-14 |
2022-11-17 |
Genentech, Inc. |
Agonists of trem2
|
|
AR125874A1
(es)
|
2021-05-18 |
2023-08-23 |
Novartis Ag |
Terapias de combinación
|
|
WO2022243261A1
(en)
|
2021-05-19 |
2022-11-24 |
F. Hoffmann-La Roche Ag |
Agonistic cd40 antigen binding molecules targeting cea
|
|
WO2022246259A1
(en)
|
2021-05-21 |
2022-11-24 |
Genentech, Inc. |
Modified cells for the production of a recombinant product of interest
|
|
AR126009A1
(es)
|
2021-06-02 |
2023-08-30 |
Hoffmann La Roche |
Moléculas agonistas de unión al antígeno cd28 que se dirigen a epcam
|
|
TW202306994A
(zh)
|
2021-06-04 |
2023-02-16 |
日商中外製藥股份有限公司 |
抗ddr2抗體及其用途
|
|
IL308015A
(en)
|
2021-06-09 |
2023-12-01 |
Hoffmann La Roche |
A combination of a specific BRAF inhibitor (paradox breaker) and a PD-1 spindle-binding antagonist for use in cancer treatment
|
|
EP4355783A1
(de)
|
2021-06-16 |
2024-04-24 |
Alector LLC |
Monovalente anti-mertk-antikörper und verfahren zur verwendung davon
|
|
EP4355786A1
(de)
|
2021-06-16 |
2024-04-24 |
Alector LLC |
Bispezifische anti-mertk- und anti-pdl1-antikörper und verfahren zur verwendung davon
|
|
EP4361176A1
(de)
|
2021-06-25 |
2024-05-01 |
Chugai Seiyaku Kabushiki Kaisha |
Verwendung eines anti-ctla-4-antikörpers
|
|
EP4361273A1
(de)
|
2021-06-25 |
2024-05-01 |
Chugai Seiyaku Kabushiki Kaisha |
Anti-ctla-4-antikörper
|
|
TW202309078A
(zh)
|
2021-07-02 |
2023-03-01 |
美商建南德克公司 |
治療癌症之方法及組成物
|
|
IL309856A
(en)
|
2021-07-14 |
2024-02-01 |
Genentech Inc |
Antibodies anti-C-C motif receptor 8 (CCR8) and methods of use
|
|
WO2023004386A1
(en)
|
2021-07-22 |
2023-01-26 |
Genentech, Inc. |
Brain targeting compositions and methods of use thereof
|
|
WO2023001884A1
(en)
|
2021-07-22 |
2023-01-26 |
F. Hoffmann-La Roche Ag |
Heterodimeric fc domain antibodies
|
|
CN117715936A
(zh)
|
2021-07-28 |
2024-03-15 |
豪夫迈·罗氏有限公司 |
用于治疗癌症的方法和组合物
|
|
CN117794953A
(zh)
|
2021-08-03 |
2024-03-29 |
豪夫迈·罗氏有限公司 |
双特异性抗体及使用方法
|
|
WO2023019239A1
(en)
|
2021-08-13 |
2023-02-16 |
Genentech, Inc. |
Dosing for anti-tryptase antibodies
|
|
CA3229448A1
(en)
|
2021-08-23 |
2023-03-02 |
Immunitas Therapeutics, Inc. |
Anti-cd161 antibodies and uses thereof
|
|
AU2022332303A1
(en)
|
2021-08-27 |
2024-02-01 |
Genentech, Inc. |
Methods of treating tau pathologies
|
|
TW202325727A
(zh)
|
2021-08-30 |
2023-07-01 |
美商建南德克公司 |
抗聚泛素多特異性抗體
|
|
WO2023044483A2
(en)
|
2021-09-20 |
2023-03-23 |
Voyager Therapeutics, Inc. |
Compositions and methods for the treatment of her2 positive cancer
|
|
WO2023056069A1
(en)
|
2021-09-30 |
2023-04-06 |
Angiex, Inc. |
Degrader-antibody conjugates and methods of using same
|
|
WO2023056403A1
(en)
|
2021-09-30 |
2023-04-06 |
Genentech, Inc. |
Methods for treatment of hematologic cancers using anti-tigit antibodies, anti-cd38 antibodies, and pd-1 axis binding antagonists
|
|
WO2023062048A1
(en)
|
2021-10-14 |
2023-04-20 |
F. Hoffmann-La Roche Ag |
Alternative pd1-il7v immunoconjugates for the treatment of cancer
|
|
WO2023062050A1
(en)
|
2021-10-14 |
2023-04-20 |
F. Hoffmann-La Roche Ag |
New interleukin-7 immunoconjugates
|
|
WO2023069919A1
(en)
|
2021-10-19 |
2023-04-27 |
Alector Llc |
Anti-cd300lb antibodies and methods of use thereof
|
|
WO2023073225A1
(en)
|
2021-11-01 |
2023-05-04 |
F. Hoffmann-La Roche Ag |
Treatment of cancer using a hla-a2/wt1 x cd3 bispecific antibody and a 4-1bb (cd137) agonist
|
|
WO2023081898A1
(en)
|
2021-11-08 |
2023-05-11 |
Alector Llc |
Soluble cd33 as a biomarker for anti-cd33 efficacy
|
|
WO2023086807A1
(en)
|
2021-11-10 |
2023-05-19 |
Genentech, Inc. |
Anti-interleukin-33 antibodies and uses thereof
|
|
WO2023088889A1
(en)
|
2021-11-16 |
2023-05-25 |
Apogenix Ag |
CD137 ligands
|
|
WO2023088876A1
(en)
|
2021-11-16 |
2023-05-25 |
Apogenix Ag |
Multi-specific immune modulators
|
|
TW202337494A
(zh)
|
2021-11-16 |
2023-10-01 |
美商建南德克公司 |
用莫蘇妥珠單抗治療全身性紅斑狼瘡(sle)之方法及組成物
|
|
WO2023092004A1
(en)
|
2021-11-17 |
2023-05-25 |
Voyager Therapeutics, Inc. |
Compositions and methods for the treatment of tau-related disorders
|
|
US20230312724A1
(en)
|
2021-12-01 |
2023-10-05 |
Kadmon Corporation, Llc |
B7-H4 Antibodies and Anti-B7-H4 Antibody/IL-15 Fusion Proteins
|
|
AR127887A1
(es)
|
2021-12-10 |
2024-03-06 |
Hoffmann La Roche |
Anticuerpos que se unen a cd3 y plap
|
|
TW202339797A
(zh)
|
2021-12-14 |
2023-10-16 |
瑞士商赫孚孟拉羅股份公司 |
使用hla-a2mage-a4xcd3雙特異性抗體及4-1bb(cd137)促效劑治療癌症
|
|
WO2023114543A2
(en)
|
2021-12-17 |
2023-06-22 |
Dana-Farber Cancer Institute, Inc. |
Platform for antibody discovery
|
|
WO2023114544A1
(en)
|
2021-12-17 |
2023-06-22 |
Dana-Farber Cancer Institute, Inc. |
Antibodies and uses thereof
|
|
TW202340248A
(zh)
|
2021-12-20 |
2023-10-16 |
瑞士商赫孚孟拉羅股份公司 |
促效性ltbr抗體及包含其之雙特異性抗體
|
|
WO2023131901A1
(en)
|
2022-01-07 |
2023-07-13 |
Johnson & Johnson Enterprise Innovation Inc. |
Materials and methods of il-1beta binding proteins
|
|
TW202340251A
(zh)
|
2022-01-19 |
2023-10-16 |
美商建南德克公司 |
抗notch2抗體及結合物及其使用方法
|
|
WO2023147329A1
(en)
|
2022-01-26 |
2023-08-03 |
Genentech, Inc. |
Antibody-conjugated chemical inducers of degradation and methods thereof
|
|
WO2023147328A1
(en)
|
2022-01-26 |
2023-08-03 |
Genentech, Inc. |
Antibody-conjugated chemical inducers of degradation with hydolysable maleimide linkers and methods thereof
|
|
WO2023150778A1
(en)
|
2022-02-07 |
2023-08-10 |
Visterra, Inc. |
Anti-idiotype antibody molecules and uses thereof
|
|
WO2023164516A1
(en)
|
2022-02-23 |
2023-08-31 |
Alector Llc |
Methods of use of anti-trem2 antibodies
|
|
WO2023173026A1
(en)
|
2022-03-10 |
2023-09-14 |
Sorrento Therapeutics, Inc. |
Antibody-drug conjugates and uses thereof
|
|
WO2023170290A1
(en)
|
2022-03-11 |
2023-09-14 |
Janssen Pharmaceutica Nv |
Multispecific antibodies and uses thereof
|
|
TW202345899A
(zh)
|
2022-03-11 |
2023-12-01 |
比利時商健生藥品公司 |
多特異性抗體及其用途(三)
|
|
WO2023170291A1
(en)
|
2022-03-11 |
2023-09-14 |
Janssen Pharmaceutica Nv |
Multispecific antibodies and uses thereof
|
|
TW202346365A
(zh)
|
2022-03-23 |
2023-12-01 |
瑞士商赫孚孟拉羅股份公司 |
抗cd20/抗cd3雙特異性抗體及化學療法之組合治療
|
|
TW202402790A
(zh)
|
2022-03-25 |
2024-01-16 |
英商梅迪繆思有限公司 |
減少呼吸系統感染之方法
|
|
WO2023186756A1
(en)
|
2022-03-28 |
2023-10-05 |
F. Hoffmann-La Roche Ag |
Interferon gamma variants and antigen binding molecules comprising these
|
|
WO2023192622A1
(en)
|
2022-04-01 |
2023-10-05 |
Genentech, Inc. |
Hydroxypropyl methyl cellulose derivatives to stabilize polypeptides
|
|
WO2023191816A1
(en)
|
2022-04-01 |
2023-10-05 |
Genentech, Inc. |
Dosing for treatment with anti-fcrh5/anti-cd3 bispecific antibodies
|
|
WO2023201299A1
(en)
|
2022-04-13 |
2023-10-19 |
Genentech, Inc. |
Pharmaceutical compositions of therapeutic proteins and methods of use
|
|
WO2023198727A1
(en)
|
2022-04-13 |
2023-10-19 |
F. Hoffmann-La Roche Ag |
Pharmaceutical compositions of anti-cd20/anti-cd3 bispecific antibodies and methods of use
|
|
US20230357381A1
(en)
|
2022-04-26 |
2023-11-09 |
Novartis Ag |
Multispecific antibodies targeting il-13 and il-18
|
|
WO2023215737A1
(en)
|
2022-05-03 |
2023-11-09 |
Genentech, Inc. |
Anti-ly6e antibodies, immunoconjugates, and uses thereof
|
|
WO2023219613A1
(en)
|
2022-05-11 |
2023-11-16 |
Genentech, Inc. |
Dosing for treatment with anti-fcrh5/anti-cd3 bispecific antibodies
|
|
WO2023220695A2
(en)
|
2022-05-13 |
2023-11-16 |
Voyager Therapeutics, Inc. |
Compositions and methods for the treatment of her2 positive cancer
|
|
US20230416412A1
(en)
|
2022-05-31 |
2023-12-28 |
Hoffmann-La Roche Inc. |
Prevention or mitigation of t-cell engaging agent-related adverse effects
|
|
WO2023240058A2
(en)
|
2022-06-07 |
2023-12-14 |
Genentech, Inc. |
Prognostic and therapeutic methods for cancer
|
|
WO2023239803A1
(en)
|
2022-06-08 |
2023-12-14 |
Angiex, Inc. |
Anti-tm4sf1 antibody-drug conjugates comprising cleavable linkers and methods of using same
|
|
WO2024015897A1
(en)
|
2022-07-13 |
2024-01-18 |
Genentech, Inc. |
Dosing for treatment with anti-fcrh5/anti-cd3 bispecific antibodies
|
|
WO2024015993A1
(en)
|
2022-07-15 |
2024-01-18 |
Fibrogen, Inc. |
Modified anti-galectin-9 antibody and uses thereof
|
|
WO2024020432A1
(en)
|
2022-07-19 |
2024-01-25 |
Genentech, Inc. |
Dosing for treatment with anti-fcrh5/anti-cd3 bispecific antibodies
|
|
WO2024020564A1
(en)
|
2022-07-22 |
2024-01-25 |
Genentech, Inc. |
Anti-steap1 antigen-binding molecules and uses thereof
|
|
WO2024020579A1
(en)
|
2022-07-22 |
2024-01-25 |
Bristol-Myers Squibb Company |
Antibodies binding to human pad4 and uses thereof
|
|
WO2024026471A1
(en)
|
2022-07-29 |
2024-02-01 |
Alector Llc |
Cd98hc antigen-binding domains and uses therefor
|
|
WO2024026447A1
(en)
|
2022-07-29 |
2024-02-01 |
Alector Llc |
Anti-gpnmb antibodies and methods of use thereof
|
|
WO2024026472A2
(en)
|
2022-07-29 |
2024-02-01 |
Alector Llc |
Transferrin receptor antigen-binding domains and uses therefor
|
|
WO2024030976A2
(en)
|
2022-08-03 |
2024-02-08 |
Voyager Therapeutics, Inc. |
Compositions and methods for crossing the blood brain barrier
|
|
WO2024040216A2
(en)
|
2022-08-19 |
2024-02-22 |
Fibrogen, Inc. |
Anti-ccr8 antibodies and uses thereof
|
|
WO2024049949A1
(en)
|
2022-09-01 |
2024-03-07 |
Genentech, Inc. |
Therapeutic and diagnostic methods for bladder cancer
|
|
WO2024056862A1
(en)
|
2022-09-15 |
2024-03-21 |
Avidicure Ip B.V. |
Multispecific antigen binding proteins for tumor-targeting of nk cells and use thereof
|
|
WO2024059739A1
(en)
|
2022-09-15 |
2024-03-21 |
Voyager Therapeutics, Inc. |
Tau binding compounds
|
|
WO2024069180A2
(en)
|
2022-09-28 |
2024-04-04 |
LiliumX Ltd. |
Multivalent proteins and screening methods
|
|
WO2024068705A1
(en)
|
2022-09-29 |
2024-04-04 |
F. Hoffmann-La Roche Ag |
Protease-activated polypeptides
|
|
WO2024074649A1
(en)
|
2022-10-05 |
2024-04-11 |
Alcea Therapeutics, Inc. |
Notch4 antibodies, compositions, and methods for treating airway inflammation
|
|
WO2024077239A1
(en)
|
2022-10-07 |
2024-04-11 |
Genentech, Inc. |
Methods of treating cancer with anti-c-c motif chemokine receptor 8 (ccr8) antibodies
|
|
WO2024079010A1
(en)
|
2022-10-10 |
2024-04-18 |
F. Hoffmann-La Roche Ag |
Combination therapy of a gprc5d tcb and cd38 antibodies
|
|
WO2024079009A1
(en)
|
2022-10-10 |
2024-04-18 |
F. Hoffmann-La Roche Ag |
Combination therapy of a gprc5d tcb and proteasome inhibitors
|
|
WO2024079015A1
(en)
|
2022-10-10 |
2024-04-18 |
F. Hoffmann-La Roche Ag |
Combination therapy of a gprc5d tcb and imids
|
|
WO2024079310A1
(en)
|
2022-10-14 |
2024-04-18 |
Ebbil, Ltd. |
Sil-6r and ctgf binding proteins and methods of use thereof
|