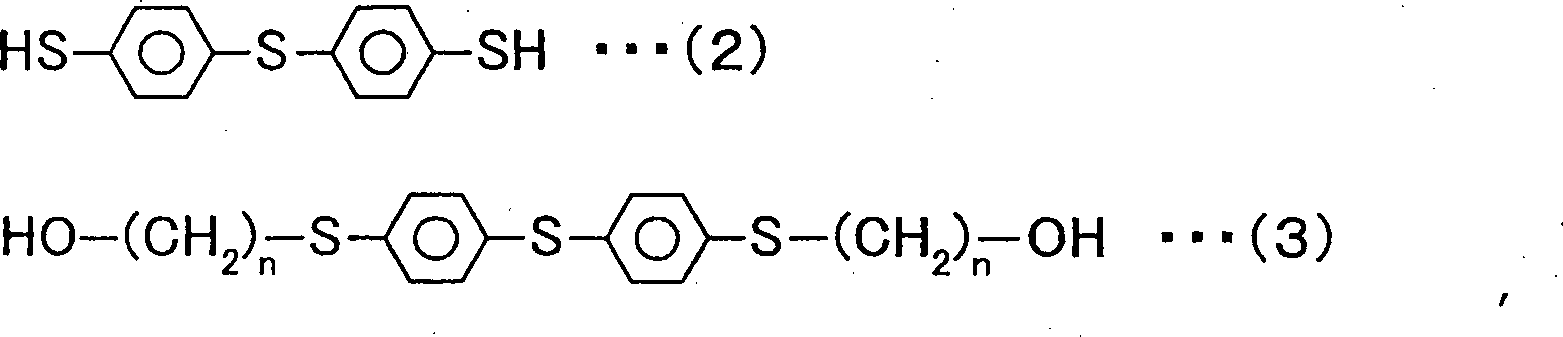-
Die vorliegende Erfindung betrifft eine elektronische Komponente mit meinem dielektrischen Film aus wenigstens einem Bis(4-mercaptophenyl)-sulfidderivat.
-
Die
US-PS 5,125,183 beschreibt den Aufbau eines Kondensators mit einer dielektrischen Beschichtung auf Basis polyfunktioneller Acrylverbindungen.
-
Die
DE 691 03 246 T2 betrifft ein gehärtetes Harz mit hoher Refraktion, ebenso wie
EP 0 795 765 B1 ,
JP 08183816A und
JP 10039111 (Abstract). Diese Harze werden in Verbindung mit dem Anwendungsgebiet Linsen beschrieben.
-
Die
US-PS 2,636,022 beschreibt einen Kondensator mit einem Dielektrikum, das aus einer dielektrischen Harzzusammensetzung gebildet ist. Diese enthält ein Polymer, welches durch Polymerisation eines Monomers der Formel R-S-R'-CH=CH
2 gebildet wird, wobei R und R' ein Aromat sein kann.
-
Herkömmlicherweise wurde ein Harzfilm als dielektrischer Film in einem Kondensator oder dergleichen verwendet. Ein solcher dielektrischer Film wird durch Bestrahlen eines auf einem Substrat abgeschiedenen Monomers mit Elektronenstrahlen oder Ultraviolettstrahlen zur Polymerisierung des Monomers ausgebildet, wie in
JP 63-32929 B ,
JP 11-147272 A und
US-PS 5,125,138 offenbart ist. Als Monomer für die Bildung des dielektrischen Filmes werden beispielsweise Dimethyloltricyclodecandiacrylat und 1,9-Nonandioldiacrylat oder dergleichen verwendet.
-
Elektronische Komponenten, welche die aus den oben beschriebenen Monomeren gebildeten dielektrischen Filme verwenden, weisen jedoch ein Problem dahingehend auf, dass die Eigenschaften bzw. Charakteristika nicht ausreichend sind. Insbesondere weisen elektronische Komponenten, welche die aus den oben beschriebenen Monomeren gebildeten dielektrischen Filme verwenden, das Problem auf, dass die Charakteristika unter hoher Feuchtigkeit und hoher Temperatur nicht ausreichend sind.
-
Um das Problem zu lösen, ist es eine Aufgabe der vorliegenden Erfindung, eine elektronische Komponente, umfassend einen dielektrischen Film mit ausgezeichneten Eigenschaften bzw. Charakteristika unter hoher Feuchtigkeit und hoher Temperatur, bereitzustellen.
-
Gegenstand der vorliegenden Erfindung ist eine elektronische Komponente gemäß Anspruch 1. Bevorzugte Ausführungsformen ergeben sich aus den Unteransprüchen 2 bis 4.
-
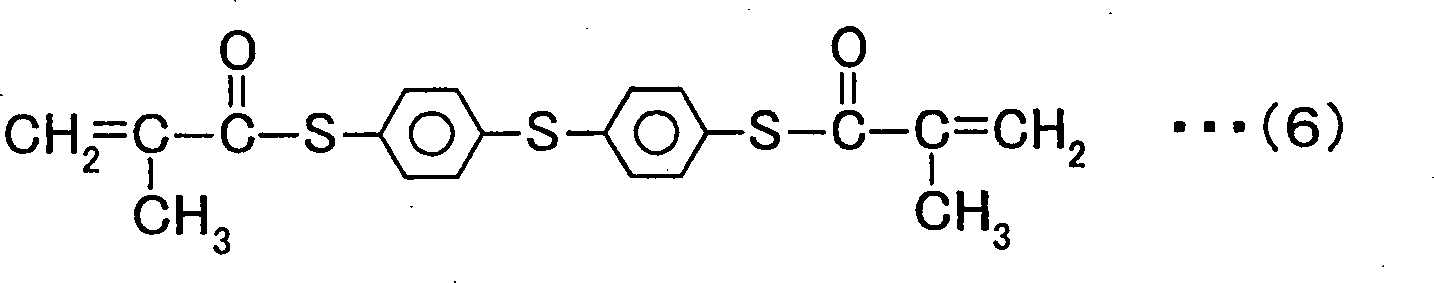
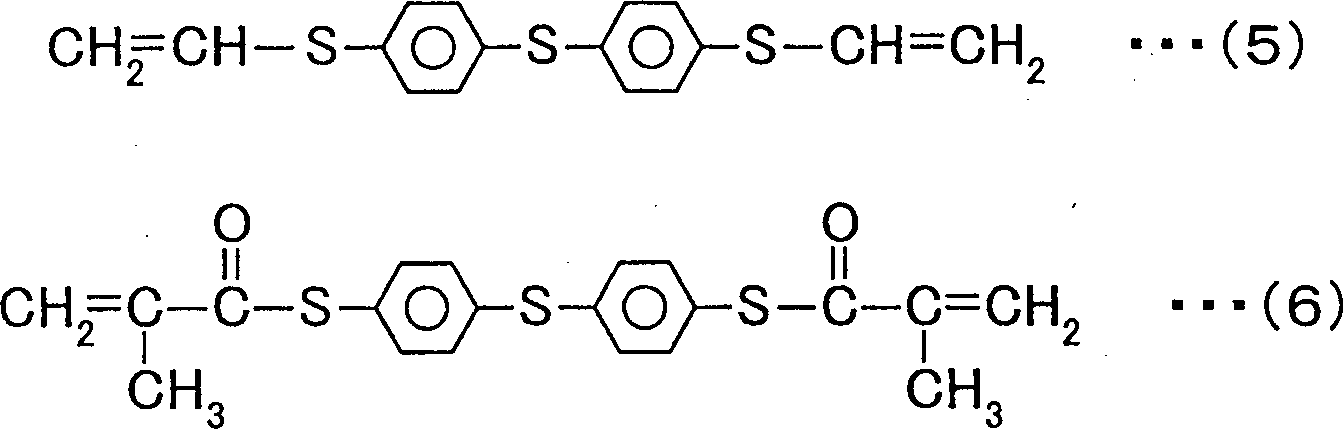
Bei der elektronischen Komponente der vorliegenden Erfindung wird bevorzugt, dass das Monomer eines oder eine Vielzahl von Monomeren umfasst, welche durch die allgemeinen Formeln 1 und 4 und die chemischen Formeln 5 und 6 dargestellt sind.
R Wasserstoff oder eine Methylgruppe und n eine ganze Zahl von 1 bis 4 ist.
worin R Wasserstoff oder eine Methylgruppe ist.
-
Diese Ausführungsform kann eine elektronische Komponente, welche besonders ausgezeichnete Eigenschaften unter hoher Feuchtigkeit und hoher Temperatur aufweist, liefern.
-
Bei der elektronischen Komponente der vorliegenden Erfindung kann der dünne Film des Weiteren ein Additiv umfassen. Als das Additiv kann beispielsweise ein Antioxidationsmittel verwendet werden. Diese Ausführungsform kann die Oxidierung des dielektrischen Films verhindern.
-
Das Bis(4-mercaptophenyl)sulfidderivat wird als ein Monomer zur Bildung eines dielektrischen Filmes, der in einer elektronischen Komponente verwendet wird, bevorzugt.
-
Bei dem Bis(4-mercaptophenyl)sulfidderivat kann R Wasserstoff und n 2 sein. Diese Ausführungsform kann ein besonders bevorzugtes Monomer zur Bildung eines in einer elektronischen Komponente verwendeten dielektrischen Filmes liefern.
-
Ein Verfahren zur Herstellung eines Bis(4-mercaptophenyl)sulfidderivats umfasst eine erste Stufe der Umsetzung von Bis(4-mercaptophenyl)sulfid, dargestellt durch die chemische Formel 2 unten, mit einem ω-Halogenalkylalkohol mit nicht mehr als 4 Kohlenstoffatomen, wobei eine organische Verbindung, dar gestellt durch die allgemeine Formel 3 unten, hergestellt wird und eine zweite Stufe der Umsetzung eines Alkylesteracrylats oder eines Alkylestermethacrylats mit der organischen Verbindung, dargestellt durch die allgemeine Formel 3, wobei ein Bis(4-mercaptophenyl)-sulfidderivat der allgemeinen Formel 1 erzeugt wird.
worin n eine ganze Zahl von 1 bis 4 ist.
-
So kann das durch die allgemeine Formel 1 dargestellte Monomer leicht hergestellt werden.
-
Bei dem Verfahren kann der ω-Halogenalkylalkohol in der ersten Stufe 2-Halogenethanol sein und Methylacrylat kann mit der durch die allgemeine Formel 3 dargestellte Verbindung in der zweiten Stufe umgesetzt werden. Gemäß dieser Ausführungsform kann das Bis(4-mercaptophenyl)-sulfidderivat, das besonders als ein Monomer zur Bildung eines in einer elektronischen Komponente verwendeten dielektrischen Filmes bevorzugt ist, leicht hergestellt werden.
-
Bei dem Verfahren kann die erste Stufe in Gegenwart eines Alkalimetallcarbonats durchgeführt werden, das ein basischer Katalysator ist. Des Weiteren kann die zweite Stufe in Gegenwart von Alkoxytitan oder einer Organozinnverbindung, die ein Umesterungskatalysator ist, durchgeführt werden. Gemäß dieser Ausführungsform kann das Bis(4-mercaptophenyl)sulfidderivat wirksam hergestellt werden.
-
Des Weiteren ist eine elektronische Komponente der vorliegenden Erfindung mit einem dielektrischen Film ausgestattet, wobei der dielektrische Film durch Ausbilden eines dünnen Filmes, welcher wenigstens eine Art von Monomer enthält, und Polymerisieren des Monomeres in dem dünnen Film, gebildet wird und das Monomer weist eine Molekülstruktur auf, in welcher Schwefel und ein aromatischer Ring kovalent gebunden sind oder eine Molekülstruktur, in welcher Schwefel und ein aromatischer Ring über eine Alkylengruppe gebunden sind. Gemäß der elektronischen Komponente der vorliegenden Erfindung kann eine elektronische Komponente mit zufrieden stellenden Eigenschaften unter hoher Feuchtigkeit und hoher Temperatur erhalten werden.
-
Die elektronische Komponente der vorliegenden Erfindung kann des Weiteren ein Paar von Elektroden umfassen, die einander gegenüber liegen, wobei wenigstens ein Teil des dielektrischen Films dazwischen angeordnet ist. Diese Ausführungsform kann eine elektronische Komponente, wie einen Kondensator, liefern, die bzw. der ausgezeichnete Eigenschaften sogar unter hoher Feuchtigkeit und hoher Temperatur aufweist.
-
Kurze Beschreibung der Zeichnungen:
-
1A ist eine Querschnittsansicht, welche ein Beispiel eines Kondensators zeigt, der eine elektronische Komponente der vorliegenden Erfindung ist.
-
1B ist eine Querschnittsansicht, welche ein weiteres Beispiel eines Kondensators zeigt, der eine elektronische Komponente der vorliegenden Erfindung ist.
-
2A bis 2D sind Verfahrenszeichnungen, welche ein Beispiel eines Verfahrens zur Herstellung eines Kondensators zeigen, der eine elektronische Komponente der vorliegenden Erfindung ist.
-
3 ist eine Zeichnung, welche eine Stufe des in 2 gezeigten Herstellungsverfahrens ist.
-
4A ist eine Querschnittsansicht, welche ein noch weiteres Beispiel eines Kondensators zeigt, der eine elektronische Komponente der vorliegenden Erfindung ist.
-
4B ist eine perspektivische Ansicht von 4A.
-
5 ist ein Diagramm, welches das IR-Spektrum von Bis(4-acryloyloxyethylenthiophenyl)sulfid zeigt, das ein Beispiel eines Monomeres ist, das zur Herstellung elektronischer Komponenten der vorliegenden Erfindung verwendet wird.
-
6 ist ein Diagramm, welches das IR-Spektrum von 1,4-Bis(methacryloyloxyethylenthiomethyl)benzol zeigt, das ein Beispiel eines Monomeres ist, das zur Herstellung von elektronischen Komponenten der vorliegenden Erfindung verwendet wird.
-
Nachfolgend werden Ausführungsformen der vorliegenden Erfindung unter Bezugnahme auf die begleitenden Zeichnungen beschrieben. In der nachfolgenden Beschreibung tragen gleiche Elemente gleiche Bezugsziffern, so dass eine Doppelbeschreibung vermieden werden kann.
-
Ausführungsform 1
-
Bei Ausführungsform 1 werden Bis(4-mercaptophenyl)sulfidderivate beschrieben.
-
Die Bis(4-mercaptophenyl)sulfidderivate der vorliegenden Erfindung sind durch die allgemeine Formel 1 unten dargestellt.
worin R Wasserstoff oder eine Methylgruppe und n eine ganze Zahl von 1 bis 4 ist.
-
Die Bis(4-mercaptophenyl)sulfidderivate, welche durch die allgemeine Formel 1 dargestellt sind, können durch das in Ausführungsform 2 beschriebene Verfahren hergestellt werden.
-
Die Bis(4-mercaptophenyl)sulfidderivate, welche durch die allgemeine Formel 1 dargestellt sind, können als ein Monomer zur Ausbildung dielektrischer Filme (Harzfilme) verwendet werden, die in elektronischen Komponenten verwendet werden. Wird ein dielektrischer Film unter Verwendung dieses Monomeres gebildet, wird zunächst ein dünner Film, welcher dieses Monomer enthält, gebildet und der dünne Film wird mit Elektronenstrahlen oder Ultraviolettstrahlen bestrahlt. Wird dieses Monomer verwendet, können dielektrische Filme, die für elektronische Komponenten geeignet sind, gebildet werden. Insbesondere haben, wenn ein Monomer eines Bis(4-mercaptophenyl)sulfidderivates, bei dem R Wasserstoff und n in der allgemeinen Formel 1 gleich 2 ist, zur Bildung dielektrischer Filme für Kondensatoren verwendet werden, die Kondensatoren ausgezeichnete Eigenschaften bzw. Charakteristika sogar unter hoher Feuchtigkeit und hoher Temperatur.
-
Gemäß einem weiteren Aspekt betrifft die vorliegende Erfindung die Verwendung einer organischen Verbindung, welche durch die allgemeine Formel 1 dargestellt ist, als Monomer eines Harzes.
-
Ausführungsform 2
-
In Ausführungsform 2 wird ein Verfahren zur Herstellung der Bis(4-mercaptophenyl)sulfidderivate, die durch die allgemeine Formel 1 dargestellt und in Ausführungsform 1 beschrieben sind, beschrieben.
-
Zunächst wird eine durch die allgemeine Formel 3 unten dargestellte organische Verbindung durch Umsetzung von Bis(4-mercaptophenyl)sulfid, dargestellt durch die chemische Formel 2 unten, mit ω-Halogenalkylalkohol unter Verwendung einer Base als Katalysator bei 60°C bis 120°C während 4 bis 8 Stunden (erstes Verfahren) hergestellt.
worin n eine ganze Zahl von 1 bis 4 ist.
-
Das durch die chemische Formel 2 dargestellte Bis(4-mercaptophenyl)sulfid ist im Handel von Sumitomo Seika Chemicals Co., Ltd. unter dem Produktnamen MPS erhältlich.
-
Der in dem ersten Verfahren verwendete ω-Halogenalkylalkohol ist ein Alkohol mit einer geraden Kohlenstoffkette mit 1 bis 4 Kohlenstoffen und einer Hydroxylgruppe an einem endständigen Kohlenstoff der Kohlenstoffkette und einem Halogen am anderen endständigen Kohlenstoff der Kohlenstoffkette. Insbesondere können beispielsweise 2-Chlorethanol, 3-Chlor-1-propanol, 4-Chlor-1-butanol, 2-Bromethanol, 3-Brom-1-propanol, 2-Iodethanol und dergleichen verwendet werden. Die Anzahl der Kohlenstoffatome des ω-Halogenalkylalkohols entspricht n der Bis(4-mercaptophenyl)sulfidderivate der allgemeinen Formel 1. Beispielsweise ist, wenn 2-Chlorethanol verwendet wird, n in der allgemeinen Formel 1 gleich 2.
-
Als basischer Katalysator, welcher im ersten Verfahren verwendet wird, sind Alkalimetallcarbonate, wie Na2CO3 und K2CO3, Erdalkalimetallcarbonate, wie CaCO3 und MgCO3 und Alkalimetalloxide geeignet. Unter diesen sind die Alkalimetallcarbonate bevorzugt. Als Lösungsmittel für den basischen Katalysator sind Ketone, wie Methylethylketon, Methylisobutylketon, Ether, wie Tetrahydrofuran und Dioxan, geeignet.
-
Nach dem ersten Verfahren können die Bis(4-mercaptophenyl)sulfidderivate der allgemeinen Formel 1 hergestellt werden, indem Alkylesteracrylat oder Alkylestermethacrylat und die durch die allgemeine Formel 3 dargestellte organische Verbindung in Gegenwart eines Umesterungskatalysators 6 bis 10 Stunden am Rückfluss gekocht werden (zweites Verfahren).
-
Bei dem zweiten Verfahren können Bis(4-mercaptophenyl)sulfidderivate mit R gleich Wasserstoff erhalten werden, wenn ein Alkylesteracrylat (dargestellt durch die allgemeine Formel CH2=CHCOOR', worin beispielsweise Methylgruppen, Ethylgruppen, Propylgruppen, Butylgruppen oder dergleichen für R' als eine Alkylgruppe verwendet werden), vorzugsweise Methacrylat verwendet wird. Alternativ dazu können Bis(4-mercaptophenyl)sulfidderivate mit einer Methylgruppe als R erhalten werden, wenn Alkylestermethacrylat (dargestellt durch die allgemeine Formel CH2=C(CH3)COOR'', worin beispielsweise Methylgruppen, Ethylgruppen, Propylgruppen, Butylgruppen und dergleichen für R' als eine Alkylgruppe verwendet werden können), vorzugsweise Methylmethacrylat verwendet wird.
-
Als Umesterungskatalysator, der in dem zweiten Verfahren verwendet wird, sind Alkoxytitan, wie Tetrabutyltitanat, Organozinnverbindungen, wie Dibutylzinnoxid, Dioctylzinnoxid, Dibutylzinndiacetat, Dibutylzinndilaurat, geeignet. Unter diesen wird Tetrabutyltitanat oder Dibutylzinnoxid bevorzugt. Als Menge an Alkylesteracrylat (oder Alkylestermethacrylat), die zugegeben werden muss, sind 3 bis 10 Gewichtsteile pro Gewichtsteile (Masse) organische Verbindung der allgemeinen Formel 3 bevorzugt.
-
Bei dem oben beschriebenen Herstellungsverfahren wird bevorzugt, dass der ω-Halogenalkylalkohol im ersten Verfahren 2-Halogenethanol ist und Methylacrylat mit der durch die allgemeine Formel 3 dargestellten Verbindung im zweiten Verfahren umgesetzt wird.
-
Das Herstellungsverfahren der Ausführungsform 2 kann die Herstellung der Bis(4-mercaptophenyl)sulfidderivate der allgemeinen Formel, die in Ausführungsform 1 beschrieben sind, erleichtern.
-
Ausführungsform 3
-
In Ausführungsform 3 wird ein Beispiel eines Kondensators als eine elektronische Komponente der vorliegenden Erfindung beschrieben. 1A ist eine Querschnittsansicht eines Kondensators 10 der Ausführungsform 3. Der Kondensator der vorliegenden Erfindung kann eine wie in 1B gezeigte Form als ein Kondensator 10a aufweisen.
-
Unter Bezugnahme auf 1A umfasst der Kondensator 10 einen Träger 11, einen unteren Elektrodenfilm 12, der auf dem Träger 11 ausgebildet ist, einen dielektrischen Film 13, der hauptsächlich auf dem unteren Elektrodenfilm 12 angeordnet ist, und einen oberen Elektrodenfilm 14, der hauptsächlich auf dem dielektrischen Film 13 angeordnet ist. Der dielektrische Film 13 ist ein Harzfilm (des Weiteren kann ein Additiv von dem Harzfilm umfasst sein). In anderen Worten, der Kondensator 10 umfasst den dielektrischen Film 13 und ein Paar Elektroden (den unteren Elektrodenfilm 12 und den oberen Elektrodenfilm 14), welche einander gegenüber liegen, wobei der dielektrische Film 13 dazwischen angeordnet ist.
-
Als Träger 11 können verschiedene Substanzen verwendet werden. Genauer gesagt können beispielsweise Filme aus Polymer, wie Polyethylenterephthalat (das nachfolgend als ”PET” bezeichnet werden kann), Polyethylennaphthalat (PEN), Polyphenylensulfid (PPS), Polyamid (PA) oder Polyamid (PI) verwendet werden. Es gibt keine Beschränkung hinsichtlich der Dicke des Trägers 11, aber im Allgemeinen wird herkömmlicherweise eine Dicke in der Größenordnung von 1 μm bis 75 μm verwendet. Wenn der untere Elektrodenfilm 12 auch als Träger dient, ist der Träger 11 nicht erforderlich. Der Träger 11 kann entfernt werden, nachdem der untere Elektrodenfilm 12, der dielektrische Film 13 und der obere Elektrodenfilm 14 ausgebildet sind. Mit anderen Worten, kann der Kondensator gemäß der vorliegenden Erfindung nicht mit einem Träger versehen sein.
-
Für den unteren Elektrodenfilm 12 und den Elektrodenfilm 14 können leitende Filme verwendet werden. Beispielsweise können Metallfilme verwendet werden. Insbesondere können Metallfilme, welche Aluminium, Zink, Kupfer oder dergleichen als Hauptkomponente enthalten, verwendet werden. Es gibt keine besondere Beschränkung hinsichtlich der Dicke der Elektrodenfilme, es können aber beispielsweise Filme mit einer Dicke von 10 nm bis 150 nm und vorzugsweise Filme mit einer Dicke von 20 nm bis 50 nm verwendet werden. Der untere Elektrodenfilm 12 und der obere Elektrodenfilm 14 des Kondensators 10 sind mit jeweiligen elektrischen Schaltungen verbunden. Die Elektrodenfilme können mit den elektrischen Schaltungen beispielsweise durch Löten, Metallsprühung, Klemmen oder dergleichen verbunden sein.
-
Der dielektrische Film 13 ist ein Harzfilm, welcher durch Ausbilden eines dünnen Filmes, der wenigstens einen Typ Monomer enthält, und dann Polymerisierung des Monomers in einen dünnen Film, gebildet wird. Das Monomer weist eine Molekülstruktur auf, in welcher Schwefel und ein aromatischer Ring kovalent gebunden sind, oder eine Molekülstruktur, in welcher Schwefel und ein aromatischer Ring über eine Alkylengruppe verbunden sind. Der dünne Film kann einen Typ Monomer oder eine Vielzahl von Monomertypen enthalten.
-
Ein dünner Film 13a (siehe 2B), welcher durch Polymerisationsreaktion in den dielektrischen Film 13 übergeführt wird, kann des Weiteren ein Additiv zusätzlich zum Monomer enthalten. Beispiele der Additive umfassen Polymerisationsinitiatoren, Antioxidantien, Weichmacher, Tenside und Adhäsionsverbesserer. Als ein Polymerisationsinitiator können beispielsweise 2-Benzyl-2-dimethylamino-1-(4-morpholinphenyl)-butanon-1, Bis(2,4,6-trimethylbenzoyl)-phenylphosphinoxid, 2-Methyl-1[4-(methylthio)phenyl]-2-morpholinpropan-1-on (Irgacure 369, 819 und 907, hergestellt von Ciba Specialty Chemicals) verwendet werden. Als ein Antioxidationsmittel können beispielsweise Octadecyl-3-(3,5-di-tert.-buty1-4-hydroxyphenyl)propionat, Benzolpropancarbonsäure, 3,5-Bis(1,1-dimethylethyl)-4-hydroxy-C7 bis C9-Seitenkettenalkylester, 4,6-Bis(octylthiomethyl)-ocresol (IRGANOX-1076, 1135 und 1520L, hergestellt von Ciba Specialty Chemicals) verwendet werden.
-
In dem Fall, in dem der dünne Film 13a einen Polymerisationsinitiator enthält, beträgt der Gehalt des Polymerisationsinitiators vorzugsweise 0,5 Gew.-% (Masse-%) bis 10 Gew.-% und bevorzugter 1 Gew.-% bis 3 Gew.-% Beträgt der Gehalt an Polymerisationsinitiator 0,5 Gew.-% oder mehr, kann die Aushärtungsgeschwindigkeit des dünnen Filmes 13a erhöht werden. Wenn der Gehalt des Polymerisationsinitiators 10 Gew.-% oder weniger beträgt, kann verhindert werden, dass die Standzeit des Monomers 31 (siehe 3) zu kurz ist. Wenn der Gehalt des Polymerisationsinitiators 1 Gew.-% bis 3 Gew.-% beträgt, kann die Aushärtungsgeschwindigkeit erhöht werden und es kann verhindert werden, dass die Standzeit des Monomers 31 zu kurz ist, und demgemäß kann der Kondensator 10 leicht hergestellt werden.
-
In dem Fall, in dem der dünne Film 13a ein Antioxidationsmittel enthält, beträgt der Gehalt des Antioxidationsmittels vorzugsweise 0,1 Gew.-% bis 10 Gew.-% und bevorzugter 0,5 Gew.-% bis 5 Gew.-%. Ist der Gehalt an Antioxidationsmittel 0,1 Gew.-% oder mehr, kann verhindert werden, dass der dielektrische Film 13 oxidiert. Wenn der Gehalt an Antioxidationsmittel 10 Gew.-% oder weniger beträgt, kann die Aushärtungszeit des dünnen Films 13a einen praktischen Wert annehmen. Beträgt der Gehalt an Antioxidationsmittel 0,5 Gew.-% oder mehr, kann verhindert werden, dass der dielektrische Film 13 deutlich oxidiert wird. Wenn der Gehalt an Antioxidationsmittel 5 Gew.-% oder weniger ist, kann die Aushärtungsrate des dünnen Films 13a einen bevorzugten Wert annehmen.
-
Als in dem dünnen Film
13a enthaltenes Monomer können beispielsweise Monomere, welche durch die allgemeinen Formeln 1 und 4 und die chemischen Formeln 5 und 6 dargestellt sind, verwendet werden.
worin R Wasserstoff oder eine Methylgruppe und n eine ganze Zahl von 1 bis 4 ist.
worin R Wasserstoff oder eine Methylgruppe ist.
-
-
Die Monomere der allgemeinen Formel 1 können durch das in Ausführungsform 2 beschriebene Verfahren hergestellt werden. Die Monomere der allgemeinen Formel 4 können durch ein Verfahren hergestellt werden, wie es unten beschrieben wird. Die Monomere der chemischen Formeln 5 und 6 sind im Handel von Sumitomo Seika Chemicals unter den Produktnamen MPV bzw. MPSMA erhältlich.
-
Für die Monomere der allgemeinen Formel 1 wird es besonders bevorzugt, dass R Wasserstoff und n gleich 2 ist. Der dünne Film 13a kann die Monomere der allgemeinen Formeln 1 und 4 und der chemischen Formeln 5 und 6 in einem willkürlichen Verhältnis enthalten und kann beispielsweise das Monomer der allgemeinen Formel 1 in einem Verhältnis von 50 Gew.-% oder mehr enthalten und des Weiteren das Monomer der allgemeinen Formel 4.
-
Nachfolgend wird ein Verfahren zur Herstellung der Monomere der allgemeinen Formel 4 beschrieben. Zunächst wird ein Zwischenprodukt, dargestellt durch die chemische Formel 7 unten, durch Umsetzen von p-Xyloldichlorid mit 2-Mercaptoethanol in gleicher Weise wie im ersten Verfahren zur Herstellung der Monomere der allgemeinen Formel 1 hergestellt.
-
-
Danach wird dieses Zwischenprodukt mit Methylacrylat oder Methylmethacrylat in gleicher Weise wie im zweiten Verfahren zur Herstellung des Monomers der allgemeinen Formel 1 umgesetzt und demzufolge kann das Monomer der allgemeinen Formel 4 leicht synthetisiert werden.
-
Nachfolgend wird ein Verfahren zur Herstellung des Kondensators 10 beschrieben werden. Die 2A bis 2D zeigen ein Beispiel des Herstellungsverfahrens.
-
Unter Bezugnahme auf 2A wird zunächst der untere Elektrodenfilm 12 auf dem Träger 11 ausgebildet. Der untere Elektrodenfilm 12 kann durch Vakuumverdampfung, wie Elektronenstrahlverdampfung, Widerstandsheizungsverdampfung und Induktionsheizungsverdampfung, Ionen-Metallisierung, Metallisierung oder dergleichen gebildet werden. Um den unteren Elektrodenfilm 12 in eine vorbestimmte Form zu bringen, kann eine Metallmaske, Photolithographie, Ätzen oder andere Techniken verwendet werden.
-
Danach wird, wie in 2B gezeigt ist, der ein Monomer enthaltende dünne Film 13a auf dem unteren Elektrodenfilm 12 gebildet. Der dünne Film 13a ist ein Film, welcher durch Polymerisationsreaktion in den dielektrischen Film 13 umgewandelt wird und enthält die oben beschriebenen Monomere, welche durch die allgemeinen Formeln 1 und 4 und die chemischen Formeln 5 und 6 dargestellt sind, und Additive. Der dünne Film 13a kann ausgebildet werden, indem ein ein Monomer 31 zur Ausbildung des dünnen Films 13a enthaltender Behälter 32 unter Vakuum gesetzt wird, so dass der Behälter 32 dem unteren Elektrodenfilm 12 gegenüber liegt, wie in 3 gezeigt, und indem der Behälter 32 erhitzt wird, um das Monomer zu verdampfen. Eine (nicht gezeigte) Metallmaske kann verwendet werden, um den dünnen Film 13a in eine vorbestimmte Form zu bringen.
-
Dann wird in dem dünnen Film eine Polymerisationreaktion des Monomers verursacht und demzufolge wird der dielektrische Film 13, wie in 2C gezeigt ist, gebildet. Die Polymerisationsreaktion (Aushärtung) kann beispielsweise durch Bestrahlen des dünnen Films 13a mit Ultraviolettstrahlen oder Elektronenstrahlen verursacht werden.
-
Danach kann, wie in 2D gezeigt ist, der obere Elektrodenfilm 14 in gleicher Weise wie der untere Elektrodenfilm 12 gebildet werden. So kann der Kondensator 10 erzeugt werden. Der Kondensator 10a kann durch dasselbe Herstellungsverfahren hergestellt werden.
-
Bei dem Kondensator gemäß Ausführungsform 3 wird der dielektrische Film 13 kaum in seinen Eigenschaften sogar unter hoher Feuchtigkeit oder hohem Druck verändert und demzufolge kann ein Kondensator erhalten werden, welcher ausgezeichnete Charakteristika sogar unter hoher Feuchtigkeit und hoher Temperatur aufweist.
-
Ausführungsform 4
-
In Ausführungsform 4 wird ein weiterer Kondensator als eine elektronische Komponente der vorliegenden Erfindung beschrieben. 4A ist eine Querschnittsansicht eines Kondensators 40 der Ausführungsform 4 und 4B ist eine perspektivische Ansicht davon. Gleiche Aspekte, wie sie in Ausführungsform 3 beschrieben worden sind, werden nicht weiter beschrieben werden.
-
Bezugnehmend auf die 4A und 4B umfasst der Kondensator 40 einen dielektrischen Film 41 (Schraffierung weggelassen), eine Vielzahl von Elektroden 42a, die auf dem dielektrischen Film 41 angeordnet sind, den Elektroden 42a gegenüber liegende Elektroden 42b und externe Elektroden 43a und 43b, welche mit den Elektroden 42a bzw. 42b verbunden sind. Mit anderen Worten umfasst der Kondensator 40 wenigstens ein Paar von Elektroden, die einander gegenüber liegen, wobei wenigstens ein Teil des dielektrischen Filmes 41 dazwischen angeordnet ist. Der Kondensator 40 umfasst des Weiteren metallische dünne Filme 44, welche an den äußeren Seiten der Elektroden 42a und 42b angeordnet sind. Der Teil des Kondensators 40, in welchem die Vielzahl der Elektroden 42a und der Elektroden 42b, welche den Elektroden 42a gegenüber liegen, vorhanden sind, dient als eine Elementschicht 40a. Die Teile des Kondensators 40, in welchen die metallischen dünnen Filme 44 ausgebildet sind, dienen als Verstärkungsschichten 40b. Die Teile des Kondensators 40, welche nur durch den dielektrischen Film 41 gebildet sind, dienen als Schutzschichten 40c. Die Verstärkungsschichten 40b und die Schutzschichten 40c sind Schichten, welche verhindern, dass die Elementschicht 40a durch thermische Belastung oder äußere Kräfte verletzt wird. Es ist möglich, dass die Verstärkungsschichten 40b oder die Schutzschichten 40c nicht in dem Kondensator 40 vorgesehen sind.
-
Der dielektrische Film 41 ist der gleiche Film wie der dielektrische Film 13, der in Ausführungsform 3 beschrieben ist, und kann durch das gleiche Verfahren wie oben hergestellt werden.
-
Der Kondensator 40 kann durch das in Ausführungsform 3 beschriebene Verfahren erzeugt werden. Das Verfahren zur Herstellung des Kondensators 40 ist jedoch verschieden von dem in Ausführungsform 3 beschriebenen Verfahren, indem es erforderlich ist, dass die dielektrischen Filme und die Elektroden 42a oder 42b alternierend laminiert werden und die externen Elektroden 43a und 43b bei dem Verfahren zur Herstellung des Kondensators 40 gebildet werden. Die externen Elektroden 43a und 43b können beispielsweise durch Metallsprühen, Ausbilden von Bumpelektroden, Auftragen leitfähiger Paste oder anderen Techniken ausgebildet werden.
-
Bei dem Kondensator 40 der Ausführungsform 4 wird der dielektrische Film 41 sogar unter hoher Feuchtigkeit oder hoher Temperatur kaum in seinen Eigenschaften verändert und demzufolge kann ein Kondensator mit ausgezeichneten Charakteristiken sogar unter hoher Feuchtigkeit oder hoher Temperatur erhalten werden.
-
Beispiele
-
Nachfolgend wird die vorliegende Erfindung spezieller mit Hilfe von Beispielen beschrieben.
-
Beispiel 1
-
In Beispiel 1 wird ein Beispiel zur Herstellung eines Monomers, das ein durch die allgemeine Formel 1 dargestelltes Bis(4-mercaptophenyl)sulfidderivat ist, wobei R Wasserstoff und n gleich 2 ist, beschrieben werden. Auch wird ein Beispiel der Herstellung eines Monomers, das ein durch die allgemeine Formel 1 dargestelltes Bis(4-mercaptophenyl)sulfidderivat ist, wobei R eine Methylgruppe und n gleich 4 ist, beschrieben.
-
Zunächst werden 25,0 g (0,10 mol) des durch die chemische Formel 2 dargestellten Bis(4-mercaptophenyl)sulfids, 16,1 g (0,20 mol) 2-Chlorethanol, 27,6 g (0,20 mol) Kaliumcarbonat und 300 ml Methylisobutylketon in einen 1 l-Kolben gebracht und bei kontinuierlichem Rühren 6 Stunden am Rückfluss gehalten. Nach Beendigung der Reaktion wurden 50 ml einer. 5-prozentigen Salzsäurelösung nach und nach der erhaltenen Lösung unter Rühren zugegeben. Danach wurden 300 ml Toluol zugefügt. Die so erhaltene Lösung wurde wiederholt mit destilliertem Wasser gewaschen, bis der pH-Wert von 7 erreicht war. Dann wurde die gewaschene Lösung mit wasserfreiem Natriumsulfat getrocknet und das Lösungsmittel wurde durch Destillation entfernt. So wurde das durch die chemische Formel 8 unten dargestellte Zwischenprodukt in einer Menge von 32 g erhalten.
-
-
Dann wurden 320 g Methylacrylat, 0,32 g Tetrabutyltitanat (1/100 Gewichtsteile bezüglich des Zwischenproduktes) und 0,16 g p-Methoxyphenol (5/1000 Gewichtsteile bezüglich des Zwischenproduktes) als Polymerisationsinhibitor zu 32 g des Zwischenproduktes, das durch die chemische Formel 8 dargestellt ist, zugegeben und dann 10 Stunden unter Rückfluss gehalten, wonach das Methylacrylat durch Destillation entfernt wurde. Das so erhaltene Reaktionsprodukt wurde in 300 ml Toluol aufgelöst und dann wurde diese Lösung nacheinander zunächst mit 20 ml 5-%iger Natriumhydroxidlösung und dann mit 50 ml 5-%iger Salzsäurelösung gewaschen. Des Weiteren wurde die Lösung mit destilliertem Wasser gewaschen, bis der pH-Wert von 7 erreicht war und dann mit wasserfreiem Natriumsulfat getrocknet. Dieser Lösung wurden 0,16 g p-Methoxyphenol zugegeben und danach wurde das Lösungsmittel durch Destillation entfernt. So wurde ein Halb-Feststoff mit einem Schmelzpunkt von 20°C erhalten. Der Halb-Feststoff wurde durch Infrarotspektroskopieanalyse und Gelpermeationschromatographie gemessen.
-
5 zeigt die Ergebnisse der Messungen durch Infrarotspektroskopieanalyse. Wie aus 5 gesehen wird, wurde ein Absorptionspeak bei 1725 cm–1, basierend auf dem Esteracrylat, beobachtet. Im GPC wurde das Ausgangsmaterial, das Zwischenprodukt und die Nebenprodukte nicht festgestellt. Aus den oben beschriebenen Aspekten zeigte sich, dass der am Ende erhaltene Halb-Feststoff Bis(4-acryloyloxyethylenthiophenyl)sulfid, dargestellt durch die chemische Formel 9 unten, ist.
-
-
Nun wird ein Beispiel der Herstellung von Bis(4-methacryloyloxybutylenthiophenyl)sulfid beschrieben werden, das ist eine durch die allgemeine Formel 1 dargestellte organische Verbindung, wobei R eine Methylgruppe und n gleich 4 ist.
-
In diesem Falle kann das gleiche Verfahren wie das zur Herstellung des Bis(4-acryloyloxyethylenthiophenyl)sulfids, dargestellt durch die chemische Formel 9, verwendet werden, mit der Ausnahme, dass ein verschiedenes Ausgangsmaterial verwendet wird. Genauer gesagt wurde 2-Chlorethanol durch 4-Chlor-1-butanol und Methylacrylat durch Methylmethacrylat ersetzt. So wurde Bis(4-methacryloyloxybutylenthiophenyl)sulfid, dargestellt durch die chemische Formel 10, erhalten.
-
-
Beispiel 2
-
In Beispiel 2 wird ein Beispiel der Herstellung eines Monomers, das durch die allgemeine Formel 4 dargestellt ist, wobei R eine Methylgruppe ist, beschrieben werden.
-
Zunächst werden 17,5 g (0,10 mol) p-Xyloldichlorid, 15,6 g (0,20 mol) 2-Mercaptoethanol, 27,6 g (0,20 mol) Kaliumcarbonat und 300 ml Methylisobutylketon in einem 1 l-Kolben vorgelegt und unter kontinuierlichem Rühren unter Rückfluss 6 Stunden umgesetzt. Nach Beendigung der Umsetzung wurde die erhaltene Lösung in gleicher Weise wie in Beispiel 1 behandelt und demgemäß wurde das Zwischenprodukt, dargestellt durch die chemische Formel 7 unten, in einer Menge von 23 g erhalten.
-
-
Dann wurden 230 g Methylacrylat, 0,23 g Tetrabutyltitanat (1/100 Gewichtsteile bezüglich des Zwischenproduktes) und 0,12 g p-Methoxyphenol (5/1000 Gewichtsteile bezüglich des Zwischenproduktes) als Polymerisationsinhibitor zu 23 g des Zwischenproduktes, das durch die chemische Formel 7 dargestellt ist, zugegeben und dann 10 Stunden unter Rückfluss gehalten und Methylacrylat wurde durch Destillation entfernt. Das so erhaltene Reaktionsprodukt wurde in gleicher Weise wie in Beispiel 1 behandelt und so wurde eine transparente hellgelbe Flüssigkeit erhalten. Diese Flüssigkeit wurde durch Infrarotspektroskopieanalyse und GPC vermessen.
-
6 zeigt die Ergebnisse der Messung durch Infrarotspektroskopieanalyse. Wie aus 6 gesehen werden kann, wurde ein Absorptionspeak bei 1725 cm–1, basierend auf Methacrylatester, beobachtet. Im GPC wurden das Ausgangsmaterial, das Zwischenprodukt und die Nebenprodukte nicht beobachtet. Aus den oben beschriebenen Aspekten zeigt sich, dass die am Ende erhaltene Flüssigkeit 1,4-Bis(methacryloyloxyethylenthiomethyl)benzol, dargestellt durch die chemische Formel 11 unten, ist.
-
-
Das Monomer der allgemeinen Formel 1 mit R gleich Wasserstoff kann durch das gleiche Verfahren, das oben beschrieben ist, hergestellt werden, mit der Ausnahme, dass Methylacrylat anstelle von Methylmethacrylat mit dem durch die chemische Formel 7 dargestellten Zwischenprodukt umgesetzt wird.
-
Beispiel 3
-
In Beispiel 3 wird ein Beispiel der Herstellung des in 1A als elektronische Komponente der vorliegenden Erfindung gezeigten Kondensators in Bezugnahme auf die 2A bis 2D beschrieben.
-
Zunächst wurde ein PET-Substrat 11 mit einer Dicke von 25 μm hergestellt und der untere Elektrodenfilm 12 (30 nm dick) aus Aluminium wurde auf dem PET-Substrat 11 durch Verdampfen in einer Abscheidungsrate von 100 nm/sek (siehe 2A) abgeschieden.
-
Danach wurde der dünne Film 13a (200 nm dick) aus dem Monomer auf dem unteren Elektrodenfilm 12 durch Verdampfen des Monomers ausgebildet (siehe 2B). Genauer gesagt wurde der das Monomer 31 enthaltende Behälter 32, wie in 3 gezeigt ist, so erhitzt, dass die Abscheidungsrate 500 nm/sek betrug und der dünne Film 13a wurde so ausgebildet, dass ein Teil des unteren Elektrodenfilms 12 freigelegt blieb.
-
Danach wurde der dünne Film mit beschleunigten Elektronen bei –15 kV bei einer Dichte von 50 μA/cm2 2 Sekunden lang bestrahlt, um das Monomer in dem dünnen Film zu polymerisieren und so wurde der dielektrische Film 13 ausgebildet (siehe 2C).
-
Danach wurde der obere Elektrodenfilm 14 aus Aluminium durch Verdampfen bei einer Abscheidungsrate von 100 nm/sek an einer Stelle ausgebildet, die über dem dielektrischen Film 13 liegt und nicht mit dem unteren Elektrodenfilm 12 in Kontakt steht (siehe 2D).
-
In Beispiel 3 wurden fünf verschiedene Kondensatoren hergestellt, indem das Monomer der chemischen Formel 9, das Monomer der chemischen Formel 4, das Monomer der chemischen Formel 11, enthaltend 3 Gew.-% IRGANOX 1520L als Antioxidationsmittel, das Monomer der chemischen Formel 5 und das Monomer der chemischen Formel 6 verwendet wurden. Demzufolge wurden Arbeitsproben 1 bis 5 erhalten.
-
Des Weiteren wurden als Vergleichsbeispiele zwei Typen von Kondensatoren (Vergleichsbeispiele 1 und 2) hergestellt, unter Verwendung von Monomeren, die durch die chemischen Formeln A und B dargestellt sind.
-
-
Hinsichtlich der oben beschriebenen sieben Typen von Kondensatoren wurde (i) eine Feuchtigkeitsabsorption-Kapazitätänderungsverhältnis und (ii) ein Hochtemperaturbelastung-Kapazitätänderungsverhältnis gemessen. Für die Kondensatoren, welche mit den Monomeren der chemischen Formeln 9, A und B hergestellt worden waren, wurden die Änderungen in der Dicke beim Eintauchen der Kondensatoren in heißes Wasser untersucht. Das Bewertungsverfahren wird später beschrieben werden. Tabelle 1 zeigt die Bewertungsergebnisse. Tabelle 1
| | Monomer | Antioxidationsmittel | Feuchtigkeitsabsorption-Kapazitätänderungsverhältnis (%) | Hochtemperaturbelastung-Kapazität-Änderungsverhältnis | Änderung der Dicke |
| Arbeitsprobe 1 | chemische Formel 9 | keines | +5,5 | –1% bis 0% | keine |
| Arbeitsprobe 2 | chemische Formel 11 | keines | +7,0 | –2% | - |
| Arbeitsprobe 3 | chemische Formel 11 | 3 Gew.-% | +7,0 | –1% bis 0% | - |
| Arbeitsprobe 4 | chemische Formel 5 | keines | +1,0 | –1% bis 0% | - |
| Arbeitsprobe 5 | chemische Formel 6 | keines | +6,4 | –1% bis 0% | - |
| Vergl.probe 1 | chemische Formel A | keines | +18 | –5% | 200% bis 300% |
| Vergl.probe 2 | chemische Formel B | keines | +8,0 | ≦–10% | 200% bis 300% |
-
Wie aus Tabelle 1 gesehen werden kann, zeigen die Kondensatoren der Arbeitsproben 1 bis 5 bessere Charakteristika als jene der Kondensatoren der Vergleichsproben 1 und 2 bei Bewertung sowohl des Feuchtigkeitsabsorption-Kapazitätänderungsverhältnisses als auch des Hochtemperaturbelastung-Kapazitätänderungsverhältnisses. Genauer gesagt wurden Kondensatoren mit ausgezeichneten Charakteristika sogar bei hoher Feuchtigkeit und hoher Temperatur durch Ausbilden dielektrischer Filme der Kondensatoren mit Monomeren erhalten, welche eine Molekülstruktur, in der Schwefel und ein aromatischer Ring kovalent gebunden sind oder eine Molekülstruktur, in der Schwefel und ein aromatischer Ring über eine Alkylengruppe verbunden sind, aufweisen.
-
Nachfolgend wird das Bewertungsverfahren der in Tabelle 1 gezeigten Charakteristika genauer beschrieben werden.
- (i) Das Feuchtigkeitsabsorptionskapazität-Änderungsverhältnis wurde auf folgende Weise bewertet. Zunächst wurde ein Kondensator in einer 105°C Atmosphäre 10 Stunden getrocknet und die Anfangskapazität C11 wurde gemessen. Die Kapazität wurde gemessen, während eine Sinuswelle mit einer Frequenz von 1 kHz und eine Spannung von 1 Vrms auf den Kondensator angelegt wurde. Danach wurde der Kondensator in einer Atmosphäre bei einer Temperatur von 60°C und einer relativen Feuchtigkeit von 95% 100 Stunden gelagert. Dann wurde die Kapazität C12 nach der Lagerung (die Kapazität, wenn der Kondensator Feuchtigkeit absorbierte) und den gleichen Bedingungen wie für die Anfangskapazität gemessen. Das Feuchtigkeitsabsorption-Kapazitätänderungsverhältnis ist ein Wert, der durch (C12 – C11)/C11 × 100(%) dargestellt ist. Je kleiner das Feuchtigkeitsabsorption-Kapazitätänderungsverhältnis ist, desto höher ist die Kapazitätsstabilität in einer feuchten Atmosphäre und solche Kondensatoren mit einem kleinen Änderungsverhältnis werden als Produkt bevorzugt. Daher ist es besonders wichtig, dass das Feuchtigkeitsabsorption-Kapazitätänderungsverhältnis so klein wie möglich ist.
- (ii) Das Hochtemperaturbelastung-Kapazitätänderungsverhältnis wurde auf folgende Weise bewertet. Zunächst wurde ein Kondensator in einer 105°C Atmosphäre 10 Stunden getrocknet und die Anfangskapazität C21 wurde gemessen. Die Kapazität wurde gemessen, während eine Sinuswelle mit einer Frequenz 1 kHz und eine Spannung von 1 Vrms an den Kondensator angelegt wurden. Danach wurde der Kondensator 50.000 Stunden in einer Atmosphäre bei einer Temperatur von 105°C gelagert, während eine Spannung von 16 V angewendet wurde. Dann wurde die Kapazität C22 nach der Lagerung unter den gleichen Bedingungen wie für die Anfangskapazität gemessen. Das Hochtemperaturbelastung-Kapazitätänderungsverhältnis ist ein Wert, der durch (C22 – C21)/C21 × 100(%) dargestellt ist. Ein Kondensator mit einem kleinen absoluten Wert des Hochtemperaturbelastung-Kapazitätänderungsverhältnisses wird weniger wahrscheinlich bei hohen Temperaturen oxidiert und ein solcher Kondensator ist ein bevorzugtes Produkt. Insbesondere wurde in den vergangenen Jahren die Hochtemperaturresistenz elektronischer Komponenten wichtig, da CPUs bei hoher Geschwindigkeit betrieben werden. Daher ist die Niedrigkeit des absoluten Wertes des Hochtemperaturbelastung-Kapazitätänderungsverhältnisses eine wichtige Anzeige bei der Bewertung von Kondensatoren.
- (iii) Die Änderung der Dicke beim Eintauchen der Kondensatoren in heißes Wasser wurde auf folgende Weise gemessen. Zunächst wurde die Dicke eines Kondensators gemessen. Dann wurde der Kondensator in heißes Wasser von 90°C für 3,5 Stunden eingetaucht. Danach wurde der Kondensator aus dem heißen Wasser herausgenommen und die Dicke wurde erneut gemessen. Danach wurden die Dicken vor und nach dem Eintauchen in heißes Wasser verglichen. Je größer die Änderung der Dicke ist, desto mehr Feuchtigkeit absorbiert der dielektrische Film und die Haftung bzw. Adhäsion zwischen dem dielektrischen Film und dem Elektrodenfilm aus Metall wird herabgesetzt. Daher weist ein Kondensator mit einer geringen Änderung der Dicke eine höhere Haftung zwischen dem dielektrischen Film und dem Elektrodenfilm auf, so dass ein solcher Kondensator ein bevorzugtes Produkt ist.
-
Des Weiteren wurde der (dielektrische) Verlusttangens (tanδ) hinsichtlich jeder Probe bewertet und die Ergebnisse waren so, dass die Kondensatoren der Arbeitsproben 1 bis 5 Charakteristika zeigten, die gleich jenen der Vergleichsproben 1 und 2 sind, oder sogar bessere Charakteristika. Der (dielektrische) Verlusttangens (tanδ) wurde gemessen, während eine Sinuswelle mit einer Frequenz von 1 kHz und eine Spannung von 1 Vrms auf den Kondensator angewendet wurde. Je kleiner der (dielektrische) Verlusttangens ist, desto kleiner ist die durch den Kondensator selbst verbrauchte Energie, so dass ein solcher Kondensator mit einem kleinen (dielektrischen) Verlusttangens ein bevorzugtes Produkt ist.
-
Bei den oben beschriebenen Ausführungsformen und Beispielen wurde der Fall beschrieben, in dem die elektronische Komponente der vorliegenden Erfindung ein Kondensator ist. Jedoch ist die elektronische Komponente der vorliegenden Erfindung nicht darauf beschränkt und jede elektronische Komponente kann verwendet werden, solange der in den obigen Ausführungsformen beschriebene dielektrische Film vorgesehen ist. Genauer gesagt kann die vorliegende Erfindung beispielsweise für Spulen, Resistoren, kapazitive Zellen, Trägerelemente anderer elektronischer Komponenten oder dergleichen verwendet werden.
-
Die Ausführungsformen der vorliegenden Erfindung wurden oben im Wege von Beispielen beschrieben. Jedoch ist die vorliegenden Erfindung nicht auf die oben beschriebenen Ausführungsformen beschränkt und kann auf weitere Ausführungsformen, die auf dem technischen Gedanken der vorliegenden Erfindung basieren, angewendet werden.
-
Gewerbliche Anwendbarkeit
-
Wie oben beschrieben worden ist, liefert die vorliegende Erfindung elektronische Komponenten, umfassend einen dielektrischen Film, enthaltend Bis(4-mercaptophenyl)sulfidderivate, dargestellt durch die allgemeine Formel 1. Die Bis(4-mercaptophenyl)sulfidderivate, dargestellt durch die allgemeine Formel 1, sind für elektronische Komponenten, wie Kondensatoren, Spulen, Resistoren, kapazitive Zellen, Trägerelemente anderer elektronischer Komponenten oder dergleichen nützlich. Wird ein dielektrischer Film unter Verwendung der Bis(4-mercaptophenyl)sulfidderivate gebildet und in einer elektronischen Komponente verwendet, kann die elektronische Komponente ausgezeichnete Charakteristika, sogar bei hoher Feuchtigkeit und hoher Temperatur, aufweisen.
-
Das angegebene Verfahren zur Herstellung von Bis(4-mercaptophenyl)sulfidderivaten macht es möglich, die Bis(4-mercaptophenyl)sulfidderivate, dargestellt durch die allgemeine Formel 1, leicht herzustellen.
-
Darüber hinaus kann gemäß der elektronischen Komponente der vorliegenden Erfindung eine elektronische Komponente mit ausgezeichneten Eigenschaften, sogar bei hoher Feuchtigkeit und hoher Temperatur, erhalten werden. Insbesondere kann ein hochqualitativer Kondensator mit reduzierten Änderungen der Charakteristika infolge der Umwelt, durch Anwenden der vorliegenden Erfindung für den Kondensator erhalten werden.