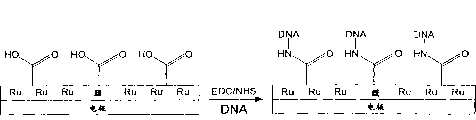CN1165629C - 电聚合膜、其制备方法及用途 - Google Patents
电聚合膜、其制备方法及用途 Download PDFInfo
- Publication number
- CN1165629C CN1165629C CNB008047057A CN00804705A CN1165629C CN 1165629 C CN1165629 C CN 1165629C CN B008047057 A CNB008047057 A CN B008047057A CN 00804705 A CN00804705 A CN 00804705A CN 1165629 C CN1165629 C CN 1165629C
- Authority
- CN
- China
- Prior art keywords
- electrode
- vbpy
- poly
- nucleic acid
- oxidation
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6816—Hybridisation assays characterised by the detection means
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y15/00—Nanotechnology for interacting, sensing or actuating, e.g. quantum dots as markers in protein assays or molecular motors
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y30/00—Nanotechnology for materials or surface science, e.g. nanocomposites
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6816—Hybridisation assays characterised by the detection means
- C12Q1/6825—Nucleic acid detection involving sensors
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S435/00—Chemistry: molecular biology and microbiology
- Y10S435/81—Packaged device or kit
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S435/00—Chemistry: molecular biology and microbiology
- Y10S435/817—Enzyme or microbe electrode
Abstract
一种电极和通过在电极的导电工作表面电聚合一种膜而制备这种电极的方法。通过还原性电聚合聚[Ru(vbpy)3 2+/vba]薄膜而修饰此电极(vbpy=4-乙烯基-4’甲基-2,2’-二吡啶,vba=对-乙烯基苯甲酸),此电极可用于电化学检测GMP、聚[G]水溶液以及表面固定化的单链DNA探针。这种膜是由介体如Ru(vbpy)3 2+与具有羧化物基团如对-乙烯基苯甲酸的功能化部分的共聚合物构成。DNA探针共价附着于这些含有鸟嘌呤的部分,可观察到由于催化氧化鸟嘌呤,Ru3+/2+对(存在于聚合薄膜中)的氧化电流非常显著地增加。
Description
发明背景
发明领域
本发明是关于用于检测核酸杂交的电极,以及制备和应用这种电极的方法。
对相关技术的论述
表面修饰技术的最新进展已促使形成了生物检测技术的许多新方法,特别是与先进的荧光检测技术相结合,例如,基因表达分析(Schena,M等,科学1995,270,467),在高密度阵列上对基因组DNA的测序(Chee,M.等,科学,1996,274,610),以及检测核酸以便鉴定感染的微生物(Spargo,C.A.等分子和细胞探针1993,7,395;Martin,W.J.聚合酶链式反应,Mullis,K.B.,Ferre,F.,Gibbs,R.A,编著,1994,406-417,Berkhauser,Boston),它们同基于预先培养或免疫测定的方法相比较具有优越的选择性和灵敏度。在此所涉及的每个专利和出版物,其公开内容均被引入作为参考。尽管这些系统表现出显著的进步,但它们仍包括繁多的处理步骤,并需要使用昂贵的荧光显微镜。
核酸的电化学检测法提供了代替荧光生物检测术的另一种选择,它有可能不需要作标记(Johnston,D.H.等,金属离子生物系统,1996,33,297;Johnston,D.H.,Cheng,C.C.等,无机化学,1994,33,6388;Steenken,S.等,美国化学学会杂志1997,119,617;Johnston,D.H.等,美国化学学会杂志1995,117,8933;和Johnston,D.H.等,物理化学杂志1996,100,13837)。
在此本发明是利用如下发现:聚合DNA的鸟嘌呤核碱基可产生一个适合于超灵敏检测的氧化还原活性标记阵列,与超微电极法相结合可提供一种方法,用于在PCR扩增之前检测许多生理学相关的核酸。对阵列引入单个微电极使之能够形成具有高密度、多重传感器阵列的低费用快速检测装置。
在溶液中通过使用Ru(bpy)3 2+作介体催化氧化鸟嘌呤碱基可以检测核酸(Johnston,D.H.等,金属离子生物系统,1996,33,297;Johnston,D.H.等,美国化学学会杂志1995,117,8933;和Johnston,D.H.等,物理化学杂志,1996,100,13837)。在溶液中Ru(bpy)3 2+表现为具有1.05V的可逆性氧化还原对状态,此电位与对鸟嘌呤观察的氧化电位相似。将会有鸟嘌呤的DNA加入到Ru(bpy)3 2+溶液中,导致按照二步骤机制催化增加氧化电流:
在此DNAox代表其中的鸟嘌呤已经历过一个电子氧化的DNA分子。
如在Thorp等的专利(美国专利5,871,918)中所述,可将杂交的DNA固定化在固体支持物上,然后通过将氧化剂固定化在同一固体支持物上,并在足以使此氧化剂与预定的碱基发生氧化-还原反应的条件下将此固体支持物浸入溶液中,使此氧化剂与杂交的DNA发生反应。
如在Thorp等的专利(美国专利5,871,918)中所述,其中DNA被固定化在聚(对苯二酸-乙二醇)或PET膜上、DNA探针直接附着于氧化铟-锡电极的补充方案被用于检测互补DNA,具有作为PCRamplicon生物检测法的用途(Napier,M.E.等,Lahgmuir 1997,13,6342;Napier,M.E.等,H.H.生物共轭化学1997,8,906)。以前的许多探索大体上主要集中在二方面:1)含有DNA溶液的溶解介体和2)含有固定化DNA的溶解介体。
电化学共聚合已被用于制备基体。例如,借助于对吡咯和带有吡咯基团的寡核苷酸的定向电化学共聚合使用,已将DNA基体制备在电极表面,与对寡核苷酸的放射性标记一道用于杂交检测(Livache,T.等,核酸研究1994,22,2915;Roget,A.等核苷和核苷酸1995,14,943)。还应用带有寡核苷酸探针的功能化的电活性聚吡咯设计了生物传感器(Korri-Youssoufi,H.等美国化学学会杂志1997,119,7388)。
虽然Livache和Roget使用了放射活性标记物以使检测附着于电聚合膜上的DNA,而Korri-Youssoufi监测该膜本身的电位以便间接地检测DNA杂交作用,但是,在此本发明通过来自鸟嘌呤的法拉第感应电流,能够直接检测附着于电聚合膜上的DNA。因此,Korri-Youssoufi的方法是电位测定法,而本方法是电流测定法。在此所述的聚合物,为电子从核酸向用于检测法拉第感应电流的电极转移提供了一个催化剂,这种电流太缓慢,如果没有固相化的介体则不能提供实用的信号。此外,本发明的膜在0-0.9V的范围内是电化学惰性的,而以前的聚吡咯膜在此范围内是活性的。
Yachynych的专利(美国专利号5,540,828)提供了一种方法,通过氧化电聚合制备蛋白质识别电极。与Yachynych不同,在此本发明是用于核酸,本发明在聚合过程中是通过还原而不是氧化来形成聚合物,本发明在此应用含乙烯基的聚合物,使用的金属复合物既是电聚合的起始物又是固相化的介体。
因此本发明的一个目标是提供表面修饰电极,用于检测在接近对DNA或RNA中鸟嘌呤或其它预定碱基所观察到的电位下发生的电子转移事件。
本发明的另一目标是固定化一个介体即Ru2+中心,用于电化学检测存在于溶液中和固相化物质表面的鸟嘌呤碱基。
本发明的再一个目标是应用电聚合作用产生以探针修饰的电极,这种探针当与含有较大量预定碱基的靶标杂交时可给出较大的氧化电流。
本发明还有一个目标是提供一种作用剂,它既作为电聚合的起始物又作为氧化预定碱基的介体。
从下面的公开内容和所附权利要求将更充分地明了本发明的其它目标和优点。
发明概述
本发明在此应用一种被修饰的金属复合物,以致可在规定的环境条件下发生聚合作用,并且本发明包括一种电极以及在电极导电的工作表面通过电聚合一种膜而制备电极的方法。通过还原性电聚合聚[Ru(vbpy)3 2+]或聚[Ru(vbpy)3 2+/vba]薄膜而对电极进行修饰(vbpy=4-乙烯基-4′甲基-2,2′-二吡啶,vba=对-乙烯基苯甲酸),此电极被用于电化学检测GMP、聚[G]水溶液表面固定化的单链DNA探针,以及杂交的DNA或RNA靶标。从介体如Ru(vbpy)3 2+与具有羧化物基团如对-乙烯苯甲酸的功能化部分的共聚物形成这种膜。借助于碳化二亚胺反应并随后酰胺化氨基连接的单链DNA,使DNA探针共价地附着于羧化物基团。在有这些含鸟嘌呤的部分存在的情况下,由于催化氧化鸟嘌呤,观察到Ru3+/2+偶连物(存在于聚合物薄膜中)的氧化电流惊人地增加。
从下面的公开内容和所附权利要求,将能更充分地明了本发明的其它目标和特征。
附图简述
图1A和1B是显示(A)聚[Ru(vbpy)3 2+]和(B)5∶1聚[Ru(vbpy)3 2+/vba],从含有0.1M TBAH的乙腈溶液中电聚合在玻璃碳电极(GCE)上的循环伏安曲线(扫描速度,100mV/s,Ag/AgNO3参比电极)。溶液中Ru(vbpy)3 2+的溶液是0.2mM。
图2是显示鸟苷-磷酸(GMP)氧化过程的循环伏安曲线,使用(A)未修饰的GCE以及在(B)不存在和(C)存在GMP的情况下使用聚[Ru(vbpy)3 2+]膜修饰的GCE(扫描速度50mV/s,Ag/AgCl参比电极,50mM,pH7.0的磷酸缓冲液)。
图3A显示对聚[Ru(vbpy)3 2+]膜修饰GCE的第一次和第二次氧化扫描,图3B显示在有GMP存在时对聚[Ru(vbpy)3 2+]膜修饰GCE的第一次和第二次氧化扫描(扫描速度50mV/s,Ag/AgCl参比电极,50mM,pH7.0的磷酸缓冲液)。
图4是显示聚[G]氧化过程的循环伏安曲线,使用(A)未修饰的GCE以及在(B)不存在和(C)存在聚[G]的情况下使用聚[Ru(vbpy)3 2+]修饰的GCE(扫描速度50mV/s,Ag/AgCl参比电极,50mM,pH7.0的磷酸缓冲液)。
图5是带有固定化CpFe(C5H4-NH2)的5∶1聚[Ru(vbpy)3 2+]膜修饰GCE的循环伏安曲线(扫描速度50mV/s,Ag/AgNO3参比电极,0.2mMRu2+,0.1M TBAH溶液)。
图6显示(A)带有在pH6.5固定化的20-聚体聚[dG]的5∶1聚[Ru(vbpy)3 2+/vba]膜修饰GCE的循环伏安曲线,以及(B)带有在pH9.0固定化的20-聚体聚[dG]的5∶1聚[Ru(vbpy)3 2+/vba]膜修饰GCE的循环伏安曲线,(扫描速度50mV/s,Ag/AgCl参比电极,50mM,pH7.0磷酸缓冲液)。
图7为示意图1,显示在电聚合时共聚物的形成。
图8为示意图2,显示出将氨基连接的DNA探针固定化在电极的表面。
发明详述及优选实施方案
在此本发明是关于一种制备电聚合膜的方法以及所形成的膜和它的用途。
概括地说,制备在其上面具有本发明电聚膜的电极的方法包括:
(a)将一种膜电聚合在电极上,该膜包含一种金属复合物与具有羧化物基团的功能化部分的共聚合物,此金属复合物既作为电聚合的起始物又作为电子转移的介体;
(b)借助于碳化二亚胺反应并随后酰胺化氨基连接的单链DNA,使DNA探针共价地附着于该羧化物基团。
本发明的电极可用于电化学检测水溶解的GMP、聚[G],以及含有预定碱基的表面固定化核酸。此电极包含具有导电工作表面的基体,并在此工作表面通过还原性电聚合修饰了一层薄膜。此薄膜是选自聚[Ru(vbpy)3 2+]和聚[Ru(vbpy)3 2+/vba],其中vbpy是4-乙烯基-4′甲基-2,2′-二吡啶,vba是对-乙烯基苯甲酸。
特别是本发明提供了包含聚吡啶基Ru11络合物的聚合物薄膜,一般是以Ru(vbpy)3 2+为基础,优选地是从乙腈稀溶液中通过还原电聚合制备在Pt和玻璃碳电极的表面(vbpy=4-乙烯基-4′-甲基-2,2′-二吡啶)。在1.1V(所有的电位都以Ag/AgCl作参照)这种膜表现出氧化性氧化还原对,此电位稍微高于对水溶液中鸟嘌呤所观察到的电位(1.05V,与Ag/AgCl对比)(Abruna,H.D.等美国化学学会杂志1981,103,1;Denisevich.P.等,无机化学1982,21,2153)。因此,这种膜对于鸟嘌呤和含有鸟嘌呤或其它预定碱基的聚合物如DNA或RNA的电氧化作用将是活性催化剂。
更进一步地说,对Ru(vbpy)3 2+和对-乙烯基苯甲本(vba)混合物的电聚合使用被用于产生含有钌催化剂的薄膜,借助于标记vba的碳化二亚胺反应可使带有氨基的寡核苷酸附着在此膜上。作为本发明的一部分,以Ru(vbpy)3 2+膜修饰的电极被用于催化DNA氧化,而Ru(vbpy)3 2+与vba的共聚合物被用于产生位点特异性组合的DNA检测部位。
扩增。因为按照本发明使用具有电聚合膜电极的步骤包括使核酸样品与寡核苷酸探针接触以便产生杂交的DNA或RNA,因此,在某些应用中理想地是在与探针接触之前先扩增此DNA或RNA样品。可通过任何适当的方法如在共同未决申请中所公开的和论述的方法,对选定的或作为目标的核酸序列进行扩增。
核酸的检测。如上面所述,本发明包括一种在其表面已形成了电聚合膜的电极,以及使用这种电极使之能够检测杂交核酸的方法。在此方法中,是使核酸样品与寡核苷酸探针接触而形成杂交的核酸。用于本发明方法中的寡核苷酸探针可以是含有大约4或6个碱基直至大约80或100个或者更多碱基的任何一种探针,较优选的是大约8-30个碱基。按照本领域熟知的技术,可以制备具有广泛多样性碱基序列的寡核苷酸探针。适合于制备这种寡核苷酸探针的碱基可以选自天然存在的核苷酸碱基如腺嘌呤、胞嘧啶、鸟嘌呤、尿嘧啶和腺嘧啶;还可以选自非天然存在的或“合成的”核苷酸碱基如8-氧代-鸟吩咐,6-巯基鸟嘌呤、4-乙酰胞苷、5-(羧基羟乙基)尿苷、2′-邻-甲基胞苷、5-羧甲基氨甲基-2-硫代尿苷,5-羧甲基氨甲基尿苷、二氢尿苷、2′-邻-甲基伪尿苷,D-半乳糖基queosine,2′-邻-甲基鸟苷、肌苷、7-去氮杂鸟嘌呤、N6-异戊烯基腺苷、1-甲基腺苷、1-甲基伪尿苷、1-甲基鸟苷、1-甲基肌苷、2,2-二甲基鸟苷、2-甲基腺苷、2-甲基鸟苷、3-甲基胞苷、5-甲基胞苷、N6-甲基腺苷、7-甲基鸟苷、5-甲基氨甲基尿苷、5-甲氧基氨甲基-2-硫代尿苷、D-甘露糖基queosine、5-甲氧基羧甲基尿苷、5-甲氧基尿苷、2-甲基硫代-N6-异戊烯基腺苷、N-((9-D-呋喃核糖基-2-甲基硫代嘌呤-6-)氨基甲酰基)苏氨酸,N-((9-D-呋喃核糖基嘌呤-6-)N-甲基-氨基甲酰基)苏氨酸、尿苷-5-羟基乙酸甲酯、尿苷-5-羟基乙酸、Wybutoxosine,伪尿苷、queosine,2-硫代胞苷、5-甲基-2-硫代尿苷、2-硫代尿苷、5-甲基尿苷、N-((9-D-呋喃核糖基嘌呤-6-)氨基甲酰基)苏氨酸、2′-邻-甲基-5-甲基尿苷、2′-邻-甲基尿苷、Wybutosine、和3-(3-氨基-3-羧丙基)尿苷。可以采用任何一种寡核苷酸骨架,包括糖基修饰的DNA,RNA(虽然RNA比DNA稍差点),此糖基可以是碳环,以及含有2′取代如氟代和甲氧基加糖基。该寡核苷酸可以是其中至少一个或全部核苷酸间桥接的磷酸残基是被修饰的磷酸酯,例如甲基膦酸酯、甲基硫代膦酸酯、吗啉磷酸酯、哌嗪磷酸酯和氨基磷酸酯(例如可以是核苷酸间桥接的磷酸残基每隔一个如所述被修饰)。该寡核苷酸还可以是一种“肽核酸”,例如在P.Nielsen等1001,科学254,1497-1500中所描述的。唯一的要求是该寡核苷酸探针应该具有一个序列,至少此序列的一部分是与靶标核酸已知的部分序列互补的。在某些应用中理想的是使核酸样品与具有不同碱基序列的若干个寡核苷酸探针接触(例如当样品中存在二个或几个靶标核酸时,或者在使单个靶标核酸的“夹心”检测法同二个或几个探针杂交的情况下)。
预定的碱基。杂交之后,使附着于电聚合膜上的杂交核酸与适当的介体发生反应,此介体被固定在膜上并且能够在氧化-还原反应中氧化预定的碱基。预定的碱基可以是在与所选择介体反应时受到氧化的任何天然存在的或合成的核苷酸碱基。当与四个天然存在的碱基中的每一个配对时该预定的碱基应该表现出独特的氧化速率。通常可应用此催化反应检测其5′-单核苷酸(例如5′-脱氧核糖核苷酸或5′-核糖核苷酸)表现出速率常数大于104M-1S-1的碱基。适合的预定碱基包括但不局限于鸟嘌呤、腺嘌呤、8-氧代-鸟嘌呤和8-氧代-腺嘌呤、8-溴代-鸟嘌呤、黄嘌呤、伪尿苷、6-巯基鸟嘌呤、8-巯基鸟嘌呤,2-硫代黄嘌呤、6-硫代黄嘌呤、6-巯基嘌呤、2-氨基-6-羧甲基-巯基嘌呤、2-巯基嘌呤、6-甲氧基嘌呤、2-乙酰氨基-6-羟基嘌呤、6-甲硫基-2-羟基嘌呤、2-二甲氨基-6-羟基嘌呤、2-羟基嘌呤、2-氨基嘌呤、6-氨基-2-二甲代烯丙基-嘌呤、2-硫代腺嘌呤、8-羟基腺嘌呤、8-甲氧基腺嘌呤。此预定的碱基典型地是选自鸟嘌呤、腺嘌呤、6-巯基鸟嘌呤、8-氧代-鸟嘌呤、和8-氧代-腺嘌呤,而鸟嘌呤是目前优选的天然存在的预定碱基,8-氧代-鸟嘌呤是目前优选的合成预定碱基。
介体。可用于启动电子转移并引发电聚合作用的介体是具有如下特点的介体:(a)具有可逆的氧化性氧-还原偶联,并能够氧化预定的碱基,(b)具有能够在与其氧化性氧化-还原偶联电位不同的电位经受电聚合作用的取代基、以及(c)表现出可以被用于启动电聚合作用的不同的氧化-还原偶联。例如,钌2+(2,2′-二吡啶)3(Ru(vbpy)3 2+,在此vbpy=4-乙烯基-4′甲基-2,2′-二吡啶)络合物在大约1.0V表现出氧化性氧化-还原偶联,这可以介导氧化鸟嘌呤,bpy配体上的乙烯基可被用于电聚合作用,并且该络合物在-1.1V表现出还原性氧化-还原偶联,可用于启动电聚合使用。满足这些标准的介体包括含有乙烯基取代的聚吡啶基配体的金属络合物,它既表现出氧化性氧化-还原偶联,又表现出还原性氧化-还原偶联。
氧化-还原反应的检测。应用根据本发明电极上的电聚合膜观察指示氧化-还原反应发生的电子信号改变,可以检测氧化-还原反应的发生。典型的方法是使以含有介体的电聚合膜修饰的电极以及被固定化在此膜上的核酸与溶液接触,此溶液还与一个参比辅助电极接触(大部分电流通过此辅助电极)。同样,适合的参比电极也是本领域熟知的,包括例如银/氯化银电极。
通过对与氧化-还原反应相关的电子信号的检测,使之能够测定是否存在杂交的核酸。测定杂交核酸是否存在的步骤典型地包括(i)测定氧化-还原反应的反应速率,(ii)将所测定的反应速率与单链核酸的过渡态金属络合物的氧化-还原反应速率相比较,然后(iii)确定此所测定的反应速率是否与带有单链核酸的过渡态金属络合物的氧化-还原反应速率基本相同。可以通过任何适当的方法实施对反应速率的测定步骤。例如通过在相同的扫描速度,相同的探针浓度、靶标浓度,相同的介体、缓冲液、温度和/或相同的电化学方法的情况下,对电流进行比较而确定其相对的反应速率。
按照本领域技术人员熟知的适当方法可测定氧化-还原反应速率。一般是通过测定与氧化-还原反应发生有关的电子信号来测定氧化-还原反应速率。例如,通过提供一种适当的电子传递检测仪来测定与氧化-还原反应有关的电子信号,这种检测仪带有以在此所述的电聚合膜包涂的电极。适当的仪器是一种恒电位器,它能够测定所产生的电子信号以致可对杂交核酸与介体之间的反应提供一个氧化-还原反应速率测定结果。
电子输出是任何一种电化学测量法的特征,电化学测量法包括循环伏安法、正态脉冲伏安法、计时安培分析法和方波伏安法,而循环伏安法是当前优选的形式。如本领域所熟知的,可应用计算机控制电极的使用以及记录电极的测量结果。根据本发明最常用于ITO电极上电聚合膜的方法是循环伏安法。在循环伏安测量法中,其电化学系统的电位从起始电位(0-800mV)至最终电位(1300-1800mV)是呈线性地改变。当达到最终电位时扫描方向被反转,并按相反方向扫描相同的电位幅度。电位以恒定的扫描速度改变(25mv/s-50V/s)。对于大多数实验起始电位设定在0mV,而最终电位足以引起介体的氧化。当前优选的扫描速度是50mV/s,以1.4V的转换电位。测量每个电位点的电流,以此数据作图,形成电流对电压范围的关系曲线。
作为循环伏安法的另一种选择,还可应用电位步进法如计时库仑分析法或计时安培分析法来分析本发明的电聚合膜。在计时库仑分析法中是应用步进式电位。以起始电位(0mV-800mV)开始,使电化学系统直接跨入最终电位(1100mV-1600mV)。使电化学系统在此最终电位保持一段特定的时间(50μs-10s),并作为时间的函数收集其电荷。虽然通常不这样做,但是如果需要可使电位逐步反回至起始电位,并可在起始电位作为时间的函数收集其电荷。在计时伏安分析法中,使电化学系统从起始电位(0mV-800mV)直接跨入最终电位(1000-1500mV)维持一段特定的时间(50μs-10s),并作为时间的函数收集其电流。如果需要可使电位逐步反回至起始电位,并可在起始电位作为时间的函数收集其电流。
在Thorp等的专利(美国专利5,871,918)所述的方法中,使用金属络合物是为了从单链和双链核酸获得电化学电流。预定的碱基如鸟嘌呤可给出电化学信号,但是对于双链DNA这种信号要弱得多。这种方法有益地显示出高度结构性灵敏度,并可以分辨出单个碱基错配。因此这种方法用于DNA测序特别优越。但是,这种方法有二个缺点:(a)从探针单链变成杂交体时出现负信号,以及(b)一些限制信号的预定碱基受到限制。在此所述的技术对这些问题提供了解决办法。此外,这些技术对于诊断性检测特别有用,对于核酸的定量检测也特别有用。
鉴于前述的以及在此和在Thorp等的专利(美国专利5,871,918)所公开的,是一种检测怀疑含有靶标核酸的待测样品中是否存在此核酸的方法,因此其中的靶标核酸含有至少一个预定的碱基。此方法中,预定的碱基是定位于靶标核酸而不是在寡核苷酸探针中。
待测样品。可对含有靶标核酸的待测样品实施本方法。可使用怀疑含有靶标核酸的任何待测样品,包括但不局限于组织样品如活组织检查样品,以及生物液体如血液、唾液、尿液和精液样品,还包括细菌培养物,土壤样品和食物样品等。靶标核酸可以是任何来源的,取决于特定的检测目的包括动物、植物或微生物(例如病毒、原核生物和直核生物,包括细菌、原生动物和真菌等)。实例包括外科手术样品,用于医学诊断的样品、用于遗传检查的样品、环境样品、食物样品、牙齿样品和兽医样品。在实施本方法之前可以按照本领域技术人员熟知或明了的技术对样品作处理或纯化,如果需要,可在实施本方法之前将其中的核酸消化、作成片段和/或扩增(见上面)。
检测方法。按照本发明应用带有电聚合膜的电极对靶标核酸上预定碱基的检测包括:(a)使待测样品与特异性结合靶标核酸而形成杂交核酸的寡核苷酸探针接触;(b)检测是否存在与杂交核酸有关的氧化-还原反应;以及(c)根据对预定碱基所检测的氧化-还原反应确定待测样品中是否存在靶标核酸。可以将寡核苷酸探针固定化在固相载体(电聚合膜)上,以便于在进行检测步骤之前(例如步骤(a)和(b)之间或步骤(b)和(c)之间)用分离步骤使待测样品与杂交核酸分离。按另一种方法,可将寡核苷酸探针游离在溶液中,并提供其它一些方法使杂交核酸与样品分离(例如借助于可结合于此寡核苷酸探针的介体核酸,或者借助于生物素-亲合素结合性相互作用,在此可将生物素结合于寡核苷酸探针,将亲合素固定化在固相载体上)。在使电聚合膜与基体的导电工作表面接触之前或之后,氧化-还原反应以及直至检测步骤的任何步骤都可以在此膜上进行。
靶标核酸优选地至少比寡核苷酸探针多含有10个预定的碱基。当靶标核酸比寡核苷酸探针多含有许多预定的碱基时,可有益地获得较大的电流增加。
任选地但比较优选的情况是,该寡核苷酸没有预定的碱基,或者至少基本上没有预定的碱基(即含有足够少的预定碱基以致来自探针的信号不会干扰或者被误解为来自靶标核酸的信号)。当不能获得可与靶标核酸方便地杂交的天然存在的碱基序列时,可采取使用氧化-还原惰性的替代碱基(将在下面论述)。
优选地是靶标核酸比寡核苷酸探针长,至少有一个预定碱基“伸出”在外,即在杂交核酸中没有与寡核苷酸探针杂交的。优选地至少10、50或100个预定碱基是“伸出的”碱基,从而有显著放大的电化学信号提供检测。
例如,可选择不含有任何鸟嘌呤残基(例如只含有A.T和C)的寡核苷酸探针。存在这种链时Ru(bpy)3 2-的循环伏安曲线非常类似于没有此寡聚体时的曲线。然后使此探针与含有鸟嘌呤的靶标链在重叠的碱基对区杂交和/或如果靶标链比寡核苷酸探针长,则在伸出的区域杂交。因为多个鸟嘌呤被检测,所以信号放大与杂交体形成的数量成比例。在基因组DNA或RNA是靶标链的情况下,将遇到给予巨大的信号放大作用的大量伸出的鸟嘌呤。
例如,在一个优选的实施方案中,对靶标链上预定碱基的测定包括将(优选地是氧化-还原沉默的)探针链固定化在紧密贴近电极表面的膜上,这样扫描时将提供较低的背景信号。然后使此电聚合膜与含有预定碱基的靶标链的溶液接触。如果发生杂交,此时靶标链将紧密地靠近电极,并将检测出电流增加。这种方法特别适合于核酸的定量检测,因为杂交的程度越高,在电极表面预定碱基的数量越多,电化学信号越强。
氧化-还原惰性的替代碱基。在此探针链中可使用替代碱基来代替鸟嘌呤(即一种类似于鸟嘌呤的碱基,与核酸双螺旋中其它碱基相比较它对胞嘧啶具有较大的结合亲和性),但是在适合的反应条件下这种替代碱基不会被介体氧化。当靶标核酸中预定的碱基是鸟嘌呤,并且此靶标核酸还含有胞嘧啶(它通常与探针中的鸟嘌呤结合),那么此探针可含有在杂交核酸中结合于胞嘧啶的替代碱基。例如此替代碱基可以是肌苷,肌苷的活性比鸟嘌呤小3个数量级。典型的反应步骤包括在足以引起选择性氧化预定碱基而不氧化替代碱基的条件下,使过渡态金属络合物与此核酸反应。
因此,在靶标核酸含有至少一个预定碱基,并且此探针或捕获核酸含有氧化-还原惰性的替代碱基的情况下,检测此靶标核酸的方法包括:(a)使此靶标核酸与可特异性结合于此靶标核酸而形成杂交核酸的互补核酸相接触;(b)检测其氧化-还原反应;以及(c)根据对预定碱基检测的氧化-还原反应确定是否存在此靶标核酸。
通过参照下面的实施例将会对本发明的特征有更明确的理解,而不要认为这些实施例是对本发明的限制。
实施例
实施例1.试剂和DNA:
用于这些实验的无机试剂都是分析级或更高的纯度。应用文献中的标准程序制备无机络合物[Ru(vbpy)3](PF6)2(Abruna,H.D等,美国化学学会杂志,1981,103,1)。借助于标准的LiAlH4还原法还原氰基取代的二茂铁CpFe(C5H4-CH2CN)随后从二乙醚中活化加工制成了传感探头CpFe(C5H4-C2H4NH2)。从Aldrich(Milwaukee,WI)购买了水溶性碳化二亚胺(WSC,1-(3-二甲基氨丙基)3-乙基碳化二亚胺盐酸盐),DCC(二环己基碳化二亚胺),TBAH(四丁基铵六氟硫酸盐),NHS(N-羟基琥珀酰亚胺),GMP(鸟苷一磷酸,二钠盐),聚鸟苷(poly[G])和vba,按普遍接受的方法使用。在电化学实验之前从50%乙醇中对vba作了二次重结晶以确保纯度。MES(2-吗啉代乙基磺酸钠盐和2-吗啉代乙基磺酸-水合物)购自Fluka(New Ulm,瑞士)。NaHPO4,NaH2PO4,NaCl,和乙腈是从Mallinckrodt(Phillipsburg,NJ)购得。在用于电聚合实验之前对活化分子筛使乙腈干燥。人工合成的寡核苷酸是由位于Chapel Hill的北卡罗来纳大学病理系合成的,并使用3000截止分子量的Amicon 3微米浓缩器纯化。从Milli-Q Plus纯化系统(Millipore,Bedford,MA)获得实验用水。从BAS(West Lafayette,IN)购得玻璃碳电极(GCE,直径3mm),使用前抛光。
实施例2.电化学分析。
使用PAR 273A恒电位器/恒电流器获得循环伏安曲线。使用二隔室的伏安测量小室在乙腈中进行实验,小室内装配有玻璃碳工作电极,铂网反电极和Ag/AgNO3参比电极。使用单室的伏安测量小室进行水介质实验,小室内装配有玻璃碳工作电极、铂丝反电极和Ag/AgCl参比电极。使用之前在毡制抛光台上用METADI金刚石抛光化合物(Buehler,Lake Bluff,IL)和Al2O3(0.5μm在水中)将所有的GCE彻底地抛光。然后在临使用之前用Milli-Q水和无水乙腈漂洗电极几次。通过以3.5ml 0.2mM[Ru(vbpy)3](PF6)2,0.1M TBAH乙腈溶液充满工作电极隔室,并以100mV/s扫描速度在-0.9与-0.2V之间还原扫描10次而进行电聚合反应。在还原扫描之前这些溶液必须被彻底干燥并除去气体,并且必须对参比电极隔室注满0.1M TBAH的乙腈溶液。为了形成vba涂膜,发现[Ru(vbpy)3](PF6)2对vba溶液5∶1的比例可产生具有最高可再现性的膜。通过以50mV/s扫描速度,从0.0至1.4V作正相扫描而对含水GMP,聚[G]和附着的DNA探针进行电化学氧化。
实施例3.使DNA附着于膜修饰的电极。
应用标准的酰胺化程序实现DNA探针的附着,其中是应用熟知的碳化二亚胺化学活化其表面羧基(作为vba间隔基而存在于膜中的),随后与氨基连接的单链DNA进行酰胺化反应(Millan,K.M.等,分析化学1993,65,2317;Sehgal,D.等,分析生物化学1994,218,87)。在将聚[Ru(vbpy)3 2+/vba]电聚合在GCF表面之后,用乙腈仔细漂洗电极,除去残余的[Ru(vbpy)3](PF6)2,vba和TBAH。然后倒置电极,并将50μl EDC/NHS溶液(通过将10mg EDC和1mg NHS溶解于1.0mlMilli-Q水中配制的)小心地滴加在电极表面。以倒扣的烧杯覆盖此电极30分钟。然后用水漂洗此被处理的GCE多次并用滤纸小心吸干。再次倒置电极,将25μl缓冲pH的5μM DNA探针溶液(20聚体,具有3′-(CH2)6NH2连接基团的聚[脱氧鸟苷])滴加于电极表面。使此电极覆盖静置90分钟不受干扰,然后以800mM NaCl,50mM磷酸盐缓冲液(pH7.0)漂洗。为了瓦解聚合体表面与非共价结合DNA之间任何形式的静电相互作用,在此漂洗步骤中的高浓度盐溶液是必需的。
实施例4.对固定化探针的定量。
按照标准的程序(Maniatis,T.等,分子克隆:实验室手册,1989,冷泉港出版社)使用T4聚核苷酸激酶和γ-32P-ATP(6000Ci/mmol)对此20聚体探针作5′-32P标记。借助于标准的技术,使用StratageneNucTrap柱除去此标记探针上未反应的ATP。在pH6.5 MES中或者在pH9.0碳酸盐缓冲液中,使用含有5pmol标记探针而被混入未标记探针至5μM的DNA贮备液(总体积270μl),通过对未标记探针所述的相同程序使标记的探针附着。固定化之后,从电极表面机械地取下探针修饰的膜,使聚合物擦拭在滤纸片上。以除去EDC/NHS酰胺化反应步骤的相同方法获得对照膜。然后应用液体闪烁法和磷光成像技术一式三份地测定这些样品的放射活性。
实施例5.制备聚合物修饰的电极。
对电聚合在电极表面的聚[Ru(vbpy)3 2+]膜已作了明确的特征鉴定,并且如在此所述,应用不同扫描次数和扫描速度可容易地制作可重复厚度的膜。图1A和1B显示对于简单的含钌膜聚[Ru(vbpy)3 2+],以及对于以含羧基vba基团涂布的膜聚[Ru(vbpy)3 2+/vba]其聚合物的生长。图7中显示的示意图表明电聚合时共聚合体的形成。如以前已证明,在使Ru3+稳定形成的介质中(即无水乙腈和强酸溶液)聚[Ru(vbpy)3 2+]膜可以被可逆地氧化(Abruna,H.D.等,美国化学学会杂志1981,103,1;Denisevich,P.等,无机化学1982,21,2153)在对聚[Ru(vbpy)3 2+/vba]涂布膜的这些研究中也观察到同样的行为。
实施例6.对GMP和聚[G]的检测。
在pH7.0磷酸盐缓冲液中存在和不存在GMP和聚[G]的情况下氧化扫描以聚[Ru(vbpy)3 2+]膜修饰的GCE(图2、3和4)。图2中,使未修饰的GCE暴露于1.0mM GMP溶液产生的氧化曲线明显地小于聚合物修饰的电极产生的曲线。即使扣除由聚合物本身氧化产生的背景电流仍显示出表明催化电子转移过程的正电流。图3A和3B中显示出对所提议催化机制的进一步支持。图3中的伏安曲线证明存在电子供体GMP时该膜的稳定性。在不存在适当浓度的电子供体时,观察到该膜中钌核心的完全分解(图3A)。但是,当溶液中存在GMP时,存在于刚性膜中的氧化Ru3+有时能够在迅速分解之前从邻近的GMP分子抽取电子。在GMP溶液中完成第二次氧化扫描时存在GMP氧化波动证明了这种作用(图3B)。GMP分子太大而不能扩散通过该膜分解丧失Ru3+时产生的孔道。在一个实验中,当不存在GMP溶液时聚[Ru(vbpy)z3 2+]膜被氧化,随之在含有GMP的溶液中作第二次氧化扫描时,观察到与图3A中第二次扫描相同的伏安曲线。单独的观察表明,将GMP溶液稀释二个数量级(0.01mM)对第一次氧化扫描过程中产生的电流量只有很小一点作用。这种作用可以是由于带正电荷的聚合物表面与阴离子GMP之间的静电吸引所致。这样可推测在电极表面形成了一个远远大于大量溶液的局部浓度。
图4中显示使用擦去修饰的和聚[Ru(vbpy)3 2+]修饰的电极聚[G]氧化的循环伏安曲线曲,证明了二个可确定的特征。第一,在没有聚[Ru(vbpy)3 2+]膜时不发生聚[G]的电化学氧化作用。由于这样一种大聚合物对膜的缓慢扩散(相对于循环伏安测量时标),聚[G]的氧化作用不可检测。但是,在存在聚[Ru(vbpy)3 2+]处理的电极时,观察到高于对聚[Ru(vbpy)3 2+]单独氧化所看到的电流增加。同样,阳离子聚合物表面的静电吸引作用很可能促进大聚[G]分子向电极表面扩散,在此可发生Ru-介导的催化氧化作用。
实施例7.对固定化探针的检测。
以溶于二氯甲烷的DCC取代EDC,应用与含水酰胺化作用相同的方案,使氨基修饰的二茂铁探针(CpFe(C5H4-C2H4NH2))附着于10次扫描的聚[Ru(vbpy)3 2+/vba]修饰电极(图1B)。在此活化步骤之后随之酰胺化此二茂铁氨基基团(图5)。致使此二茂铁分子固定化在电极表面。在0.1M TBAH乙腈溶液中,在0.2V观察到可测量的电流,表示在此修饰电极表面存在Fe2+/Fe3+二茂铁偶联。
将氨基连接的DNA探针固定化在电极表面(图8中显示的示意图2)。在二个不同的pH值(6.5和9.0)进行固定化反应,以便以二种明显不同的方式化学吸附探针。在较高的pH,优先在与DNA嘌呤和嘧啶环上任何天然内源性胺基团不同的,所附着的(CH2)6NH2基团的一级胺发生酰胺化作用。对这些天然胺基团的酰胺化将产生附着DNA的电极表面,不但附着在氨基连接的基团,而且附着在若干天然胺基团,也产生具有较少探针分子被“钉住”的表面(示意图3)。应用这种假设,设想在pH9.0酰胺化将产生含有较大量固定化DNA探针链的膜,因为重叠将被最大化,并且天然胺基团的酰胺化(或固定)将是最小。
然后在二种pH氧化以DNA探针处理的膜,与仅仅膜氧化所产生的电流相比较。
图6中明显可见,只是那些在pH6.5以DNA探针处理的膜产生了具有可测定催化增加量的电流。只有这些在pH6.5处理其中DNA探针的膜显示出催化电流的增加(典型地观察到8-13μA的增加量)。
实施例8.对固定化探针的定量。
根据电化学资料当与仅仅氧化聚合物相比较,存在20聚体G探针时由聚[Ru(vbpy)3 2+/vba]膜产生的氧化电流催化增加量表明大约有10μl以上的电荷或10-10以上摩尔的电子(由伏安曲线积分值确定的)被转移了。还应用放射标记的探针作为一种方法,定量测定在pH6.5和9.0化学吸附于GCE表面的DNA探针量。对在pH6.5和9.0以探针处理的表面作闪烁计数表明,分别已固定化了7.4×10-12摩尔和3.0×10-14摩尔的探针。通过将磷光成像屏用于检测而进行的单独的标记实验支持了这些资料。应用这种替代性的和更灵敏的技术,在pH6.5和9.0对固定化DNA探针所得到的数值是8.0×10-12和8.0×10-13mol。根据电化学测定,为了获得10μC的催化增加量将需要氧化10-10摩尔鸟嘌呤。与放射标记的资料相一致,这相当于氧化固定化在表面的接近50%的鸟嘌呤碱基。
实施例9.对杂交核酸的检测。
如在上面的实施例中,通过聚合Ru(bpy)3 2+和vba制备电聚合膜。借助于碳化二亚胺反应使含有代替鸟嘌呤替代碱基的寡核苷酸探针附着于此膜。然后使此电极与含有靶标核酸的溶液接触,此靶标核酸含有鸟嘌呤并与该固相化探针互补。杂交发生之后,以50mV/s的扫描速度从0至1.4V扫描,以循环伏安测量法对此电极进行分析。其电化学电流明显地大于没有与互补的含鸟嘌呤序列杂交的电极电流。
Claims (4)
1.一种用于电化学检测核酸的电极,它包括:
a)一层薄膜,此薄膜含有一种金属络合物,所述金属络合物是一种电聚合作用的起始物,并且所述金属络合物又是作为该核酸中预定碱基氧化的介体,以及
b)作为薄膜一部分的、该核酸可附着于所述薄膜的功能化部分。
2.权利要求1的电极,其中的金属络合物选自聚[Ru(vbpy)3 2+]和聚[Ru(Vbpy)3 2+/vba],其中vbpy是4-乙烯基-4′甲基-2,2′-二吡啶,vba是对-乙烯基苯甲酸。
3.一种用于电化学检测核酸中预定碱基的电极,该电极包括:
(a)一种具有导电工作表面的基体;以及
(b)一种在该导电工作表面的电聚合膜,该电聚合膜包含(i)在一种核酸中用于预定碱基氧化的介体和(ii)具有羧化物基团的功能化部分二者之间的共聚物。
4.权利要求3的电极,其中的介体是Ru(vbpy)3 2+,而功能化部分是对-乙烯基苯甲酸。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US09/267,552 US6180346B1 (en) | 1995-06-27 | 1999-03-12 | Electropolymerizable film, and method of making and use thereof |
| US09/267,552 | 1999-03-12 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1343260A CN1343260A (zh) | 2002-04-03 |
| CN1165629C true CN1165629C (zh) | 2004-09-08 |
Family
ID=23019269
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB008047057A Expired - Fee Related CN1165629C (zh) | 1999-03-12 | 2000-02-04 | 电聚合膜、其制备方法及用途 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US6180346B1 (zh) |
| EP (1) | EP1161560A1 (zh) |
| JP (1) | JP2002539462A (zh) |
| KR (1) | KR20010104724A (zh) |
| CN (1) | CN1165629C (zh) |
| AU (1) | AU775533B2 (zh) |
| CA (1) | CA2366866A1 (zh) |
| HK (1) | HK1044024A1 (zh) |
| NO (1) | NO20014429L (zh) |
| NZ (1) | NZ513604A (zh) |
| WO (1) | WO2000055366A1 (zh) |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6833267B1 (en) * | 1998-12-30 | 2004-12-21 | Clinical Micro Sensors, Inc. | Tissue collection devices containing biosensors |
| EP1134294A3 (en) * | 2000-03-16 | 2004-06-30 | Kabushiki Kaisha Toshiba | Method for producing immobilized nucleic acid strand |
| US20020155476A1 (en) * | 2000-10-20 | 2002-10-24 | Nader Pourmand | Transient electrical signal based methods and devices for characterizing molecular interaction and/or motion in a sample |
| DE10126798A1 (de) | 2001-06-01 | 2002-12-19 | Nanotype Gmbh | Verfahren zur Bestimmung einer Probe |
| GB0205455D0 (en) | 2002-03-07 | 2002-04-24 | Molecular Sensing Plc | Nucleic acid probes, their synthesis and use |
| WO2004023128A1 (en) * | 2002-09-05 | 2004-03-18 | Unisearch Limited | Detection of target nucleic acid molecules by alteration of reaction of a redox species following hybridization with immoblized capture nucleic acid molecules |
| US7258978B2 (en) * | 2002-11-06 | 2007-08-21 | Geneohm Sciences | Electrochemical method to measure DNA attachment to an electrode surface in the presence of molecular oxygen |
| US20040086892A1 (en) * | 2002-11-06 | 2004-05-06 | Crothers Donald M. | Universal tag assay |
| DE10253337B4 (de) * | 2002-11-14 | 2005-10-20 | November Ag Molekulare Medizin | Verfahren zum Nachweis einer Nukleinsäure |
| US7138121B2 (en) * | 2003-01-23 | 2006-11-21 | Spangler Brenda D | Biosensors utilizing dendrimer-immobilized ligands and there use thereof |
| CA2524585A1 (en) * | 2003-05-02 | 2004-11-11 | Centrum Mikrobiologii I Wirusologii Polskiej Akademii Nauk | Nucleoside derivative, modified oligonucleotide, method for their synthesis and applications thereof |
| DE602004029152D1 (de) * | 2003-05-02 | 2010-10-28 | Geneohm Sciences San Diego | Elektrochemisches verfahren zur messung der bindung von dna an eine elektrodenoberfläche in gegenwart von molekularem sauerstoff |
| US7741033B2 (en) * | 2003-05-13 | 2010-06-22 | Trustees Of Boston College | Electrocatalytic nucleic acid hybridization detection |
| JP4939945B2 (ja) * | 2003-12-15 | 2012-05-30 | ジーンオーム サイエンシーズ、インク. | Dnaおよびタンパク質分子の結合のための炭素電極表面 |
| JP3952042B2 (ja) * | 2004-06-07 | 2007-08-01 | ソニー株式会社 | 凹状部位を有する電極を備えるハイブリダイゼーション検出部と該検出部を備えるdnaチップ |
| US20060094024A1 (en) * | 2004-11-01 | 2006-05-04 | Pirrung Michael C | Electrochemical arrays |
| EP1877789A4 (en) * | 2005-04-12 | 2010-02-10 | Trustees Boston College | METHOD FOR ELECTROCATALYTIC DETECTION OF PROTEINS |
| JP5712129B2 (ja) | 2008-09-02 | 2015-05-07 | ザ ガバニング カウンシル オブ ザ ユニバーシティ オブ トロント | ナノ構造化微小電極およびそれを組み込んだバイオセンシング装置 |
| ES2704685T3 (es) | 2011-01-11 | 2019-03-19 | Governing Council Univ Toronto | Método para la detección de proteínas |
| EP2683822B1 (en) | 2011-03-10 | 2020-04-22 | General Atomics | Diagnostic and sample preparation devices and methods |
Family Cites Families (39)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3278334D1 (en) | 1981-10-23 | 1988-05-19 | Genetics Int Inc | Sensor for components of a liquid mixture |
| WO1985002627A1 (en) | 1983-12-16 | 1985-06-20 | Genetics International, Inc. | Assay for nucleic acids |
| US4883579A (en) | 1984-04-27 | 1989-11-28 | Molecular Devices Corporation | Photoresponsive redox detection and discrimination |
| US4704353A (en) | 1984-04-27 | 1987-11-03 | Molecular Devices Corporation | Photoresponsive redox detection and discrimination |
| GB8417301D0 (en) | 1984-07-06 | 1984-08-08 | Serono Diagnostics Ltd | Assay |
| US5112974A (en) | 1985-01-18 | 1992-05-12 | The Trustees Of Columbia University In The City Of New York | Mixed ligand complexes and uses thereof as binding agents to DNA |
| US5157032A (en) | 1985-01-18 | 1992-10-20 | The Trustees Of Columbia University In The City Of New York | Mixed ligand complexes and uses thereof as binding agents and probes to DNA |
| US4965188A (en) | 1986-08-22 | 1990-10-23 | Cetus Corporation | Process for amplifying, detecting, and/or cloning nucleic acid sequences using a thermostable enzyme |
| US4683195A (en) | 1986-01-30 | 1987-07-28 | Cetus Corporation | Process for amplifying, detecting, and/or-cloning nucleic acid sequences |
| US4800159A (en) | 1986-02-07 | 1989-01-24 | Cetus Corporation | Process for amplifying, detecting, and/or cloning nucleic acid sequences |
| GB8606719D0 (en) | 1986-03-19 | 1986-04-23 | Lister Preventive Med | Genetic probes |
| US5066372A (en) | 1986-05-02 | 1991-11-19 | Ciba Corning Diagnostics Corp. | Unitary multiple electrode sensor |
| US4756807A (en) * | 1986-10-09 | 1988-07-12 | Gas Research Institute | Chemically modified electrodes for the catalytic reduction of CO2 |
| US4908307A (en) | 1986-12-19 | 1990-03-13 | Karin D. Rodland | Hybridization method and probe for detecting nucleic acid sequences |
| US5540828A (en) | 1987-06-08 | 1996-07-30 | Yacynych; Alexander | Method for making electrochemical sensors and biosensors having a polymer modified surface |
| US4963815A (en) | 1987-07-10 | 1990-10-16 | Molecular Devices Corporation | Photoresponsive electrode for determination of redox potential |
| US4995402A (en) | 1988-10-12 | 1991-02-26 | Thorne, Smith, Astill Technologies, Inc. | Medical droplet whole blood and like monitoring |
| US5143854A (en) | 1989-06-07 | 1992-09-01 | Affymax Technologies N.V. | Large scale photolithographic solid phase synthesis of polypeptides and receptor binding screening thereof |
| US5194372A (en) | 1989-07-10 | 1993-03-16 | Hitachi, Ltd. | Method and apparatus for detecting disorders in genomic substances |
| JPH0376600A (ja) | 1989-08-21 | 1991-04-02 | Hitachi Ltd | 遺伝子変異検出法 |
| CA2033692A1 (en) | 1990-01-25 | 1991-07-26 | Wilhelm Bannwarth | Energy transfer systems |
| JPH05507613A (ja) | 1990-04-06 | 1993-11-04 | シンジーン,インコーポレイテッド | Dnaアッセイを行う方法および組成物 |
| DE69125441T2 (de) | 1990-09-28 | 1997-11-06 | Toshiba Kawasaki Kk | Verfahren zum Gennachweis |
| JP3076600B2 (ja) | 1990-11-20 | 2000-08-14 | 株式会社日本マイクロニクス | 表示パネル用プローバ |
| US5272056A (en) | 1991-01-03 | 1993-12-21 | The Research Foundation Of State University Of New York | Modification of DNA and oligonucleotides using metal complexes of polyaza ligands |
| US5439829A (en) | 1991-01-30 | 1995-08-08 | Eli Lilly And Company | Immobilization of biologically active molecules by changing the Oxidation state of a chelated transition metal ion |
| FR2673289B1 (fr) | 1991-02-21 | 1994-06-17 | Asulab Sa | Capteur de mesure de la quantite d'un composant en solution. |
| US5171853A (en) | 1991-08-05 | 1992-12-15 | North Carolina State University | Process of cleaving nucleic acids with oxoruthenium(IV) complexes |
| US5605662A (en) | 1993-11-01 | 1997-02-25 | Nanogen, Inc. | Active programmable electronic devices for molecular biological analysis and diagnostics |
| US5632957A (en) | 1993-11-01 | 1997-05-27 | Nanogen | Molecular biological diagnostic systems including electrodes |
| EP1067134B1 (en) | 1991-11-07 | 2004-07-28 | Nanotronics, Inc. | Hybridization of polynucleotides conjugated with chromophores and fluorophores to generate donor-to-donor energy transfer system |
| GB9206671D0 (en) | 1992-03-27 | 1992-05-13 | Cranfield Biotech Ltd | Electrochemical detection of dna hybridisation |
| CA2096193A1 (en) * | 1992-06-01 | 1993-12-02 | Daniel L. Woodard | Chemically synthesized silanes that bind nucleic acids |
| US5312527A (en) * | 1992-10-06 | 1994-05-17 | Concordia University | Voltammetric sequence-selective sensor for target polynucleotide sequences |
| FR2703359B1 (fr) | 1993-03-31 | 1995-06-23 | Cis Bio Int | Copolymère nucléotide(s)/polymère conducteur électronique ; son procédé de préparation et son utilisation . |
| WO1995000530A1 (en) | 1993-06-25 | 1995-01-05 | Affymax Technologies N.V. | Hybridization and sequencing of nucleic acids |
| US5871918A (en) * | 1996-06-20 | 1999-02-16 | The University Of North Carolina At Chapel Hill | Electrochemical detection of nucleic acid hybridization |
| CN1192249A (zh) * | 1995-06-27 | 1998-09-02 | 查珀尔希尔北卡罗来纳大学 | 核酸杂交的电化学检测法 |
| IT1275482B (it) | 1995-07-05 | 1997-08-07 | Cooperativa Centro Ricerche Po | Biosensori elettrochimici basati su trasduttori compositi |
-
1999
- 1999-03-12 US US09/267,552 patent/US6180346B1/en not_active Expired - Lifetime
-
2000
- 2000-02-04 JP JP2000605782A patent/JP2002539462A/ja not_active Withdrawn
- 2000-02-04 KR KR1020017011551A patent/KR20010104724A/ko not_active Application Discontinuation
- 2000-02-04 WO PCT/US2000/003110 patent/WO2000055366A1/en not_active Application Discontinuation
- 2000-02-04 EP EP00908508A patent/EP1161560A1/en not_active Withdrawn
- 2000-02-04 CA CA002366866A patent/CA2366866A1/en not_active Abandoned
- 2000-02-04 NZ NZ513604A patent/NZ513604A/xx unknown
- 2000-02-04 CN CNB008047057A patent/CN1165629C/zh not_active Expired - Fee Related
- 2000-02-04 AU AU29835/00A patent/AU775533B2/en not_active Ceased
-
2001
- 2001-09-12 NO NO20014429A patent/NO20014429L/no unknown
-
2002
- 2002-05-16 HK HK02103719.2A patent/HK1044024A1/zh unknown
Also Published As
| Publication number | Publication date |
|---|---|
| AU2983500A (en) | 2000-10-04 |
| NO20014429D0 (no) | 2001-09-12 |
| JP2002539462A (ja) | 2002-11-19 |
| NZ513604A (en) | 2003-03-28 |
| NO20014429L (no) | 2001-11-09 |
| CN1343260A (zh) | 2002-04-03 |
| WO2000055366A1 (en) | 2000-09-21 |
| US6180346B1 (en) | 2001-01-30 |
| EP1161560A1 (en) | 2001-12-12 |
| AU775533B2 (en) | 2004-08-05 |
| CA2366866A1 (en) | 2000-09-21 |
| KR20010104724A (ko) | 2001-11-26 |
| HK1044024A1 (zh) | 2002-10-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1165629C (zh) | 电聚合膜、其制备方法及用途 | |
| Gooding | Electrochemical DNA hybridization biosensors | |
| US6221586B1 (en) | Electrochemical sensor using intercalative, redox-active moieties | |
| Korri-Youssoufi et al. | Toward bioelectronics: specific DNA recognition based on an oligonucleotide-functionalized polypyrrole | |
| Garnier et al. | Toward intelligent polymers: DNA sensors based on oligonucleotide-functionalized polypyrroles | |
| Wang | Towards genoelectronics: electrochemical biosensing of DNA hybridization | |
| de-los-Santos-Álvarez et al. | Current strategies for electrochemical detection of DNA with solid electrodes | |
| Napier et al. | Probing biomolecule recognition with electron transfer: electrochemical sensors for DNA hybridization | |
| KR20020008157A (ko) | 라벨-표지 표적을 검출하기 위한 단일층 및 전극과 그것의사용방법 | |
| Liu et al. | Ultrasensitive DNA detection based on coulometric measurement of enzymatic silver deposition on gold nanoparticle-modified screen-printed carbon electrode | |
| Popovich et al. | New strategies for electrochemical nucleic acid detection | |
| Teymourian et al. | Development of a New Label‐free, Indicator‐free Strategy toward Ultrasensitive Electrochemical DNA Biosensing Based on Fe3O4 Nanoparticles/Reduced Graphene Oxide Composite | |
| Bizid et al. | Direct Electrochemical DNA Sensor based on a new redox oligomer modified with ferrocene and carboxylic acid: Application to the detection of Mycobacterium tuberculosis mutant strain | |
| US6387625B1 (en) | Monolayer and electrode for detecting a label-bearing target and method of use thereof | |
| Fojta et al. | Electrochemical stripping techniques in analysis of nucleic acids and their constituents | |
| EP1425419A2 (en) | Electrochemical sensor using intercalative, redox-active moieties | |
| Silva et al. | Dual signaling DNA electrochemistry: an approach to understand DNA interfaces | |
| Rivas et al. | Electrochemical biosensors for sequence‐specific DNA detection | |
| Bouchet et al. | Cylinder-shaped conducting polypyrrole for labelless electrochemical multidetection of DNA | |
| Ye et al. | Screen-printed electrode-based biosensors modified with functional nucleic acid probes and their applications in this pandemic age: a review | |
| Palecek et al. | Electrochemical DNA sensors | |
| JP2006520469A (ja) | 生体分子検出のための方法と装置 | |
| Wang et al. | New acridone derivatives for the electrochemical DNA-hybridisation labelling | |
| US20040152091A1 (en) | Biosensor, device and method for detecting nucleic acids by means of at least two units for immobilizing nucleic acids | |
| Wang | Electrochemical nucleic acid biosensors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C19 | Lapse of patent right due to non-payment of the annual fee | ||
| CF01 | Termination of patent right due to non-payment of annual fee |