CN103285395A - 治疗剂的组合和给予方式以及联合治疗 - Google Patents
治疗剂的组合和给予方式以及联合治疗 Download PDFInfo
- Publication number
- CN103285395A CN103285395A CN2013102337091A CN201310233709A CN103285395A CN 103285395 A CN103285395 A CN 103285395A CN 2013102337091 A CN2013102337091 A CN 2013102337091A CN 201310233709 A CN201310233709 A CN 201310233709A CN 103285395 A CN103285395 A CN 103285395A
- Authority
- CN
- China
- Prior art keywords
- compositions
- treatment
- nano
- taxane
- particle
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/141—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers
- A61K9/146—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers with organic macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/337—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having four-membered rings, e.g. taxol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/165—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/17—Amides, e.g. hydroxamic acids having the group >N—C(O)—N< or >N—C(S)—N<, e.g. urea, thiourea, carmustine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/28—Compounds containing heavy metals
- A61K31/282—Platinum compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/436—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a six-membered ring having oxygen as a ring hetero atom, e.g. rapamycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/517—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with carbocyclic ring systems, e.g. quinazoline, perimidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/555—Heterocyclic compounds containing heavy metals, e.g. hemin, hematin, melarsoprol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/675—Phosphorus compounds having nitrogen as a ring hetero atom, e.g. pyridoxal phosphate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/69—Boron compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7028—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages
- A61K31/7034—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin
- A61K31/704—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin attached to a condensed carbocyclic ring system, e.g. sennosides, thiocolchicosides, escin, daunorubicin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
- A61K31/7064—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines
- A61K31/7068—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines having oxo groups directly attached to the pyrimidine ring, e.g. cytidine, cytidylic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7042—Compounds having saccharide radicals and heterocyclic rings
- A61K31/7052—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides
- A61K31/706—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom
- A61K31/7064—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines
- A61K31/7068—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines having oxo groups directly attached to the pyrimidine ring, e.g. cytidine, cytidylic acid
- A61K31/7072—Compounds having saccharide radicals and heterocyclic rings having nitrogen as a ring hetero atom, e.g. nucleosides, nucleotides containing six-membered rings with nitrogen as a ring hetero atom containing condensed or non-condensed pyrimidines having oxo groups directly attached to the pyrimidine ring, e.g. cytidine, cytidylic acid having two oxo groups directly attached to the pyrimidine ring, e.g. uridine, uridylic acid, thymidine, zidovudine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/24—Heavy metals; Compounds thereof
- A61K33/243—Platinum; Compounds thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/38—Albumins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/42—Proteins; Polypeptides; Degradation products thereof; Derivatives thereof, e.g. albumin, gelatin or zein
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/643—Albumins, e.g. HSA, BSA, ovalbumin or a Keyhole Limpet Hemocyanin [KHL]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6921—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere
- A61K47/6927—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being a solid microparticle having no hollow or gas-filled cores
- A61K47/6929—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being a solid microparticle having no hollow or gas-filled cores the form being a nanoparticle, e.g. an immuno-nanoparticle
- A61K47/6931—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being a particulate, a powder, an adsorbate, a bead or a sphere the form being a solid microparticle having no hollow or gas-filled cores the form being a nanoparticle, e.g. an immuno-nanoparticle the material constituting the nanoparticle being a polymer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/08—Peptides, e.g. proteins, carriers being peptides, polyamino acids, proteins
- A61K51/10—Antibodies or immunoglobulins; Fragments thereof, the carrier being an antibody, an immunoglobulin or a fragment thereof, e.g. a camelised human single domain antibody or the Fc fragment of an antibody
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5107—Excipients; Inactive ingredients
- A61K9/513—Organic macromolecular compounds; Dendrimers
- A61K9/5169—Proteins, e.g. albumin, gelatin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N5/00—Radiation therapy
- A61N5/10—X-ray therapy; Gamma-ray therapy; Particle-irradiation therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/08—Vasodilators for multiple indications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y5/00—Nanobiotechnology or nanomedicine, e.g. protein engineering or drug delivery
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2121/00—Preparations for use in therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Abstract
本发明提供了治疗增殖性疾病(如癌症)的联合治疗方法,包括第一治疗和第二治疗,所述第一治疗包括给予个体纳米颗粒组合物中的有效量的紫杉烷,所述第二治疗可以包括,例如,放射、手术、给予化疗剂或它们的组合。也提供了根据节律性(metronomic)给药方案,给予个体纳米颗粒组合物中的药物紫杉烷的方法。
Description
本申请是申请日为2006年2月21日、申请号为200680011677.9、题为“治疗剂的组合和给予方式以及联合治疗”的专利申请的分案申请。
相关申请
本申请要求2005年2月18日提交的临时专利申请60/654,245的优先权权益,其整体并入本文作为参考。
技术领域
本发明涉及治疗增殖性疾病的方法和组合物,包括施用紫杉烷(taxane)和至少一种其它化疗剂,以及用于治疗增殖性疾病的其它治疗形式的联合。特别地,本发明涉及应用包含紫杉醇(paclitaxel)和白蛋白的纳米颗粒(如AbraxaneTM)并联合其它化疗剂或放疗,所述其它化疗剂或放疗可以用于治疗癌症。
背景
大量的肿瘤不对药物和/或放疗起反应,这是癌症治疗中的一个严重的问题。事实上,虽然在化疗领域中取得了一些进展,上述问题是许多最普遍形式的人类癌症仍然抵抗有效的化疗干预的主要原因之一。
现在,主要应用三种疗法中的一种或组合来治疗癌症:手术、放疗和化疗。手术是传统方法,其中肿瘤被全部或部分地从机体去除。一般地,手术仅对治疗较早期癌症有效。虽然手术在去除一些部位的肿瘤方面有时是有效的,例如,在乳腺、结肠和皮肤肿瘤时,但它不能用于治疗位于手术达不到的其它部位的肿瘤,也不能用于治疗播散性肿瘤情况如白血病。对于50%以上的癌症个体,在它们被诊断时,它们不再是有效的手术治疗候选者。手术方法可能增加手术期间肿瘤通过血液循环的转移。大多数癌症个体不是在诊断或手术时死于癌症,而是死于癌症的转移和复发。
其它治疗也常常是无效的。放射治疗仅对癌症早期和中期表现为临床局部化疾病的个体有效,对于伴有转移的晚期癌症是无效的。放疗一般用于含有异常增殖性组织的对象机体中的限定区域,目的是使异常组织吸收的剂量最大化并使附近正常组织吸收的剂量最小化。然而,将治疗性放射选择性给予异常组织是困难的(如果不是不可能的)。因此,与异常组织接近的正常组织在整个治疗过程中也暴露于潜在的损害性剂量的放射。也存在一些治疗,它们在称为“全身放射”或“TBI”的过程中,需要将对象的全部身体暴露于放射。放疗技术在破坏异常增殖细胞中的效应从而由于对附近正常细胞相关的细胞毒性作用而被抵消。因此,放疗技术具有固有的窄的治疗指数,使得大多数肿瘤被不充分治疗。甚至最佳的放疗技术也引起不完全的肿瘤缩小、肿瘤复发、增加肿瘤负荷和诱导对放射具有抗性的肿瘤。
化学治疗包含细胞复制或细胞代谢的破坏。化疗可以是有效的,但具有严重的副作用,例如,恶心、白细胞(WBC)减少、脱发、体重减轻和其它毒性作用。由于极端的毒性副作用,许多癌症个体不能成功地完成整个化疗方案。化疗诱导的副作用显著影响个体的生活质量,并可以明显影响个体对治疗的依从性。此外,与化疗剂有关的不利副作用一般是给予这些药物中的主要的剂量限制性毒性(DLT)。例如,粘膜炎是几种抗癌药的主要剂量限制性毒性之一,所述抗癌药包括抗代谢剂细胞毒性药5-FU、甲氨喋呤和抗肿瘤抗生素如阿霉素。这些化疗诱导的副作用中的许多如果严重的话可能导致住院治疗,或者需要止痛剂治疗疼痛。一些癌症个体由于对化疗的耐受不良而死于化疗。抗癌药的极端副作用是由这些药物的靶向特异性不良而引起的。药物循环通过个体的大多数正常器官以及目标靶肿瘤。引起副作用的靶特异性不良也降低化疗的效果,因为仅有一部分药物被正确靶向。化疗的效果由于抗癌药在靶肿瘤内的保持性差而被进一步降低。
归因于赘生物、肿瘤和癌症的严重程度和广度,存在着对克服手术、化疗和放疗的各种缺点的有效治疗这种疾病或病症的巨大需求。
化疗剂的问题
药物抵抗问题是联合化疗的重要性增加的一个原因,因为所述治疗必需避免抗性细胞的产生和杀死预先存在的已经具有药物抗性的细胞。
药物抵抗是用于疾病不响应于一种或多种治疗药物的情况的名称。药物抵抗可以是固有的,这意味着疾病从未对药物产生响应,或者可以是获得性的,这意味着疾病停止对药物产生响应,该疾病曾经对所述药物具有反应。多重药物抵抗(MDR)是特定类型的药物抵抗,其特征是疾病对一种以上功能上和/或结构上不相关的药物具有交叉抵抗。癌症领域中的多重药物抵抗在“Detoxification Mechanismsand Tumor Cell Resistance to Anticancer Drugs”,Kuzmich and Tew,特别是部分VII“The Multidrug-Resistant Phenotype(MDR),”Medical Research Reviews,Vol.11,No.2,185-217,(部分VII在208-213页)(1991);和“Multidrug Resistance andChemosensitization:Therapeutic Implications for Cancer Chemotherapy”,Georges,Sharom and Ling,Advances in Pharmacology,Vol.21,185-220(1990)中详述。
多重药物抵抗(MDR)的一种形式是由被称作P-糖蛋白(P-gp)的膜结合的170-180kD的能量依赖性流出泵介导的。已经显示,P-糖蛋白在许多人肿瘤对疏水性天然产物药物的固有和获得性抵抗中起关键作用。作为P-gp的底物并且因而被P-gp解毒的药物包括长春花碱(长春新碱和长春碱)、蒽环类抗生素(阿霉素)和表鬼臼毒素(依托泊甙)。虽然与P-gp有关的MDR是肿瘤细胞对化疗剂抵抗的主要决定因素,显然,MDR现象是多因素的并且包含许多不同的机制。
癌症化疗和抗病毒化疗的一个主要并发症是对骨髓细胞的损伤或对其功能的抑制。具体地,化疗损伤或破坏主要见于骨髓和脾的造血前体细胞,从而削弱了新的血细胞(粒细胞、淋巴细胞、红细胞、单核细胞、血小板等)的产生。例如,用5-氟尿嘧啶治疗癌症个体,降低白细胞数目(淋巴细胞和/或粒细胞),并且可以引起个体对感染的敏感性增强。许多癌症个体死于化疗后感染或造血失败的其它后果。化疗剂也可以引起血小板形成低于正常水平,产生出血倾向。对红细胞产生的抑制可以引起贫血。对于一些癌症个体,对造血系统或其它重要组织的损伤的风险常常限制将化疗剂的化疗剂量增加至足以提供良好的抗肿瘤或抗病毒效应的机会。重复化疗或高剂量化疗周期可能引起严重的干细胞损耗,从而导致严重的长期造血后遗症和骨髓耗竭。
防止化疗副作用或保护免遭化疗副作用,将对癌症个体的有巨大的益处。对于威胁生命的副作用,所作的努力集中于改变化疗剂的剂量和时间安排来降低副作用。其它的选择也可以利用,如应用粒细胞集落刺激因子(G-CSF)、粒细胞-巨噬细胞-CSF(GM-CSF)、表皮生长因子(EGF)、白介素11、促红细胞生成素、血栓形成素、巨核细胞生成和生长因子、pixykines、干细胞因子、FLT-配体、以及白介素1、3、6和7,以便增加化疗开始前各种组织中的正常细胞数量(参见,Jimenez andYunis,Cancer Research52:413-415;1992)。这些因子的保护机制虽然未被充分了解,但是最可能与细胞毒剂治疗前正常的关键靶细胞的数目增加有关,并且与化疗后细胞存活增加无关。
肿瘤治疗的化疗靶向性
实体肿瘤的生长和转移是血管发生依赖性的(Folkman,J.Cancer Res.,46,467-73(1986);Folkman,J.Nat.Cancer Inst.,82,4-6(1989);Folkman et al.,"TumorAngiogenesis,"Chapter10,pp.206-32,The Molecular Basis of Cancer,Mendelsohn etal.,eds.(W.B.Saunders,1995))。已经显示,例如,增大至直径2mm以上的肿瘤必需获得它们自身的血液供应并且通过诱导新毛细血管生长实现这一点。这些新血管埋入肿瘤后,它们提供对于肿瘤生长必要的营养物和生长因子以及肿瘤细胞进入循环和转移到远部如肝脏、肺或骨的手段(Weidner,New Eng.J.Med.,324(1),1-8(1991))。当被用作携带肿瘤动物的药物时,血管发生的天然抑制剂可以防止小肿瘤的生长(O′Reilly et al,O′Reilly et al.,Cell,79,315-28(1994))。事实上,在一些方案中,这种抑制剂的应用使得肿瘤退化和静止,甚至在治疗结束后(O'Reilly et al.,Cell,88,277-85(1997))。而且,提供血管发生抑制剂到一些肿瘤能够加强它们对其它治疗方案(例如化疗)的反应(参见,例如,Teischer et al.,Int.J.Cancer,57,920-25(1994))。
蛋白酪氨酸激酶催化参与调节细胞生长和分化的多种蛋白质中的特定酪氨酰残基磷酸化(A.F.Wilks,Progress in Growth Factor Research,1990,2,97-111;S.A.Courtneidge,Dev.Supp.l,1993,57-64;J.A.Cooper,Semin.Cell Biol,1994,5(6),377-387;R.F.Paulson,Semin.Immunol.,1995,7(4),267-277;A.C.Chan,Curr.Opin.Immunol.,1996,8(3),394-401)。蛋白酪氨酸激酶可以被广义地归类为受体(例如,EGFr、c-erbB-2、c-met、tie-2、PDGFr、FGFr)或非受体(例如,c-src、Ick、Zap70)激酶。已显示,这些激酶中的许多的不适当或不受控制的激活,即,蛋白酪氨酸激酶活性异常,例如,由于过表达或突变所致,引起不受控制的细胞生长。例如,表皮生长因子受体(EGFR)活性增加涉及小细胞肺癌、膀胱癌和头颈癌,c-erbB-2活性增加涉及乳腺癌、卵巢癌、胃癌和胰腺癌。因此,蛋白酪氨酸激酶抑制应该可用于治疗如上列出的肿瘤。
生长因子是诱导细胞增殖的物质,典型地通过与细胞表面上的特定受体结合实现。表皮生长因子(EGF)诱导体内多种细胞增殖,并且是大多数培养细胞生长所需的。EGF受体是170-180kD的跨膜糖蛋白,可以在多种细胞类型上检测到。该受体的细胞外N端结构域被高度糖基化,并且与选择性结合EGFR的EGF抗体结合。已经应用竞争性结合EGFR的药剂来治疗一些类型的癌症,因为许多中胚层和外胚层起源的肿瘤过表达EGF受体。例如,已显示EGF受体在许多神经胶质瘤、鳞状细胞癌、乳腺癌、黑色素瘤、侵入性膀胱癌和食道癌中过表达。研究EGFR系统以获得抗肿瘤治疗的尝试一般包括应用针对EGFR的单克隆抗体。此外,原发性人乳腺肿瘤的研究显示,EGFR高度表达和存在转移、增殖速度增高和个体存活时间较短之间具有相关性。
Herlyn et al在美国专利5,470,571中公开了应用放射标记Mab425治疗表达EGFR的神经胶质瘤。Herlyn et al.报道,抗-EGFR抗体可以刺激或抑制癌细胞生长和增殖。已报道,对EGFR有特异性的其它单克隆抗体—或是单独地或是与细胞毒性化合物偶联,对治疗一些类型的癌症是有效的。Bendig et al在美国专利5,558,864中公开了治疗性抗-EGFR Mab,其与EGFR竞争性结合。Heimbrook et al.在美国专利5,690,928中公开了应用与来源于假单胞菌某种的内毒素融合的EGF治疗膀胱癌症。Brown et al.在美国专利5,859,018中公开了治疗以由EGF等介导的细胞高增殖为特征的疾病的方法。
施用的化疗方式
应用单一或多种化疗剂进行频繁治疗被诊断患有癌症的人,以杀死肿瘤原发部位或癌症转移的远端部位的癌细胞。一般地,化疗治疗或是在单剂量或几个大剂量中给予,或是在数周至数月的变化时间期间给予。然而,重复化疗或高剂量周期化疗可以引起毒性增加和严重的副作用。
新的研究表明,节律性化疗(metronomic chemotherapy)——即低剂量和频繁给予细胞毒性剂而没有延长的无药物间隔,靶向肿瘤血管中活化的内皮细胞。许多临床前期研究表明,节律性方案相比于最大耐受剂量(MTD)对应方案具有优越的抗肿瘤效应、有效的抗血管发生作用、和减轻的毒性和副作用(例如,骨髓抑制)(Bocci,et al.,Cancer Res,62:6938-6943,(2002);Bocci,et al.,PNAS,vol,100(22):12917-12922,(2003);和Bertolini,et al.,Cancer Res,63(15):4342-4346,(2003))。是否所有的化疗剂发挥相似作用或是否一些化疗剂比其它化疗剂更适于这种方案,仍然是未知的。然而,节律性化疗在克服与化疗有关的一些主要缺点方面似乎是有效的。
化疗剂
已经显示,紫杉醇在药物难治性卵巢癌中具有明显的抗肿瘤和抗癌作用,并且在宽范围的肿瘤模型中表现出优异的抗肿瘤活性,并且在以非常低的剂量应用时也抑制血管发生(Grant et al.,Int.J.Cancer,2003)。然而,紫杉醇的水溶性差为施用于人类提出了难题。事实上,在含水介质中固有地不溶或溶解性差的药物的输送可以被严重削弱,如果经口输送不是有效的。因此,目前应用的紫杉醇制剂(例如,)需要聚氧乙烯蓖麻油()来溶解药物。在此制剂中的存在与动物(Lorenz et al.,Agents Actions7:63-67(1987))和人(Weiss et al.,J.Clin.Oncol.8:1263-68(1990))的严重超敏反应有关,因而需要对个体预先应用皮质类固醇(地塞米松)和抗组胺剂。也报道,制剂载体聚氧乙烯蓖麻油(EL)在中的临床相关的浓度使得紫杉醇的抗血管生成作用无效,这表明在Cremophor EL中配制的这一药物或其它抗癌药可能需要在比实现有效节律性化疗所预期的剂量高的剂量下应用(Ng et al.,Cancer Res.,64:821-824(2004))。因而,与传统的MTD化疗相比,缺乏与低剂量紫杉醇方案有关的不利副作用的优势可能被破坏。也参见美国专利公布2004/0143004;WO00/64437。
临床前期模型已经显示,相比于(Desai et al.,EORTC-NCI-AACR,2004)和在患有转移性乳腺癌个体中(O′Shaughnessy et al.,San Antonio Breast CancerSymposium,Abstract#1122,Dec.2003),AbraxaneTM在安全性和效率方面显著改进。这可能是由于AbraxaneTM中不存在表面活性剂(例如,或,分别用在和中),和/或优先应用基于白蛋白的转运机制,该机制利用微血管内皮细胞上的gp60/小凹(caveolae)(Desai et al.,EORTC-NCI-AACR,2004)。此外,已经显示,和强烈抑制紫杉醇与白蛋白的结合,可能影响基于白蛋白的转运(Desai et al.,EORTC-NCI-AACR,2004)。
IDN5109(Ortataxel)是新的紫杉烷,目前在II期中,由于其在表达多重药物抗性表型的肿瘤细胞系(MDR/Pgp)中缺乏交叉抵抗和对P糖蛋白(P gp)的抑制而被选择(Minderman;Cancer Chemother.Pharmacol.2004;53:363-9)。由于其疏水性,IDN5109目前在表面活性剂(与相同的载体)中被配制。从紫杉烷制剂中去除表面活性剂,例如,在纳米颗粒白蛋白结合的紫杉醇(AbraxaneTM)的情况下,显示出与它们的含表面活性剂的对应物相比,具有改进的安全性和效率(O′Shaughnessy et al.,San Antonio Breast Cancer Symposium,Abstract#1122,Dec.2003)。也强烈抑制紫杉烷、紫杉醇与白蛋白的结合,可能破坏通过微血管内皮细胞上的gp60受体的、基于白蛋白的药物转运(Desai et al.,EORTC-NCI-AACR,2004)。
秋藏红花,秋水仙(Colchicum autumnale)和非洲攀爬性百合,嘉兰(Gloriosasuperba)中的主要生物碱—秋水仙碱的抗肿瘤活性,在20世纪初被首次报道。通过X射线研究和许多总合成,其结构最终被阐明(参见Shiau et al.,J.Pharm.Sci.1978,67(3)394-397)。秋水仙碱被认为是有丝分裂毒性剂,特别是在tyhmic、肠和造血细胞中,其作为纺锤体毒性剂并且阻止运动。它对有丝分裂纺锤体的作用被认为代表了它对多种有关结构和运动的组织化的、易变的纤维系统的作用的一个具体例子。
硫代秋水仙碱(Thiocolchicine)二聚体IDN5404由于其在对顺铂和托泊替康A2780-CIS和A2780-TOP具有抗性的人卵巢癌亚系中的活性而被选择。该作用涉及双重作用机制,即,如在长春花碱中微管活性,和不同于喜树碱的拓扑异构酶I抑制作用。(Raspaglio,Biochemical Pharmacology69:113-121(2005))。
已发现,联合化疗,例如,将一种或多种化疗剂或其它治疗方式联合,例如,将化疗与放射或手术和化疗联合,比分别单药化疗或单独治疗方式更成功。
其它参考包括美国公布2006/0013819;美国公布2006/0003931;WO05/117986;WO05/117978和WO05/000900。
需要对增殖性疾病,特别是癌症的更有效治疗。
本文提及的所有出版物、专利、专利申请和公开的专利申请的公开内容以整体并入本文作为参考。
发明简述
本发明提供了治疗增殖性疾病如癌症的方法。本发明提供了治疗增殖性疾病(如癌症)的联合治疗方法,所述方法包括a)第一治疗,包括给予个体有效量的组合物,所述组合物包括含有紫杉烷(如紫杉醇)和载体蛋白(如白蛋白)的纳米颗粒,和b)第二治疗,如化疗、放疗、手术、或其组合。在另一方面,提供了根据节律性给药方案给予个体组合物的方法,所述组合物包括含有紫杉烷(如紫杉醇)和载体蛋白(如白蛋白)的纳米颗粒。
在一些实施方式中,本发明提供了治疗个体的增殖性疾病(如癌症)的方法,包括给予个体a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒,和b)有效量的至少一种其它化疗剂。在一些实施方式中,本发明提供了治疗个体的增殖性疾病(如癌症)的方法,包括给予个体a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒(如AbraxaneTM),和b)有效量的至少一种其它化疗剂。在一些实施方式中,化疗剂是任何下列物质(以及在一些实施方式中,化疗剂选自):抗代谢物(包含核苷类似物)、基于铂的药剂、烷化剂、酪氨酸激酶抑制剂、蒽环类抗生素、长春花碱、蛋白酶体抑制剂、大环内酯类和拓扑异构酶抑制剂。在一些实施方式中,化疗剂是基于铂的药剂,如卡铂。
在一些实施方式中,含有纳米颗粒的组合物(也称为“纳米颗粒组合物”)和化疗剂或是在同一组合物中或是在独立的组合物中同时给予。在一些实施方式中,纳米颗粒组合物和化疗剂被相继给予,即,在给予化疗剂之前或之后给予纳米颗粒组合物。在一些实施方式中,纳米颗粒组合物和化疗剂同时给予,即,纳米颗粒组合物和化疗剂的给药时间互相重叠。在一些实施方式中,纳米颗粒组合物和化疗剂不同时给予。例如,在一些实施方式中,在给予化疗剂之前终止纳米颗粒组合物的给予。在一些实施方式中,在给予纳米颗粒组合物之前终止化疗剂的给予。
在一些实施方式中,第一治疗紫杉烷是纳米颗粒白蛋白结合的紫杉醇,如美国专利6,566,405所述,可以以商品名AbraxaneTM经商业途径得到。此外,第一治疗紫杉烷也被认为是纳米颗粒白蛋白结合的多烯紫杉醇(docetaxel),例如,描述于美国专利公布2005/0004002A1。
另一方面,提供了治疗个体的增殖性疾病(如癌症)的方法,该方法包括a)第一治疗,包括给予个体组合物,该组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒,和b)第二治疗,包括放疗、手术或其组合。在一些实施方式中,提供了治疗个体的增殖性疾病(如癌症)的方法,该方法包括a)第一治疗,包括给予个体组合物,该组合物包括含有紫杉醇和白蛋白的纳米颗粒(如AbraxaneTM),和b)第二治疗,包括放疗、手术或其组合。在一些实施方式中,第二治疗是放疗。在一些实施方式中,第二治疗是手术。在一些实施方式中,在第二治疗之前进行第一治疗。在一些实施方式中,在第二治疗之后进行第一治疗。
另一方面,所述方法包括给予患有增殖性疾病(如癌症)的哺乳动物联合治疗,所述联合治疗包括含有紫杉烷的第一治疗和选自化疗剂和放疗或其组合的第二治疗。联合治疗可以以多种方式中的任何方式给予,如相继给予或同时给予,如果是相继给予,可以在给予第二治疗之前或之后给予紫杉烷,虽然优选首先给予含有紫杉烷的第一治疗。也将被理解,第二治疗可以包括一种以上的化疗剂。
本发明也提供了节律性治疗方案。在一些实施方式中,提供了给予组合物的方法,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒,其中所述纳米颗粒组合物在至少一个月期间施用,其中每次施用之间的间隔不多于大约一周,并且其中每次施用时的紫杉烷剂量为遵照传统给药方案的其最大耐受剂量的大约0.25%至约25%。在一些实施方式中,提供了给予组合物的方法,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒(如AbraxaneTM),其中所述纳米颗粒组合物在至少一个月期间施用,其中每次施用之间的间隔不多于大约一周,并且其中每次施用时的紫杉醇剂量为遵照传统给药方案的其最大耐受剂量的大约0.25%至约25%。在一些实施方式中,紫杉烷(如紫杉醇,例如AbraxaneTM)的每次给药剂量是最大耐受剂量的约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、18%、20%、22%、24%或25%中的任何百分比以下。在一些实施方式中,纳米颗粒组合物以每周至少约1×、2×、3×、4×、5×、6×、7×(即,每日)中的任何频率给药。在一些实施方式中,每次给药间的间隔是约7日、6日、5日、4日、3日、2日和1日中的任何时间间隔以下。在一些实施方式中,纳米颗粒组合物在至少约2、3、4、5、6、7、8、9、10、11、12、18、24、30和36个月中的任一期间给药。
在一些实施方式中,提供了给予组合物的方法,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒,其中所述紫杉烷在至少一个月期间施用,其中每次施用之间的间隔不多于大约一周,并且其中每次施用时的紫杉烷剂量为约0.25mg/m2至约25mg/m2。在一些实施方式中,提供了给予组合物的方法,所述组合物包括含有紫杉醇和白蛋白和载体蛋白(如白蛋白)的纳米颗粒(如AbraxaneTM),其中所述紫杉醇在至少一个月期间施用,其中每次施用之间的间隔不多于大约一周,并且其中每次施用时的紫杉烷剂量是约0.25mg/m2至约25mg/m2。在一些实施方式中,紫杉烷(如紫杉醇,例如AbraxaneTM)的每次给药剂量是约2、3、4、5、6、7、8、9、10、11、12、13、14、15、18、20、22和25mg/m2中的任何剂量以下。在一些实施方式中,纳米颗粒组合物以每周至少约1×、2×、3×、4×、5×、6×、7×(即,每日)中的任一情形给药。在一些实施方式中,每次给药间的间隔是约7日、6日、5日、4日、3日、2日和1日中的任何间隔以下。在一些实施方式中,纳米颗粒组合物在至少约2、3、4、5、6、7、8、9、10、11、12、18、24、30和36个月中的任一期间给药。
本发明的方法一般包括给予组合物,所述组合物包括含有紫杉烷和载体蛋白的纳米颗粒。在一些实施方式中,纳米颗粒组合物包括含有紫杉醇和白蛋白的纳米颗粒。在一些实施方式中,紫杉醇/白蛋白纳米颗粒的平均直径不大于约200nm。在一些实施方式中,紫杉醇/白蛋白纳米颗粒组合物基本上不含(如不含)表面活性剂(如Cremophor)。在一些实施方式中,组合物中的白蛋白与紫杉醇的重量比为约18:1或更低,如约9:1或更低。在一些实施方式中,紫杉醇包被有白蛋白。在一些实施方式中,紫杉醇/白蛋白纳米颗粒的平均直径不大于约200nm,并且紫杉醇/白蛋白组合物基本上不含(如不含)表面活性剂(如Cremophor)。在一些实施方式中,紫杉醇/白蛋白纳米颗粒的平均直径不大于约200nm,并且紫杉醇包被有白蛋白。上述特征的其它组合也被考虑。在一些实施方式中,纳米颗粒组合物是AbraxaneTM。含有其它紫杉烷(如多烯紫杉醇和ortataxel)的纳米颗粒组合物也包括上述特征中的一种或多种。
通过阅读随后的详述和所附权利要求,本发明的这些方面和优势以及其它方面和优势将是显而易见的。也将被理解,本文所述的多种实施方案中的一种、一些或所有特性可以被组合,以形成本发明的其他实施方式。
附图简述
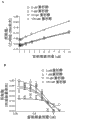
图1A示出了ABI-007对大鼠主动脉环血管发生的影响。图1B示出了ABI-007对人内皮细胞增殖的影响。图1C示出了ABI-007对内皮细胞管形成的影响。
图2示出了对用于节律性给药的ABI-007的最佳生物学剂量的确定。图中示出了对渐增剂量的ABI-007作出响应的Balb/cJ小鼠外周血中,存活的循环内皮祖细胞(CEPs)的水平。Untr'd,未处理对照;S/A,盐水/白蛋白载体对照。柱条,均值±SE。*与未处理对照显著不同(p<0.05)。
图3A和3B示出了节律性或MTD方案中应用的ABI-007和Taxol对带有MDA-MB-231(A)和PC3(B)肿瘤的SCID小鼠的肿瘤生长的影响。图3C和3D示出了节律性或MTD方案中应用的ABI-007和Taxol对带有MDA-MB-231(C)和PC3(D)肿瘤的SCID小鼠的体重的影响。
图4A和4B示出了在应用下列药物治疗之后,携带MDA-MB-231(图4A)和PC3(图4B)肿瘤的SCID小鼠的外周血中,存活的循环内皮祖细胞(CEPs)的水平的变化:A,盐水/白蛋白;B,Cremophor EL对照;C,节律性Taxol,1.3mg/kg;D、E和F,节律性ABI-007,分别是3、6和10mg/kg;G,MTD Taxol;H,MTDABI-007。柱条:均值±SE。a与盐水/白蛋白载体对照明显不同(p<0.05)。b与Cremophor EL载体对照明显不同(p<0.05)。
图5A示出了应用下列物质治疗的MDA-MB-231(■)和PC3(□)异种移植物的肿瘤内微血管密度:A,盐水/白蛋白;B,Cremophor EL对照;C,节律性Taxol,1.3mg/kg;D、E和F,节律性ABI-007,分别是3、6和10mg/kg;G,MTD Taxol;H,MTD ABI-007。柱条:均值±SE。图5B和图5C示出了在携带MDA-MB-231(图5B)和PC3(图5C)肿瘤的SCID小鼠中,肿瘤内微血管密度和外周血中存活CEPs数目之间的关联性。
图6示出了在皮下注射入Balb/cJ小鼠侧腹的基质栓(Matrigel plug)中,应用于节律性或MTD方案中的ABI-007或Taxol对碱性成纤维细胞生长因子(bFGF)-诱导的血管发生的影响。处理——A,盐水/白蛋白;B,Cremophor EL对照;C,节律性Taxol1.3mg/kg;D、E和F,节律性ABI-007,分别是3、6和10mg/kg;G,MTD Taxol;H,MTD ABI-007。不带有bFGF(-bEGF)的植入的基质(Matrigel)作为阴性对照。柱条,均值±SE。
图7A和图7B示出了nab-雷帕霉素与AbraxaneTM联合对血管平滑肌细胞的细胞毒性活性。细胞毒性通过用乙啡啶同型二聚体-1染色而测定(图7A)或通过用钙黄氯素染色而测定(图7B)。
图8示出了在HT29人结肠癌异种移植物模型中,nab-雷帕霉素与AbraxaneTM联合的细胞毒性活性。
图9示出了在H358人肺癌异种移植物中,nab-17-AAG与AbraxaneTM联合的细胞毒性活性。
发明详述
本发明提供了联合治疗方法,包括第一治疗与第二治疗联合,第一治疗包括给予含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒,第二治疗如放疗、手术、给予至少一种其它化疗剂或它们的组合。本发明也提供了节律性治疗方法。
本发明涉及这样的发现:AbraxaneTM由于其优越的抗肿瘤活性和降低的毒性和副作用,能够与其它治疗药和/或治疗形式联合施用,并且也能够在节律性化疗中应用。由于含有药物/载体蛋白纳米颗粒的组合物(如AbraxaneTM)的安全性显著改善,我们认为,应用这种纳米颗粒组合物(如AbraxaneTM)的联合化疗比应用其它药物的联合化疗更加有效。另外,纳米颗粒组合物(如AbraxaneTM)与放射的联合应用也被认为比其它药物与放射的联合更加有效。因此,当纳米颗粒组合物(特别是紫杉醇/白蛋白纳米颗粒组合物,如AbraxaneTM)与其它化疗药联合使用时,或者与其它治疗形式联合使用时,应该非常有效并且克服手术、放疗和化疗在治疗增殖性疾病(如癌症)中的缺陷。
本发明在一个实施方式中,是第一治疗和第二治疗联合用于治疗增殖性疾病如癌症,第一治疗包括紫杉烷如AbraxaneTM,第二治疗如另一化疗药或几种化疗药、放射或类似治疗。包括紫杉烷的第一治疗和第二治疗可以相继给予患有增殖性疾病的哺乳动物,或者可以同时给予,甚至在同一药物组合物中同时给予。
进一步地,已发现,应用AbraxaneTM的节律性给药方案比相同药物组合物的传统MTD给药方案更加有效。已发现,AbraxaneTM的这种节律性给药方案比的节律性给药更加有效。
本文所述方法一般用于治疗疾病,特别是增殖性疾病。如本文所用,“治疗”是获得有益或所需临床结果的方法。对于本发明目的,有益或所需临床结果包括但不限于下列任一或多个:一种或多种症状的缓解、疾病程度减轻、疾病的稳定状态(即,不恶化)、预防或延迟疾病播散(例如,转移)、防止或延迟疾病发生或复发、延迟或减慢疾病进展、疾病状态改善、和好转(部分或全部)。“治疗”也包括增殖性疾病的病理后果减轻。本发明方法考虑了这些治疗方面中的任一或多种。
如本文所用,“增殖性疾病”被定义为肿瘤疾病(包括良性或恶性)和/或任何转移,不论肿瘤或转移位于何处,更具体地,被定义为选自下列一种或多种的肿瘤(在一些实施方式中,选自):乳腺癌、泌尿生殖系统癌症、肺癌、胃肠癌、表皮癌、黑色素瘤、卵巢癌、胰腺癌、神经母细胞瘤、结肠直肠癌、头颈癌。在本发明的更宽意义上,增殖性疾病可以进一步选自高增殖性疾病如增生、纤维化(特别是肺,但是也有其它类型的纤维化,如肾纤维化)、血管生成、牛皮癣、动脉粥样硬化和血管平滑肌增殖,如血管成形术后狭窄或再狭窄。在一些实施方式中,增殖性疾病是癌症。在一些实施方式中,增殖性疾病是非癌性疾病。在一些实施方式中,增殖性疾病是良性或恶性肿瘤。当上文和下文提及肿瘤、肿瘤病、癌或癌症时,也可选地或附加地暗示原发器官或组织和/或任何其它位置的转移,不论肿瘤和/或转移的部位在何处。
本文所用术语“有效量”是指足以治疗特定障碍、症状或疾病,如改善、缓解、减轻和/或延迟其一种或多种症状的化合物或组合物的量。当提及癌症或其它不需要的细胞增殖时,有效量包括足以引起肿瘤皱缩和/或降低肿瘤生长速度(如抑制肿瘤生长)或防止或延迟其它不需要的细胞增殖的量。在一些实施方式中,有效量是足以延迟疾病发展的量。在一些实施方式中,有效量是足以防止或延迟发生和/或再发的量。有效量可以在一次或多次给药中施用。在癌症的情况下,有效量的药物或组合物可以:(i)减少癌细胞数量;(ii)减小肿瘤大小;(iii)一定程度地抑制、延迟、减缓,并优选地终止癌细胞向外周器官浸润;(iv)抑制(即,一定程度减缓,优选地终止)肿瘤转移;(v)抑制肿瘤生长;(vi)防止或延迟肿瘤发生和/或再发;和/或(vii)一定程度减轻与癌症有关的症状的一种或多种。
在一些实施方式中,提供了治疗原发性肿瘤的方法。在一些实施方式中,提供了治疗转移癌的方法(即,从原发肿瘤转移的癌症)。在一些实施方式中,提供了治疗晚期癌症的方法。在一些实施方式中,提供了治疗乳腺癌(可以是HER2阳性或HER2阴性)的方法,包括,例如,晚期乳腺癌,IV期乳腺癌,局部晚期乳腺癌和转移乳腺癌。在一些实施方式中,提供了治疗肺癌的方法,包括,例如,非小细胞肺癌(NSCLC,如晚期NSCLC)、小细胞肺癌(SCLC,如晚期SCLC)和肺中的恶性晚期实体肿瘤。在一些实施方式中,提供了治疗卵巢癌、头颈癌、胃恶性肿瘤、黑色素瘤(包括转移性黑色素瘤)、结肠直肠癌、胰腺癌和实体瘤(如晚期实体瘤)中的任何一种的方法。在一些实施方式中,提供了减少细胞增殖和/或细胞迁移的方法。在一些实施方式中,提供了治疗下列任意疾病的方法:再狭窄、狭窄、纤维化、血管生成、牛皮癣、动脉粥样硬化和平滑肌细胞增殖。本发明也提供了延迟本文所述的任何增殖性疾病进展的方法。
术语“个体”是哺乳动物,包括人。个体包括但不限于人、牛、马、猫科动物、犬科动物、啮齿动物或灵长动物。在一些实施方式中,个体是人。个体(如人)可以患有晚期疾病或程度较低的疾病,如低肿瘤负荷。在一些实施方式中,个体处于增殖性疾病(如癌症)的早期。在一些实施方式中,个体处于增殖性疾病的晚期(如晚期癌症)。在一些实施方式中,个体是HER2阳性。在一些实施方式中,个体是HER2阴性。
本方法可以在辅助情况下实施。“辅助情况(辅助治疗,辅助调整,adjuvantsetting)”是指个体具有增殖性疾病、特别是癌症病史的临床情况,并且一般(但不是必需)对治疗起反应,所述治疗包括但不限于手术(如手术切除)、放疗和化疗。然而,由于增殖性疾病(如癌症)的病史,这些个体被认为处于发生疾病的风险中。“辅助情况”中的治疗或给药是指后来的治疗方式。危险程度(即,当辅助情况下的个体被认为是“高风险”或“低风险”)取决于几个因素,最通常为首次治疗时的疾病程度。本文提供的方法也可以在新辅助情况(neoadjuvant setting)下实施,即,本方法可以在初步/最后治疗(primary/definitive therapy)之前实施。在一些实施方式中,个体之前已被治疗。在一些实施方式中,个体之前未曾被治疗。在一些实施方式中,治疗是一线治疗(first line therapy)。
应该理解,本文所述的本发明的方面和实施方式包括“由各方面和实施方式构成(consisting)”和/或“基本上由各方面和实施方式构成(consisting essentially of)”。
应用化疗剂的联合治疗
本发明提供了治疗个体的增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒;和b)有效量的至少一种其它化疗剂。在一些实施方式中,紫杉烷是紫杉醇、多烯紫杉醇和ortataxel中的任何一种或多种(在一些实施方式中,基本上由其组成)。在一些实施方式中,纳米颗粒组合物包括AbraxaneTM。在一些实施方式中,化疗剂是抗代谢剂(包含核苷类似物)、基于铂的药剂、烷化剂、酪氨酸激酶抑制剂、蒽环类抗生素、长春花碱、蛋白酶体抑制剂、大环内酯类和拓扑异构酶抑制剂中的任何种(在一些实施方式中,选自这些药物)。
在一些实施方式中,所述方法包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒;和b)有效量的至少一种其它化疗药。在一些实施方式中,紫杉醇/白蛋白纳米颗粒的平均直径不大于约200nm。在一些实施方式中,紫杉醇/白蛋白纳米颗粒组合物基本上不含(如不含)表面活性剂(如Cremophor)。在一些实施方式中,组合物中的白蛋白与紫杉醇的重量比为约18:1或更低,如约9:1或更低。在一些实施方式中,紫杉醇包被有白蛋白。在一些实施方式中,紫杉醇/白蛋白纳米颗粒的平均直径不大于约200nm,并且紫杉醇/白蛋白组合物基本上不含(如不含)表面活性剂(如Cremophor)。在一些实施方式中,紫杉醇/白蛋白纳米颗粒的平均直径不大于约200nm,并且紫杉醇包被有白蛋白。在一些实施方式中,纳米颗粒组合物是AbraxaneTM。
在一些实施方式中,本发明提供了治疗个体的增殖性疾病(如癌症)的方法,该方法包括给予个体a)有效量的AbraxaneTM,和b)有效量的至少一种其它化疗剂。与AbraxaneTM相继或共同给予或同时给予的优选的药物组合是,与单独的单一组分相比时,表现出增强的抗增殖活性的组合,特别是引起增殖性组织消退和/或增殖性疾病治愈的组合。
本文所述的化疗剂可以是药剂本身,其药学上可接受的盐和其药学上可接受的酯,以及立体异构体、对映体、外消旋混合物和类似物。可以给予所述的化疗剂(一种或多种)以及含有所述药剂(一种或多种)的药学组合物,其中所述药学组合物包括药学上可接受的载体赋形剂或类似物。
化疗剂可以存在于纳米颗粒组合物中。例如,在一些实施方式中,提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒;和b)有效量的组合物,所述组合物包括含有至少一种其它化疗剂和载体蛋白(如白蛋白)的纳米颗粒。在一些实施方式中,所述方法包括给予个体a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒(如AbraxaneTM);和b)有效量的组合物,所述组合物包括含有至少一种其它化疗剂和载体蛋白(如白蛋白)的纳米颗粒。在一些实施方式中,化疗剂是下列任何物质(在一些实施方式中,选自):硫代秋水仙碱或其衍生物(如二聚体硫代秋水仙碱,包括,例如,nab-5404、nab-5800和nab-5801),雷帕霉素或其衍生物,和格尔德霉素或其衍生物(如17-烯丙基氨基格尔德霉素(17-AAG))。在一些实施方式中,化疗剂是雷帕霉素。在一些实施方式中,化疗剂是17-AAG。
本文提供了被考虑的化疗剂的示范性和非限制性列表。合时的化疗剂包括例如,长春花碱,破坏微管形成的药剂(如秋水仙碱和其衍生物),抗血管生成药,治疗性抗体,EGFR靶向剂,酪氨酸激酶靶向剂(如酪氨酸激酶抑制剂),过渡金属复合物,蛋白酶体抑制剂,抗代谢剂(如核苷类似物),烷化剂,基于铂的药剂,蒽环类抗生素,拓扑异构酶抑制剂,大环内酯类,治疗性抗体,视黄醛(如全反式维甲酸或其衍生物);格尔德霉素或其衍生物(如17-AAG),和本领域公知的其它标准化疗剂。
在一些实施方式中,化疗剂是下列任何物质(在一些实施方式中,选自):阿霉素、秋水仙碱、环磷酰胺、放线菌素、博来霉素、duanorubicin、阿霉素、表阿霉素、丝裂霉素、氨甲蝶呤、米托蒽醌、氟尿嘧啶、卡铂、卡莫司汀(BCNU)、甲基-CCNU、顺铂、依托泊甙、干扰素、喜树碱及其衍生物、苯芥胆固醇、紫杉烷及其衍生物(例如,紫杉醇及其衍生物,泰索帝及其衍生物和类似物)、topetecan、长春碱、长春新碱、他莫昔芬、哌泊舒凡、nab-5404、nab-5800、nab-5801、依立替康、HKP、Ortataxel、吉西他滨、、长春瑞宾、、卡培他滨(capecitabine)、、、、、、Lapatinib、索拉非尼(Sorafeni)其衍生物,本领域已知的化疗剂和类似物。在一些实施方式中,化疗剂是组合物,所述组合物包括含有硫代秋水仙碱衍生物和载体蛋白(如白蛋白)的纳米颗粒。
在一些实施方式中,化疗剂是抗肿瘤药,包括但不限于卡铂、(长春瑞宾)、蒽环类抗生素()、lapatinib(GW57016)、、吉西他滨()、卡培他滨()、、顺铂、5-氟尿嘧啶、表阿霉素、环磷酰胺、、等。
在一些实施方式中,化疗剂是参与肿瘤生长的其它因子的拮抗剂,所述因子如EGFR、ErbB2(也称为Herb)、ErbB3、ErbB4或TNF。有时,也给予个体一种或多种细胞因子可以是有益的。在一些实施方式中,治疗药是生长抑制剂。生长抑制剂的合适剂量是目前应用的量,并且可以由于生长抑制剂和紫杉烷的联合作用(协同)而被减低。
在一些实施方式中,化疗剂是除了抗VEGF抗体、HER2抗体、干扰素和HGFβ拮抗剂之外的化疗剂。
本文中针对化疗剂提及的内容适用于所述化疗剂或其衍生物,因此本发明考虑和包含任一这些实施方式(药剂;药剂或衍生物(一种或多种))。化疗剂或其它化学部分的“衍生物”或“类似物”包括但不限于,结构上与化疗剂或部分相似的化合物,或者在与化疗剂或部分相同的通用化学类别中的化合物。在一些实施方式中,化疗剂或部分的衍生物或类似物保持与化疗剂或部分相似的化学和/或物理性质(包含,例如,功能特性)。
在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,该方法包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒;和b)有效量的酪氨酸激酶抑制剂。在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,该方法包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒(如AbraxaneTM);和b)有效量的酪氨酸激酶抑制剂。合适的酪氨酸激酶抑制剂包括,例如,伊马替尼()、吉非替尼()、Tarceva、(苹果酸舒尼替尼)和拉帕替尼。在一些实施方式中,酪氨酸激酶抑制剂是拉帕替尼。在一些实施方式中,酪氨酸激酶抑制剂是Tarceva。Tarceva是小分子人表皮生长因子1型/表皮生长因子受体(HER1/EGFR)抑制剂,其在III期临床试验中表明,晚期非小细胞肺癌(NSCLC)个体的存活增加。在一些实施方式中,所述方法用于治疗乳腺癌,包括治疗转移性乳腺癌和在新辅助情况下治疗乳腺癌。在一些实施方式中,所述方法用于治疗晚期实体瘤。在一些实施方式中,提供了抑制哺乳动物中表达EGFR的肿瘤增殖的方法,该方法包括给予感染这种肿瘤的哺乳动物AbraxaneTM和吉非替尼,其中吉非替尼通过脉冲剂量(pulse-dosing)给予。
在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒;和b)有效量的抗代谢剂(如核苷类似物,包括,例如,嘌呤类似物和嘧啶类似物)。在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒(如AbraxaneTM);和b)有效量的抗代谢剂。“抗代谢剂(antimetabolicagent)”是在结构上与代谢物类似,但是不能以有益方式被机体应用的药剂。许多抗代谢剂干扰核酸、RNA和DNA的产生。例如,抗代谢剂可以是核苷类似物,其包括但不限于阿扎胞苷、硫唑嘌呤、卡培他滨()、阿糖胞苷、cladribine、阿糖胞嘧啶(cytosine arabinoside)(ara-C,cytosar)、去氧氟尿苷、氟尿嘧啶(如5-氟尿嘧啶)、UFT、羟基脲、吉西他滨、巯基嘌呤、氨甲蝶呤、硫鸟嘌呤(如6-硫鸟嘌呤)。其它抗代谢剂包括,例如,L-天冬酰胺酶(Elspa)、氮烯咪胺(decarbazine)(DTIC)、2-脱氧-D-葡萄糖和丙卡巴肼(甲基苄肼)。在一些实施方式中,核苷类似物是下列任何物质(在一些实施方式中,选自):吉西他滨、氟尿嘧啶和卡培他滨。在一些实施方式中,所述方法用于治疗转移性乳腺癌或局部晚期乳腺癌。在一些实施方式中,所述方法用于转移性乳腺癌的一线治疗。在一些实施方式中,方法用于治疗新辅助情况下的乳腺癌。在一些实施方式中,所述方法用于治疗NSCLC、转移性结肠直肠癌、胰腺癌或晚期实体瘤中的任何疾病。
在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒;和b)有效量的烷化剂。在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒(如AbraxaneTM);和b)有效量的烷化剂。合适的烷化剂包括但不限于环磷酰胺(Cytoxan)、双氯乙基甲胺、苯丁酸氮芥、美法仑、卡莫司汀(BCNU)、噻替哌、白消安、烷基硫胺类、ethylene imines、氮芥类似物、雌莫司汀磷酸钠、异环磷酰胺、亚硝基脲、洛莫司汀和链佐星。在一些实施方式中,烷化剂是环磷酰胺。在一些实施方式中,在给予纳米颗粒组合物之前给予环磷酰胺。在一些实施方式中,所述方法用于治疗早期乳腺癌。在一些实施方式中,所述方法用于治疗辅助或新辅助情况下的乳腺癌。
在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,该方法包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒;和b)有效量的基于铂的药剂。在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,该方法包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒(如AbraxaneTM);和b)有效量的基于铂的药剂。合适的基于铂的药剂包括但不限于卡铂、顺铂和奥沙利铂。在一些实施方式中,基于铂的药剂是卡铂。在一些实施方式中,本方法用于治疗:乳腺癌(HER2阳性或HER2阴性,包括转移乳腺癌和晚期乳腺癌);肺癌(包括晚期NSCLC,一线NSCLC,SCLC和肺中的晚期恶性实体瘤);卵巢癌;头颈癌;和黑色素瘤(包括转移性黑色素瘤)。
在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒;和b)有效量的蒽环类抗生素。在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白(如AbraxaneTM)和载体蛋白(诸如白蛋白)的纳米颗粒;和b)有效量的蒽环类抗生素。合适的蒽环类抗生素包括但不限于、放线菌素、放线菌素D、柔红霉素(daunorubicin(daunomycin))、阿霉素(doxorubicin)(阿霉素(adriamycin))、表阿霉素、伊达比星、米托蒽醌、valrubicin。在一些实施方式中,蒽环类抗生素是下列任何一种或多种(在一些实施方式中,选自下列):、表阿霉素和阿霉素。在一些实施方式中,本方法用于治疗早期乳腺癌。在一些实施方式中,本方法用于治疗辅助或新辅助情况下的乳腺癌。
在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒;和b)有效量的长春花碱。在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白(如AbraxaneTM)的纳米颗粒和载体蛋白(诸如白蛋白);和b)有效量的长春花碱。合适的长春花碱包括,例如,长春碱、长春新碱、长春地辛、长春瑞宾()和VP-16。在一些实施方式中,长春花碱是长春瑞宾()。在一些实施方式中,本方法用于治疗IV期乳腺癌和肺癌。
在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒;和b)有效量的大环内酯。在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白(如AbraxaneTM)和载体蛋白(诸如白蛋白)的纳米颗粒;和b)有效量的大环内酯。合适的大环内酯包括,例如,雷帕霉素、卡波霉素和红霉素。在一些实施方式中,大环内酯是雷帕霉素或其衍生物。在一些实施方式中,本方法用于治疗实体瘤。
在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒;和b)有效量的拓扑异构酶抑制剂。在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白(如AbraxaneTM)和载体蛋白(诸如白蛋白)的纳米颗粒;和b)有效量的拓扑异构酶抑制剂。在一些实施方式中,化疗剂是拓扑异构酶抑制剂,包括,例如,拓扑异构酶I和拓扑异构酶II的抑制剂。示范性拓扑异构酶I抑制剂包括但不限于喜树碱,如依立替康和托泊替康。示范性的拓扑异构酶II抑制剂包括但不限于安吖啶、依托泊甙、依托泊甙磷酸酯和替尼泊甙。
在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒;和b)有效量的抗血管生成剂。在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白(如AbraxaneTM)和载体蛋白(诸如白蛋白)的纳米颗粒;和b)有效量的抗血管生成剂。在一些实施方式中,本方法用于治疗转移性乳腺癌,辅助情况或新辅助情况下的乳腺癌、肺癌(如一线晚期NSCLC和NSCLC)、卵巢癌和黑色素瘤(包括转移性黑色素瘤)。
许多抗血管生成剂已被鉴定并且是本领域已知的,包括Carmeliet and Jain(2000)列举的那些。抗血管生成剂可以是天然发生的或非天然发生的。在一些实施方式中,化疗剂是合成的抗血管生成肽。例如,以前曾经报道,小的合成促凋亡肽的抗血管生成活性包括两个功能域,一个靶向于肿瘤微血管上的CD13受体(氨基肽酶N),另一个内化后破坏线粒体膜。Nat.Med.1999,5(9):1032-8。发现第二代二聚体肽CNGRC-GG-d(KLAKLAK)2,称为HKP(Hunter Killer Peptide),具有改进的抗肿瘤活性。因此,在一些实施方式中,抗血管生成肽是HKP。在一些实施方式中,抗血管生成剂不同于抗-VEGF抗体(如)。
在一些实施方式中,本发明提供了治疗个体的增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒;和b)有效量的蛋白酶体抑制剂,如bortezomib(Velcade)。在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白(如AbraxaneTM)和载体蛋白(如白蛋白)的纳米颗粒;和b)有效量的蛋白酶体抑制剂如bortezomib(Velcade)。
在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒;和b)有效量的治疗性抗体。在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白(如AbraxaneTM)以及载体蛋白(如白蛋白)的纳米颗粒;和b)有效量的治疗性抗体。合适的治疗性抗体包括但不限于抗-VEGF抗体(如(贝伐单抗))、抗-HER2抗体(如(曲妥珠单抗))、(cetuximab)、Campath(阿仑单抗)、Myelotarg(吉妥单抗)、Zevalin(ibritumomabtiuextan、Rituxan(利妥昔单抗)和Bexxar(托西莫单抗)。在一些实施方式中,化疗剂是(cetuximab)。在一些实施方式中,化疗剂是针对VEGF或HER2的抗体之外的治疗性抗体。在一些实施方式中,本方法用于治疗HER2阳性乳腺癌,包括治疗晚期乳腺癌,治疗转移癌,治疗辅助情况下的乳腺癌,和治疗新辅助情况下的癌症。在一些实施方式中,本方法用于治疗下列任何疾病:转移性乳腺癌、辅助情况下的乳腺癌和新辅助情况下的乳腺癌、肺癌(如一线晚期NSCLC和NSCLC)、卵巢癌、头颈癌、和黑色素瘤(包括转移性黑色素瘤)。例如,在一些实施方式中,提供了治疗个体HER2阳性转移性乳腺癌的方法,包括每周给予个体125mg/m2紫杉醇/白蛋白纳米颗粒组合物(如AbraxanerM),持续3周,第4周停药,同时给予。
在一些实施方式中,在纳米颗粒组合物中,除了紫杉烷,还给予两种或更多种化疗剂。这些两种或更多种化疗剂可以(但不必需)属于不同类型的化疗剂。本文提供了这些组合的例子。其它组合也被考虑。
在一些实施方式中,提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒;b)有效量的抗代谢物(如核苷类似物,例如,吉西他滨);和c)蒽环类抗生素(如表阿霉素)。在一些实施方式中,提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒(如AbraxaneTM);b)有效量的抗代谢物(如核苷类似物,例如,吉西他滨);c)有效量的蒽环类抗生素(如表阿霉素)。在一些实施方式中,本方法用于治疗新辅助情况下的乳腺癌。例如,在一些实施方式中,提供了治疗个体局部晚期/炎性癌症的方法,包括给予个体220mg/m2紫杉醇/白蛋白纳米颗粒组合物(如AbraxaneTM),每2周给予;2000mg/m2吉西他滨,每2周给予;和50mg/m2表阿霉素,每2周给予。在一些实施方式中,提供了治疗辅助情况下个体的乳腺癌的方法,包括给予个体175mg/m2紫杉醇/白蛋白纳米颗粒组合物(如AbraxaneTM),每2周给予,2000mg/m2吉西他滨,每2周给予,和50mg/m2表阿霉素,每2周给予。
在一些实施方式中,提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒,b)有效量的基于铂的药剂(如卡铂),和c)治疗性抗体(如抗-HER2抗体(如)和抗-VEGF抗体(如))。在一些实施方式中,提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒(如AbraxaneTM);b)有效量的基于铂的药剂(如卡铂),和c)治疗性抗体(如抗-HER2抗体(如)和抗-VEGF抗体(如))。在一些实施方式中,本方法用于治疗下列任何疾病:晚期乳腺癌,转移性乳腺癌,辅助情况下的乳腺癌,和肺癌(包括NSCLC和晚期NSCLC)。在一些实施方式中,提供了治疗个体转移癌的方法,包括给予个体75mg/m2紫杉醇/白蛋白纳米颗粒组合物(如AbraxaneTM)和卡铂,AUC=2,其中每周给药,给予3周,第4周不给药。在一些实施方式中,本方法还包括每周给予约2-4mg/kg的。
在一些实施方式中,提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒,b)有效量的基于铂的药剂(如卡铂),和c)长春花碱(如)。在一些实施方式中,提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒(如AbraxaneTM);b)有效量的基于铂的药剂(如卡铂),和c)长春花碱(如)。在一些实施方式中,本方法用于治疗肺癌。
在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒;b)有效量的烷化剂(如环磷酰胺)和c)蒽环类抗生素(如阿霉素)。在一些实施方式中,本发明提供了治疗个体增殖性疾病(如癌症)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒;b)有效量的烷化剂(如环磷酰胺)和c)蒽环类抗生素(如阿霉素)。在一些实施方式中,本方法用于治疗早期乳腺癌。在一些实施方式中,本方法用于治疗辅助情况下或新辅助情况下的乳腺癌。例如,在一些实施方式中,提供了治疗个体早期乳腺癌的方法,包括给予260mg/m2紫杉醇/白蛋白纳米颗粒组合物(如AbraxaneTM),60mg/m2阿霉素和600mg/m2环磷酰胺,其中每2周给药1次。
其它实施方式在表1中提供。例如,在一些实施方式中,提供了治疗个体晚期乳腺癌的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒(如AbraxaneTM),b)有效量的卡铂。在一些实施方式中,本方法还包括,给予个体有效量的。在一些实施方式中,提供了治疗个体转移性乳腺癌的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒(如AbraxaneTM),b)有效量的吉西他滨。在一些实施方式中,提供了治疗个体的晚期非小细胞肺癌的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒(如AbraxaneTM),b)有效量的卡铂。
在一些实施方式中,提供了组合物,所述组合物包括含有紫杉烷(如紫杉醇、多烯紫杉醇或ortataxel)和载体蛋白(如白蛋白)的纳米颗粒和至少一种其它化疗剂。本文所述组合物可以包括有效量的紫杉烷和化疗剂,用于治疗增殖性疾病(如癌症)。在一些实施方式中,化疗剂和紫杉烷以预定比例在组合物中存在,所述预定比例诸如本文所述的重量比。在一些实施方式中,本发明提供了由有效量的组合物和有效量的至少一种其它化疗剂组成的协同组合物(synergistic composition),所述有效量的组合物包括含有紫杉烷(如紫杉醇、多烯紫杉醇或ortataxel)的纳米颗粒。
在一些实施方式中,本发明提供了用于治疗增殖性疾病(如癌症)的药物组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒,其中所述应用包括同时和/或相继给予至少一种其它化疗剂。在一些实施方式中,本发明提供了用于治疗增殖性疾病(如癌症)的药物组合物,所述组合物包括化疗剂,其中所述应用包括同时和/或相继给予组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒。在一些实施方式中,本发明提供了含紫杉烷的纳米颗粒组合物和含有一种其它化疗剂的组合物,用于同时和/或相继应用以治疗增殖性疾病(如癌症)。
给药方式
包括含有紫杉烷的纳米颗粒的组合物(也称为“纳米颗粒组合物”)和化疗剂可以同时施用(即,同时给药)和/或相继施用(即,相继给药)。
在一些实施方式中,纳米颗粒组合物和化疗剂(包括本文所述的具体化疗剂)被同时给予。如本文所用的术语“同时给药”,意味着在不多于约15分钟的时间间隔内给予纳米颗粒组合物和化疗剂,如不多于约10、5或1分钟中的任何时间间隔。当药物同时给药时,纳米颗粒中的药物和化疗剂可以包含在同一组合物中(例如,含有纳米颗粒和化疗剂的组合物)或在分开的组合物中(例如,纳米颗粒包含在一个组合物中,化疗剂包含在另一组合物中)。例如,紫杉烷和化疗剂可以存在于含有至少两种不同的纳米颗粒的单一组合物中,其中组合物中的一些纳米颗粒包括紫杉烷和载体蛋白,组合物中的一些其它纳米颗粒包括化疗剂和载体蛋白。本发明考虑和包括这样的组合物。在一些实施方式中,纳米颗粒中仅含有紫杉烷。在一些实施方式中,纳米颗粒组合物中的药物和化疗剂的同时给药,可以与补充剂量的紫杉烷和/或化疗剂联合。
在一些实施方式中,纳米颗粒组合物和化疗剂相继给予。本文所用的术语“相继给药”指以约15分钟以上的时间间隔给予纳米颗粒组合物中的药物和化疗剂,如约20、30、40、50、60或更长时间中的任何时间间隔以上。可以先给予纳米颗粒组合物或化疗剂。纳米颗粒组合物和化疗剂包含在分开的组合物中,它们可以包含在同一包装或不同包装中。
在一些实施方式中,纳米颗粒组合物和化疗剂的给予是同时进行的,即,给予纳米颗粒组合物的时间和给予化疗剂的时间彼此重叠。在一些实施方式中,纳米颗粒组合物和化疗剂的给予不是同时进行的。例如,在一些实施方式中,在给予化疗剂之前终止给予纳米颗粒组合物。在一些实施方式中,在给予纳米颗粒组合物之前终止给予化疗剂。这两个非同时给药之间的时间间隔可以从大约2周至大约8周的范围内,诸如大约4周。
根据给药医生的判断,可以随疗程调整含药物纳米颗粒组合物和化疗剂的给药频率。当分别给药时,可以以不同的给药频率或时间间隔给予含药物纳米颗粒组合物和化疗剂。例如,可以每周给予含含药物纳米颗粒组合物,而化疗剂的给药频率可以更高或更低。在一些实施方式中,可以应用含药物纳米颗粒和/或化疗剂的持续释放制剂。实现持续释放的各种制剂和装置是本领域已知的。
可以应用相同的给药途径或不同的给药途径给予纳米颗粒组合物和化疗剂。在一些实施方式中(对于同时给药和相继给药),以预先确定的比例给予纳米颗粒组合物中的紫杉烷和化疗剂。例如,在一些实施方式中,纳米颗粒组合物中的紫杉烷和化疗剂的重量比是约1比1。在一些实施方式中,重量比可以是约0.001至约1之间和约1000至约1之间,或约0.01至约1之间和约100至约1之间。在一些实施方式中,纳米颗粒组合物中的紫杉烷和化疗剂的重量比是约100:1、50:1、30:1、10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1和1:1中的任意重量比以下。在一些实施方式中,纳米颗粒组合物中的紫杉烷和化疗剂的重量比是约1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、30:1、50:1、100:1中的任意重量比以上。也考虑其它比例。
紫杉烷和/或化疗剂的所需剂量可以是(但不必需)低于单独给予每一药剂时通常需要的剂量。因此,在一些实施方式中,纳米颗粒组合物中亚治疗量的药物和/或化疗剂被给予。“亚治疗量(低于治疗的量,Subtherapeutic amount)”或“亚治疗水平(低于治疗的水平,subtherapeutic level)”是指低于治疗量的量,即,所述量低于单独给予纳米颗粒组合物中的药物和/或化疗剂时通常应用的量。该剂量的降低可以通过在指定给药中给予的量来反映和/或在指定时间段给予的量来反映(降低的频率)。
在一些实施方式中,给予足够的化疗剂,使得取得相同治疗程度所需的纳米颗粒组合物中的药物的正常剂量降低至少约5%、10%、20%、30%、50%、60%、70%、80%、90%或更多中的任何降低量。在一些实施方式中,给予纳米颗粒组合物中的足量药物,使得取得相同治疗程度所需的化疗剂的正常剂量降低至少约5%、10%、20%、30%、50%、60%、70%、80%、90%或更多中的任何降低量。
在一些实施方式中,纳米颗粒组合物中的紫杉烷和化疗剂的剂量与单独给药时相应的正常剂量相比都降低。在一些实施方式中,纳米颗粒组合物中的紫杉烷和化疗剂均以亚治疗水平,即降低的水平被给予。在一些实施方式中,纳米颗粒组合物和/或化疗剂的剂量实质上低于确立的最大毒性剂量(MTD)。例如,纳米颗粒组合物和/或化疗剂的剂量低于MTD的约50%、40%、30%、20%或10%。
可以应用本文所述的给药方案(administration configuration)的组合。可以单独进行本文所述的联合治疗方法,或者与另一治疗如手术、放射、化疗、免疫治疗、基因治疗和类似治疗联合进行。此外,具有较大的发生增殖性疾病的风险的人可以接受治疗,以抑制或和/或延迟疾病发展。
如本领域普通技术人员所知,化疗剂的合适剂量将是已经在临床治疗中应用的近似剂量,其中化疗剂被单独给药或与其它化疗剂联合给药。根据被治疗的疾病,可能发生剂量变化。如上所述,在一些实施方式中,可以以降低水平给予化疗剂。
本文所述的纳米颗粒组合物可以通过多种途径给予个体(如人),如肠胃外,包括静脉内、动脉内、腹膜内、肺内、经口、吸入、囊内、肌内、气管内、皮下、眼内、鞘内或经皮。例如,可以通过吸入给予纳米颗粒组合物,以便治疗呼吸道疾病。可以用该组合物治疗呼吸疾病如肺纤维化、闭塞性细支气管炎、肺癌、支气管肺泡癌和类似疾病。在一些实施方式中,静脉内给予纳米颗粒组合物。在一些实施方式中,经口给予纳米颗粒组合物。
给予纳米颗粒组合物的给药频率取决于联合治疗的性质和正被治疗的特定疾病。一个示范性给药频率包括但不限于,每周不间断地给予;每周给予,在4周中给予3周(给予三周停一周);每三周一次给予;每两周一次给予;每周给药,在3周中给予2周。也参见表1。
纳米颗粒组合物中的紫杉烷的剂量将随着联合治疗的性质和被治疗的特定疾病而变化。剂量应该足以实现所需的反应,如对特定疾病的治疗或预防反应。纳米颗粒组合物中的紫杉烷(在一些实施方式中是紫杉醇)的示范性剂量包括但不限于,约50mg/m2、60mg/m2、75mg/m2、80mg/m2、90mg/m2、100mg/m2、120mg/m2、160mg/m2、175mg/m2、200mg/m2、210mg/m2、220mg/m2、260mg/m2和300mg/m2中的任意剂量。例如,纳米颗粒组合物中的紫杉醇的剂量范围可以是,以三周给药方案给予时为100-400mg/m2,或以每周一次给药方案给予时为50-250mg/m2。也参见表1。
给予纳米颗粒组合物(如紫杉醇/白蛋白纳米颗粒组合物,例如AbraxaneTM)的一个示范性给药方案包括但不限于,100mg/m2,每周给予,无间隔;75mg/m2每周给予,在4周中给予3周;100mg/m2,每周给予,在4周中给予3周;125mg/m2,每周给予,在4周中给予3周;125mg/m2,每周给予,在3周中给予2周;130mg/m2,每周给予,无间隔;175mg/m2,每两周一次;260mg/m2,每两周一次;260mg/m2,每三周一次;180-300mg/m2,每三周一次;60-175mg/m2,每周给予,无间隔。此外,可以按照本文所述的节律性给药方案给予紫杉烷(单独或联合治疗)。
纳米颗粒组合物(如紫杉醇/白蛋白纳米颗粒组合物,例如,AbraxaneTM)和其它药剂的联合治疗的示范性给药方案包括但不限于,125mg/m2,每周给予,在3周中给予2周,加825mg/m2 ,每日给予;260mg/m2,每两周一次,加60mg/m阿霉素和600mg/m环磷酰胺,每两周一次;220-340mg/m2,每三周一次,加卡铂,AUC=6,每三周一次;100-150mg/m2,每周给予,加卡铂,AUC=6,每三周一次;175mg/m2,每两周一次,加2000mg/m2吉西他滨和50mg/m2表阿霉素,每两周一次;和75mg/m2,每周给予,在4周中给予3周,加卡铂,AUC=2,每周给予,在4周中给予3周。
在一些实施方式中,根据表1中描述的任何给药方案,给予紫杉烷纳米颗粒组合物和化疗剂。
在一些实施方式中,提供了治疗个体乳腺癌的方法,包括:给予个体a)有效量的组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒,和b)有效量的至少一种其它化疗剂,如表1中第1至35行所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给药可以是如表1中第1至35行所表示的任何给药方案。在一些实施方式中,提供了治疗个体转移性乳腺癌的方法,该方法包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒,和b)有效量的至少一种其它化疗剂,如表1中第2、4-8和10-15行所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给药可以是如表1中第2、4-8和10-15行所表示的任何给药方案。
在一些实施方式中,提供了治疗个体晚期乳腺癌的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒,和b)有效量的至少一种其它化疗剂,如表1中第1和16行所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给药可以是如表1中第1和16行所表示的任何给药方案。在一些实施方式中,提供了治疗个体IV期乳腺癌的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒,和b)有效量的至少一种其它化疗剂,如表1中第3行所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给药可以是如表1中第3行所表明的给药方案。
在一些实施方式中,提供了治疗个体在辅助情况下的乳腺癌的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒,和b)有效量的至少一种其它化疗剂,如表1中第18至24行所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给药可以是如表1中第18至24行所表示的任何给药方案。
在一些实施方式中,提供了治疗个体在新辅助情况下的乳腺癌的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒,和b)有效量的至少一种其它化疗剂,如表1中第25至35行所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给药可以是如表1中第25至35行所表示的任何给药方案。
在一些实施方式中,提供了治疗个体肺癌的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒,和b)有效量的至少一种其它化疗剂,如表1中第36至48行所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给药可以是如表1中第36至48行所表示的任何给药方案。
在一些实施方式中,提供了治疗个体NSCLC(包括晚期NSCLC和一线NSCLC)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒,和b)有效量的至少一种其它化疗剂,如表1中第36-40和42-43行所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给药可以是如表1中第36-40和42-43行所示出的任何给药方案。在一些实施方式中,提供了治疗个体的肺脏晚期恶性实体瘤的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒,和b)有效量的至少一种其它化疗剂,如表1中第41行所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给药可以是如表1中第41行所表明的给药方案。在一些实施方式中,提供了治疗个体SCLC的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒,和b)有效量的至少一种其它化疗剂,如表1中第48行所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给药可以是如表1中第48行所表明的给药方案。
在一些实施方式中,提供了治疗个体卵巢癌的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒,和b)有效量的至少一种其它化疗剂,如表1中第49-52行所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给药可以是如表1中第49-52行所示出的任何给药方案。
在一些实施方式中,提供了治疗个体头颈癌的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒,和b)有效量的至少一种其它化疗剂,如表1中第53-55行所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给药可以是如表1中第53-55行所示出的任何给药方案。
在一些实施方式中,提供了治疗个体实体瘤(包括晚期实体瘤)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒,和b)有效量的至少一种其它化疗剂,如表1中第56-59行所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给药可以是如表1中第56-59行所示出的任何给药方案。
在一些实施方式中,提供了治疗个体黑色素瘤(包括转移性黑色素瘤)的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒,和b)有效量的至少一种其它化疗剂,如表1中第60-63行所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给药可以是如表1中第60-63行所示出的任何给药方案。
在一些实施方式中,提供了治疗个体转移性结肠直肠癌的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒,和b)有效量的至少一种其它化疗剂,如表1中第64行所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给药可以是如表1中第64行所表明的给药方案。
在一些实施方式中,提供了治疗个体胰腺癌的方法,包括给予个体:a)有效量的组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒,和b)有效量的至少一种其它化疗剂,如表1中第65-66行所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给药可以是如表1中第65-66行所示出的任何给药方案。
表1
如本文所用(例如表1中),ABX是指AbraxaneTM;GW572016是指拉帕替尼(Lapatinib);Xel是指卡培他滨或;贝伐单抗也称为;曲妥珠单抗也称为;pemtrexed也称为;西妥昔单抗也称为;吉非替尼也称为;FEC指5-氟尿嘧啶、表阿霉素和环磷酰胺的联合;AC是指阿霉素加环磷酰胺的联合;TAC是指FDA批准的辅助乳腺癌方案;RAD001是指雷帕霉素衍生物;NSCLC是指非小细胞肺癌;SCLC是指小细胞肺癌。
如本文所用(例如,在表1中),AUC是指曲线下面积;q4wk是指每4周给药1次,q3wk是指每3周给药1次;q2wk是指每2周给药1次;qwk是指每周1次给药;qwk×3/4是指每周1次给药,给予3周,第4周不给予;qwk×2/3是指每周1次给药,给予2周,第3周不给予。
与放疗和手术的联合治疗
另一方面,本发明提供了治疗增殖性疾病(如癌症)的方法,包括第一治疗和第二治疗,第一治疗包括给予紫杉烷(特别是含有紫杉烷的纳米颗粒)和载体蛋白,第二治疗包括放射和/或手术。
在一些实施方式中,方法包括:a)第一治疗,包括给予个体组合物,所述组合物包括含有有效量紫杉烷和载体蛋白(如白蛋白)的纳米颗粒,和b)第二治疗,包括放疗、手术或其联合。在一些实施方式中,紫杉烷包被有载体蛋白(如白蛋白)。在一些实施方式中,第二治疗是放疗。在一些实施方式中,第二治疗是手术。
在一些实施方式中,方法包括:a)第一治疗,包括给予个体组合物,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒,和b)第二治疗,包括放疗、手术或其组合。在一些实施方式中,第二治疗是放疗。在一些实施方式中,第二治疗是手术。在一些实施方式中,紫杉醇/白蛋白纳米颗粒的平均直径不大于约200nm。在一些实施方式中,紫杉醇/白蛋白纳米颗粒组合物基本上不含(如不含)表面活性剂(如Cremophor)。在一些实施方式中,组合物中的白蛋白与紫杉醇的重量比是约18:1或更小,如约9:1或更小。在一些实施方式中,紫杉醇包被有白蛋白。在一些实施方式中,紫杉醇/白蛋白纳米颗粒的平均直径不大于约200nm,并且紫杉醇/白蛋白组合物基本上不含(如不含)表面活性剂(如Cremophor)。在一些实施方式中,紫杉醇/白蛋白纳米颗粒的平均直径不大于约200nm,并且紫杉醇包被有白蛋白。在一些实施方式中,纳米颗粒组合物是AbraxaneTM。
纳米颗粒组合物的给药可以在放射和/或手术之前,放射和/或手术之后,或与放射和/或手术同时进行。例如,纳米颗粒组合物的给予可以在放射和/或手术治疗之前或之后,间隔数分钟至数周。在一些实施方式中,第一治疗和第二治疗之间的时间段是这样的:使得紫杉烷和放射/手术仍然能够对细胞发挥有益的联合作用。例如,纳米颗粒组合物中的紫杉烷(如紫杉醇)可以在放射和/或手术之前约1、3、6、9、12、18、24、48、60、72、84、96、108、120小时中的任何时间以下给予。在一些实施方式中,纳米颗粒组合物在放射和/或手术之前约9小时以内给予。在一些实施方式中,纳米颗粒组合物在放射和/或手术之前约1、2、3、4、5、6、7、8、9或10天中的任何天数之内给予。在一些实施方式中,纳米颗粒组合物中的紫杉烷(如紫杉醇)在放射和/或手术之后约1、3、6、9、12、18、24、48、60、72、84、96、108或120小时中的任何时间之内的任意给予。在一些实施方式中,为了使治疗效果显著,需要延长时间,其中在两次治疗期间有几天至几周间隔。
本文考虑的放射包括,例如,γ-射线、X-射线(外部光束)和直接输送放射性同位素到肿瘤细胞。也考虑其它形式的DNA损伤因素,如微波和UV照射也被考虑。可以在单一剂量中进行辐射,或者在剂量分割方案中以一系列小剂量给予辐射。本文考虑的辐射量从约1至约100Gy,包括,例如,约5至约80,约10至约50Gy,或约10Gy。总剂量可以在分割方案中施用。例如,方案可以包括分割的2Gy的单独剂量。放射性同位素的剂量范围可以广泛变化,并依赖于同位素的半衰期和发射的辐射的类型和强度。
当辐射包括应用放射性同位素时,同位素可以与靶向性药剂偶联,如治疗性抗体,其将放射性核苷酸携带到靶组织。合适的放射活性同位素包括但不限于砹211,14碳,51铬,36氯,57铁,58钴,铜67,152Eu,镓67,3氢,碘123,碘131,铟111,59离子(59ion),32磷,铼186,75硒,35硫,technicium99m和/或钇90。
在一些实施方式中,将足够的辐射施加到个体,以至于使得产生相同治疗程度所需的纳米颗粒组合物中的紫杉烷(如紫杉醇)的正常剂量降低至少约5%、10%、20%、30%、50%、60%、70%、80%、90%或更多。在一些实施方式中,给予纳米颗粒组合物中的足够的紫杉烷,使得产生相同治疗程度所需的辐射的正常剂量降低至少约5%、10%、20%、30%、50%、60%、70%、80%、90%或更多。在一些实施方式中,纳米颗粒组合物中的紫杉烷(如紫杉醇)和辐射的剂量都比单独应用时各自相应的正常剂量低。
在一些实施方式中,联合给予纳米颗粒组合物和辐射治疗产生超加和作用。在一些实施方式中,纳米颗粒组合物中的紫杉烷(如紫杉醇)以90mg/kg的剂量每日给予一次,辐射以80Gy的剂量每日给予五次。
本文所述的手术包括切除术,其中全部或部分癌组织被物理去除、切除和/或破坏。肿瘤切除术是指物理去除肿瘤的至少一部分。除了肿瘤切除术之外,手术治疗包括激光手术、冷冻手术、电外科学和显微控制手术(micropically controlledsurgery)(Mohs手术)。也考虑去除体表组织(superficial surgery)、胰腺或正常组织。
放疗和/或手术可以在给予化疗剂之外进行。例如,可以首先给予个体含紫杉烷的纳米颗粒组合物和至少一种其它化疗剂,随后接受放疗和/或手术。可选地,可以首先用放疗和/或手术治疗个体,随后给予纳米颗粒组合物和至少一种其它化疗剂。其它组合也被考虑。
与化疗剂给予联合的上面公开的纳米颗粒组合物给予,同样适用于与放疗和/或手术的联合。
在一些实施方式中,根据表2中描述的任何给药方案,紫杉烷的纳米颗粒组合物和/或化疗剂与放射联合。
在一些实施方式中,提供了治疗个体NSCLC的方法,包括:a)第一治疗,包括给予个体组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒;和b)第二治疗,包括放射,如表2中的第1至5行中所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给予可以是表2中的第1至5行所描述的任何给药方案。
在一些实施方式中,提供了治疗个体头颈癌的方法,包括:a)第一治疗,包括给予个体组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒;和b)第二治疗,包括放射,如表2中的第6至9行中所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给予可以是表2中的第6至9行所描述的任何给药方案。
在一些实施方式中,提供了治疗个体胰腺癌的方法,包括:a)第一治疗,包括给予个体组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒;和b)第二治疗,包括放射,如表2中的第10行中所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给予可以是表2中的第10行所描述的给药方案。
在一些实施方式中,提供了治疗个体胃恶性肿瘤的方法,包括:a)第一治疗,包括给予个体组合物,所述组合物包括含有紫杉烷(如紫杉醇)和白蛋白的纳米颗粒;和b)第二治疗,包括放射,如表2中的第11行中所提供。在一些实施方式中,纳米颗粒组合物和化疗剂的给予可以是表2中的第11行所描述的给药方案。
表2
在一些实施方式中,本发明提供了药物组合物,包括含有紫杉烷(如紫杉醇)和载体蛋白(如白蛋白)的纳米颗粒,用于治疗增殖性疾病(如癌症),其中所述应用包括第二治疗,包括放疗、手术或其组合。
节律性治疗
本发明也提供了节律性治疗方案。提供了根据节律性给药方案给予个体组合物的方法,所述组合物包括含有紫杉烷(如紫杉醇、多烯紫杉醇或ortataxel)和载体蛋白(如白蛋白)的纳米颗粒。本方法适用于治疗方法、延迟发展和本文所述的其它临床情况和形态(configuraion)。例如,在一些实施方式中,本方法用于治疗增殖性疾病(如癌症)。
本文应用的“节律性给药方案”是指,在没有延长的间隔的情况下频繁地给予紫杉烷,给予的剂量低于根据有间断的传统给药时间表确定的最大耐受剂量(此后称为“标准MTD时间表”或“标准MTD方案”)。在节律性给药中,可以在一定的时间内最终给予与通过标准MTD时间表给予的相同、较低或较高的积累剂量。在一些情况下,这通过延长进行所述给药方案期间的时长和/或频率,同时降低每次给药剂量来实现。一般地,通过本发明的节律性给药方案给予的紫杉烷被个体更好地耐受。节律性给药也可以称为维持性给药(maintenance dosing)或慢性给药(chronic dosing)。
在一些实施方式中,提供了给予组合物的方法,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒,其中在至少1个月期间给予纳米颗粒组合物,其中每次给药之间的间隔不多于约1周,并且其中每次给药时的紫杉烷剂量是遵照传统给药方案的其最大耐受剂量的约0.25%至约25%。在一些实施方式中,提供了给予组合物的方法,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒,其中在至少1个月期间给予纳米颗粒组合物,其中每次给药之间的间隔不多于约1周,并且其中每次给药时的紫杉烷剂量是遵照传统给药方案的其最大耐受剂量的约0.25%至约25%。
在一些实施方式中,每次给药时纳米颗粒组合物中的紫杉烷(如紫杉醇)剂量低于MTD的约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、18%、20%、22%、24%或25%,所述MTD是相同的紫杉烷(如紫杉醇)在相同的制剂中,按照给定的传统给药时间表得到的MTD。传统的给药时间表指一般已在临床情况下确立的给药时间表。例如,AbraxaneTM的传统给药时间表是每三周的时间表,即,每三周给予组合物。
在一些实施方式中,每次给药的紫杉烷(如紫杉醇)剂量是相应MTD值的约0.25%至约25%之间,包括,例如,相应MTD的约0.25%至约20%、约0.25%至约15%、约0.25%至约10%、约0.25%至约20%、和约0.25%至约25%中的任何范围。按照传统给药时间表的紫杉烷的MTD值是已知的,或者可以由本领域技术人员容易地确定。例如,当AbraxaneTM按照传统的三周给药时间表给予时的MTD值是约300mg/m2。
在一些实施方式中,提供了给予组合物的方法,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒,其中在至少1个月期间给予纳米颗粒组合物,其中每次给药之间的间隔不多于约1周,并且其中每次给药时的紫杉烷剂量是约0.25mg/m2至约25mg/m2。在一些实施方式中,提供了给予组合物的方法,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒,其中在至少1个月期间给予纳米颗粒组合物,其中每次给药之间的间隔不多于约1周,并且其中每次给药时的紫杉烷剂量约0.25mg/m2至约25mg/m2。
在一些实施方式中,每次给药的紫杉烷(如紫杉醇)剂量低于约2、3、4、5、6、7、8、9、10、11、12、13、14、15、18、20、22、25和30mg/m2中的任意剂量。例如,紫杉烷(如紫杉醇)的剂量范围可以从约0.25mg/m2至约30mg/m2,约0.25mg/m2至约25mg/m2,约0.25mg/m2至约15mg/m2,约0.25mg/m2至约10mg/m2和约0.25mg/m2至约5mg/m2。
纳米颗粒组合物中的紫杉烷(如紫杉醇)的给药频率包括但不限于,至少约每周1次、每周2次、每周3次、每周4次、每周5次、每周6次或每日1次中的任意给药频率。一般地,每次给药之间的间隔是少于约1周,例如少于约6、5、4、3、2或1日中的任意天数。在一些实施方式中,每次给药之间的间隔是恒定的。例如,可以每日、每2日、每3日、每4日、每5日或每周进行给药。在一些实施方式中,可以以每日2次、每日3次或更高的频率进行给药。
本文所述的节律性给药方案可以延长一段延长的时间段,如约1个月至约3年。例如,给药方案可以延长约2、3、4、5、6、7、8、9、10、11、12、18、24、30和36个月中的任意时间段。一般地,在给药时间表中没有间断。
通过节律性方案给予的紫杉烷(如紫杉醇)的累积剂量可以高于根据标准MTD给药时间表、在相同时间段内给予的紫杉烷剂量。在一些实施方式中,通过节律性方案给予的紫杉烷的累积剂量等于或低于根据标准MTD给药时间表、在相同时间段内给予的紫杉烷剂量。
应该理解,本文提供的教导仅是为了举例的目的;并且根据本文所述的教导和基于各个标准MTD时间表,可以对节律性给药方案进行常规设计;并且这些试验中应用的节律性给药方案仅仅作为给药间隔和持续时间可能改变的一个例子,所述给药间隔和持续时间是针对标准MTD时间表作出的,以便实现最佳的节律性给药方案。
本文所述的节律性给药方案可以单独用作对增殖性疾病的治疗,或者在联合治疗中应用,如本文所述的联合治疗。在一些实施方式中,节律性治疗给药方案可以与通过标准MTD方案给予的其它已确立的治疗联合或结合。“联合或结合(combination or in conjunction with)”意味着,本发明的节律性给药方案或是与已确立治疗的标准MTD方案同时进行,或是在诱导治疗的各疗程之间进行以维持诱导治疗对个体产生的益处,目的在于持续抑制肿瘤生长,同时不过度损伤个体健康或个体忍受下一诱导治疗疗程的能力。例如,在最初的短的MTD化疗过程之后,可以采用节律性给药方案。
根据本文所述的节律性给药方案给予的纳米颗粒组合物可以通过多种途径被给予个体(如人),如肠胃外,包含静脉内、动脉内、肺内、经口、吸入、囊内、肌内、气管内、皮下、眼内、鞘内或经皮途径。例如,可以通过吸入给予纳米颗粒组合物,以便治疗呼吸道疾病。组合物可以用于治疗呼吸疾病,如肺纤维化、闭塞性细支气管炎、肺癌、支气管肺泡癌和类似疾病。在一些实施方式中,经口给予纳米颗粒组合物。
下面提供了一些不同的示例性实施方式。
在一些实施方式中,提供了给予组合物的方法,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒,其中在至少1个月期间给予纳米颗粒组合物,其中每次给药之间的间隔不多于约1周,并且其中每次给药时的紫杉烷剂量是其遵照传统给药方案的最大耐受剂量的约0.25%至约25%。在一些实施方式中,紫杉烷被载体蛋白(如白蛋白)包被。在一些实施方式中,每次给药的紫杉烷剂量低于最大耐受剂量的约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、18%、20%、22%、24%或25%。在一些实施方式中,紫杉烷以至少约每周1×、2×、3×、4×、5×、6×、7×(即,每日1次)中的任意频率给予。在一些实施方式中,每次给药之间的间隔低于约7日、6日、5日、4日、3日、2日和1日中的任意天数。在一些实施方式中,紫杉烷在至少约2、3、4、5、6、7、8、9、10、11、12、18、24、30和36个月中的任意时间段内给予。
在一些实施方式中,提供了给予组合物的方法,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒,其中在至少1个月的期间内给予纳米颗粒组合物,其中每次给药之间的间隔不多于约1周,并且其中每次给药时的紫杉烷剂量是其遵照传统给药方案的最大耐受剂量的约0.25%至约25%。在一些实施方式中,紫杉醇/白蛋白纳米颗粒的平均直径不大于约200nm。在一些实施方式中,紫杉醇/白蛋白纳米颗粒组合物基本上不含(如不含)表面活性剂(如Cremophor)。在一些实施方式中,组合物中的白蛋白与紫杉醇的重量比为约18:1或更低,如约9:1或更低。在一些实施方式中,紫杉醇用白蛋包被白。在一些实施方式中,紫杉醇/白蛋白纳米颗粒的平均直径不大于约200nm,并且紫杉醇/白蛋白组合物基本上不含(如不含)表面活性剂(如Cremophor)。在一些实施方式中,紫杉醇/白蛋白纳米颗粒的平均直径是不大于约200nm,并且紫杉醇包被有白蛋白。在一些实施方式中,纳米颗粒组合物是AbraxaneTM。
在一些实施方式中,提供了给予组合物的方法,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒,其中在至少1个月期间给予纳米颗粒组合物,其中每次给药之间的间隔不多于约1周,并且其中每次给药时的紫杉烷剂量约0.25mg/m至约25mg/m2。在一些实施方式中,紫杉烷包被有载体蛋白(如白蛋白)。在一些实施方式中,每次给药的紫杉烷剂量低于约2、3、4、5、6、7、8、9、10、11、12、13、14、15、18、20、22和25mg/m2中的任意剂量。在一些实施方式中,紫杉烷以至少约每周1×、2×、3×、4×、5×、6×、7×(即,每日1次)中的任何频率给予。在一些实施方式中,每次给药之间的间隔低于约7日、6日、5日、4日、3日、2日和1日中的任何时间。在一些实施方式中,紫杉烷在至少约2、3、4、5、6、7、8、9、10、11、12、18、24、30和36个月中的任意时间段内给予。
在一些实施方式中,提供了给予组合物的方法,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒,其中在至少1个月期间给予纳米颗粒组合物,其中每次给药之间的间隔不多于约1周,并且其中每次给药时的紫杉烷剂量是约0.25mg/m2至约25mg/m2。在一些实施方式中,紫杉醇/白蛋白纳米颗粒的平均直径不大于约200nm。在一些实施方式中,紫杉醇/白蛋白纳米颗粒组合物基本上不含(如不含)表面活性剂(如Cremophor)。在一些实施方式中,组合物中的白蛋白与紫杉醇的重量比是约18:1或更低,如约9:1或更低。在一些实施方式中,紫杉醇包被有白蛋白。在一些实施方式中,紫杉醇/白蛋白纳米颗粒的平均直径不大于约200nm,并且紫杉醇/白蛋白组合物基本上不含(如不含)表面活性剂(如Cremophor)。在一些实施方式中,紫杉醇/白蛋白纳米颗粒的平均直径不大于约200nm,并且紫杉醇包被有白蛋白。在一些实施方式中,纳米颗粒组合物是AbraxaneTM。
在一些实施方式中,AbraxaneTM(或其它紫杉醇/白蛋白纳米颗粒组合物)以每日约3mg/kg至约10mg/kg的剂量给予。在一些实施方式中,AbraxaneTM以每日约6mg/kg至约10mg/kg的剂量给予。在一些实施方式中,AbraxaneTM以每日约6mg/kg的剂量给予。在一些实施方式中,Abraxane以每日约3mg/kg的剂量给予。
本发明也提供了用于本文描述的节律性方案的组合物。在一些实施方式中,提供了组合物,其包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒,其中所述组合物通过节律性给药方案给予个体,如本文所述的给药方案。
本发明的其它方面
另一方面,提供了治疗增殖性疾病的方法,包括给予组合物,所述组合物包括含有紫杉烷(包含紫杉醇、多烯紫杉醇或ortataxel)和载体蛋白(如白蛋白)的纳米颗粒。在一些实施方式中,提供了治疗癌症的方法,包括给予组合物,所述组合物包括含有ortataxel和载体蛋白(如白蛋白)的纳米颗粒。
在一些实施方式中,提供了治疗增殖性疾病的方法,包括给予组合物,所述组合物包括含有硫代秋水仙碱或其衍生物(如二聚体硫代秋水仙碱)和载体蛋白(如白蛋白)的纳米颗粒。在一些实施方式中,提供了治疗癌症的方法,包括给予组合物,所述组合物包括含有二聚体秋水仙碱和载体蛋白(如白蛋白)的纳米颗粒。在一些实施方式中,纳米颗粒组合物是下列中的任意(在一些实施方式中,选自下列):Nab-5404、Nab-5800和Nab-5801。
在一些实施方式中,提供了治疗癌症的方法,包括给予组合物,所述组合物包括含有紫杉醇的纳米颗粒,其中所述纳米颗粒组合物根据表3所述的任意给药方案给予。在一些实施方式中,癌症是紫杉烷难治的转移性乳腺癌。
表3
纳米颗粒组合物
本文所述的纳米颗粒组合物包括含有紫杉烷(如紫杉醇)和载体蛋白(如白蛋白)的纳米颗粒(在多种实施方式中基本上由它们组成)。水溶性差的药物(如紫杉烷)的纳米颗粒已经描述于例如,美国专利5,916,596;6,506,405和6,537,579中,也描述于美国专利公布2005/0004002A1中。虽然下文提供的描述具体针对紫杉烷,但应该理解,相同的描述适用于其它药物,如雷帕霉素、17-AAG和二聚体硫代秋水仙碱。
在一些实施方式中,组合物包括平均直径不大于约1000纳米(nm)的纳米颗粒,如不大于约900、800、700、600、500、400、300、200和100nm中的任何直径。在一些实施方式中,纳米颗粒的平均直径不大于约200nm。在一些实施方式中,纳米颗粒的平均直径不大于约150nm。在一些实施方式中,纳米颗粒的平均直径不大于约100nm。在一些实施方式中,纳米颗粒的平均直径为约20至约400nm。在一些实施方式中,纳米颗粒的平均直径为约40至约200nm。在一些实施方式中,纳米颗粒是可无菌过滤的。
本文所述的纳米颗粒可以以干燥制剂存在(如冻干组合物)或悬浮于生物相容性介质中。合适的生物相容性介质包括但不限于,水、含水缓冲介质、盐水、缓冲盐水、氨基酸的任选缓冲溶液、蛋白质的任选缓冲溶液、糖的任选缓冲溶液、维生素的任选缓冲溶液、合成聚合物的任选缓冲溶液、含脂类乳剂和类似物。
术语“蛋白质”是指任意长度的多肽或氨基酸聚合物(包含全长或片段),其可以是线性或分支的,包括修饰的氨基酸和/或被非氨基酸中断。该术语也包括已被天然修饰的氨基酸聚合物或被干扰而修饰的氨基酸聚合物;例如二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何操作或修饰。此术语中也包括,例如,含有一个或多个氨基酸类似物(包括,例如,非天然氨基酸等)以及本领域已知的其它修饰的多肽。本文所述的蛋白质可以是天然发生的,即,获自或来自天然来源(如血液)或是合成的(如化学合成或通过重组DNA技术合成)。
合适的载体蛋白的例子包括通常见于血液或血浆中的蛋白质,其包括但不限于白蛋白、免疫球蛋白包括IgA、脂蛋白、载脂蛋白B、α-酸性糖蛋白、β-2-巨球蛋白、甲状腺球蛋白、转铁蛋白、纤连蛋白、因子VII、因子VIII、因子IX、因子X和类似物。在一些实施方式中,载体蛋白是非血液蛋白质,如酪蛋白、α-乳清蛋白和β-乳球蛋白。载体蛋白可以是天然来源或是合成制备的。在一些实施方式中,药学上可接受的载体包括白蛋白,如人血清白蛋白。人血清白蛋白(HSA)是高度可溶性球蛋白,Mr65K,由585个氨基酸组成。HSA是血浆中最丰富的蛋白质,并且构成人血浆胶体渗透压的70-80%。HSA的氨基酸序列包含总共17个二硫键,一个游离硫醇(Cys34)和一个色氨酸(Trp214)。HSA溶液的静脉内应用已经被指出用于预防和治疗低血容量性休克(参见,例如,Tullis,JAMA,237,355-360,460-463,(1977))和Houser et al.,Surgery,Gynecology and Obstetrics,150,811-816(1980))和在新生儿胆红素血症治疗中与交换输血法(exchange transfusion)结合(参见,例如,Finlayson,Seminars in Thrombosis and Hemostasis,6,85-120,(1980))。其它白蛋白被考虑,如牛血清白蛋白。这些非人白蛋白的应用可能适用于例如,这些组合物应用在非人哺乳动物的情况中,如兽医应用(包含家养宠物和农业应用)。
人血清白蛋白(HSA)具有多个疏水性结合位点(对脂肪酸共有8个,脂肪酸是HSA的内源性配体)并且结合不同组的紫杉烷,特别是中性和带负电荷的疏水化合物(Goodman et al.,The Pharmacological Basis of Therapeutics,9th ed,McGraw-HillNew York(1996))。在HSA的亚结构域HA和IIIA中已经提出了两个高亲和结合位点,它们是高度延长的疏水袋,表面附近具有带电荷的赖氨酸和精氨酸残基,发挥极性配体特征的结合点的功能(参见,例如,Fehske et al.,Biochem.Pharmcol,30,687-92(198a),Vorum,Dan.Med.Bull.,46,379-99(1999),Kragh-Hansen,Dan.Med.Bull,1441,131-40(1990),Curry et al.,Nat.Struct.Biol.,5,827-35(1998),Sugioet al.,Protein.Eng.,12,439-46(1999),He et al.,Nature,358,209-15(199b),和Carteret al.,Adv.Protein.Chem.,45,153-203(1994))。已经显示,紫杉醇和propofol结合HSA(参见,例如,Paal et al.,Eur.J.Biochem.,268(7),2187-91(200a),Purcell et al.,Biochim.Biophys.Acta,1478(a),61-8(2000),Altmayer et al.,Arzneimittelforschung,45,1053-6(1995)和Garrido et al.,Rev.Esp.Anestestiol.Reanim.,41,308-12(1994))。此外,已经显示,多烯紫杉醇结合人血浆蛋白(参见,例如,Urien et al.,Invest.NewDrugs,14(b),147-51(1996))。
组合物中的载体蛋白(如白蛋白)一般作为紫杉烷的载体,即,与不含载体蛋白的组合物相比,组合物中的载体蛋白使得紫杉烷更容易悬浮在含水介质中或者帮助维持悬浮。这可以避免应用毒性溶剂(或表面活性剂)来溶解紫杉烷,从而可以降低给予个体(如人)紫杉烷的一种或多种副作用。因此,在一些实施方式中,本文所述的组合物基本上不含(如不含)表面活性剂,如Cremophor(包括Cremophor (BASF))。在一些实施方式中,纳米颗粒组合物基本上不含(如不含)表面活性剂。当给予个体纳米颗粒组合物时,如果组合物中Cremophor或表面活性剂的量不足以在个体中引起一种或多种副作用,则组合物“基本上无Cremophor”或“基本上无表面活性剂”。
本文所述的组合物中的载体蛋白的量将根据组合物的其它成分变化。在一些实施方式中,组合物包括的载体蛋白的量足以在含水悬浮液中稳定紫杉烷,例如,是稳定胶体悬浮液的形式(如稳定的纳米颗粒悬浮液)。在一些实施方式中,载体蛋白的量能够降低含水介质中的紫杉烷的沉降速度。对于含颗粒组合物,载体蛋白的量也取决于紫杉烷纳米颗粒的大小和密度。
如果紫杉烷保持悬浮在含水介质中(如没有可见的沉淀或沉降)一段延长的时间,如至少约0.1、0.2、0.25、0.5、1、2、3、4、5、6、7、8、9、10、11、12、24、36、48、60或72小时中的任意时间,则它在含水悬浮液中是“稳定的”。悬浮液通常适合给予个体(如人),但不是必需的。悬浮液的稳定性通常(但不必需)在贮存温度下(如室温(如20-25℃)或冷藏温度下(如4℃))被评价。例如,如果悬浮液在制备后约15分钟时,对于裸眼或者当在1000倍光学显微镜下观察时没有表现出可见的絮凝或颗粒聚集,则悬浮液在贮存温度下是稳定的。稳定性也可以在加速的试验条件下评价,如在高于约40℃的温度下。
在一些实施方式中,载体蛋白存在的量足以将紫杉烷在含水介质中稳定在一定浓度下。例如,组合物中的紫杉烷浓度是约0.1至约100mg/ml,包括例如,约0.1至约50mg/ml、约0.1至约20mg/ml、约1至约10mg/ml、约2mg/ml至约8mg/ml、约4至约6mg/ml、约5mg/ml中的任意浓度。在一些实施方式中,紫杉烷的浓度是至少约1.3mg/ml、1.5mg/ml、2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml、15mg/ml、20mg/ml、25mg/ml、30mg/ml、40mg/ml和50mg/ml中的任意浓度。在一些实施方式中,载体蛋白存在的量避免表面活性剂(如Cremophor)的使用,从而组合物不含或基本上不含表面活性剂(如Cremophor)。
在一些实施方式中,液体形式的组合物包括约0.1%至约50%(w/v)(例如,约0.5%(w/v)、约5%(w/v)、约10%(w/v)、约15%(w/v)、约20%(w/v)、约30%(w/v)、约40%(w/v)或约50%(w/v))的载体蛋白。在一些实施方式中,液体形式的组合物包括约0.5%至约5%(w/v)的载体蛋白。
在一些实施方式中,纳米颗粒组合物中的载体蛋白例如白蛋白与紫杉烷的重量比是这样的,使得足量的紫杉烷结合于细胞或被细胞转运。虽然载体蛋白与紫杉烷的重量比将必需针对不同的载体蛋白和紫杉烷组合而优化,但通常地,载体蛋白例如白蛋白与紫杉烷的重量比(w/w)是约0.01:1至约100:1、约0.02:1至约50:1、约0.05:1至约20:1、约0.1:1至约20:1、约1:1至约18:1、约2:1至约15:1、约3:1至约12:1、约4:1至约10:1、约5:1至约9:1、或约9:1。在一些实施方式中,载体蛋白与紫杉烷的重量比是约18:1或更低、15:1或更低、14:1或更低、13:1或更低、12:1或更低、11:1或更低、10:1或更低、9:1或更低、8:1或更低、7:1或更低、6:1或更低、5:1或更低、4:1或更低、和3:1或更低中的任意比例。
在一些实施方式中,载体蛋白使得组合物被给予个体(如人)而没有明显的副作用。在一些实施方式中,载体蛋白(如白蛋白)的量有效降低向人施用紫杉烷的一种或多种副作用。术语“降低施用紫杉烷的一种或多种副作用”是指减轻、缓解、改善或避免紫杉烷引起的一种或多种副作用,以及用于输送紫杉烷的输送载体(如使得紫杉烷适于注射的溶剂)引起的副作用。这些副作用包括,例如,骨髓抑制、神经毒性、超敏性、炎症、静脉刺激(venous irritation)、静脉炎、疼痛、皮肤刺激(skin irritation)、外周神经病、粒细胞缺乏性发热(neutropenic fever)、过敏性反应、静脉血栓、外渗(extravasation)和它们的组合。然而,这些副作用仅仅是示范性的,与紫杉烷有关的其它副作用或副作用的组合都可以被降低。
在一些实施方式中,组合物包括AbraxaneTM。AbraxaneTM是由人白蛋白USP稳定的紫杉醇制剂,其可以分散在可直接注射的生理溶液中。当其分散在合适的含水介质如0.9%氯化钠注射液或5%葡萄糖注射液中时,AbraxaneTM形成稳定的紫杉醇胶体悬浮液。胶体悬浮液中的纳米颗粒的平均颗粒大小是约130纳米。由于HSA在水中自由溶解,AbraxaneTM能够以宽范围的浓度范围重构,从稀的(0.1mg/ml紫杉醇)到浓的(20mg/ml紫杉醇),包括,例如,约2mg/ml至约8mg/ml,约5mg/ml。
制备纳米颗粒组合物的方法是本领域已知的。例如,含有紫杉烷(如紫杉醇)和载体蛋白(如白蛋白)的纳米颗粒可以在高剪切力条件下(例如,超声波、高压匀化、或类似条件)制备。这些方法描述于,例如,美国专利5,916,596、6,506,405和6,537,579中,也描述于美国专利公布2005/0004002A1中。
简言之,紫杉烷(如多烯紫杉醇)被溶解在有机溶剂中,并且溶液可以被加到人血清白蛋白溶液中。使混合物接受高压匀化处理。随后可以通过蒸发去除有机溶剂。获得的分散体可以进一步冻干。合适的有机溶剂包括,例如,酮、酯、醚、氯化的溶剂和本领域已知的其它溶剂。例如,有机溶剂可以是二氯甲烷和氯仿/乙醇(例如,比例是1:9、1:8、1:7、1:6、1:5、1:4、1:3、1:2、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1或9:a)。
纳米颗粒组合物中的其它组分
本文所述的纳米颗粒可以在含有其它试剂、赋形剂或稳定剂的组合物中存在。例如,为了通过增加纳米颗粒的负ζ电势来增加稳定性,可以加入一些负电荷成分。这种负电荷成分包括但不限于,胆汁酸的胆汁酸盐,所述胆汁酸由甘氨胆酸、胆酸、鹅去氧胆酸、牛磺胆酸、糖基鹅去氧胆酸、牛磺熊鹅脱氧胆酸、litocholic acid、熊脱氧胆酸、脱氢胆酸和其它组成;磷脂,包括卵磷脂(蛋黄)基磷脂,包括下列磷脂酰胆碱:棕榈酰油酰磷脂酰胆碱、棕榈酰亚油酰磷脂酰胆碱、硬脂酰亚油酰磷脂酰胆碱、硬脂酰油酰磷脂酰胆碱、硬脂酰花生四烯酰磷脂酰胆碱、和二棕榈酰磷脂酰胆碱。其它磷脂包括L-α-双十四酰磷脂酰胆碱(DMPC)、双油酰磷脂酰胆碱(DOPC)、二硬脂酰磷脂酰胆碱(DSPC)、氢化大豆卵磷脂(HSPC)和其它相关化合物。负电荷表面活性剂或乳化剂也适于作为添加剂,例如,胆固醇硫酸钠和类似物。
在一些实施方式中,组合物适于给予人类。在一些实施方式中,组合物适于给予哺乳动物如,兽医应用、家养宠物和农业动物。有宽范围的合适的纳米颗粒组合物制剂(参见,例如,美国专利5,916,596和6,096,331)。下列制剂和方法仅仅是示范性的,决不是限制性的。适于口服施用的制剂可以由如下组成:(a)液体溶液,如有效量的溶解于稀释剂中的化合物,稀释剂如水、盐水或桔汁,(b)胶囊、袋或片剂,各自含有预先确定量的活性成分,如固体或颗粒,(c)在合适液体中的悬浮剂,和(d)合适的乳剂。片剂可以包括乳糖、甘露醇、玉米淀粉、马铃薯淀粉、微晶纤维素、阿拉伯胶、明胶、胶体二氧化硅、羟甲基纤维素钠、滑石、硬脂酸镁、硬脂酸和其它赋形剂、着色剂、稀释剂、缓冲剂、湿润剂、防腐剂、风味剂和药学上相容的赋形剂中的一种或多种。锭剂形式可以包括香料,通常是蔗糖和阿拉伯胶或黄蓍胶中的活性成分,以及含有惰性基质如明胶和甘油或蔗糖和阿拉伯胶中的活性成分的锭剂、乳剂、凝胶,和含有除活性成分外的本领域已知的此类赋形剂的类似形式。
合适的载体、赋形剂和稀释剂的例子包括但不限于乳糖、葡萄糖、蔗糖、山梨醇、甘露醇、淀粉、阿拉伯胶、磷酸钙、藻酸盐、黄蓍胶、明胶、硅酸钙、微晶纤维素、聚乙烯基吡咯烷酮、纤维素、水、盐水溶液、糖浆、甲基纤维素、甲基和丙基羟基苯甲酸盐、滑石、硬脂酸镁和矿物油。制剂可以附加地包含润滑剂、湿润剂、乳化剂和悬浮剂、防腐剂、甜味剂或风味剂。
适于肠道外给药的制剂包括含水的和非含水的,等渗无菌注射液,其可以含有抗氧化剂、缓冲液、抑菌剂、和使得制剂与目标接受者的血液生物相容的溶质,和含水的和非含水的无菌悬浮液,其可以含有悬浮剂、增溶剂、增稠剂、稳定剂和防腐剂。制剂可以保存在单位剂量或多剂量密封的容器中,如安瓿(ampules)和小瓶,并且可以贮存在冷冻干燥(冻干)条件下,其仅需要在应用之前一刻加入无菌液体赋形剂,例如,注射用水。临时注射液和悬浮液可以由无菌粉末、颗粒和前述类型的片剂制备。优选可注射制剂。
在一些实施方式中,组合物被配制为具有约4.5至约9.0的pH范围,包括,例如,约5.0至约8.0、约6.5至约7.5和约6.5至约7.0的pH范围中的任意范围。在一些实施方式中,组合物的pH被配制为不大于约6,包括,例如,不大于约6.5、7或8中的任意范围(如约8)。通过加入合适的张力修饰剂如甘油,也可以使组合物与血液等渗。
试剂盒
本发明也提供了用于本方法的试剂盒。本方法的试剂盒包括一种或多种容器,所述容器包括含紫杉烷的纳米颗粒组合物(或单位剂型和/或制品)和/或化疗剂,在一些实施方式中,还包括根据本文所述任意方法的使用说明书。试剂盒还可以包括对选择适于治疗的个体的说明。本发明试剂盒中提供的说明书一般是标签或包装插入物(例如,试剂盒中包含的一页纸)上的书面说明书,但是机器可读的说明书(例如,在磁盘或光盘上携带的说明书)也可以接受。
在一些实施方式中,试剂盒包括:a)组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒,b)有效量的至少一种其它化疗剂,和c)用于同时和/或相继施用纳米颗粒和化疗剂的说明书,用于治疗增殖性疾病(如癌症)。在一些实施方式中,紫杉烷是紫杉醇、多烯紫杉醇和ortataxel中的任意。在一些实施方式中,试剂盒包括纳米颗粒,包含a)组合物,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒(如AbraxaneTM),b)有效量的至少一种其它化疗剂,和c)用于同时和/或相继施用纳米颗粒和化疗剂的说明书,用于治疗增殖性疾病(如癌症)。
在一些实施方式中,试剂盒包括:a)组合物,所述组合物包括含有紫杉烷和载体蛋白(如白蛋白)的纳米颗粒,b)组合物,所述组合物包括含有至少一种其它化疗剂和载体蛋白(如白蛋白)的纳米颗粒,和c)用于同时和/或相继施用纳米颗粒组合物的说明书,用于治疗增殖性疾病(如癌症)。在一些实施方式中,试剂盒包括纳米颗粒,包括:a)组合物,所述组合物包括含有紫杉醇和白蛋白的纳米颗粒(如AbraxaneTM),b)组合物,所述组合物包括含有至少一种其它化疗剂和载体蛋白(如白蛋白)的纳米颗粒,和c)用于同时和/或相继施用纳米颗粒组合物的说明书,用于有效地治疗增殖性疾病(如癌症)。
纳米颗粒和化疗剂可以存在于分开的容器中或在单个容器中。应该理解,试剂盒可以包括一种独特的组合物或两种或更多种组合物,其中一种组合物包括纳米颗粒,一个组合物包括化疗剂。
本发明的试剂盒处于合适的包装中。合适的包装包括但不限于,小瓶、瓶、罐、柔性包装(例如,seled Mylar或塑料袋)和类似物。试剂盒可以任选地提供其它组分,如缓冲液和说明信息。
关于应用纳米颗粒组合物的说明书一般包括有关目的治疗的剂量、给药方案和给药途径的信息。容器可以是单位剂量、大包装(例如,多剂量包装)或亚单位剂量。例如,试剂盒可能提供为,含有足够的紫杉烷(如紫杉烷)剂量,如本文所述,以便为个体提供延长时间的有效治疗,如1周、2周、3周、4周、6周、8周、3个月、4个月、5个月、7个月、8个月、9个月或更长时间中的任意时间。试剂盒也可以包括多单位剂量的紫杉烷和药物组合物和使用说明书,并且以足以贮存的药房应用的量包装,所述药房例如,医院药房和配药药房。
本领域技术人员将知道,在本发明范围和精神内,几种变化是可能的。通过参考下列的非限制性例子,本发明将更加详细地被描述。下列实施例进一步说明了本发明,但是当然,不应该被解释为以任何方式限制其范围。
实施例
嗜中性白血球减少症和超敏性的发生率明显降低、不需要类固醇预先给药、更短的神经病持续时间、更短的输注时间和更高的剂量。
在患有转移性乳腺癌(MBC)的个体中,将ABI-007(AbraxaneTM)——不含任何溶剂的、纳米颗粒形式的第一生物学相互作用性白蛋白结合的紫杉醇,与基于的紫杉醇()比较。进行该III期研究以证实临床前研究,从而证明ABI-007与相比的优越效应和降低的毒性。使个体随机化设计为3周循环,或是在30分钟期间(静脉内)给予ABI-007260mg/m2而不预先给药(n=229),或是在3小时期间静脉内给予175mg/m2,预先给药(n=225)。与相比,ABI-007显示出明显更高的响应速度(33%比19%;p=0.001)和明显更长的肿瘤消退时间(23.0比16.9周,HR=0.75,p=0.006)。在接受ABI-007的个体中,具有更长的整体存活的趋势(65.0比55.7周;p=0.374)。在未计划的分析中,ABI-007提高了接受二线或更高线治疗的个体的存活时间(56.4比46.7周,HR=0.73,p=0.024)。在ABI-007组中,4级中性白细胞减少症的发生率明显降低(9%比22%,p<0.001),虽然紫杉醇剂量高49%。3级感觉神经病在ABI-007组中比组中更加普遍(10%比2%,p<0.001),但是比TaxolR(中间数73天)更容易被管理和改进速度更快(中间数22天)。在ABI-007组的任一个体中,没有发生严重的(3或4级)治疗相关超敏反应,虽然没有预先给药并且给药时间较短。与之相比,3级超敏反应在组中发生,虽然应用标准的预先给药(胸痛:2个人;过敏反应:3个人)。按照方案,没有常规给予ABI-007组中的个体皮质类固醇和抗组胺药;然而,在2%的治疗周期中,在ABI-007组中的18个个体(8%)中,进行预先给药以防止呕吐、肌痛/关节痛或厌食;而在95%的治疗周期中,组中的224个个体(>99%)接受预先给药。2个治疗组之间明显不同的唯一临床化学值是,在-治疗个体中,血清葡萄糖水平更高,所述个体也具有更高的高血糖症发生率,其被报告为AE(不利作用)(15[7%]比3[1%];p=0.003)。总之,相比于,ABI-007在这些个体群中证明了更高的效应和优越的安全特性。治疗指数的改进和基于溶剂的紫杉烷所需的类固醇预先给药的消除,使得该纳米颗粒白蛋白结合的紫杉醇成为MBC治疗中的重要改进。
实施例2.在紫杉烷难治的转移性乳腺癌个体中,每周给予AbraxaneTM
最近的II期临床研究示出,在患有转移性乳腺癌的个体中,以125mg/m2每周给予AbraxaneTM(纳米颗粒白蛋白结合的紫杉醇)产生长期的疾病控制,所述患者的疾病在应用或治疗的情况下仍然进展(即,所述个体是紫杉烷难治性的)。
AbraxaneTM被认为代表了第一生物学相互作用组合物,其利用受体介导(gp60)的通路,所述通路被发现是获得活性成分-紫杉醇的高细胞内肿瘤浓度所必需的。II期研究包括75个患有紫杉烷难治性转移乳腺癌的个体。每周以125mg/m2通过30分钟输注给予AbraxaneTM,不预先给予类固醇/抗组胺药或进行G-CSF预防。个体接受三次周剂量,随后停止1周,每28天重复。与或——它们含有可能抑制肿瘤摄取的去污剂——不同,白蛋白结合的纳米颗粒紫杉烷的作用机制可以产生改进的后果,特别是在这些难于治疗的个体群中。
特别地,数据示出了,虽然在该高度预先治疗和预先紫杉烷暴露的个体群中的每周剂量是高达125mg/m2,但75个个体中仅有3个(4%)由于外周神经病而不得不停止AbraxaneTM。而且,在经历3级外周神经病的个体中,一般80%在仅延迟1或2周后能够重新开始治疗和继续接受降低剂量的AbraxaneTM,平均再4个月。这一快速改进与我们从III期试验中的观察结果一致,所述结果是:与诱导的外周神经病相比,单独的紫杉醇(即,不含)诱导的外周神经病快速改善。这些AbraxaneTM临床试验经历提供了评价化疗剂紫杉醇本身的作用的第一临床机会,与溶剂的作用区分开来。基于II期和III期试验经历,现在数据表明,在持续时间和对个体的影响方面,AbraxaneTM产生的外周神经病比不上或产生的外周神经病。
对于给予或后的外周神经病的临床经历,Abraxis Oncology最近完成了对200个肿瘤学家的调查,肿瘤学家被问道:他们认为由诱导的外周神经病经过多久能够得到改善和/或解决;25%的肿瘤学家报告“7-12个月”,另外23%报告“没有解决”;对于,各自的百分比是29%和7%。这些数据与和的包装插入物中的陈述一致。
对II期数据的分析证明,在这些预后不良的群体(87%内脏(肺和肝)疾病,69%>3个转移灶,88%在紫杉烷情况下肿瘤生长)中,AbraxaneTM具有活性,所述群体是患有转移性乳腺癌的紫杉烷难治性个体。观察结果包括在-难治性个体中的疾病控制是44%,在-难治性个体中的疾病控制是39%。在转移性情况下应用单独的时疾病发展的那些个体中(n=27),观察到在接受每周一次的AbraxaneTM后的响应率是19%。在转移性情况下应用单独的时疾病发展的那些个体中(n=23),观察到在接受每周一次AbraxaneTM后的响应率是13%。
当每周一次在30分钟期间给予时,发现AbraxaneTM被良好耐受,其中不给予类固醇或G-CSF预防:4级中性粒细胞减少症=3%(没有G-CSF);4级贫血=1%;没有严重的超敏反应(虽然没有预先给药)。在该高度预处理的个体群中,75%的个体以每周125mg/m2AbraxaneTM的完全高剂量处理,没有由于毒性/副作用引起的剂量减低。在发生3级感觉性神经病的个体中,77%的个体能够重新开始减低剂量的AbraxaneTM(75-100mg/m2)和接受平均12.2(范围,1-28)的额外剂量的AbraxaneTM。明显注意到,在重新应用AbraxaneTM的这些个体中,在神经病改善为1级或2级后14天内,80%(10中的8个)的个体能够重新开始药物治疗。这些结果支持了关键的III期试验的观察结果,所述试验应用260mg/m2的AbraxaneTM,每3周给予,其中也注意到神经病的快速改进(中间数22天)。综合这两个临床试验,表明当单独给予紫杉醇时,发生的神经病似乎时间短并且容易控制。
AbraxaneTM应用微血管内皮细胞上的基于gp60受体的通路,以转运白蛋白-紫杉醇复合物到血管外并进入肿瘤间隙,已经显示,不通过这一机制转运。而且,白蛋白结合的蛋白SPARC,在乳腺肿瘤中过度表达,可能在AbraxaneTM的增加的肿瘤内积累中起作用。所提出的机制表明,一旦位于肿瘤间隙,则白蛋白-紫杉醇复合物会与肿瘤细胞表面上存在的SPARC结合,并且通过非溶酶体机制被迅速内化入肿瘤细胞中。
此外,目前的紫杉烷制剂中一般应用的表面活性剂/溶剂,如、80和TPGS,强烈抑制紫杉醇与白蛋白的结合,从而限制跨内皮转运。示出的其它数据表明,在MX-1乳腺癌异种移植物中,等剂量的AbraxaneTM比的效率在统计学上有所改进。
总之,75%的个体以完全高剂量进行治疗,剂量没有减低。数据表明,单独给予纳米颗粒白蛋白结合的紫杉醇而没有溶剂时,外周神经病得到快速改善。其它数据提供了增加的证据,证明该作用机制在增强个体结果方面可能起重要作用。
实施例3.在MDA-MB-435人肿瘤异种转移物中,AbraxaneTM(ABI-007)与靶向抗血管生成促凋亡肽(HKP)协同作用。
小的合成的促凋亡肽的抗血管生成活性由两个功能域构成,一个靶向于肿瘤微血管上的CD13受体(氨基肽酶N),另一个在内化后干扰线粒体膜,这已经被报道。参见,Nat Med.1999Sep;5(9):1032-8。第二代二聚体肽CNGRC-GG-d(KLAKLAK)2命名为HKP(Hunter Killer Peptide),发现其具有改进的抗肿瘤活性。由于抗血管生成剂如表现出与细胞毒性剂如5-氟尿嘧啶的协同作用,我们在MDA-MB-435人乳腺肿瘤异种转移物中,评价抗血管生成剂HKP和AbraxaneTM(ABI-007)的联合作用,AbraxaneTM是白蛋白纳米颗粒紫杉醇,由血管内皮中的gp60受体转运(Desai,SABCS2003)。
方法:以平均肿瘤体积100mm3建立MDA-MB-435人肿瘤异种转移物,将小鼠随机分为12-13只动物的组,并用HKP、AbraxaneTM或HKP和AbraxaneTM处理。静脉输送HKP(250ug),每周1次,持续16周。静脉给予AbraxaneTM,每日给予,持续5日,10mg/kg/日,仅第一周治疗给予。应用的AbraxaneTM剂量实质上低于其MTD(30mg/kg/日,qd×5),以防止肿瘤完全消退,从而可以注意到HKP的作用。
结果:在处理第19周时,在对照组(10,298mm3±2,570)和HKP(4,372mm3±2,470;p<0.05,比对照组)或ABI-007(3,909mm3±506;p<0.01比对照组)之间,肿瘤体积显著降低。与任一单药治疗相比,ABI-007和HKP的联合明显降低肿瘤体积(411mm3±386;p<0.01,比AbraxaneTM单药治疗或HKP单药治疗)。所述处理被良好耐受。
实施例4.节律性ABI-007治疗:纳米颗粒白蛋白结合的紫杉醇的抗血管生成和抗肿瘤活性
实施例4a
方法:通过大鼠主动脉环、人脐静脉内皮细胞(HUVEC)增殖和管腔形成试验评价ABI-007的抗血管生成活性。通过测定Balb/c携带非肿瘤小鼠的外周血中循环内皮祖细胞(CEPs)的水平(n=5/组;剂量1-30mg/kg,腹膜内,qd×7)和流式细胞分析,确定ABI-007用于节律性治疗的最佳剂量(Shaked et al.,Cancer Cell,7:101-111(2005))。随后,在带有人MDA-MD-231乳腺癌和PC3前列腺癌异种移植物的SCID小鼠中,评价并比较节律性(qd;i.p.)和MTD(qd×5,1个周期,i.v.)ABI-007和的抗肿瘤效应。
结果:5nM的ABI-007显著(p<0.05)抑制大鼠动脉微血管向外生长,人内皮细胞增殖和管腔形成,分别为53%、24%和75%。根据CEP测定,观察到ABI-007用于节律性治疗的最佳剂量是6-10mg/kg。节律性ABI-007(6mg/kg)而不是(1.3mg/kg)显著(p<0.05)抑制两种异种移植物模型中的肿瘤生长。节律性给予的ABI-007和都不诱导任何体重减轻。虽然MTD ABI-007(30mg/kg)比MTD (13mg/kg)更有效地抑制肿瘤生长,但前者观察到明显的体重丢失。有趣的是,节律性ABI-007的抗肿瘤作用近似MTD 的抗肿瘤作用。
结论:当用于节律性方案时,ABI-007表现出强效抗血管生成和抗肿瘤活性。
实施例4b
大鼠主动脉环分析。将12孔组织培养板包被有基质凝胶(Matrigel)(Collaborative Biomedical Products,Bedford,MA),使其于37℃和5%CO2下凝胶30分钟。从8至10周龄的雄性Sprague-Dawley大鼠切除胸主动脉,切为1-mm长的横截面切片,放在基质凝胶(Matrigel)包被的孔中,用额外的基质凝胶(Matrigel)覆盖。设置第二层基质凝胶(Matrigel)之后,用EGM-II覆盖这些环,于37℃和5%CO2下温育。EGM-II由内皮细胞基础培养基(EBM-II;Cambrex,Walkersville,MD)加内皮细胞生长因子构成,以EGM-II Bulletkit(Cambrex)被提供。随后将培养基更换为EBM-II,补充有2%FBS、0.25μg/ml两性霉素B和10μg/ml庆大霉素。用含有载体(0.9%盐水/白蛋白)、羧基酰胺三唑(CAI;12μg/ml)或ABI-007(0.05-10nM紫杉醇)的EBM-II处理主动脉环4天,并在第5天照相。CAI是已知的抗血管生成剂,以高于临床上可实现的浓度应用,作为阳性对照。用来自四种不同大鼠的主动脉重复试验4次。用Adobe Photoshop6.0量化血管发生萌发面积,报告为正方形像素。
如图1A所示,相对于载体对照,ABI-007以浓度依赖性方式明显抑制大鼠主动脉微血管向外生长,在5nM(53%抑制)和10nM(68%抑制)时,取得统计学显著性(p<0.05)。以ABI-007的每一浓度单独存在的白蛋白量不抑制血管生成。
内皮细胞增殖试验。在37℃和5%CO2下,在EGM-II中维持人脐静脉内皮细胞(Human umbilical vein endothelial cells(HUVEC;Cambrex))。将HUVECs种于12孔板上,密度是30,000个细胞/孔,使其粘附过夜。随后吸取培养基,向每个孔加入含有载体(0.9%盐水/白蛋白)或ABI-007(0.05-10nM紫杉醇)的新鲜培养基。48h后,细胞被胰蛋白酶消化,用Coulter Z1计数器(Coulter Corp.,Hialeah,FL)计数。所有试验重复三次。
如图1B所示,人内皮细胞增殖被5nM和10nM的ABI-007显著抑制,分别抑制36%和41%。
内皮细胞管腔形成试验。用Matrigel包被8孔玻片室(slide chambers),使其于37℃和5%CO2下胶凝30分钟。随后在含有载体(0.9%盐水/白蛋白)或ABI-007(0.05-10nM紫杉醇)的EGM-II中,以30,000个细胞/孔种植HUVECs,于37℃和5%CO2下温育16小时。温育后,在PBS中洗涤玻片,在100%甲醇中固定10秒钟,用DiffQuick溶液II(Dade Behring Inc.,Newark,DE)染色2分钟。为了分析管腔形成,应用2.5×物镜对每个孔进行数字化照相。设定一个阈值水平,以便遮蔽被染色的管。应用MetaMorph软件(Universal Imaging,Downingtown,PA)将相应面积测量为像素数目。试验重复进行三次。
如图1C所示,ABI-007在5nM和10nM时阻断管形成75%。
通过测量循环内皮细胞(CEC)和循环内皮祖细胞(CEC)确定ABI-007的体内最佳生物学剂量。将6至8周龄的雌性Balb/cJ小鼠随机分为下列8组(每组n=5):未治疗;通过每日腹膜内弹丸注射药物载体(0.9%盐水/白蛋白)或ABI-007进行治疗,剂量为1、3、6、10、15或30mg/kg紫杉醇,进行7天。治疗末期,通过心脏穿刺采取血样,在含有EDTA的真空管(Becton Dickinson,Franklin Lakes,NJ)中收集。用四色流式细胞仪计数CECs和CEPs。应用特异于CD45的单克隆抗体排除CD45+造血细胞。应用鼠类内皮标志物,胎儿肝脏激酶1/VEGF受体2(flk-l/VEGFR2)、CD13和CD117(BD Pharmingen,San Diego,CA),描述CECs及其CEP亚类。进行核染色(Procount;BD Biosciences,San Jose,CA)以便排除血小板或细胞碎片干扰CEC和CEP计数精确性的可能性。红细胞裂解后,利用设计用于排除死细胞、血小板和碎片的分析途径,通过FACSCalibur(BD Biosciences)评价细胞悬浮液。为了分析CEC和CEP的百分数,得到至少100,000个事件/样品。随后将CECs和CEPs的绝对数计算为,CEC和CEP计数途径中收集的事件百分数乘以白细胞总数。确定染色细胞的百分数,与合适的阴性对照比较。阳性对照被定义为,大于非特异性背景染色。应用7-氨基放射菌素D(7AAD)对存活细胞比凋亡和死亡细胞进行计数。
图2示出了,以3、10-30mg/kg每日腹膜内给予ABI-007持续7天,明显降低非肿瘤携带Balb/cJ小鼠的CEP水平。然而,10-30mg/kg的ABI-007与表示毒性的白细胞计数的显著降低有关。虽然6mg/kg的ABI-007导致的CEP水平降低未达到统计学显著性,但白细胞计数上的减少是不明显的。因此,结论是,节律性ABI-007的体内最佳生物学剂量是3-10mg/kg之间。在一个研究中,每日腹膜内给予1.3、3、6或13mg/kg的节律性持续7天没有显著降低CEP存活水平,而30mg/kg或更高的节律性引起小鼠严重的毒性并且最终死亡。以前报道,腹膜内给予临床普遍应用剂量的引起紫杉醇在腹膜腔中包封在EL胶束中,结果使得血浆紫杉醇浓度不明显(Gelderblom et al.,Clin.Cancer Res.8:1237-41(2002))。这解释了不引起死亡的节律性(1.3、3、6和13mg/kg)剂量为何不能改变CEP存活水平。在这种情况下,腹膜内以1.3mg/kg剂量给予节律性不会与13mg/kg的剂量有任何差异。因此,选择较低剂量1.3mg/kg以便在随后的试验中使每次给予紫杉醇时的EL量最小化。
节律性和MTD ABI-007相比于节律性和MTD 的抗肿瘤作用。人前列腺癌细胞系PC3和人乳腺癌细胞系MDA-MD-231得自American Type CultureCollection(Manassas,VA)。将PC3细胞(5×106)皮下注射入6至8周龄SCID小鼠,而MDA-MB-231细胞(2×106)原位植入雌性SCID小鼠的乳腺脂肪垫。当原发性肿瘤体积达到约150-200mm3时,将动物随机分为8组(n=5-10/组)。每组应用下列各项治疗:0.9%盐水/白蛋白载体对照、EL载体对照、节律性(1.3mg/kg,i.p.,qd)、节律性ABI-007(3、6或10mg/kg紫杉醇,i.p.,qd)、MTD(13mg/kg,i.p.,qd×5,1周期)或MTD ABI-007(30mg/kg紫杉醇,i.v.,qd×5,1个周期)。用测径器每周1次测量肿瘤垂直直径,并计算它们的体积。在治疗末期,从所有组的小鼠经心脏穿刺采取血样。CECs和CEPs如本文所述计数。
腹膜内每日给予节律性ABI-007(3、6和10mg/kg)而不是(1.3mg/kg)持续4周,明显(p<0.05)抑制MDA-MB-231和PC3肿瘤生长(图3A和图3B)。节律性给予的ABI-007和Taxol都不诱导任何体重减轻(图3C和图3D)。虽然MTDABI-007(30mg/kg)抑制肿瘤生长比MTD (13mg/kg)更加有效,在前者中观察到明显的体重丢失,表明具有毒性。此外,药物末次剂量后6天,用MTD ABI-007治疗的5只小鼠中的2只表现出单肢体的麻痹迹象。麻痹是暂时的,在24-48小时内恢复。有趣的是,在MDA-MB-23异种移植物模型中,6mg/kg的节律性ABI-007的抗肿瘤作用类似于MTD 的作用(图3A)。增加节律性ABI-007的剂量至10mg/kg似乎不赋予更显著的肿瘤生长抑制作用。相比而言,在PC3异种移植物中,10mg/kg的节律性ABI-007比3和6mg/kg引起更强的抗肿瘤响应(图3B)。
节律性ABI-007以剂量依赖性方式显著降低MDA-MB-231肿瘤携带小鼠中的存活CEPs水平(图4A)。在PC3肿瘤携带小鼠中,响应于节律性ABI-007,存活CEP水平也表现出剂量依赖性降低,但仅在10mg/kg达到统计学显著性(图4B)。在两种异种移植物模型中,CEPs的水平没有被节律性改变(图4A和图4B)。
节律性和MTD ABI-007与节律性和MTD 对肿瘤内微血管密度的作用被研究。5-um厚的切片得自冷冻的MDA-MB-231和PC3肿瘤,通过本领域技术人员已知的标准方法,应用H&E对其染色用于组织学检查。为了检测微血管,用大鼠抗小鼠CD31/PECAM-1抗体(1:1000,BD Pharmingen)对切片染色,随后用德克萨斯红(Texas Red)-偶联的羊抗大鼠二抗(1:200,Jackson ImmunoResearchLaboratories,Inc.,West Grove,PA)染色。单个微血管被定义为,CD31/PECAM-1d染色阳性的不连续簇或单个细胞,腔的存在不是用于作为微血管评分所必需的。每一肿瘤的MVD表示为三个染色最密集的区域的平均数,以20×物镜在ZeissAxioVision3.0荧光显微成像系统中鉴定。对每一载体对照或治疗组,分析4至5种不同肿瘤。
在MDA-MB-231肿瘤中,6和10mg/kg的节律性ABI-007,以及MTD ABI-007似乎轻微降低微血管密度(microvessel density(MVD)),虽然没有达到统计学显著性(图5A)。在PC3肿瘤中,3和10mg/kg的节律性ABI-007,似乎降低MVD,但没有达到统计学显著性(图5A)。有趣的是,在MVD和存活CEP水平之间存在明显的关联性,这发生于MDA-MB-231(图5B;r=0.76,P-0.04)而不是PC3(图5C;r=-0.071,P-0.88)模型中。
进行体内血管生成评价。进行基质凝胶栓输注分析(Matrigel plug perfusionassay),对本领域技术人员已知的方法进行微小的修改。简言之,在第0天将补充有500ng/ml碱性成纤维细胞生长因子(bFGF;R&D Systems Inc.,Minneapolis,MN)的0.5ml基质凝胶(Matrigel)皮下注射入10周龄雌性Balb/cJ小鼠的侧腹。在第3天,将动物随机分配到8组中(每组n=5)。各组用下列各项处理:0.9%盐水/白蛋白载体对照、EL载体对照、节律性(1.3mg/kg,i.p.,qd)、节律性ABI-007(3、6或10mg/kg紫杉醇,i.p.,qd)、MTD (13mg/kg,i.v.,qd×5)或MTD ABI-007(30mg/kg紫杉醇,i.v,qd×5)。作为阴性对照,另外5只相似年龄的雌性Balb/cJ小鼠注射以单独的基质凝胶(Matrigel)。在第10天,对所有动物静脉注射0.2ml的25mg/ml FITC-葡萄糖(Sigma,St.Louis,MO)。随后收集血浆样品。去除基质凝胶栓(Matrigel plugs),用分散酶(Dispase(CollaborativeBiomedical Products,Bedford,MA))于37℃温育过夜,随后匀浆化。用FL600荧光平板读数器(Biotech Instruments,Winooski,VT)获得荧光读数。血管生成反应表示为基质凝胶栓荧光比血浆荧光的比值。
实施例5.Nab-5109—一种纳米颗粒白蛋白结合的IDN5109(A Nanoparticlealbumin-bound IDN5109(nab-5109))—表现出比制剂(-5109,Ortataxel)改进的效率和降低的毒性
方法:应用nab技术制备纳米颗粒nab-5109,用激光散射表征。在裸鼠中(n=5/组),针对Pgp+DLD-1(已知其抵抗紫杉醇和多烯紫杉醇-Vredenburg et al,JNCI93:1234-1245,2001)人结肠癌异种移植物,测定Nab-5109和Tween-5109,剂量是50mg/kg(-5109,以前表示为MTD)和75mg/kg(nab-5109),以q3d×4静脉内给予。也应用PBS和人血清白蛋白(HSA)对照组。
结果:Nab-5109产生具有平均大小、ZAve=119nm;Zeta电位=-32.7mV的纳米颗粒。将Nab-5109冻干为容易在盐水中分散的干燥粉末。在体内,在携带肿瘤的小鼠中,应用-5109(50mg/kg,8.8%体重丢失)的体重丢失明显大于应用nab-5109(75mg/kg,3.4%体重丢失)(ANOVA,p<0.001),这表示nab-5109具有实质上更低的毒性,虽然剂量高了50%。nab-5109和-5109对肿瘤有明显抑制(ANOVA,p<0.0001比对照),nab-5109(75mg/kg)和-5109(50mg/kg)的肿瘤生长分别延迟36天和28天。在抑制肿瘤生长方面,Nab-5109比-5109更有效(ANOVA,p=0.0001)。PBS和HAS对照组之间,在毒性和效应方面没有差异。
实施例6.纳米颗粒白蛋白结合的(Nanoparticle Albumin Bound(nab))二聚体硫代秋水仙碱nab-5404、nab-5800和nab-5801:AbraxaneTM和依立替康的抗肿瘤活性的比较性评价
方法:应用纳米颗粒白蛋白结合(nab)技术制备纳米颗粒秋水仙碱。应用人MX-I乳腺癌培养物,体外评价细胞毒性。比较伊立替康和AbraxaneTM在裸鼠中的体内抗肿瘤活性(人HT29结肠肿瘤异种移植物)。nab-秋水仙碱和依利替康的剂量水平是20mg/kg、30mg/kg和40mg/kg,以q3d×4静脉给予。AbraxaneTM的剂量是其MTD,30mg/kg,以qd×5给予。
结果:疏水硫代秋水仙碱二聚体产生如下的纳米颗粒:对于nab-5404、nab-5800和nab-5801而言,平均大小ZAve(nm)分别为119、93和84。通过0.22um过滤器和冻干,对纳米颗粒悬浮液除菌。在体外,nab-5404是三种类似物中对抗MX-I最有效的(p<0.0005,ANOVA),(对于nab-5404、nab-5800和nab-5801,IC50(ug/ml)分别是18、36和77),以及在体内对抗HT29异种移植物是最有效的(p<0.0001,ANOVA)。应用剂量40mg/kg、30mg/kg和20mg/kg,nab-5404分别抑制肿瘤体积93%、79%和48%。与之相比,分别应用剂量40mg/kg、30mg/kg和20mg/kg,nab-5800仅抑制肿瘤体积分别为31%、16%和21%;nab-5801仅抑制肿瘤体积分别为17%、30%和23%。Nab-5404在所有剂量水平下都比伊立替康更加有效(p<0.008,ANOVA),在40mg/kg、30mg/kg和20mg/kg水平,伊立替康对肿瘤体积仅分别抑制48%、34%和29%。与AbraxaneTM相比,基于相等的体重丢失,nab-5404在等毒性剂量(equitoxic dose(ETD))下更具有活性(p<0.0001,ANOVA)。在各自的ETD下,肿瘤体积被nab-5404(40mg/kg,q4d×3)抑制93%,被AbraxaneTM(30mg/kg,qd×5)抑制80%。
结论:应用Nab技术将3个疏水性二聚体硫代秋水仙碱(IDN5404、IDN5800、IDN5801)转变为适于静脉注射的纳米颗粒。Nab-5404相比于nab-5800和nab-5801具有优越的体外和体内抗肿瘤活性。Nab-5404比等剂量的伊立替康(Irinotecan)更有效。在等毒性剂量下,由体重减轻进行确定,nab-5404比AbraxaneTM更有效。这些数据使得有理由对nab-5404作进一步研究。
方法:在以q4d×3时间表给予药物的裸鼠中的剂量范围研究中,比较AbraxaneTM和的毒性。剂量水平是7、15、22、33和50mg/kg,ABX15、30、60、120和240mg/kg。在带有人MX-1乳腺异种移植物的裸鼠中,比较AbraxaneTM和的抗肿瘤活性,剂量是每周15mg/kg,持续3周。
结果:在小鼠的剂量增加研究中,最大耐受剂量(maximum tolerateddose(MTD))是15mg/kg,致死剂量(lethal dose(LD100))是50mg/kg。与之相比,AbraxaneTMMTD在120至240mg/kg之间,LD100是240mg/kg。在肿瘤研究中,AbraxaneTM比相等剂量的在肿瘤生长抑制方面更有效(79.8%比29.1%,p<0.0001,ANOVA)。
实施例8.具有对微管蛋白和拓扑异构酶1的双重作用机制的纳米颗粒白蛋白结合的硫代秋水仙碱二聚体(Nanoparticle Albumin Bound Thiocolchinine dimmer(nab-5404)):体外和体内活性的评价
方法:应用MCF7-S乳腺癌及其多重药物抗性突变体MCF7-R(ρgp+)检测IDN5404的细胞毒性活性。也针对NCI-60人肿瘤细胞系组评价其细胞毒性。应用多种时间表,将纳米颗粒白蛋白结合的nab-5404静脉给予SCID小鼠,所述SCID小鼠皮下植入有人A121卵巢肿瘤异种移植物的。
结果:对于MCF7细胞系,母体化合物秋水仙碱,显示了肿瘤生长抑制活性,对MCF7-S细胞的IC50值(50%生长抑制浓度)是3.9±0.2nM。抗性变体MCF7-R显示了IC50值为66+8.6nM,由于药物抗性,IC50增加约17倍。IDN5404显示了对两种细胞系的活性增加,表明了IC50值分别是1.7±0.1和40±3.8nM。这些结果在NCI60人肿瘤细胞系组中得到确认,IDN5404的平均IC50<10—8M,在MCF7-S和MCF7-R细胞系中抗性大于10倍。COMPARE算法鉴定EDN5404为微管蛋白结合物,类似于长春花碱,从而证明了前面的结果。体内针对A121卵巢肿瘤异种移植物,nab-5404的剂量和效应是剂量和时间依赖性的。纳米颗粒nab-5404被良好耐受并且能够诱导完全退缩和治愈:静脉给药24mg/kg,qd×5,5只小鼠中的5只是长期存活者(long-term survivors(LTS)),没有肿瘤的证据。然而,增加剂量至30mg/kg使得5只中的5只毒性死亡。在q3d×4方案中,30mg/kg使得5只小鼠中的4只LTS,在50mg/kg时,5中的5只毒性死亡。应用q7d×3方案,40mg/kg使得5只小鼠中的3只LTS,在50mg/kg,4只中的4只被观察到LTS。
结论:IDN5404——一种新的具有双重作用机制的硫代秋水仙碱二聚体——在pgp-表达的、顺铂和托泊替康抗性细胞系中表现出活性。在体内,纳米颗粒白蛋白结合的nab-5404对A121卵巢异种移植物有活性。
实施例9.AbraxaneTM和其它药剂的联合试验
由于上述AbraxaneTM(ABX,纳米颗粒白蛋白结合的紫杉醇)的有利性质,AbraxaneTM已被应用于以及正被应用于许多不同给药方式和时间表的研究中,并且与其它肿瘤学药物以及放射治疗联合。这些列举如下:
在转移性乳腺癌中,这些研究包括:
在乳腺癌新辅助情况下,研究包括:
在肺癌研究中,试验包括:
前列腺中的研究包括:
卵巢癌中的研究包括:
在放化疗中的研究包括:
其它研究包括:
实施例10.纳米颗粒发明药物与其它药剂和治疗方式的组合
本文所述的纳米颗粒发明药物的较低毒性使得能够与其它具有更加有益效果的肿瘤学药物和其它治疗方式结合。这些包括纳米颗粒形式的紫杉醇、多烯紫杉醇、其它紫杉烷和类似物、格尔德霉素、秋水仙碱和类似物、combretastatins和类似物、疏水嘧啶化合物、lomaiviticins和类似物,包括具有lomaiviticin核心结构的化合物,埃博霉素和类似物、discoderaiolide和类似物等等。本发明的药物可以和紫杉醇、多烯紫杉醇、卡铂、顺铂、其它铂类(platins)、阿霉素、表阿霉素、环磷酰胺、异环磷酰胺、吉西他滨、卡培他滨、长春瑞宾、托泊替康、依立替康、他莫昔芬、喜树碱、5-FU、EMP、依托泊甙、氨甲喋呤和类似物组合。
和卡铂的联合已显示出对转移性乳腺癌的显著效应。在每周时间表中,在这种联合中,仅仅可以以80mg/m2的剂量给药。更高的剂量由于毒性不能被耐受。此外,当包含在治疗方案中时,HER-2-阳性个体得到更大益处。进行此开放性标记II期研究以便确定ABI-007(AbraxaneTM)与这些药物的协同治疗作用。开始目前的研究以评价ABI-007/卡铂和对于HER-2阳性疾病个体的安全性和抗肿瘤活性。ABI-007与卡铂和联合给予,每周静脉给予患有HER-2阳性晚期乳腺癌的个体。一组3个个体接受剂量为75mg/m2IV的ABI-007,随后接受卡铂,目标AUC=2,每周给予,和输注(第1周为4mg/kg,在随后各周为2mg/kg),1个周期。这些个体对药物的耐受十分好,因此对于所有的随后周期和个体,ABI-007的剂量被增高至100mg/m2。迄今为止已处理了6个个体。评价响应的4个个体中,所有4个个体(100%)对治疗表现出响应。应该注意,由于AbraxaneTM的毒性较低,可以给予比更高总剂量的紫杉醇,对个体产生益处。
实施例12.AbraxaneTM与卡铂联合
与卡铂的联合在肺癌中表现出明显效果。在患有肺癌的个体中,正在进行以3周方案联合应用AbraxaneTM和卡铂的另一研究。
实施例13.AbraxaneTM与放射联合应用
实施例13a
AbraxaneTM与临床放疗联合,增强治疗效果和降低正常组织的毒性。应用AbraxaneTM增强对肿瘤的放疗治疗益处;增强肿瘤对单次放射和分次放射的反应;增强正常组织对放射的反应和增强放疗的治疗比。
应用被称为OCa-I的鼠类卵巢癌,其已经被广泛研究。首先,相对于局部肿瘤放射,给予AbraxaneTM的最佳时间被设定为产生最大抗肿瘤效应。通过肌肉内注射肿瘤细胞,肿瘤于小鼠的右侧后肢产生,当肿瘤大小达到8mm时开始治疗。用10Gy单剂量放射,单剂量AbraxaneTM和应用AbraxaneTM联合治疗来治疗小鼠,所述联合治疗中,AbraxaneTM在放射前5天至放射后1天的不同时间给予。应用等于或高于紫杉醇最大耐受剂量的约1.5倍的AbraxaneTM剂量,剂量为90mg/kg。效应终点是肿瘤生长延迟。每组由8只小鼠构成。如目标1(Aim1)所述,产生和治疗肿瘤。效应终点是肿瘤生长延迟。应用5、7.5或10Gy照射肿瘤,其以每日1、1.5或2Gy照射的单次剂量或分割剂量给予,连续5天。由于AbraxaneTM保持在肿瘤中数天并且发挥其对5个每日分割中的每一个的增强作用,在放射方案起始时即刻给予AbraxaneTM。由于临床放疗的最终目标是实现肿瘤治愈,AbraxaneTM增强肿瘤放射可治愈的潜力被确定。应用与分割肿瘤生长延迟研究中所述的方案相同的方案,除了每日给予2至16Gy的剂量范围,持续5天(总辐射剂量是10至80Gy)。肿瘤然后被消退,至照射后120天时肿瘤再生长,此时测定TCD50(使50%的动物产生局部肿瘤治愈所需的放射剂量)。有两种TCD50试验:仅仅放射和AbraxaneTM加放射,每一试验由10个放射剂量组构成,各自含有15只小鼠。为了提供治疗益处,任何放射增强剂包括AbraxaneTM,其增加的肿瘤放射反应必须大于由放射引起的正常组织损伤的增加。评价对空肠粘膜的损伤—受到紫杉烷影响的一种高增殖性组织。应用空肠微集落试验(jejunal microcolony assay)确定暴露于放射的小鼠的空肠中的隐窝上皮细胞的存活情况。使小鼠暴露于周身放射(WBI),X线的日剂量从3至7Gy,连续5天。用AbraxaneTM处理小鼠,以相等的紫杉醇剂量80mg/kg,在WBI首次剂量前24小时静脉给予,在WBI末次剂量后3.5天杀死小鼠。制备空肠进行组织学检查,计数空肠横截面中产生的隐窝数。为了绘制放射存活曲线,产生的隐窝数被转变为存活细胞数。
实施例13b
本试验的目标是评价ABI-007是否(a)作为单一药剂具有针对同系鼠卵巢癌OCa-I的抗肿瘤作用,和(b)在前述实施例所述的联合治疗方案中增强OCa-I肿瘤的放射反应,对前述实施例作下列修改。
将OCa-I肿瘤细胞肌肉内注射入C3H小鼠的后肢。当生长至平均直径7mm时,开始对携带肿瘤的腿部应用局部放射(10Gy),静脉给予ABI-00790mg/kg的单一治疗,或两种治疗。为了确定最佳治疗方案,在放射前5天至9小时以及放射后24小时给予ABI-007。治疗终点是绝对肿瘤生长延迟(absolute tumor growthdelay(AGD)),定义为治疗肿瘤和未治疗肿瘤之间直径从7mm生长至12mm的天数的差异。对于联合应用ABI-007和放射治疗的组,计算增强因子(enhancementfactor(EF)),为联合治疗的肿瘤和仅用ABI-007治疗的肿瘤从7mm生长至12mm的天数差异与仅用放射治疗的肿瘤的AGD的比值。为了评价用于分割放射方案的ABI-007对终点肿瘤治愈的放射增强效应,进行TCD50试验并在治疗140天后分析。5个每日分割中的5至80Gy的总剂量或是单独给予或是与ABI-007联合给予,ABI-007在首次放射剂量之前24小时给予。
与未治疗肿瘤的16天相比,作为单一药剂,ABI-007明显延长OCa-I肿瘤的生长延迟(37天)。ABI-007作为单一药剂比单一剂量的10Gy更有效,10Gy产生29天延迟。对于联合治疗方案,ABI-007在放射前5天的任何时间给予,产生超附加的抗肿瘤作用。在治疗间隔9小时、24小时和2、3、4、5天时的EF分别是1.3、1.4、2.4、2.3、1.9和1.6。当放射后给予ABI-007时,联合抗肿瘤作用低于上述附加的抗肿瘤作用。通过将仅应用放射治疗的肿瘤的TCD5055.3Gy转变为应用联合治疗时的43.9Gy,ABI-007和放射的联合治疗也对肿瘤治愈有明显作用(EF1.3)。
这一试验说明,ABI-007对OCa-1具有单药剂抗肿瘤活性并且当放疗之前数日给予时能够增强放疗的作用。如之前对于紫杉醇和多烯紫杉醇所证明的,放射增强作用可能是多机制的结果,在短暂的治疗间隔时细胞周期主要停滞在G2/M,在较长的治疗间隔时主要是肿瘤再氧化作用。
实施例14.AbraxaneTM和酪氨酸激酶抑制剂联合
吉非替尼的脉冲给药与AbraxaneTM联合应用,对于抑制表达EGFr的肿瘤增殖是有用的。用BT474肿瘤细胞接种120只裸鼠,以获得至少90只带有BT474异种移植物肿瘤的小鼠,并将其分为18个试验组(experimental arms)(每组5只小鼠)。组1小鼠接受对照静脉注射。所有其它小鼠接受每周静脉注射AbraxaneTM,50mg/kg,持续3周。组2接受单独的AbraxaneTM。组3、4、5、6、7、8每周接受AbraxaneTM,在先2天接受增加剂量的吉非替尼脉冲给药(pulse)。组9、10、11、12、13每周接受AbraxaneTM,在先1天接受增加剂量的吉非替尼脉冲给药。组14、15、16、17、18每周接受AbraxaneTM,同时每日给予增加剂量的吉非替尼。确立吉非替尼的最大耐受剂量,该最大耐受剂量可以在每周一次的AbraxaneTM之前1或2天内脉冲给予,或者与AbraxaneTM连续给予。此外,对抗肿瘤响应的测量将确定是否存在剂量响应关系和是否2天脉冲或1天脉冲是优越的。应用这些数据选择脉冲吉非替尼的最佳剂量和与AbraxaneTM给予的连续每日吉非替尼的最佳剂量。
用BT474肿瘤细胞接种120只裸鼠,得到90只带有肿瘤的小鼠。将这些小鼠分为6组(每组15只)。组1接受对照静脉注射。组2静脉内接受AbraxaneTM,50mg/kg每周,持续3周。组3接受口服吉非替尼,150mg/kg/日。组4接受AbraxaneTM,50mg/kg,连同之前确定的吉非替尼日剂量。组5接受AbraxaneTM50mg/kg,此前给予以前确立吉非替尼脉冲剂量和持续时间。组6仅接受以前确立的每周吉非替尼脉冲剂量。治疗三周后,监测小鼠,直至对照达到最大许可肿瘤大小。
本研究们目的是,评价(1)安全性和耐受性,和(2)每周剂量密集曲妥珠单抗/AbraxaneTM/卡铂的目标反应率,作为患有晚期/转移性(IV期腺癌)HER-2过表达乳腺癌患者的一线治疗。曲妥珠单抗是单克隆抗体,也称为,它结合erbB2受体的胞外片段。
一般而言,没有近期细胞毒性或放疗的患者被包含在内。根据标准3+3规则,将AbraxaneTM剂量从第1、8、15天的75mg/m2,30分钟静脉输注增加到100mg/m2,进行随后的周期。卡铂AUC=2在第1、8、15天通过静脉输注30-60分钟给予,持续起初29天的周期。曲妥珠单抗在第1、8、15、22天通过静脉输注30-90min给予,第1周的剂量是4mg/kg,所有随后各周的剂量是2mg/kg。
在可评价反应的9个患者中的8个中,反应率(确认的加上未确认的)是63%,38%是稳定疾病。最普遍的毒性是中性粒细胞减少症(3级:44%;4级:11%)和白血球减少症(33%)。
这些结果提示,曲妥珠单抗加AbraxaneTM加卡铂作为MBC的一线治疗显示了高度的抗肿瘤活性,同时具有可接受的耐受性。
实施例16.转移性乳腺癌一线治疗中,卡培他滨加nαbTM-紫杉醇(AbraxaneTM)的II期试验
此II期研究的目的是评价安全性、功效(时间对进展和整体存活)和MBC患者的生活质量,所述患者接受卡培他滨联合AbraxaneTM。卡培他滨是氟嘧啶氨基甲酸酯,也称为,已经显示在MBC治疗中具有实质效应,单独地或者联合紫杉烷。
在此开放性标记单组试验中,AbraxaneTM125mg/m2通过静脉输注给予,在第1天和第8天,每3周给予,加卡培他滨825mg/m2,在第1至14天每日两次口服,每3周给予。患者是HER-2/neu阴性的,预期寿命为3个月以上。患者之前没有对转移性疾病进行化疗治疗,之前没有卡培他滨治疗,之前没有氟嘧啶治疗和辅助条件下给予的紫杉醇化疗。
招募12名患者,在前6个患者中完成安全性分析,2个周期后在前8个患者中评价反应率。没有独特的或意料不到的毒性,没有4级毒性或1级以上的神经病。反应数据仅在起始2个治疗周期(第一评价点)在6个患者中被证实。两名患者完成了6个周期,1个部分反应,1个稳定疾病。2个周期后在前8个患者中,2个部分反应,4个具有稳定疾病。
这些结果示出,卡培他滨和有效剂量的每周AbraxaneTM联合是可行的,迄今为止没有新的毒性。AbraxaneTM相关毒性主要是不伴有临床后果的中性粒细胞减少症,手足综合症是卡培他滨的主要毒性。
实施例17.在早期乳腺癌患者中,剂量密集阿霉素加环磷酰胺随后施用nab-紫杉醇(AbraxaneTM)的探索研究(Pilot Study)
本试验的目的是评价阿霉素(阿霉素)加环磷酰胺随后施用AbraxaneTM在早期乳腺癌中的毒性。
患者具有可手术的、组织学确认的早期乳腺腺癌。患者每2周接受阿霉素(阿霉素)60mg/m2加环磷酰胺600mg/m2(AC)进行4个周期,随后每2周应用AbraxaneTM260mg/m2,进行4个周期。
30名患者接受4个周期的AC,29名患者中的27名接受4个周期的AbraxaneTM;33%的患者接受非格司亭(),因为在AbraxaneTM期间缺乏ANC(绝对中性粒细胞计数)的恢复。9名患者(31%)由于非血液学毒性AbraxaneTM剂量降低。总共9名患者患有2级外周神经病,4名患者患有3级外周神经病(peripheral neuropathy(PN));在中间数28天中,PN改进≥l级。
这些结果提示,在患有早期乳腺癌的患者中,如下所述的剂量密集治疗被良好耐受:应用阿霉素(60mg/m2)加环磷酰胺(600mg/m2)的剂量密集治疗,每2周进行,4个周期;然后剂量密集AbraxaneTM(260mg/m2),每2周进行,4个周期。
实施例18.每周nab-紫杉醇(AbraxaneTM)作为转移性乳腺癌的一线治疗,对HER-2/neu阳性患者加入曲妥珠单抗
目前研究的目的是将每周Abraxane移动到前线位置(frontline setting)和加入曲妥珠单抗用于HER2/neu-阳性患者。
此II期开放性标记研究包括20个HER2-阳性和50个HBR2-阴性患者,所述患者患有局部晚期或转移性乳腺癌。AbraxaneTM在第1、8和15天以125mg/m2静脉输注给予,时间为30分钟,随后停止一周。曲妥珠单抗给予与此研究治疗同时进行,用于HER2-阳性患者。初步终点是响应率,第二终点是时间与进展比(timeto progression(TTP))、总存活(overall survival(OS))和毒性。
在安全群体中,23名患者迄今接受中间值3个周期的AbraxaneTM。最普遍的治疗相关不利事件是3级中性粒细胞减少症(8.7%),没有4级不利事件。4个可评价患者中的1个对治疗响应。
实施例19.nab-紫杉醇(AbraxaneTM)和卡铂的I期试验
本研究的目的是确定AbraxaneTM(每周和每三周)的最大耐受剂量,卡铂AUC=6,并且比较给药顺序对药物动力学(pharmacokinetics(PK))的影响。
具有“标准治疗(standard therapy)”后发生进展的组织学或细胞学证明的恶性肿瘤的患者被包含在内。组1以剂量增加形式每三周接受AbraxaneTM,基于每3周的周期1毒性(220、260、300、340mg/m2),随后卡铂AUC=6。组2每周接受(第1、8、15天,随后停止1周)AbraxaneTM(100、125、150mg/m2),随后卡铂AUC=6。对本研究的PK部分,周期1中AbraxaneTM之后是卡铂,给药顺序在周期2中颠倒,PK水平在起始6、24、48和72小时时确定。
在每3周时间表中,中性粒细胞减少、血小板减少和神经病是最常见的3/4级毒性(每一个3/17)。在每周时间表中,中性粒细胞减少5/13是最普通的3/4级毒性。对每周125mg/m2的最高剂量给药(n=6)的最佳响应是2个局部响应(胰腺癌、黑色素瘤)和2个稳定的疾病(NSCLC)。对每三周340mg/m2的最高剂量给药(n=5)的最佳响应是1个稳定疾病(NSCLC)和2个局部响应(SCLC、食道癌)。
这些数据表明,AbraxaneTM和卡铂联合的活性。每周给药的MTD是300mg/m2,对于每3周一次,给药是100mg/m2。
实施例20.剂量密集的吉西他滨、表阿霉素和nab-紫杉醇(AbraxaneTM)(GEA)在局部晚期/炎性乳腺癌中的II期试验
在开放性标记、II期研究中,在局部干预前开始诱导/新辅助方案。治疗方案是吉西他滨2000mg/m2静脉,每2周一次,6个周期;表阿霉素50mg/m2,每2周一次,6个周期;AbraxaneTM175mg/m2每2周一次,6个周期;聚乙二醇化非格司亭(pegfilgrastim)6mg皮下,每2周的第2天。局部干预后的手术后/辅助治疗方案是吉西他滨2000mg/m2每2周一次,4个周期;AbraxaneTM220mg/m2每2周一次,4个周期,和聚乙二醇化非格司亭6mg皮下,每2周的第天。患者包含组织学确认的局部晚期/炎性乳腺腺癌的雌性。
实施例21.nab-雷帕霉素联合AbraxaneTM对于血管平滑肌细胞的细胞毒性活性
在增加浓度的nab-雷帕霉素和0μM、1μM、10μM或100μM的AbraxaneTM(ABI-007)存在的情况下,将血管平滑肌(VSMC)种植在96孔板上。为了评价nab-雷帕霉素和AbraxaneTM的毒性作用,将处理的VSMCs用乙啡啶同型二聚体-1(Invitrogen,Carlsbad CA)染色并分析红色荧光。乙啡啶同型二聚体-1是高亲和性的,荧光核酸染色剂,仅能够通过受损的死细胞膜从而对核酸染色。如图7A所示,nab-雷帕霉素本身表现出剂量依赖性细胞杀伤性,如荧光增加所证明。细胞被nab-雷帕霉素杀死效应不被1μM或10μM的AbraxaneTM增强;然而,被100μM的AbraxaneTM大大增强(ANOVA,p<0.0001)。如图7A所示,用乙啡啶同型二聚体-1染色的细胞,也暴露于钙黄绿素。钙黄绿素AM(Invitrogen)是非荧光分子,其通过非特异性胞质酯酶水解为荧光钙黄绿素。暴露于钙黄绿素AM的活细胞表现出更亮的绿色荧光,因为它们能够产生荧光产物和保持该荧光产物。如图7B所示,nab-雷帕霉素表现出剂量依赖性细胞毒性活性,如钙黄绿素产生的荧光染色的量降低所示。此荧光降低通过与AbraxaneTM共温育而以剂量依赖性方式增强。在所有AbraxaneTM药物浓度下,ANOVA统计给出p<0.0001。
实施例22.nab-雷帕霉素联合AbraxaneTM对HT29(人结肠癌)肿瘤异种移植物的细胞毒性活性
裸鼠的右侧腹种植106个HT29细胞。一旦肿瘤可触知并且在100-200mm3以上,治疗开始。将小鼠随机分为4组(每组n=8)。组1静脉接受盐水,每周3次,进行4周;组2每日腹膜内接受10mg/kg的AbraxaneTM,进行5日;组3静脉接受40mg/kg的nab-雷帕霉素,每周3次,进行4周;组4接受nab-雷帕霉素(40mg/kg,每周3次,进行4周,静脉)和AbraxaneTM(10mg/kg,每日一次,进行5日,腹膜内)。如图8所示,AbraxaneTM加nab-雷帕霉素联合治疗对肿瘤的抑制大于任一单一治疗组。
实施例23.nab-17-AAG联合AbraxaneTM对H358(人肺癌)肿瘤异种移植物的细胞毒性活性
裸鼠的右侧腹种植107个H358细胞。一旦肿瘤可触知并且在100-200mm3以上,治疗开始。将小鼠随机分为4组(每组n=8)。组1静脉接受盐水,每周3次,进行4周;组2每日腹膜内接受10mg/kg的AbraxaneTM,进行5日;组3静脉接受80mg/kg的nab-17-AAG at,每周3次,进行4周;组4接受nab-17-AAG(80mg/kg,每周3次,进行4周,静脉给予)和AbraxaneTM(10mg/kg,每日,进行5日,腹膜内)。如图9所示,AbraxaneTM加nab-17-AAG联合治疗对肿瘤的抑制大于任一单一治疗。
虽然为了清楚理解的目的,前述发明已通过举例说明和实施例的方式进行一定程度的详细描述,但对本领域技术人员来说,显然是:可以进行一些微小的改变和修改。因此,描述和实施例不应被解释为限制本发明的范围。
本文引用的所有参考文件,包括出版物、专利申请和专利都并入本文作为参考,并入的程度相当于指明每一参考文件单独和特异地并入本文作为参考,并且在本文中以其整体被阐述。
本文描述了本发明的优选实施方式,包括发明人知道的实施本发明的最佳方式。在阅读前面的描述后,这些优选实施方式的变化对于本领域技术人员是明显的。发明人期望技术人员适当应用这些变化,并且发明人的意图在于,以不同于本文特定描述的方式实施本发明。因此,本发明包括所附权利要求书中描述的主题的所有修改和等同物,如可以适用的法律所允许的。而且,如果本文没有另外指明或上下文没有明确抵触,在所有可能变化中的上述要素的任何组合,都包含在本发明中。
Claims (20)
1.有效量的组合物在制备用于治疗增殖性疾病的药物中的用途,所述组合物包括含有紫杉烷和载体蛋白的纳米颗粒,其中所述药物与至少一种其它治疗剂联合使用。
2.权利要求1的用途,其中所述治疗剂选自抗代谢物、基于铂的药剂、烷化剂、酪氨酸激酶抑制剂、蒽环类抗生素、长春花碱、蛋白酶体抑制剂、大环内酯类、治疗性抗体、抗血管生成剂、格尔德霉素、格尔德霉素衍生物和拓扑异构酶抑制剂。
3.含有紫杉烷和载体蛋白的纳米颗粒在制备用于与包括放射治疗、手术治疗或其组合的第二治疗组合治疗增殖性疾病的药物中的用途。
4.含有紫杉烷和载体蛋白的纳米颗粒在制备用于治疗增殖性疾病的药物中的用途,其中所述药物在至少一个月的期间内被施用,其中在每一施用之间的间隔不大于约一周,并且其中在每次施用时所述药物中的紫杉烷的剂量为根据传统的剂量方案其最大耐受剂量的约0.25%至约25%。
5.含有紫杉烷和载体蛋白的纳米颗粒在制备用于治疗增殖性疾病的药物中的用途,其中所述药物以约100mg/m2至约150mg/m2的紫杉烷每周施用。
6.包括纳米颗粒的组合物在制备用于治疗增殖性疾病的药物中的用途,所述纳米颗粒包含:a)选自雷帕霉素、17-AAG、硫代秋水仙碱、或其衍生物的药物,和b)载体蛋白。
7.权利要求6的用途,其中所述纳米颗粒包含雷帕霉素或其衍生物和载体蛋白。
8.权利要求6的用途,其中所述纳米颗粒包含17-AAG或其衍生物和载体蛋白。
9.权利要求6的用途,其中所述纳米颗粒包含硫代秋水仙碱或其衍生物和载体蛋白。
10.权利要求1-9任一项的用途,其中所述增殖性疾病是癌症。
11.权利要求1-10任一项的用途,其中所述紫杉烷是紫杉醇。
12.权利要求1-11任一项的用途,其中所述载体蛋白是白蛋白。
13.权利要求1-12任一项的用途,其中所述白蛋白是人血清白蛋白。
14.权利要求1-13任一项所述的用途,其中所述纳米颗粒的平均直径不大于约200nm。
15.组合物,包括:a)含有紫杉烷和载体蛋白的纳米颗粒;和b)至少一种其它的治疗剂。
16.权利要求15的组合物,其中所述治疗剂选自抗代谢物、基于铂的药剂、烷化剂、酪氨酸激酶抑制剂、蒽环类抗生素、长春花碱、蛋白酶体抑制剂、大环内酯类、治疗性抗体、抗血管生成剂、格尔德霉素、格尔德霉素衍生物和拓扑异构酶抑制剂。
17.权利要求15-16任一项的组合物,其中所述紫杉烷是紫杉醇。
18.权利要求15-17任一项的组合物,其中所述载体蛋白是白蛋白。
19.权利要求18的组合物,其中所述白蛋白是人血清白蛋白。
20.权利要求15-19任一项的组合物,其中所述所述组合物中的所述纳米颗粒的平均直径不大于约200nm。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US65424505P | 2005-02-18 | 2005-02-18 | |
| US60/654,245 | 2005-02-18 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2006800116779A Division CN101160123B (zh) | 2005-02-18 | 2006-02-21 | 治疗剂的组合 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN103285395A true CN103285395A (zh) | 2013-09-11 |
Family
ID=36593193
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2013100757784A Pending CN103169729A (zh) | 2005-02-18 | 2006-02-21 | 治疗剂的组合和给予方式以及联合治疗 |
| CN201510411744.7A Pending CN105288630A (zh) | 2005-02-18 | 2006-02-21 | 治疗剂的组合和给予方式以及联合治疗 |
| CN2013102337091A Pending CN103285395A (zh) | 2005-02-18 | 2006-02-21 | 治疗剂的组合和给予方式以及联合治疗 |
| CN2006800116779A Active CN101160123B (zh) | 2005-02-18 | 2006-02-21 | 治疗剂的组合 |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2013100757784A Pending CN103169729A (zh) | 2005-02-18 | 2006-02-21 | 治疗剂的组合和给予方式以及联合治疗 |
| CN201510411744.7A Pending CN105288630A (zh) | 2005-02-18 | 2006-02-21 | 治疗剂的组合和给予方式以及联合治疗 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2006800116779A Active CN101160123B (zh) | 2005-02-18 | 2006-02-21 | 治疗剂的组合 |
Country Status (26)
| Country | Link |
|---|---|
| US (11) | US8034375B2 (zh) |
| EP (4) | EP2301531B1 (zh) |
| JP (8) | JP5769358B2 (zh) |
| KR (8) | KR20200038337A (zh) |
| CN (4) | CN103169729A (zh) |
| AT (1) | ATE531365T1 (zh) |
| AU (1) | AU2006213999B2 (zh) |
| BR (1) | BRPI0607809A2 (zh) |
| CA (3) | CA2902071C (zh) |
| CY (4) | CY1112907T1 (zh) |
| DK (3) | DK2301531T3 (zh) |
| ES (3) | ES2375828T3 (zh) |
| HK (3) | HK1109589A1 (zh) |
| HU (2) | HUE038768T2 (zh) |
| IL (4) | IL185288A (zh) |
| LT (2) | LT2301531T (zh) |
| LU (1) | LU92484I2 (zh) |
| MX (2) | MX2007009960A (zh) |
| NZ (2) | NZ560879A (zh) |
| PL (3) | PL2301531T3 (zh) |
| PT (3) | PT1853250E (zh) |
| RU (2) | RU2452482C2 (zh) |
| SG (1) | SG166775A1 (zh) |
| SI (3) | SI2301531T1 (zh) |
| WO (1) | WO2006089290A1 (zh) |
| ZA (1) | ZA200707491B (zh) |
Families Citing this family (187)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20030133955A1 (en) * | 1993-02-22 | 2003-07-17 | American Bioscience, Inc. | Methods and compositions useful for administration of chemotherapeutic agents |
| US20070116761A1 (en) * | 1993-02-22 | 2007-05-24 | Desai Neil P | Novel formulations of pharmacological agents, methods for the preparation thereof and methods for the use thereof |
| US5439686A (en) * | 1993-02-22 | 1995-08-08 | Vivorx Pharmaceuticals, Inc. | Methods for in vivo delivery of substantially water insoluble pharmacologically active agents and compositions useful therefor |
| US20070092563A1 (en) * | 1996-10-01 | 2007-04-26 | Abraxis Bioscience, Inc. | Novel formulations of pharmacological agents, methods for the preparation thereof and methods for the use thereof |
| US20030199425A1 (en) * | 1997-06-27 | 2003-10-23 | Desai Neil P. | Compositions and methods for treatment of hyperplasia |
| KR100789008B1 (ko) * | 1997-06-27 | 2007-12-26 | 아브락시스 바이오사이언스 인크. | 신규 약물 제제 |
| US8853260B2 (en) | 1997-06-27 | 2014-10-07 | Abraxis Bioscience, Llc | Formulations of pharmacological agents, methods for the preparation thereof and methods for the use thereof |
| BRPI0314042B8 (pt) | 2002-09-06 | 2021-05-25 | Calando Pharmaceuticals Inc | polímeros à base de ciclodextrina para o fornecimento de agentes terapêuticos ligados a eles por covalência |
| US20050004002A1 (en) | 2002-12-09 | 2005-01-06 | American Bioscience, Inc. | Compositions and methods of delivery of pharmacological agents |
| EP2260874A1 (en) | 2003-01-06 | 2010-12-15 | Angiochem Inc. | Aprotinin analogs as carriers across the blood-brain barrier |
| US20070166388A1 (en) * | 2005-02-18 | 2007-07-19 | Desai Neil P | Combinations and modes of administration of therapeutic agents and combination therapy |
| DK2301531T3 (en) | 2005-02-18 | 2018-07-30 | Abraxis Bioscience Llc | COMBINATIONS AND WAYS FOR ADMINISTRATING THERAPEUTIC SUBSTANCES AND COMBINATION THERAPY |
| US8735394B2 (en) | 2005-02-18 | 2014-05-27 | Abraxis Bioscience, Llc | Combinations and modes of administration of therapeutic agents and combination therapy |
| CA2609251A1 (en) * | 2005-06-16 | 2006-12-28 | Myriad Genetics, Inc. | Pharmaceutical compositions and use thereof |
| EP2433653B1 (en) | 2005-07-15 | 2019-06-05 | Angiochem Inc. | Use of aprotinin polypeptides as carriers in pharmaceutical conjugates |
| DE102005039579B4 (de) * | 2005-08-19 | 2022-06-30 | Magforce Ag | Verfahren zur Einschleusung von therapeutischen Substanzen in Zellen |
| KR101457834B1 (ko) | 2005-08-31 | 2014-11-05 | 아브락시스 바이오사이언스, 엘엘씨 | 증가된 안정성을 가진 수 난용성 약물의 조성물 및 제조 방법 |
| ES2718323T3 (es) * | 2005-08-31 | 2019-07-01 | Abraxis Bioscience Llc | Composiciones que comprenden agentes farmacéuticos poco solubles en agua |
| US20100081681A1 (en) * | 2006-08-16 | 2010-04-01 | Blagosklonny Mikhail V | Methods and compositions for preventing or treating age-related diseases |
| CN101568332A (zh) * | 2006-08-31 | 2009-10-28 | 阿布拉科斯生物科学公司 | 抑制血管生成及治疗血管生成相关疾病的方法 |
| US20080280987A1 (en) * | 2006-08-31 | 2008-11-13 | Desai Neil P | Methods of inhibiting angiogenesis and treating angiogenesis-associated diseases |
| US8168662B1 (en) | 2006-11-06 | 2012-05-01 | Poniard Pharmaceuticals, Inc. | Use of picoplatin to treat colorectal cancer |
| US8178564B2 (en) | 2006-11-06 | 2012-05-15 | Poniard Pharmaceuticals, Inc. | Use of picoplatin to treat colorectal cancer |
| US8173686B2 (en) | 2006-11-06 | 2012-05-08 | Poniard Pharmaceuticals, Inc. | Use of picoplatin to treat colorectal cancer |
| US8168661B2 (en) | 2006-11-06 | 2012-05-01 | Poniard Pharmaceuticals, Inc. | Use of picoplatin to treat colorectal cancer |
| ES2700074T3 (es) | 2006-12-14 | 2019-02-13 | Abraxis Bioscience Llc | Terapia para el cáncer de mama sobre la base del estado de los receptores hormonales con nanopartículas que comprenden taxano |
| US20080176958A1 (en) | 2007-01-24 | 2008-07-24 | Insert Therapeutics, Inc. | Cyclodextrin-based polymers for therapeutics delivery |
| CA3201293A1 (en) | 2007-03-07 | 2008-09-12 | Abraxis Bioscience, Llc | Nanoparticle comprising rapamycin and albumin as anticancer agent |
| AU2015271950B2 (en) * | 2007-03-07 | 2017-09-28 | Abraxis Bioscience, Llc | Nanoparticle comprising rapamycin and albumin as anticancer agent |
| US8642067B2 (en) | 2007-04-02 | 2014-02-04 | Allergen, Inc. | Methods and compositions for intraocular administration to treat ocular conditions |
| EP2144888A4 (en) * | 2007-04-10 | 2012-10-03 | Myrexis Inc | METHODS OF TREATING CANCER |
| EP2144886A4 (en) * | 2007-04-10 | 2012-10-03 | Myrexis Inc | METHOD OF TREATING MELANOMA |
| NZ580866A (en) * | 2007-04-10 | 2011-02-25 | Myriad Pharmaceuticals Inc | Method of treating brain cancer |
| EP2144887A4 (en) * | 2007-04-10 | 2012-10-03 | Myrexis Inc | PHARMACEUTICAL FORMS AND METHOD FOR THE TREATMENT OF CANCER |
| WO2008124828A1 (en) * | 2007-04-10 | 2008-10-16 | Myriad Genetics, Inc. | Methods for treating vascular disruption disorders |
| CA2686736A1 (en) | 2007-05-03 | 2008-11-13 | Abraxis Bioscience, Llc | Nanoparticle compositions comprising rapamycin for treating pulmonary hypertension |
| WO2008140751A1 (en) * | 2007-05-11 | 2008-11-20 | Champions Biotechnology, Inc. | Human leiosarcoma and non small cell lung cancer lung xenograft models |
| US9365634B2 (en) | 2007-05-29 | 2016-06-14 | Angiochem Inc. | Aprotinin-like polypeptides for delivering agents conjugated thereto to tissues |
| US8927019B2 (en) * | 2007-06-01 | 2015-01-06 | Abraxis Bioscience, Llc | Methods and compositions for treating recurrent cancer |
| WO2008149230A2 (en) * | 2007-06-04 | 2008-12-11 | Pfizer Products Inc. | Nanoparticles comprising drug, a non-ionizable cellulosic polymer and tocopheryl polyethylene glycol succinate |
| US20080319048A1 (en) * | 2007-06-22 | 2008-12-25 | Scidose Llc | Solubilized formulation of docetaxel without tween 80 |
| CA2742388C (en) * | 2007-11-08 | 2019-02-19 | Virginia Tech Intellectual Properties, Inc. | Thiolated paclitaxels for reaction with gold nanoparticles as drug delivery agents |
| EP2240162A4 (en) | 2007-12-06 | 2013-10-09 | Bend Res Inc | NANOTE PARTICLES WITH A NON-IONIZABLE POLYMER AND AN AMIN-FUNCTIONALIZED METHACRYLATE COPOLYMER |
| WO2009078755A1 (en) * | 2007-12-19 | 2009-06-25 | Ardenia Investments, Ltd. | Drug delivery system for administration of a water soluble, cationic and amphiphilic pharmaceutically active substance |
| EP2259844A4 (en) * | 2008-03-05 | 2012-02-01 | Vicus Therapeutics Llc | COMPOSITIONS AND METHODS FOR MUCOSITIS AND ONCOLOGY THERAPIES |
| MX2010011165A (es) * | 2008-04-10 | 2011-02-22 | Abraxis Bioscience Llc | Composiciones de derivados de taxano hidrofobos y sus usos. |
| US8710013B2 (en) * | 2008-04-18 | 2014-04-29 | Angiochem Inc. | Pharmaceutical compositions of paclitaxel, paclitaxel analogs or paclitaxel conjugates and related methods of preparation and use |
| DK3782611T3 (da) | 2008-05-15 | 2022-09-05 | Celgene Corp | Orale formuleringer af cytidinanaloger og fremgangsmåder til anvendelse deraf |
| JP2011520993A (ja) * | 2008-05-27 | 2011-07-21 | オンコリティクス バイオテク,インコーポレーテッド | 間質圧力の調節並びに腫瘍崩壊性ウイルスの送達及び分布 |
| UA104147C2 (uk) * | 2008-09-10 | 2014-01-10 | Новартис Аг | Похідна піролідиндикарбонової кислоти та її застосування у лікуванні проліферативних захворювань |
| BRPI0920209A2 (pt) | 2008-10-15 | 2015-12-22 | Angiochem Inc | conjugados de agonistas de glp-1 e usos dos mesmos |
| WO2010043049A1 (en) | 2008-10-15 | 2010-04-22 | Angiochem Inc. | Etoposide and doxorubicin conjugates for drug delivery |
| CA2745524C (en) | 2008-12-05 | 2020-06-09 | Angiochem Inc. | Conjugates of neurotensin or neurotensin analogs and uses thereof |
| EP2367425B1 (en) * | 2008-12-11 | 2018-02-28 | Abraxis BioScience, LLC | Combination therapy including a taxane and a further therapeutic agent |
| US8853353B2 (en) | 2008-12-17 | 2014-10-07 | Angiochem, Inc. | Membrane type-1 matrix metalloprotein inhibitors and uses thereof |
| EP2405750B1 (en) * | 2009-03-13 | 2018-05-09 | Abraxis BioScience, LLC | Combination therapy with thiocolchicine derivatives |
| EA201171195A8 (ru) * | 2009-03-30 | 2014-08-29 | Серулин Фарма Инк. | Конъюгаты, частицы, композиции "полимер-агент" и способы их применения |
| WO2010114768A1 (en) * | 2009-03-30 | 2010-10-07 | Cerulean Pharma Inc. | Polymer-epothilone conjugates, particles, compositions, and related methods of use |
| WO2010114770A1 (en) * | 2009-03-30 | 2010-10-07 | Cerulean Pharma Inc. | Polymer-agent conjugates, particles, compositions, and related methods of use |
| WO2010121000A1 (en) * | 2009-04-15 | 2010-10-21 | Abraxis Bioscience, Llc | Prion-free nanoparticle compositions and methods |
| MX2011011023A (es) | 2009-04-20 | 2012-01-20 | Angiochem Inc | Tratamiento de cancer de ovarios usando un agente anti-cancer conjugado con un analogo de angiopep-2. |
| CA2763040C (en) * | 2009-06-05 | 2018-05-01 | Joan M. Caron | Methods and compositions for the treatment of cancer |
| BRPI1015918A2 (pt) | 2009-07-02 | 2019-09-24 | Angiochem Inc | conjugados de peptídeo multiméricos e usos dos mesmos |
| US9340697B2 (en) | 2009-08-14 | 2016-05-17 | Nano-C, Inc. | Solvent-based and water-based carbon nanotube inks with removable additives |
| WO2011025838A1 (en) | 2009-08-25 | 2011-03-03 | Abraxis Bioscience, Llc | Combination therapy with nanoparticle compositions of taxane and hedgehog inhibitors |
| MX2012003287A (es) * | 2009-09-18 | 2012-08-03 | Abraxis Bioscience Llc | Uso de la identificacion microambiental de sparc en el tratamiento del cancer. |
| US8912228B2 (en) | 2009-10-19 | 2014-12-16 | Scidose Llc | Docetaxel formulations with lipoic acid |
| US8541465B2 (en) * | 2009-10-19 | 2013-09-24 | Scidose, Llc | Docetaxel formulations with lipoic acid and/or dihydrolipoic acid |
| US7772274B1 (en) | 2009-10-19 | 2010-08-10 | Scidose, Llc | Docetaxel formulations with lipoic acid |
| US20110092579A1 (en) * | 2009-10-19 | 2011-04-21 | Scidose Llc | Solubilized formulation of docetaxel |
| CN102782573A (zh) * | 2009-11-22 | 2012-11-14 | 圣诺制药公司 | 在治疗和诊断中应用的稀土掺杂上转换纳米颗粒 |
| KR20120115390A (ko) * | 2010-01-12 | 2012-10-17 | 네스텍 소시에테아노님 | 삼중 음성 유방암의 치료요법에 대한 반응 예측 방법 |
| KR101786142B1 (ko) | 2010-03-26 | 2017-10-17 | 아브락시스 바이오사이언스, 엘엘씨 | 간세포 암종의 치료 방법 |
| CN107158389A (zh) | 2010-03-29 | 2017-09-15 | 阿布拉科斯生物科学有限公司 | 增强药物递送和治疗剂有效性的方法 |
| WO2011123395A1 (en) | 2010-03-29 | 2011-10-06 | Abraxis Bioscience, Llc | Methods of treating cancer |
| EP2555802A1 (en) * | 2010-04-08 | 2013-02-13 | Sanford-Burnham Medical Research Institute | Methods and compositions for enhanced delivery of compounds |
| EP2382993A1 (en) | 2010-04-19 | 2011-11-02 | KTB Tumorforschungsgesellschaft mbH | Combination of drugs with protein-binding prodrugs |
| JP2013527232A (ja) * | 2010-06-02 | 2013-06-27 | アブラクシス バイオサイエンス, エルエルシー | 膀胱がんの処置方法 |
| CN103002905A (zh) * | 2010-06-03 | 2013-03-27 | 阿布拉西斯生物科学有限责任公司 | Sparc微环境标签在癌症治疗中的应用 |
| EP2575804A4 (en) * | 2010-06-04 | 2013-10-23 | Abraxis Bioscience Llc | METHOD FOR THE TREATMENT OF PANCREASCRE |
| CA2801891C (en) * | 2010-06-07 | 2020-10-27 | Abraxis Bioscience, Llc | Combination therapy methods for treating proliferative diseases |
| KR101223484B1 (ko) * | 2010-10-05 | 2013-01-17 | 한국과학기술연구원 | 사람 혈청 알부민-siRNA 나노입자 전달체 |
| US8884027B2 (en) | 2010-10-22 | 2014-11-11 | University Of Rochester | Melampomagnolide B derivatives as antileukemic and cytotoxic agents |
| WO2012068531A2 (en) * | 2010-11-18 | 2012-05-24 | The General Hospital Corporation | Novel compositions and uses of anti-hypertension agents for cancer therapy |
| KR102023207B1 (ko) | 2010-12-02 | 2019-11-25 | 온콜리틱스 바이오테크 인코포레이티드 | 동결건조 바이러스 제형 |
| CA2819246C (en) * | 2010-12-02 | 2023-04-25 | Oncolytics Biotech Inc. | Liquid viral formulations |
| CN109172809A (zh) | 2011-04-28 | 2019-01-11 | 阿布拉科斯生物科学有限公司 | 纳米颗粒组合物的血管内递送及其应用 |
| PT2707030T (pt) | 2011-05-09 | 2020-05-22 | Mayo Found Medical Education & Res | Tratamentos de cancro |
| CN109908341B (zh) * | 2011-10-14 | 2023-06-27 | 霍夫曼-拉罗奇有限公司 | Her2二聚化抑制剂帕妥珠单抗的用途和包含her2二聚化抑制剂帕妥珠单抗的制品 |
| CA2853949A1 (en) * | 2011-11-01 | 2013-05-10 | Celgene Corporation | Methods for treating cancers using oral formulations of cytidine analogs |
| WO2013085902A1 (en) | 2011-12-05 | 2013-06-13 | The University Of Texas M.D. | Combination therapy methods for treating an inflammatory breast cancer |
| DK2790675T3 (da) | 2011-12-14 | 2019-09-09 | Abraxis Bioscience Llc | Anvendelse af polymerexcipienser til frysetørring eller frysning af partikler |
| GB201121924D0 (en) * | 2011-12-20 | 2012-02-01 | Fahy Gurteen Labs Ltd | Detection of breast cancer |
| EP2630971B8 (en) | 2012-02-21 | 2017-12-13 | Vergell Medical S.A. | Combinations of albumin-based drug delivery systems |
| KR101809858B1 (ko) | 2012-04-04 | 2017-12-15 | 할로자임, 아이엔씨 | 항-히알루로난 제제 및 종양-표적 탁산을 이용한 병용 치료 |
| WO2014026143A1 (en) * | 2012-08-09 | 2014-02-13 | Pono Corporation | Conjugated anti-microbial compounds and conjugated anti-cancer compounds and uses thereof |
| US20150216868A1 (en) * | 2012-09-04 | 2015-08-06 | Glaxosmithkline Llc | Method of Adjuvant Cancer Treatment |
| US10413606B2 (en) | 2012-10-01 | 2019-09-17 | Mayo Foundation For Medical Education And Research | Methods for treating cancer with nanoparticle complexes of albumin-bound paclitaxel and anti-VEGF antibodies |
| WO2014055493A1 (en) | 2012-10-02 | 2014-04-10 | Cerulean Pharma Inc. | Methods and systems for polymer precipitation and generation of particles |
| US9149455B2 (en) | 2012-11-09 | 2015-10-06 | Abraxis Bioscience, Llc | Methods of treating melanoma |
| TWI598341B (zh) | 2012-11-12 | 2017-09-11 | 伊格尼塔公司 | 苯達莫司汀衍生物及其使用方法 |
| EP2919759A4 (en) | 2012-11-14 | 2016-07-20 | Ohio State Innovation Foundation | MATERIALS AND METHODS FOR THE TREATMENT OF GLIOBLASTOMES |
| AU2013352106B2 (en) | 2012-11-30 | 2018-04-26 | Novomedix, Llc | Substituted biaryl sulfonamides and the use thereof |
| MX2015007185A (es) * | 2012-12-04 | 2017-09-05 | Eisai R&D Man Co Ltd | Uso de eribulina en el tratamiento de cancer de pecho. |
| CN104688740A (zh) * | 2012-12-21 | 2015-06-10 | 百奥泰生物科技(广州)有限公司 | 类美登素衍生物及其制备方法和用途 |
| US20140199404A1 (en) * | 2013-01-11 | 2014-07-17 | Abraxis Bioscience, Llc | Method for treating cancer based on level of a nucleoside transporter |
| US9511046B2 (en) | 2013-01-11 | 2016-12-06 | Abraxis Bioscience, Llc | Methods of treating pancreatic cancer |
| US20140199405A1 (en) * | 2013-01-11 | 2014-07-17 | Abraxis Bioscience, Llc | Method for treating cancer based on mutation status of k-ras |
| US9962452B2 (en) | 2013-02-04 | 2018-05-08 | Zhuhai Beihai Biotech Co., Ltd. | Soluble complexes of drug analogs and albumin |
| CN105120859B (zh) * | 2013-02-11 | 2018-10-09 | 阿布拉科斯生物科学有限公司 | 治疗黑素瘤的方法 |
| EP3698784A1 (en) | 2013-03-12 | 2020-08-26 | Abraxis BioScience, LLC | Methods of treating lung cancer |
| US20160015817A1 (en) | 2013-03-13 | 2016-01-21 | Abraxis Bioscience, Llc | Methods of treatment of pediatric solid tumor |
| US9376437B2 (en) | 2013-03-13 | 2016-06-28 | Oncoceutics, Inc | 7-benzyl-4-(2-methylbenzyl)-2,4,6,7,8,9-hexahydroimidazo[1,2-a]pyrido[3,4-e]pyrimidin-5(1H)-one, salts thereof and methods of using the same in combination therapy |
| US9688679B2 (en) | 2013-03-13 | 2017-06-27 | Oncoceutics, Inc. | 7-benzyl-4-(methylbenzyl)-2,4,6,7,8,9-hexahydroimidazo[1,2-A]pyrido[3,4-E]pyrimidin-5 (1H)-one, salts thereof and methods of using the same in combination therapy |
| EP3572083A1 (en) | 2013-03-13 | 2019-11-27 | Oncoceutics, Inc. | 7-benzyl-10-(2-methylbenzyl)-2,6,7,8,9,10-hexahydroimidazo[1,2-a]pyrido[4,3-d]pyrimidin-5(3h)-on for use in the treatment of cancer |
| KR20150127187A (ko) | 2013-03-14 | 2015-11-16 | 아브락시스 바이오사이언스, 엘엘씨 | 방광암의 치료 방법 |
| WO2014165842A2 (en) * | 2013-04-05 | 2014-10-09 | Igdrasol | Nanoparticle formulations in biomarker detection |
| KR101329646B1 (ko) * | 2013-05-02 | 2013-11-14 | 주식회사 지니스 | 표적지향증폭형 항암나노입자 및 이의 제조방법 |
| WO2015042234A1 (en) * | 2013-09-20 | 2015-03-26 | Igdrasol | Conditionally stable micelle compositions for cancer treatment including ovarian cancer |
| EP3049078B1 (en) * | 2013-09-27 | 2018-06-27 | BlueLink Pharmaceuticals, Inc. | Treatment of cancer |
| US10842969B2 (en) | 2013-10-25 | 2020-11-24 | Mercator Medsystems, Inc. | Systems and methods of treating malacia by local delivery of hydrogel to augment tissue |
| CN105873529A (zh) * | 2013-10-25 | 2016-08-17 | 墨卡托医疗系统公司 | 通过局部递送细胞毒性剂、细胞抑制剂或抗肿瘤剂保持支气管通畅 |
| PT3546461T (pt) * | 2013-11-15 | 2021-10-18 | Oncoceutics Inc | 7-benzil-4-(2-metilbenzil)-2,4,6,7,8,9-hexahidroimidazo[ 1,2-a]pirido[3,4-e]pirimidin-5(1h)-ona, seus sais e métodos de utilização dos mesmos em terapia de combinação |
| FI20130341L (fi) | 2013-11-19 | 2015-05-20 | Safemed Ltd Oy | Huonosti vesiliukoisten lääkeaineiden kuljetus metalli-ioneilla tasapainotetun alfafetoproteiinin mukana |
| HUE057092T2 (hu) * | 2013-12-06 | 2022-04-28 | Novartis Ag | Alfa-izoformára szelektív foszfatidilinozitol-3-kináz-inhibitor adagolási rendje |
| NO2699580T3 (zh) | 2014-01-24 | 2018-02-24 | ||
| EP2924022A1 (en) * | 2014-03-27 | 2015-09-30 | INDENA S.p.A. | Amorphous form of a thiocolchicine derivative |
| MX2016016617A (es) | 2014-06-16 | 2017-03-23 | Mayo Foundation | Tratamiento de mielomas. |
| WO2015195634A1 (en) | 2014-06-17 | 2015-12-23 | Celgne Corporation | Methods for treating epstein-barr virus (ebv) associated cancers using oral formulations of 5-azacytidine |
| WO2015200837A1 (en) | 2014-06-27 | 2015-12-30 | Fl Therapeutics Llc | Abiraterone derivatives and non-covalent complexes with albumin |
| WO2015018380A2 (en) | 2014-07-03 | 2015-02-12 | Cspc Zhongqi Pharmaceutical Technology(Shijiazhuang)Co., Ltd. | Therapeutic nanoparticles and the preparation methods thereof |
| US9446148B2 (en) | 2014-10-06 | 2016-09-20 | Mayo Foundation For Medical Education And Research | Carrier-antibody compositions and methods of making and using the same |
| US10201617B2 (en) | 2014-10-24 | 2019-02-12 | Zhuhai Beihai Biotech Co., Ltd. | 3-substituted piperidine-2, 6-diones and non-covalent complexes with albumin |
| WO2016065283A1 (en) * | 2014-10-24 | 2016-04-28 | Bishop Alexander James Roy | Methods and compositions for enhancing chemotherapy |
| MA41434B1 (fr) | 2015-01-30 | 2021-03-31 | Oncoceutics Inc | 7-benzyl-4-(4-(trifluorométhyl)benzyl)-1,2,6,7,8,9-hexahydroimidazo[1,2-a]pyrido[3,4-e]pyrimidin-5(4h)-one, ses sels et leur utilisation en thérapie |
| US10705070B1 (en) | 2015-03-05 | 2020-07-07 | Abraxis Bioscience, Llc | Methods of assessing suitability of use of pharmaceutical compositions of albumin and poorly water soluble drug |
| US10527604B1 (en) | 2015-03-05 | 2020-01-07 | Abraxis Bioscience, Llc | Methods of assessing suitability of use of pharmaceutical compositions of albumin and paclitaxel |
| WO2016172515A1 (en) | 2015-04-23 | 2016-10-27 | Sanford Burnham Prebys Medical Discovery Institute | Targeted delivery system and methods of use therefor |
| CN107921143B (zh) | 2015-06-15 | 2021-11-19 | 安吉奥开米公司 | 用于治疗软脑膜癌病的方法 |
| EA036790B1 (ru) | 2015-06-29 | 2020-12-22 | АБРАКСИС БАЙОСАЙЕНС, ЭлЭлСи | Способ лечения злокачественной пекомы |
| TW201707725A (zh) | 2015-08-18 | 2017-03-01 | 美國馬友醫藥教育研究基金會 | 載體-抗體組合物及其製造及使用方法 |
| TW201713360A (en) | 2015-10-06 | 2017-04-16 | Mayo Foundation | Methods of treating cancer using compositions of antibodies and carrier proteins |
| WO2017106630A1 (en) | 2015-12-18 | 2017-06-22 | The General Hospital Corporation | Polyacetal polymers, conjugates, particles and uses thereof |
| US11571469B2 (en) | 2016-01-07 | 2023-02-07 | Mayo Foundation For Medical Education And Research | Methods of treating cancer with interferon wherein the cancer cells are HLA negative or have reduced HLA expression |
| AU2017217881B2 (en) | 2016-02-12 | 2022-11-17 | Mayo Foundation For Medical Education And Research | Hematologic cancer treatments |
| CA3014428A1 (en) | 2016-02-19 | 2017-08-24 | Nant Holdings Ip, Llc | Methods of immunogenic modulation |
| EP3432926A4 (en) | 2016-03-21 | 2019-11-20 | Mayo Foundation for Medical Education and Research | METHODS OF REDUCING THE TOXICITY OF A CHEMOTHERAPEUTIC MEDICAMENT |
| EP3432928A4 (en) | 2016-03-21 | 2019-11-20 | Mayo Foundation for Medical Education and Research | PROCESS FOR IMPROVING THE THERAPEUTIC INDEX FOR CHEMOTHERAPEUTIC |
| EP3475434A4 (en) | 2016-03-24 | 2020-07-29 | Nantcell, Inc. | SEQUENCE ARRANGEMENTS AND SEQUENCES FOR NEOEPITOP REPRESENTATION |
| US10618969B2 (en) | 2016-04-06 | 2020-04-14 | Mayo Foundation For Medical Education And Research | Carrier-binding agent compositions and methods of making and using the same |
| CN109310631A (zh) | 2016-06-02 | 2019-02-05 | 因华生技制药股份有限公司 | 供癌症医疗的节拍式口服吉西他宾 |
| TW201803598A (zh) | 2016-06-30 | 2018-02-01 | 南特細胞公司 | Nant癌症疫苗 |
| WO2018026965A1 (en) | 2016-08-02 | 2018-02-08 | Isi Life Sciences, Inc. | Compositions and methods for detecting cancer cells in a tissue sample |
| JP7158372B2 (ja) | 2016-08-05 | 2022-10-21 | マヨ ファウンデーション フォー メディカル エデュケーション アンド リサーチ | 癌治療のための修飾抗体-アルブミンナノ粒子複合体 |
| CN107714652B (zh) * | 2016-08-12 | 2021-03-02 | 四川科伦药物研究院有限公司 | 替西罗莫司白蛋白纳米组合物及其冻干制剂、制法和用途 |
| WO2018043530A1 (ja) * | 2016-08-31 | 2018-03-08 | 富士フイルム株式会社 | 抗腫瘍剤、抗腫瘍効果増強剤及び抗腫瘍用キット |
| CA3035378A1 (en) | 2016-09-01 | 2018-03-08 | Mayo Foundation For Medical Education And Research | Carrier-pd-l1 binding agent compositions for treating cancers |
| AU2017321798B2 (en) | 2016-09-01 | 2023-06-15 | Mayo Foundation For Medical Education And Research | Methods and compositions for targeting T-cell cancers |
| KR102486055B1 (ko) | 2016-09-06 | 2023-01-09 | 메이오 파운데이션 포 메디칼 에쥬케이션 앤드 리써치 | 파클리탁셀-알부민-결합제 조성물 및 그의 사용 및 제조 방법 |
| US11590098B2 (en) | 2016-09-06 | 2023-02-28 | Mayo Foundation For Medical Education And Research | Methods of treating triple-negative breast cancer using compositions of antibodies and carrier proteins |
| JP2019526587A (ja) | 2016-09-06 | 2019-09-19 | マヨ ファウンデーション フォー メディカル エデュケーション アンド リサーチMayo Foundation For Medical Education And Research | Pd−l1を発現する癌を処置する方法 |
| US10973773B2 (en) | 2016-09-13 | 2021-04-13 | Tiziana Life Sciences Plc | Dactinomycin compositions and methods for the treatment of myelodysplastic syndrome and acute myeloid leukemia |
| EP3541931A4 (en) | 2016-11-21 | 2020-11-04 | Nant Holdings IP, LLC | COMBINED FRACTAL TREATMENT |
| AU2017361541A1 (en) * | 2016-11-21 | 2019-07-11 | Bexion Pharmaceuticals, Inc. | A combination therapy including SapC-DOPS for the treatment of pancreatic cancer |
| AU2017381449B2 (en) * | 2016-12-21 | 2021-10-28 | Liminal Biosciences Limited | Methods and compositions for preventing or minimizing epithelial-mesenchymal transition |
| AU2018219862B2 (en) | 2017-02-07 | 2020-09-17 | Nant Holding IP, LLC | Maximizing T-cell memory and compositions and methods therefor |
| US20180235936A1 (en) * | 2017-02-17 | 2018-08-23 | University Of Notre Dame Du Lac | Cancer treatment methods |
| EP3615675A4 (en) | 2017-04-24 | 2021-03-03 | Nantcell, Inc. | TARGETED NEOEPITOP VECTORS AND METHOD FOR THEREFORE |
| US10753942B2 (en) | 2017-05-15 | 2020-08-25 | Indicator Systems International, Inc. | Methods to detect remnant cancer cells |
| WO2019018813A1 (en) * | 2017-07-21 | 2019-01-24 | Varian Medical Systems, Inc. | METHODS OF USING ULTRA HIGH DOSE RATE RADIATION AND THERAPEUTIC AGENTS |
| KR20200078481A (ko) | 2017-08-18 | 2020-07-01 | 아다스트라 파마수티컬스, 인코포레이티드 | Tg02의 다형성 형태 |
| CA3081750A1 (en) | 2017-11-06 | 2019-05-09 | Rapt Therapeutics, Inc. | Anticancer agents |
| US11773187B2 (en) | 2018-01-17 | 2023-10-03 | Nantbio, Inc. | Enhanced immunogenicity for GPI-anchored antigens |
| CN111741761B (zh) | 2018-01-26 | 2023-04-18 | 加利福尼亚大学董事会 | 用于使用抗vegf剂治疗血管生成病症的方法和组合物 |
| JP2021528362A (ja) | 2018-03-20 | 2021-10-21 | アブラクシス バイオサイエンス, エルエルシー | mTOR阻害剤およびアルブミンのナノ粒子の投与を介して中枢神経系障害を処置する方法 |
| EP3773477A1 (en) | 2018-04-03 | 2021-02-17 | Vaxess Technologies, Inc. | Microneedle comprising silk fibroin applied to a dissolvable base |
| US11823773B2 (en) | 2018-04-13 | 2023-11-21 | Nant Holdings Ip, Llc | Nant cancer vaccine strategies |
| EP3858846A4 (en) * | 2018-09-30 | 2023-08-09 | Bai Yao Zhi Da (Beijing) Nanobio Technology Co., Ltd. | NUCLEIC ACID NANO-CARRIER MEDICINE, METHOD FOR PREPARING IT, PHARMACEUTICAL COMPOSITION THEREOF, AND CORRESPONDING USE |
| WO2020078219A1 (zh) * | 2018-10-16 | 2020-04-23 | 百药智达(北京)纳米生物技术有限公司 | 核酸纳米载体药物、其制备方法、药物组合物及应用 |
| WO2020112868A1 (en) * | 2018-11-30 | 2020-06-04 | Aileron Therapeutics, Inc. | Combination therapy of peptidomimetic macrocycles |
| RU2706347C1 (ru) * | 2019-07-24 | 2019-11-18 | ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ "РОССИЙСКИЙ НАУЧНЫЙ ЦЕНТР РАДИОЛОГИИ И ХИРУРГИЧЕСКИХ ТЕХНОЛОГИЙ ИМЕНИ АКАДЕМИКА А.М. ГРАНОВА" МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ / ФГБУ "РНЦРХТ им. ак. А.М. Гранова" Минздрава России | Способ лечения операбельной аденокарциномы головки поджелудочной железы |
| US11497737B2 (en) | 2019-10-28 | 2022-11-15 | Abraxis Bioscience, Llc | Pharmaceutical compositions of albumin and rapamycin |
| EP4065150A4 (en) | 2019-11-25 | 2023-12-06 | The Regents of the University of California | LONG-ACTING VEGF INHIBITORS FOR INTRAOCULAR NEOVASCULARIZATION |
| WO2022232420A1 (en) * | 2021-04-29 | 2022-11-03 | Insmed Incorporated | Certain n-(1-cyano-2-phenylethyl)-1,4-oxazepane-2-carboxamides for treating cancer |
| WO2023174210A1 (en) | 2022-03-14 | 2023-09-21 | Laekna Limited | Combination treatment for cancer |
| WO2023250117A2 (en) | 2022-06-24 | 2023-12-28 | Vaxess Technologies, Inc. | Applicator for medicament patch |
| WO2024044775A1 (en) * | 2022-08-26 | 2024-02-29 | Ideaya Biosciences, Inc. | Methods of treating uveal melanoma |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001089522A1 (en) * | 2000-05-19 | 2001-11-29 | American Bioscience, Inc. | Compositions and methods for administration of pharmacologically active compounds |
Family Cites Families (150)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5206018A (en) * | 1978-11-03 | 1993-04-27 | Ayerst, Mckenna & Harrison, Inc. | Use of rapamycin in treatment of tumors |
| US5470571A (en) * | 1988-01-27 | 1995-11-28 | The Wistar Institute | Method of treating human EGF receptor-expressing gliomas using radiolabeled EGF receptor-specific MAB 425 |
| FR2660556B1 (fr) | 1990-04-06 | 1994-09-16 | Rhone Poulenc Sante | Microspheres, leur procede de preparation et leur utilisation. |
| IL98528A0 (en) * | 1990-06-21 | 1992-07-15 | Merck & Co Inc | Pharmaceutical compositions containing hybrid for killing bladder cancer cells |
| US5399363A (en) | 1991-01-25 | 1995-03-21 | Eastman Kodak Company | Surface modified anticancer nanoparticles |
| CA2082160C (en) | 1991-03-06 | 2003-05-06 | Mary M. Bendig | Humanised and chimeric monoclonal antibodies |
| US6515009B1 (en) * | 1991-09-27 | 2003-02-04 | Neorx Corporation | Therapeutic inhibitor of vascular smooth muscle cells |
| US5811447A (en) * | 1993-01-28 | 1998-09-22 | Neorx Corporation | Therapeutic inhibitor of vascular smooth muscle cells |
| CA2086874E (en) * | 1992-08-03 | 2000-01-04 | Renzo Mauro Canetta | Methods for administration of taxol |
| US6306421B1 (en) * | 1992-09-25 | 2001-10-23 | Neorx Corporation | Therapeutic inhibitor of vascular smooth muscle cells |
| FR2697752B1 (fr) * | 1992-11-10 | 1995-04-14 | Rhone Poulenc Rorer Sa | Compositions antitumorales contenant des dérivés du taxane. |
| US6491938B2 (en) * | 1993-05-13 | 2002-12-10 | Neorx Corporation | Therapeutic inhibitor of vascular smooth muscle cells |
| US5981568A (en) * | 1993-01-28 | 1999-11-09 | Neorx Corporation | Therapeutic inhibitor of vascular smooth muscle cells |
| US5439686A (en) | 1993-02-22 | 1995-08-08 | Vivorx Pharmaceuticals, Inc. | Methods for in vivo delivery of substantially water insoluble pharmacologically active agents and compositions useful therefor |
| US20030068362A1 (en) * | 1993-02-22 | 2003-04-10 | American Bioscience, Inc. | Methods and formulations for the delivery of pharmacologically active agents |
| US5997904A (en) * | 1993-02-22 | 1999-12-07 | American Bioscience, Inc. | Total nutrient admixtures as stable multicomponent liquids or dry powders and methods for the preparation thereof |
| US5362478A (en) | 1993-03-26 | 1994-11-08 | Vivorx Pharmaceuticals, Inc. | Magnetic resonance imaging with fluorocarbons encapsulated in a cross-linked polymeric shell |
| US20070116761A1 (en) | 1993-02-22 | 2007-05-24 | Desai Neil P | Novel formulations of pharmacological agents, methods for the preparation thereof and methods for the use thereof |
| US6753006B1 (en) * | 1993-02-22 | 2004-06-22 | American Bioscience, Inc. | Paclitaxel-containing formulations |
| US20030133955A1 (en) * | 1993-02-22 | 2003-07-17 | American Bioscience, Inc. | Methods and compositions useful for administration of chemotherapeutic agents |
| US5650156A (en) * | 1993-02-22 | 1997-07-22 | Vivorx Pharmaceuticals, Inc. | Methods for in vivo delivery of nutriceuticals and compositions useful therefor |
| US20030073642A1 (en) * | 1993-02-22 | 2003-04-17 | American Bioscience, Inc. | Methods and formulations for delivery of pharmacologically active agents |
| BR9405798A (pt) * | 1993-02-22 | 1995-12-12 | Vivorx Pharmaceuticals Inc | Métodos para liberação in vivo de material biológico e composições úteis dos mesmos |
| US6096331A (en) | 1993-02-22 | 2000-08-01 | Vivorx Pharmaceuticals, Inc. | Methods and compositions useful for administration of chemotherapeutic agents |
| US5916596A (en) * | 1993-02-22 | 1999-06-29 | Vivorx Pharmaceuticals, Inc. | Protein stabilized pharmacologically active agents, methods for the preparation thereof and methods for the use thereof |
| US5665382A (en) * | 1993-02-22 | 1997-09-09 | Vivorx Pharmaceuticals, Inc. | Methods for the preparation of pharmaceutically active agents for in vivo delivery |
| US6749868B1 (en) * | 1993-02-22 | 2004-06-15 | American Bioscience, Inc. | Protein stabilized pharmacologically active agents, methods for the preparation thereof and methods for the use thereof |
| US6528067B1 (en) | 1993-02-22 | 2003-03-04 | American Bioscience, Inc. | Total nutrient admixtures as stable multicomponent liquids or dry powders and methods for the preparation thereof |
| US5665383A (en) * | 1993-02-22 | 1997-09-09 | Vivorx Pharmaceuticals, Inc. | Methods for the preparation of immunostimulating agents for in vivo delivery |
| WO1995003036A1 (en) | 1993-07-19 | 1995-02-02 | Angiogenesis Technologies, Inc. | Anti-angiogenic compositions and methods of use |
| US5886026A (en) * | 1993-07-19 | 1999-03-23 | Angiotech Pharmaceuticals Inc. | Anti-angiogenic compositions and methods of use |
| US6441026B1 (en) * | 1993-11-08 | 2002-08-27 | Aventis Pharma S.A. | Antitumor compositions containing taxane derivatives |
| AU1831395A (en) * | 1994-01-14 | 1995-08-01 | Cell Therapeutics, Inc. | Method for treating diseases mediated by cellular proliferation in response to pdgf, egf, fgf and vegf |
| US5626862A (en) * | 1994-08-02 | 1997-05-06 | Massachusetts Institute Of Technology | Controlled local delivery of chemotherapeutic agents for treating solid tumors |
| US5662883A (en) | 1995-01-10 | 1997-09-02 | Nanosystems L.L.C. | Microprecipitation of micro-nanoparticulate pharmaceutical agents |
| US5534270A (en) | 1995-02-09 | 1996-07-09 | Nanosystems Llc | Method of preparing stable drug nanoparticles |
| US5510118A (en) | 1995-02-14 | 1996-04-23 | Nanosystems Llc | Process for preparing therapeutic compositions containing nanoparticles |
| US5609629A (en) * | 1995-06-07 | 1997-03-11 | Med Institute, Inc. | Coated implantable medical device |
| AU716005B2 (en) * | 1995-06-07 | 2000-02-17 | Cook Medical Technologies Llc | Implantable medical device |
| US5744460A (en) * | 1996-03-07 | 1998-04-28 | Novartis Corporation | Combination for treatment of proliferative diseases |
| US6441025B2 (en) | 1996-03-12 | 2002-08-27 | Pg-Txl Company, L.P. | Water soluble paclitaxel derivatives |
| NZ332234A (en) * | 1996-03-12 | 2000-06-23 | Pg Txl Company Lp | Water soluble paclitaxel prodrugs formed by conjugating paclitaxel or docetaxel with a polyglutamic acid polymer and use for treating cancer |
| PT956034E (pt) * | 1996-07-30 | 2002-12-31 | Novartis Ag | Composicoes farmaceuticas para o tratamento da rejeicao de transplantes estados inflamatorios ou auto-imunes compreendendo ciclosporina a e 40-o-(2-hidroxietil)-rapamicina |
| US5997899A (en) | 1996-10-01 | 1999-12-07 | Skyepharma Inc. | Method for producing liposomes with increased percent of compound encapsulated |
| US20070092563A1 (en) * | 1996-10-01 | 2007-04-26 | Abraxis Bioscience, Inc. | Novel formulations of pharmacological agents, methods for the preparation thereof and methods for the use thereof |
| US6495579B1 (en) * | 1996-12-02 | 2002-12-17 | Angiotech Pharmaceuticals, Inc. | Method for treating multiple sclerosis |
| US6143276A (en) * | 1997-03-21 | 2000-11-07 | Imarx Pharmaceutical Corp. | Methods for delivering bioactive agents to regions of elevated temperatures |
| US6884879B1 (en) * | 1997-04-07 | 2005-04-26 | Genentech, Inc. | Anti-VEGF antibodies |
| ES2236634T3 (es) | 1997-04-07 | 2005-07-16 | Genentech, Inc. | Anticuerpos anti-vegf. |
| KR100789008B1 (ko) * | 1997-06-27 | 2007-12-26 | 아브락시스 바이오사이언스 인크. | 신규 약물 제제 |
| US20030199425A1 (en) * | 1997-06-27 | 2003-10-23 | Desai Neil P. | Compositions and methods for treatment of hyperplasia |
| US8853260B2 (en) | 1997-06-27 | 2014-10-07 | Abraxis Bioscience, Llc | Formulations of pharmacological agents, methods for the preparation thereof and methods for the use thereof |
| US6258084B1 (en) | 1997-09-11 | 2001-07-10 | Vnus Medical Technologies, Inc. | Method for applying energy to biological tissue including the use of tumescent tissue compression |
| GB9800569D0 (en) * | 1998-01-12 | 1998-03-11 | Glaxo Group Ltd | Heterocyclic compounds |
| DE69934681T2 (de) | 1998-04-16 | 2007-11-08 | Eurovita A/S | Neue synergistische zusammensetzungen, die aromatische verbindungen und in alpinia galanga vorhandene terpenoide enthalten |
| EP1100494A1 (en) * | 1998-07-30 | 2001-05-23 | Novopharm Biotech, Inc. | Pharmaceutically composition comprising an aqueous solution of paclitaxel and albumin |
| US6682758B1 (en) * | 1998-12-22 | 2004-01-27 | The United States Of America As Represented By The Department Of Health And Human Services | Water-insoluble drug delivery system |
| US6740665B1 (en) | 1999-02-10 | 2004-05-25 | Ramachandran Murali | Tyrosine kinase inhibitors and methods of using the same |
| US6537585B1 (en) * | 1999-03-26 | 2003-03-25 | Guilford Pharmaceuticals, Inc. | Methods and compositions for treating solid tumors |
| WO2000064437A1 (en) | 1999-04-22 | 2000-11-02 | American Biosciences, Inc. | Long term administration of pharmacologically active agents |
| EP1178786A4 (en) | 1999-05-21 | 2006-03-01 | American Bioscience Inc | PHARMACOLOGICALLY ACTIVE PROTEIN STABILIZING AGENTS; METHODS OF MANUFACTURE AND METHODS OF USE |
| EP1185301A1 (en) | 1999-05-24 | 2002-03-13 | Sonus Pharmaceuticals, Inc. | Emulsion vehicle for poorly soluble drugs |
| JP2003527337A (ja) | 1999-11-12 | 2003-09-16 | エントレメッド インコーポレイテッド | 抗血管新生スケジュールに基づく治療薬の投与方法 |
| US7740841B1 (en) * | 2000-01-28 | 2010-06-22 | Sunnybrook Health Science Center | Therapeutic method for reducing angiogenesis |
| IT1318401B1 (it) * | 2000-03-17 | 2003-08-25 | Indena Spa | Derivati di n-desacetiltiocolchicina e composizioni farmaceutiche cheli contengono. |
| AU2001253334A1 (en) | 2000-04-10 | 2001-10-23 | Teva Pharmaceutical Industries Ltd. | Method and composition for treating cancer by administration of apoptosis-inducing chemotherapeutic agents |
| ITMI20001107A1 (it) * | 2000-05-18 | 2001-11-18 | Acs Dobfar Spa | Metodo per il trattamento di tumori solici mediante microparticelle di albumina incorporanti paclitaxel |
| AR031248A1 (es) * | 2000-06-30 | 2003-09-17 | Glaxo Group Ltd | Compuestos de ditosilato de quinazolina, composicion farmaceutica, metodo de tratamiento y uso en terapia y proceso para la preparacion de dichos compuestos |
| EP1322307B1 (en) | 2000-07-28 | 2011-09-28 | Sloan-Kettering Institute For Cancer Research | Methods for treating cell proliferative disorders and viral infections |
| CZ2003837A3 (cs) | 2000-09-22 | 2004-12-15 | Bristol-Myers Squibb Company | Způsob pro snížení toxicity při kombinovaných chemoterapiích |
| ATE290882T1 (de) * | 2001-01-16 | 2005-04-15 | Glaxo Group Ltd | Pharmazeutische mischung gegen krebs, die ein 4- chinazolinamin in kombination mit paclitaxel, carboplatin or vinorelbine enthält |
| WO2002056755A2 (en) | 2001-01-19 | 2002-07-25 | Bionumerik Pharmaceuticals, Inc. | Method for treating cancer |
| US6548531B2 (en) * | 2001-02-09 | 2003-04-15 | Hoffmann-La Roche Inc. | Method for cancer therapy |
| GB0103668D0 (en) * | 2001-02-15 | 2001-03-28 | Biointeractions Ltd | Methods and clinical devices for the inhibition or prevention of mammalian cell growth |
| WO2002069949A2 (en) * | 2001-03-06 | 2002-09-12 | Prendergast Patrick T | Combination therapy for reduction of toxycity of chemotherapeutic agents |
| RU2284184C2 (ru) | 2001-03-06 | 2006-09-27 | Бристол-Маерс Сквибб Компани | Способ лечения рака |
| US6752922B2 (en) * | 2001-04-06 | 2004-06-22 | Fluidigm Corporation | Microfluidic chromatography |
| US7638161B2 (en) | 2001-07-20 | 2009-12-29 | Applied Materials, Inc. | Method and apparatus for controlling dopant concentration during BPSG film deposition to reduce nitride consumption |
| US6872715B2 (en) | 2001-08-06 | 2005-03-29 | Kosan Biosciences, Inc. | Benzoquinone ansamycins |
| US7056338B2 (en) * | 2003-03-28 | 2006-06-06 | Conor Medsystems, Inc. | Therapeutic agent delivery device with controlled therapeutic agent release rates |
| US20040033271A1 (en) * | 2001-12-03 | 2004-02-19 | Seth Lederman | Methods for contemporaneous administration of levamisole and 5-fluorouracil |
| US20040143004A1 (en) * | 2002-02-26 | 2004-07-22 | Joseph Fargnoli | Metronomic dosing of taxanes |
| ITMI20020681A1 (it) | 2002-03-29 | 2003-09-29 | Acs Dobfar Spa | Procedimento per la produzione di nanoparticelle di paclitaxel ed albumina |
| ITMI20020680A1 (it) * | 2002-03-29 | 2003-09-29 | Acs Dobfar Spa | Composizione antitumorale migliorata a base di paclitaxel e metodo per il suo ottenimento |
| US20040126400A1 (en) * | 2002-05-03 | 2004-07-01 | Iversen Patrick L. | Delivery of therapeutic compounds via microparticles or microbubbles |
| US7794743B2 (en) * | 2002-06-21 | 2010-09-14 | Advanced Cardiovascular Systems, Inc. | Polycationic peptide coatings and methods of making the same |
| TWI272273B (en) | 2002-07-16 | 2007-02-01 | Sonus Pharma Inc | Platinum compounds |
| AP2005003232A0 (en) | 2002-08-19 | 2005-03-31 | Pfizer Prod Inc | Combination therapy for hyperproliferative diseases. |
| US20040047835A1 (en) | 2002-09-06 | 2004-03-11 | Cell Therapeutics, Inc. | Combinatorial drug therapy using polymer drug conjugates |
| US20050158375A1 (en) * | 2002-11-15 | 2005-07-21 | Toshikiro Kimura | Pharmaceutical composition containing liposomes for treating cancer |
| US20050095267A1 (en) * | 2002-12-04 | 2005-05-05 | Todd Campbell | Nanoparticle-based controlled release polymer coatings for medical implants |
| PT1585548T (pt) * | 2002-12-09 | 2018-10-17 | Abraxis Bioscience Llc | Composições e métodos de administração de agentes farmacológicos |
| US20050004002A1 (en) | 2002-12-09 | 2005-01-06 | American Bioscience, Inc. | Compositions and methods of delivery of pharmacological agents |
| KR20050098244A (ko) * | 2003-01-10 | 2005-10-11 | 쓰레솔드 파마슈티컬스, 인코포레이티드 | 2-데옥시글루코오스를 사용한 암 치료 방법 |
| WO2004087045A2 (en) | 2003-03-28 | 2004-10-14 | Kosan Biosciences, Inc. | Devices, methods, and compositions to prevent restenosis |
| US20060165744A1 (en) | 2003-05-22 | 2006-07-27 | Neopharm, Inc | Combination liposomal formulations |
| US20050026893A1 (en) | 2003-05-30 | 2005-02-03 | Kosan Biosciences, Inc. | Method for treating diseases using HSP90-inhibiting agents in combination with immunosuppressants |
| JP2007525466A (ja) | 2003-05-30 | 2007-09-06 | ジェネンテック・インコーポレーテッド | 抗vegf抗体での治療 |
| AR046510A1 (es) * | 2003-07-25 | 2005-12-14 | Regeneron Pharma | Composicion de un antagonista de vegf y un agente anti-proliferativo |
| US20080085902A1 (en) | 2003-09-23 | 2008-04-10 | Guido Bold | Combination Of A Vegf Receptor Inhibitor Or With A Chemotherapeutic Agent |
| ES2574231T3 (es) | 2003-10-15 | 2016-06-16 | Syncore Biotechnology Co., Ltd | Uso de liposomas catiónicos que comprenden paclitaxel |
| ATE472551T1 (de) | 2003-10-29 | 2010-07-15 | Sonus Pharma Inc | Tocopherolmodifizierte therapeutische arzneimittelverbindung |
| US20080045559A1 (en) | 2003-10-29 | 2008-02-21 | Sonus Pharmaceuticals, Inc. | Tocopherol-modified therapeutic drug compounds |
| US20050203174A1 (en) | 2004-03-09 | 2005-09-15 | Kosan Biosciences, Inc. | Combination therapies using leptomycin B |
| WO2005090372A2 (en) | 2004-03-15 | 2005-09-29 | Sonus Pharmaceuticals, Inc. | Platinum carboxylate anticancer compounds |
| WO2006001911A2 (en) | 2004-05-06 | 2006-01-05 | Genentech, Inc. | Crystal structure of the hepatocyte growth factor beta chain and methods of use |
| ES2529660T3 (es) | 2004-05-14 | 2015-02-24 | Abraxis Bioscience, Llc | Métodos de tratamiento en los que se utilizan las proteínas de unión a albúmina como dianas |
| US8420603B2 (en) * | 2004-05-14 | 2013-04-16 | Abraxis Bioscience, Llc | SPARC and methods of use thereof |
| CN102973947A (zh) | 2004-06-01 | 2013-03-20 | 健泰科生物技术公司 | 抗体-药物偶联物和方法 |
| BRPI0511760A (pt) * | 2004-06-03 | 2008-01-08 | Hoffmann La Roche | tratamento com gemcitabina e um inibidor de egfr |
| WO2005117978A2 (en) | 2004-06-04 | 2005-12-15 | Genentech, Inc. | Method for treating multiple sclerosis |
| GT200500155A (es) * | 2004-06-16 | 2006-05-15 | Terapia del càncer resistente al platino | |
| US8735394B2 (en) | 2005-02-18 | 2014-05-27 | Abraxis Bioscience, Llc | Combinations and modes of administration of therapeutic agents and combination therapy |
| DK2301531T3 (en) | 2005-02-18 | 2018-07-30 | Abraxis Bioscience Llc | COMBINATIONS AND WAYS FOR ADMINISTRATING THERAPEUTIC SUBSTANCES AND COMBINATION THERAPY |
| US20070166388A1 (en) * | 2005-02-18 | 2007-07-19 | Desai Neil P | Combinations and modes of administration of therapeutic agents and combination therapy |
| US7332568B2 (en) * | 2005-02-18 | 2008-02-19 | Abraxis Bioscience, Inc. | Q3 SPARC deletion mutant and uses thereof |
| JP5700909B2 (ja) | 2005-05-04 | 2015-04-15 | メディゲーネ アクチエンゲゼルシャフトMediGene AG | パクリタキセルを含む陽イオン性リポソーム製剤を投与する方法 |
| US20080221135A1 (en) | 2005-05-13 | 2008-09-11 | Bristol-Myers Squibb Company | Combination therapy |
| KR101457834B1 (ko) * | 2005-08-31 | 2014-11-05 | 아브락시스 바이오사이언스, 엘엘씨 | 증가된 안정성을 가진 수 난용성 약물의 조성물 및 제조 방법 |
| ES2718323T3 (es) | 2005-08-31 | 2019-07-01 | Abraxis Bioscience Llc | Composiciones que comprenden agentes farmacéuticos poco solubles en agua |
| WO2007059116A2 (en) | 2005-11-14 | 2007-05-24 | Abraxis Bioscience, Inc. | Geldanamycin derivatives and pharmaceutical compositions thereof |
| EP3056196A1 (en) | 2006-03-22 | 2016-08-17 | SynCore Biotechnology CO., LTD | Treatment of triple receptor negative breast cancer |
| US9037257B2 (en) * | 2006-04-07 | 2015-05-19 | Medtronic, Inc. | Resonance tuning module for implantable devices and leads |
| SG136814A1 (en) | 2006-04-12 | 2007-11-29 | Tencube Pte Ltd | System for tracking mobile equipment and associated mobile subscribersæ identity |
| US20080280987A1 (en) * | 2006-08-31 | 2008-11-13 | Desai Neil P | Methods of inhibiting angiogenesis and treating angiogenesis-associated diseases |
| US20100112077A1 (en) | 2006-11-06 | 2010-05-06 | Abraxis Bioscience, Llc | Nanoparticles of paclitaxel and albumin in combination with bevacizumab against cancer |
| ES2700074T3 (es) | 2006-12-14 | 2019-02-13 | Abraxis Bioscience Llc | Terapia para el cáncer de mama sobre la base del estado de los receptores hormonales con nanopartículas que comprenden taxano |
| CA3201293A1 (en) | 2007-03-07 | 2008-09-12 | Abraxis Bioscience, Llc | Nanoparticle comprising rapamycin and albumin as anticancer agent |
| CA2686736A1 (en) | 2007-05-03 | 2008-11-13 | Abraxis Bioscience, Llc | Nanoparticle compositions comprising rapamycin for treating pulmonary hypertension |
| US8927019B2 (en) | 2007-06-01 | 2015-01-06 | Abraxis Bioscience, Llc | Methods and compositions for treating recurrent cancer |
| WO2009009587A2 (en) | 2007-07-09 | 2009-01-15 | Board Of Regents Of The University Of Nebraska | Apoptosis-modulating protein therapy for proliferative disorders and nanoparticles containing the same |
| MX2010011165A (es) | 2008-04-10 | 2011-02-22 | Abraxis Bioscience Llc | Composiciones de derivados de taxano hidrofobos y sus usos. |
| EP2367425B1 (en) | 2008-12-11 | 2018-02-28 | Abraxis BioScience, LLC | Combination therapy including a taxane and a further therapeutic agent |
| EP2405750B1 (en) | 2009-03-13 | 2018-05-09 | Abraxis BioScience, LLC | Combination therapy with thiocolchicine derivatives |
| KR20120005505A (ko) | 2009-04-10 | 2012-01-16 | 아브락시스 바이오사이언스, 엘엘씨 | 나노입자 제제 및 그의 용도 |
| WO2010121000A1 (en) | 2009-04-15 | 2010-10-21 | Abraxis Bioscience, Llc | Prion-free nanoparticle compositions and methods |
| WO2011025838A1 (en) | 2009-08-25 | 2011-03-03 | Abraxis Bioscience, Llc | Combination therapy with nanoparticle compositions of taxane and hedgehog inhibitors |
| KR101786142B1 (ko) | 2010-03-26 | 2017-10-17 | 아브락시스 바이오사이언스, 엘엘씨 | 간세포 암종의 치료 방법 |
| CN107158389A (zh) | 2010-03-29 | 2017-09-15 | 阿布拉科斯生物科学有限公司 | 增强药物递送和治疗剂有效性的方法 |
| WO2011123395A1 (en) | 2010-03-29 | 2011-10-06 | Abraxis Bioscience, Llc | Methods of treating cancer |
| US9096660B2 (en) | 2010-04-26 | 2015-08-04 | Abraxis Bioscience, Llc | SPARC binding antibodies and uses thereof |
| JP2013527232A (ja) | 2010-06-02 | 2013-06-27 | アブラクシス バイオサイエンス, エルエルシー | 膀胱がんの処置方法 |
| EP2575804A4 (en) | 2010-06-04 | 2013-10-23 | Abraxis Bioscience Llc | METHOD FOR THE TREATMENT OF PANCREASCRE |
| CA2801891C (en) | 2010-06-07 | 2020-10-27 | Abraxis Bioscience, Llc | Combination therapy methods for treating proliferative diseases |
| CN109172809A (zh) | 2011-04-28 | 2019-01-11 | 阿布拉科斯生物科学有限公司 | 纳米颗粒组合物的血管内递送及其应用 |
| DK2790675T3 (da) | 2011-12-14 | 2019-09-09 | Abraxis Bioscience Llc | Anvendelse af polymerexcipienser til frysetørring eller frysning af partikler |
| US9149455B2 (en) | 2012-11-09 | 2015-10-06 | Abraxis Bioscience, Llc | Methods of treating melanoma |
| US20140199405A1 (en) | 2013-01-11 | 2014-07-17 | Abraxis Bioscience, Llc | Method for treating cancer based on mutation status of k-ras |
| US20140199404A1 (en) | 2013-01-11 | 2014-07-17 | Abraxis Bioscience, Llc | Method for treating cancer based on level of a nucleoside transporter |
| US9511046B2 (en) | 2013-01-11 | 2016-12-06 | Abraxis Bioscience, Llc | Methods of treating pancreatic cancer |
-
2006
- 2006-02-21 DK DK10011106.1T patent/DK2301531T3/en active
- 2006-02-21 KR KR1020207009782A patent/KR20200038337A/ko not_active Application Discontinuation
- 2006-02-21 SI SI200632272T patent/SI2301531T1/sl unknown
- 2006-02-21 CA CA2902071A patent/CA2902071C/en active Active
- 2006-02-21 NZ NZ560879A patent/NZ560879A/en unknown
- 2006-02-21 PL PL10011106T patent/PL2301531T3/pl unknown
- 2006-02-21 KR KR1020177021183A patent/KR101914254B1/ko active IP Right Grant
- 2006-02-21 EP EP10011106.1A patent/EP2301531B1/en active Active
- 2006-02-21 HU HUE10011106A patent/HUE038768T2/hu unknown
- 2006-02-21 MX MX2007009960A patent/MX2007009960A/es active IP Right Grant
- 2006-02-21 AT AT06735710T patent/ATE531365T1/de active
- 2006-02-21 JP JP2007556407A patent/JP5769358B2/ja active Active
- 2006-02-21 KR KR1020197012570A patent/KR20190062506A/ko not_active Application Discontinuation
- 2006-02-21 ES ES06735710T patent/ES2375828T3/es active Active
- 2006-02-21 LT LTEP10011106.1T patent/LT2301531T/lt unknown
- 2006-02-21 KR KR1020157009103A patent/KR101625347B1/ko active IP Right Review Request
- 2006-02-21 NZ NZ595313A patent/NZ595313A/xx unknown
- 2006-02-21 AU AU2006213999A patent/AU2006213999B2/en active Active
- 2006-02-21 EP EP06735710A patent/EP1853250B1/en not_active Revoked
- 2006-02-21 RU RU2007134571/15A patent/RU2452482C2/ru active
- 2006-02-21 WO PCT/US2006/006167 patent/WO2006089290A1/en active Application Filing
- 2006-02-21 KR KR1020137034986A patent/KR20140016402A/ko not_active Application Discontinuation
- 2006-02-21 PT PT06735710T patent/PT1853250E/pt unknown
- 2006-02-21 CN CN2013100757784A patent/CN103169729A/zh active Pending
- 2006-02-21 CA CA3054535A patent/CA3054535A1/en not_active Abandoned
- 2006-02-21 ZA ZA200707491A patent/ZA200707491B/xx unknown
- 2006-02-21 DK DK17165979.0T patent/DK3248600T3/da active
- 2006-02-21 KR KR1020077021327A patent/KR20070114753A/ko not_active Application Discontinuation
- 2006-02-21 ES ES10011106.1T patent/ES2678448T3/es active Active
- 2006-02-21 CA CA2598239A patent/CA2598239C/en active Active
- 2006-02-21 KR KR1020187031184A patent/KR101976003B1/ko active IP Right Review Request
- 2006-02-21 SI SI200631217T patent/SI1853250T1/sl unknown
- 2006-02-21 SG SG201007821-0A patent/SG166775A1/en unknown
- 2006-02-21 EP EP20154548.0A patent/EP3698783A1/en not_active Withdrawn
- 2006-02-21 HU HUE17165979A patent/HUE049789T2/hu unknown
- 2006-02-21 BR BRPI0607809-5A patent/BRPI0607809A2/pt not_active Application Discontinuation
- 2006-02-21 CN CN201510411744.7A patent/CN105288630A/zh active Pending
- 2006-02-21 PT PT171659790T patent/PT3248600T/pt unknown
- 2006-02-21 MX MX2011009748A patent/MX339142B/es unknown
- 2006-02-21 SI SI200632377T patent/SI3248600T1/sl unknown
- 2006-02-21 KR KR1020167013205A patent/KR101764375B1/ko active IP Right Grant
- 2006-02-21 PL PL06735710T patent/PL1853250T3/pl unknown
- 2006-02-21 DK DK06735710.3T patent/DK1853250T3/da active
- 2006-02-21 US US11/359,286 patent/US8034375B2/en active Active
- 2006-02-21 CN CN2013102337091A patent/CN103285395A/zh active Pending
- 2006-02-21 ES ES17165979T patent/ES2802541T3/es active Active
- 2006-02-21 PL PL17165979T patent/PL3248600T3/pl unknown
- 2006-02-21 CN CN2006800116779A patent/CN101160123B/zh active Active
- 2006-02-21 PT PT100111061T patent/PT2301531T/pt unknown
- 2006-02-21 EP EP17165979.0A patent/EP3248600B8/en not_active Revoked
- 2006-02-21 LT LTEP17165979.0T patent/LT3248600T/lt unknown
- 2006-10-06 US US11/544,242 patent/US8257733B2/en active Active
-
2007
- 2007-07-20 US US11/880,314 patent/US7780984B2/en active Active
- 2007-08-15 IL IL185288A patent/IL185288A/en active IP Right Grant
-
2008
- 2008-04-14 HK HK08104204.6A patent/HK1109589A1/xx not_active IP Right Cessation
- 2008-10-08 HK HK08111140.8A patent/HK1119071A1/xx unknown
- 2008-12-12 US US12/334,115 patent/US7758891B2/en active Active
-
2011
- 2011-09-08 US US13/228,323 patent/US8268348B2/en active Active
-
2012
- 2012-01-05 CY CY20121100013T patent/CY1112907T1/el unknown
- 2012-02-22 RU RU2012106620A patent/RU2632103C2/ru active
- 2012-06-21 IL IL220547A patent/IL220547A0/en unknown
- 2012-07-12 JP JP2012156721A patent/JP2012193205A/ja not_active Withdrawn
- 2012-08-01 US US13/564,633 patent/US20130195922A1/en not_active Abandoned
- 2012-08-14 US US13/585,696 patent/US9101543B2/en active Active
-
2013
- 2013-01-09 JP JP2013001664A patent/JP2013064014A/ja not_active Withdrawn
- 2013-02-25 US US13/776,484 patent/US20140017315A1/en not_active Abandoned
- 2013-02-25 US US13/776,481 patent/US20140023717A1/en not_active Abandoned
-
2014
- 2014-06-18 LU LU92484C patent/LU92484I2/xx unknown
- 2014-06-19 CY CY2014023C patent/CY2014023I1/el unknown
- 2014-08-25 US US14/468,127 patent/US20150079177A1/en not_active Abandoned
- 2014-09-05 JP JP2014180852A patent/JP6092824B2/ja active Active
-
2015
- 2015-04-30 JP JP2015092577A patent/JP6513467B2/ja active Active
-
2016
- 2016-10-07 JP JP2016198882A patent/JP6685875B2/ja active Active
-
2017
- 2017-06-06 IL IL252715A patent/IL252715A0/en unknown
- 2017-10-18 US US15/787,586 patent/US20180169017A1/en not_active Abandoned
-
2018
- 2018-03-19 JP JP2018050735A patent/JP2018090643A/ja active Pending
- 2018-05-25 HK HK18106804.3A patent/HK1250006A1/zh not_active IP Right Cessation
- 2018-07-20 CY CY20181100760T patent/CY1120445T1/el unknown
-
2019
- 2019-10-28 JP JP2019195457A patent/JP2020012005A/ja not_active Withdrawn
-
2020
- 2020-04-02 IL IL273765A patent/IL273765A/en unknown
- 2020-06-25 CY CY20201100579T patent/CY1123110T1/el unknown
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001089522A1 (en) * | 2000-05-19 | 2001-11-29 | American Bioscience, Inc. | Compositions and methods for administration of pharmacologically active compounds |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN101160123B (zh) | 治疗剂的组合 | |
| CN101573108A (zh) | 紫杉醇和白蛋白纳米颗粒联合贝伐单抗对抗癌症 | |
| CN101605535A (zh) | 用包含紫杉烷的纳米颗粒基于激素受体状态治疗乳腺癌 | |
| KR20130109025A (ko) | 방광암의 치료 방법 | |
| AU2016204834B2 (en) | Combinations and modes of administration of therapeutic agents and combination therapy | |
| AU2012201568B2 (en) | Combinations and modes of administration of therapeutic agents and combination therapy |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1188739 Country of ref document: HK |
|
| RJ01 | Rejection of invention patent application after publication |
Application publication date: 20130911 |
|
| RJ01 | Rejection of invention patent application after publication |