CN101627134B - 用于急性髓细胞白血病(aml)的诊断、预后和治疗的基于微rna的方法和组合物 - Google Patents
用于急性髓细胞白血病(aml)的诊断、预后和治疗的基于微rna的方法和组合物 Download PDFInfo
- Publication number
- CN101627134B CN101627134B CN2008800037367A CN200880003736A CN101627134B CN 101627134 B CN101627134 B CN 101627134B CN 2008800037367 A CN2008800037367 A CN 2008800037367A CN 200880003736 A CN200880003736 A CN 200880003736A CN 101627134 B CN101627134 B CN 101627134B
- Authority
- CN
- China
- Prior art keywords
- mir
- gene product
- mirna
- aml
- mir gene
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
- C12Q1/6886—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material for cancer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6834—Enzymatic or biochemical coupling of nucleic acids to a solid phase
- C12Q1/6837—Enzymatic or biochemical coupling of nucleic acids to a solid phase using probe arrays or probe chips
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2545/00—Reactions characterised by their quantitative nature
- C12Q2545/10—Reactions characterised by their quantitative nature the purpose being quantitative analysis
- C12Q2545/114—Reactions characterised by their quantitative nature the purpose being quantitative analysis involving a quantitation step
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2565/00—Nucleic acid analysis characterised by mode or means of detection
- C12Q2565/50—Detection characterised by immobilisation to a surface
- C12Q2565/501—Detection characterised by immobilisation to a surface being an array of oligonucleotides
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/106—Pharmacogenomics, i.e. genetic variability in individual responses to drugs and drug metabolism
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/112—Disease subtyping, staging or classification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/118—Prognosis of disease development
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/178—Oligonucleotides characterized by their use miRNA, siRNA or ncRNA
Abstract
本发明提供了用于急性髓细胞白血病(AML)的诊断、预后和治疗的新的方法和组合物。本发明还提供了鉴别抗AML试剂的方法。
Description
发明背景
急性髓细胞白血病(AML)是一种异质病症,它包括许多具有不同遗传异常状况和临床特征的实体1。已知相对少数类型的白血病的发病机理2。具有中等和差的危险细胞遗传学的患者代表大多数AML;基于化疗的方案不能治愈这些患者中的大多数,干细胞移植经常是治疗选择 3-4。由于同种异体干细胞移植不是许多高危白血病患者的选择,迫切需要提高我们对这些白血病的生物学的理解和开发改良的疗法。
AML中mRNA表达水平的系统性高通量分析,已经描述了AML的新的分子亚群;已经提出,它们中的一些可预测结果5-6。尽管有该进展,聚焦于已知的基因可能不足以揭示AML的分子难题。包括非编码RNA的完整基因组方案的整合,可能提高对AML生物学的理解。
微RNA(microRNA,miRNA)是长度为19-25个核苷酸的非编码RNA,其通过与部分或完全互补的位点进行碱基配对来诱导翻译抑制或切割它们的靶mRNA,从而调节基因表达7。miRNA参与关键的生物学过程,包括发育、细胞分化、细胞凋亡和增殖8。最近,已经将miRNA表达与造血作用和癌症相关联9-11。Calin等人已经证实了慢性淋巴细胞性白血病中miR-15a和miR-16-1的缺失和下调12。几个研究组已经报道了大细胞淋巴瘤13和小儿Burkitt淋巴瘤14中miRNA表达的变化。更近地,已经证实转基因小鼠的B细胞中miR-155的过表达导致多克隆B细胞增殖和B细胞瘤形成15。这些发现表明,miRNA参与人癌症的起始和进展。
如本文所公开的,使用miRNA微阵列来描绘一大组具有明显中等和较差预后的AML患者,以研究miRNA谱与细胞遗传组和临床特征之间的关联。
在急性髓细胞白血病癌细胞中差异表达的微RNA的鉴别,将辅助诊断、预知和治疗白血病。此外,这些mi RNA的推定靶的鉴别,将辅助解释它们的致病作用。在一个主要方面,本文提供了用于急性髓细胞白血病的诊断、预后和治疗的新的方法和组合物。
发明内容
本发明部分基于与正常对照细胞相比在乳腺癌细胞中差异表达的miRNA的急性髓细胞白血病癌症特异性特征(signature)的鉴定。
因此,本发明包括诊断受试者是否患有急性髓细胞白血病(AML)或处于发展该疾病的风险中的方法,该方法包括测量来自所述受试者的受试样品中至少一种miR基因产物的水平,其中与对照样品中相应的miR基因产物水平相比,受试样品中miR基因产物水平的改变表示受试者患有AML或处于发展AML的风险中。
在某些实施方案中,至少一种miR基因产物是miR-29或miR-181。在某些实施方案中,至少一种miR基因产物是miR-29b和/或miR-181b。
可使用多种本领域技术人员熟知的技术测量至少一种miR基因产物的水平。在一个实施方案中,使用RNA印迹分析测量至少一种miR基因产物的水平。在另一个实施方案中,受试样品中至少一种miR基因产物的水平低于对照样品中相应的miR基因产物的水平。此外,在另一个实施方案中,受试样品中至少一种miR基因产物的水平可高于对照样品中相应的miR基因产物的水平。
本发明还提供了诊断与受试者中一个或多个预后标记关联的AML的方法,该方法包括测量来自所述受试者的AML样品中至少一种miR基因产物的水平,其中与对照样品中相应的miR基因产物水平相比,受试样品中至少一种miR基因产物水平的改变表示受试者患有与一个或多个预后标记关联的AML。在一个实施方案中,这样测量至少一种miR基因产物的水平,即通过逆转录获自受试者的受试样品的RNA以提供一组靶寡脱氧核苷酸;将所述靶寡脱氧核苷酸与包含miRNA-特异 性探针寡核苷酸的微阵列杂交以提供受试样品的杂交谱;和,将受试样品杂交谱与从对照样品产生的杂交谱相比较来进行测量。至少一种miRNA的信号的改变表示受试者患有AML或处于发展AML的风险中。
本发明还包括治疗受试者的CLL的方法,其中与从对照样品产生的信号相比,至少一种miRNA的信号失调(例如,下调,上调)。
在某些实施方案中,微阵列包含针对选自miR-29或miR-181和其组合的一种或多种miRNA的miRNA-特异性探针寡核苷酸。
本发明还包括诊断受试者是否患有与受试者中一种或多种不利的预后标记关联的AML或处于发展该疾病的风险中的方法,即通过逆转录获自受试者的受试样品的RNA以提供一组靶寡脱氧核苷酸;将所述靶寡脱氧核苷酸与包含miRNA-特异性探针寡核苷酸的微阵列杂交以提供所述受试样品的杂交谱;和,将受试样品杂交谱与从对照样品产生的杂交谱相比较来进行诊断。信号的改变表示受试者患有癌症或处于发展癌症的风险中。
本发明还包括治疗患有AML的受试者的AML的方法,其中,与对照细胞相比,受试者的癌细胞中至少一种miR基因产物被下调或上调。当至少一种miR基因产物在癌细胞中下调时,该方法包括对受试者施用有效量的至少一种分离的miR基因产物,从而抑制受试者中癌细胞的增殖。当至少一种miR基因产物在癌细胞中上调时,该方法包括对受试者施用有效量的至少一种用于抑制至少一种miR基因产物表达的化合物,从而抑制受试者中癌细胞的增殖。在某些实施方案中,至少一种分离的miR基因产物选自miR-29、miR-181和其组合。
在相关实施方案中,本发明提供了在受试者中治疗AML的方法,该方法包括:测定与对照细胞相比,AML细胞中至少一种miR基因产物的量;和如下改变AML细胞中表达的miR基因产物的量:如果癌细胞中表达的miR基因产物的量低于对照细胞中表达的miR基因产物的量,对受试者施用有效量的至少一种分离的miR基因产物;或如果癌细胞中表达的miR基因产物的量高于对照细胞中表达的miR基因产物的量,对受试者施用有效量的至少一种用于抑制至少一种miR基因产 物的表达的化合物,从而抑制受试者中癌细胞的增殖。在某些实施方案中,至少一种分离的miR基因产物选自miR-29、miR-181和其组合。
本发明还提供了用于治疗AML的药物组合物,所述药物组合物包含至少一种分离的miR基因产物和药学上可接受的载体。在具体的实施方案中,药物组合物中至少一种分离的miR基因产物相应于在AML细胞中下调(与合适的对照细胞相比)的miR基因产物。在具体的实施方案中,药物组合物选自miR-29、miR-181和其组合。在另一个具体的实施方案中,药物组合物包含至少一种miR表达抑制剂化合物和药学上可接受的载体。此外,在具体的实施方案中,药物组合物包含至少一种特异于在AML细胞中上调(与合适的对照细胞相比)的miR基因产物的miR表达抑制剂化合物。
在其它实施方案中,本发明提供了鉴定抗AML试剂的方法,该方法包括对细胞提供受试试剂和测量与AML细胞中减少的表达水平关联的至少一种miR基因产物的水平,其中与合适的对照细胞相比,细胞中miR基因产物水平的增加表示受试试剂为抗AML试剂。在某些实施方案中,至少一种miR基因产物选自图5-6,8-18和21(表1-2,5-15和18)的任一个中所示的miRNA。在一个具体实施方案中,至少一种miR基因产物选自:miR-20,miR-25,miR-191,miR-199a,和miR-199b和其组合。
本发明还提供了鉴定抗AML试剂的方法,该方法包括给细胞提供受试试剂和测量与AML细胞中增加的表达水平关联的至少一种miR基因产物的水平,其中与合适的对照细胞相比,细胞中miR基因产物水平的减少表示受试试剂为抗AML试剂。在一个具体实施方案中,miR基因产物选自miR-29、miR-181和其组合。
本发明的其它优点、目的和特征将在下面的描述中予以部分阐述,且本领域普通技术人员在检查下述内容后其将部分地显而易见,或可以从本发明的实践中学习。如所附权利要求书特别指出的,可以实现和达到本发明的目的和优点。
附图简述
图1A-F.通过qRT-PCR来定量成熟的miRNA,验证微阵列数据。
图1A.6个AML样品相对于CD34+祖细胞的微RNA(miRNA)表达。将结果表示为用let-7i标准化(Ct)和2ΔCt转换18后AML样品中的miRNA表达相对于CD34+表达值的变化倍数(细条代表标准差)。
图1B.使用qRT-PCR验证微阵列数据。散布图显示了每个样品的miRNA微阵列表达值(2log)和标准化的qRT-PCR Oct值(对数尺度)之间的负相关(Pearson相关系数R=0.88 p<0.001)。粉色实线代表预测的Y。qRT-PCR(Ct值)越低,miRNA的表达水平越高。例如,在底部右侧的点具有低ΔCt值(高表达),且与高微阵列(芯片)值对应。
图1C.成熟的和造血定向的前体细胞中相对于CD34+干细胞的MiRNA表达。将结果表示为用18S标准化和2ΔCt转换后不同成熟的和定向的前体细胞的平均miRNA表达相对于CD34+细胞的表达的变化倍数。
图1D.根据FAB分类分组的AML样品中miR-181b的平均qRT-PCR表达;每个种类中患者样品的数目如下:M0-M1(6),M2(8)和M6M7(5)。
图1E.与其它异常核型(26)相比具有正常核型(10)的AML患者中的平均miR-10qRT-PCR表达。
图1F.通过qRT-PCR测得的具有复杂核型的患者(6)和具有其它细胞遗传异常情况的患者(22)中miR-126的平均表达。使用t检验(SPSS),对比不同组之间的miRNA表达。
图2A-D.新诊断的AML患者中与总存活率(overall survival)有关的微RNA。通过微阵列检测的具有高或低miR-20(图2A)和miR-25(图2B)表达的122位AML患者的总存活率的Kaplan-Meier估计值。使用时序检验(log-rank test)来对比存活曲线之间的差异。使用不同的技术(miRNA qRT-PCR),使用具有类似临床特征(图4(表1))的36位AML患者的独立组来验证miR-20和miR-25的结果预测力。显示出通过qRT-PCR测得的具有高或低miR-20(图2C)和miR-25(图2D)表达的36位AML患者的总存活率的Kaplan-Meier估计值。通过 Kaplan-Meier方法,得到具有95%置信区间(CI 95%)的危害比(hazardratio)。
图3A.从4位不同健康供体得到的骨髓红细胞/巨核细胞前体和外周血成熟的粒细胞/单核细胞中的miR-181b和miR-135a的平均qRT-PCR表达。将结果表示为不同谱系中的miRNA表达相对于4种CD34+细胞中miR-181b和miR-135b的表达的变化倍数。
图3B.10位具有正常核型的患者和22位具有异常核型的患者中miR-30c的平均qRT-PCR表达值。使用t检验(SPSS),对比来自两组(正常对异常核型)的miRNA表达值。
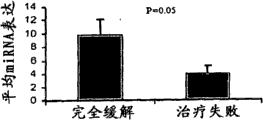
图3C.在实现完全缓解(6)或诱导化疗失败(6)的具有新诊断的AML的12位独立患者中,通过qRT-PCR测得的接受伊达比星和阿糖胞苷诱导化疗的AML患者中的平均miR-29b表达。使用t检验(SPSS),对比来自两组(完全缓解对失败)的miRNA表达值。
图4.表1.158位新诊断的AML患者的临床和细胞遗传学特征。
图5.表2.与FAB分类和细胞遗传学相关的微RNA。
图6.表3.与122位AML患者中的总存活率相关的微RNA。
图7.表4.用于微阵列数据的标准化的持家基因探针。
图8.表5.在CD 34+细胞和122位AML患者之间差异表达的MiRNA。
图9(表6).与其它AML FAB亚型相比在AML FAB M0-M1中差异表达的MiRNA。
图10.表7.在AML FAB M3[t(15;17)]中差异表达的MiRNA。
图11.表8.与其它AML相比在AML FAB M4和M5中差异表达的MiRNA。
图12.表9.与其它AML相比在AML FAB M6和M7中差异表达的MiRNA。
图13.表10.与高WBC以及外周血(PB)和骨髓(BM)母细胞(blast)相关的MiRNA。
图14.表11.与其它AML相比在正常核型AML中差异表达的 MiRNA。
图15.表12.与11q23重排相关的MiRNA。
图16.表13.与非复杂的或正常的核型相比,在具有复杂核型的患者中差异表达的MiRNA。
图17.表14.与染色体7相关的MiRNA。
图18.表15.与三体性8相关的MiRNA。
图19.表16.最初诱导化疗后首次复发或患有原发性难治病的54位AML患者的特征。
图20.表17.用伊达比星和阿糖胞苷治疗的24位患者的临床特征。
图21.表18.与对伊达比星和阿糖胞苷的响应有关的MiRNA。
发明详述
本发明部分地基于,与正常对照细胞相比在急性髓细胞白血病(AML)癌细胞中具有改变的表达的特定微RNA的鉴别,和这些微RNA与特定诊断、预后和治疗特征的关联。
如在本文中可互换使用的,“miR基因产物”、“微RNA”、“miR”或“miRNA”是指来自miR基因的未加工或已加工的RNA转录物。由于miR基因产物不翻译成蛋白质,因此术语“miR基因产物”不包括蛋白质。未加工的miR基因转录物也称为“miR前体”,其通常包括长度大约70-100个核苷酸的RNA转录物。可通过用RNA酶(例如,Dicer、Argonaut或RNA酶III(例如大肠杆菌RNA酶III))将其消化成具有活性的19至25个核苷酸的RNA分子来加工miR前体。该具有活性的19-25个核苷酸的RNA分子也称为“已加工的”miR基因转录物或“成熟的”miRNA。
可通过天然加工途径(例如使用完整的细胞或细胞裂解物)或通过合成加工途径(例如使用分离的加工酶,例如分离的Dicer、Argonaut或RNA酶III),从miR前体获得具有活性的19-25个核苷酸的RNA分子。应理解,还可通过生物或化学合成(而不用从miR前体 加工),直接产生具有活性的19-25个核苷酸的RNA分子。当在本文中用名称提及微RNA时,该名称对应着前体和成熟形式,除非另有说明。
本发明包括诊断受试者是否患有AML或处于发展AML的风险中的方法,该方法包括测量来自受试者的受试样品中至少一种miR基因产物的水平和将受试样品中的miR基因产物水平与对照样品中的相应miR基因产物水平相比较。如本文所使用的,“受试者”可以是患有或怀疑患有AML的任何哺乳动物。在一个优选的实施方案中,受试者是患有或怀疑患有AML的人。
可在从受试者获得的生物样品的细胞中,测量至少一种miR基因产物的水平。例如,可通过常规的活组织检查技术,从怀疑患有AML的受试者中取出组织样品。在另一个实施方案中,可从受试者中取出血液样品,并且可通过标准技术分离白细胞以用于DNA提取。优选在开始放射疗法、化学疗法或其它疗法之前从受试者获得血液或组织样品。可从受试者的未受影响的组织、从正常人个体或正常个体的群体或从相应于受试者的样品的大部分细胞的培养细胞获得相应的对照组织或血液样品或对照参照样品。然后将对照组织或血液样品与来自受试者的样品一起进行处理,以便可将从来自受试者的样品的细胞中给定的miR基因产生的miR基因产物的水平与来自对照样品的细胞的相应的miR基因产物的水平进行比较。可选地,可以从受试样品分开地得到和加工参照样品(例如,在不同时间),并且可以将从来自受试样品的细胞中的给定的miR基因生成的miR基因产物的水平与来自参照样品的相应miR基因产物水平相对比。
在一个实施方案中,受试样品中至少一种miR基因产物水平高于对照样品中相应的miR基因产物的水平(即,miR基因产物的表达“上调”)。如本文中所使用的,当来自受试者的细胞或组织样品中miR基因产物的量大于对照细胞或组织样品中相同基因产物的量时,miR基因产物的表达“上调”。在另一个实施方案中,受试样品中至少一种miR基因产物水平低于对照样品中相应miR基因产物的水平(即,miR 基因产物的表达“下调”)。如本文中所使用的,当从来自受试者的细胞或组织样品中的该基因产生的miR基因产物的量低于从对照细胞或组织样品中的相同基因产生的量时,miR基因的表达“下调”。可根据一个或多个RNA表达标准确定对照和正常样品中相对miR基因表达。所述标准可包括例如0miR基因表达水平、标准细胞系中的miR基因表达水平、受试者的未受影响的组织中的miR基因表达水平或之前从正常人对照群体获得的miR基因表达的平均水平。
与对照样品中相应的miR基因产物的水平相比,从受试者获得的样品中miR基因产物水平的改变(即增加或减少),指示受试者中存在AML癌。在一个实施方案中,受试样品中至少一种miR基因产物水平高于对照样品中相应的miR基因产物的水平。在另一个实施方案中,受试样品中至少一种miR基因产物水平低于对照样品中相应的miR基因产物的水平。
在某个实施方案中,至少一种miR基因产物选自本文的表和图中所示的组。
可使用适合用于检测生物样品中RNA表达水平的任何技术测量样品中miR基因产物的水平。适用于测定生物样品(例如,细胞,组织)中的RNA表达水平的技术(例如,RNA印迹分析、RT-PCR、原位杂交)对于本领域技术人员来说是熟知的。在具体的实施方案中,使用RNA印迹分析检测至少一种miR基因产物的水平。例如,可通过在核酸提取缓冲液存在的情况下进行匀浆,接着进行离心来从细胞纯化总的细胞RNA。沉淀核酸,然后通过用DNA酶处理和沉淀来除去DNA。然后按照标准技术在琼脂糖凝胶上通过凝胶电泳分离RNA分子,并将其转移至硝酸纤维素滤器。然后通过加热将RNA固定在滤器上。使用适当标记的与所述RNA互补的DNA或RNA探针进行特定RNA的检测和定量。参见,例如,Molecular Cloning:A Laboratory Manual,J.Sambrook等人,eds.,第2版,Cold Spring Harbor Laboratory Press,1989,Chapter 7,其全部公开内容通过引用合并入本文。
从本文表中提供的核酸序列,可以生成适用于特定miR基因产物 的RNA印迹杂交的探针(例如,DNA探针,RNA探针),包括、但不限于,与目标miR基因产物具有至少约70%、75%、80%、85%、90%、95%、98%或99%互补性的探针,以及与目标miR基因产物具有完全互补性的探针。标记的DNA和RNA探针的制备方法和其与靶核苷酸序列杂交的条件,描述在Molecular Cloning:A Laboratory Manual,J.Sambrook等人,eds.,第2版,Cold Spring Harbor Laboratory Press,1989,Chapters 10和11,其公开内容通过引用合并入本文。
例如,可用例如放射性核素例如3H、32P、33P、14C或35S、重金属或能够用作已标记的配体的特异性结合对成员的配体(例如,生物素、抗生物素蛋白或抗体)、荧光分子、化学发光分子、酶等来标记核酸探针。
可通过Rigby等人(1977),J.Mol.Biol.113:237-251的切口平移法或Fienberg等人(1983),Anal.Biochem.132:6-13的随机引物法(其全部公开内容通过引用合并入本文)将探针标记至高比放射性(specific activity)。后者是选择用于从单链DNA或从RNA模板合成高比放射性的32P-标记的探针的方法。例如,按照切口平移法通过用高放射性的核苷酸置换预先存在的核苷酸,可能制备具有大大超过108cpm/微克的比放射性的32P-标记的核酸探针。然后可通过将杂交滤器暴露于照相胶片来进行杂交的放射自显影检测。暴露于杂交滤器的照相胶片的光密度扫描提供了miR基因转录物水平的精确测量。使用另一个方法,可通过计算机化的成像系统例如可从AmershamBiosciences,Piscataway,NJ获得的Molecular Dynamics 400-B 2DPhosphorimager定量miR基因转录物水平。
当不能进行DNA或RNA探针的放射性核素标记时,可使用随机引物法将类似物例如dTTP类似物5-(N-(N-生物素基-ε-氨基己酰基)-3-氨基烯丙基)脱氧尿苷三磷酸掺入探针分子。可通过与结合生物素的蛋白质例如偶联至荧光染料或产生颜色反应的酶的抗生物素蛋白、链霉抗生物素蛋白和抗体(例如抗生物素抗体)反应来检测生物素化的探针寡核苷酸。
除了Northern和其它RNA杂交技术外,可使用原位杂交技术来测定RNA转录物的水平。该技术需要比Northern印迹技术更少的细胞,其包括将整个细胞置于显微镜盖玻片上和用含有放射性标记的或另外标记的核酸(例如,cDNA或RNA)探针的溶液探测细胞的核酸含量。该技术特别适合用于分析来自受试者的组织活组织检查样品。原位杂交技术的实施在美国专利5,427,916(其全部公开内容通过引用合并入本文)中进行了更详细的描述。用于给定的miR基因产物的原位杂交的合适的探针可从本文表中提供的核酸序列生产,包括、但不限于,与目标miR基因产物具有至少约70%、75%、80%、85%、90%、95%、98%或99%互补性的探针,以及与目标miR基因产物具有完全互补性的探针,如上所述。
细胞中miR基因转录物的相对数目还可通过对miR基因转录物进行逆转录,然后通过聚合酶链式反应(RT-PCR)扩增经逆转录的转录物来进行测定。可通过与内部标准例如存在于相同样品中的来自“持家”基因的mRNA的水平相比较来定量miR基因转录物的水平。用作内部标准的合适的“持家”基因包括例如,肌球蛋白或甘油醛-3-磷酸脱氢酶(G3PDH)。用于定量和半-定量RT-PCR和其变型的方法是本领域技术人员众所周知的。
在一些情况下,可能期望同时测定样品中多个不同miR基因产物的表达水平。在其它情况下,可能期望测定与癌症关联的所有已知miR基因的转录物的表达水平。评估数百种miR基因或基因产物的癌症特异性表达水平非常费时,并且需要大量的总RNA(例如,对于每一个Northern印迹需要至少20μg)和需要放射性同位素的放射自显影技术。
为了克服这些限制,可构建以微芯片形式(即,微阵列)存在的寡核苷酸文库,该文库包含一组特异于一组miR基因的寡核苷酸(例如,寡脱氧核苷酸)探针。使用该微阵列,可通过逆转录RNA以产生一组靶寡脱氧核苷酸,将它们与微阵列上的探针寡核苷酸杂交以产生杂交谱或表达谱,来测定生物样品中多个微RNA的表达水平。然后将受试 样品的杂交谱与对照样品的杂交谱比较,从而确定在AML癌细胞中具有改变的表达水平的微RNA。如本文中所使用的,“探针寡核苷酸”或“探针寡脱氧核苷酸”是指能够与靶寡核苷酸杂交的寡核苷酸。“靶寡核苷酸”或“靶寡脱氧核苷酸”是指待检测(例如,通过杂交)的分子。“miR-特异性探针寡核苷酸”或“特异于miR的探针寡核苷酸”是指具有选择用于与特定miR基因产物或特定miR基因产物的逆转录物杂交的序列的探针寡核苷酸。
特定样品的“表达谱”或“杂交谱”本质上是样品的状态指纹;虽然两种状态可能具有相似表达的任何特定基因,但同时评价大量基因允许产生对于细胞的状态是独特的基因表达谱。即,正常组织可与AML细胞相区别,并且在AML细胞内,可确定不同的预后状态(例如,良好的或不良的长期存活希望)。通过比较不同状态中AML细胞的表达谱,获得关于在这些状态的每一个状态中为重要的基因的信息(包括基因的上调或下调)。在AML细胞或正常细胞中差异表达的序列的鉴定以及导致不同预后结果的差异表达允许以许多方法使用该信息。例如,可评估特定的治疗方案(例如,确定化疗药物是否改善特定患者的长期预后)。类似地,可通过将患者样品与已知的表达谱比较来进行或确认诊断。此外,这些基因表达谱(或个体基因)允许筛选抑制AML表达谱或将不良预后谱转变成更好的预后谱的药物候选物。
因此,本发明提供了诊断受试者是否患有AML或处于发展AML的风险中的方法,该方法包括逆转录获自受试者的受试样品的RNA以提供一组靶寡脱氧核苷酸,将靶寡脱氧核苷酸与包含miRNA-特异性探针寡核苷酸的微阵列杂交以提供受试样品的杂交谱,和将受试样品杂交谱与从对照样品产生的杂交谱比较,其中至少一种miRNA的信号的改变表示受试者患有AML或处于发展AML的风险中。在一个实施方案中,微阵列包含针对所有已知的人miRNA的大部分的miRNA-特异性探针寡核苷酸。
在一个具体实施方案中,微阵列包含针对选自下述的一种或多种miRNA的miRNA-特异性探针寡核苷酸:图5-6、8-18和21(表1-2,5-15 和18)的任一个中所示的miRNA。在一个实施方案中,至少一种miR基因产物选自:miR-20,miR-25,miR-191,miR-199a,和miR-199b和其组合。
可从基因特异性寡核苷酸探针(所述探针从已知的miRNA序列产生)制备微阵列。对于各miRNA,阵列可包含两种不同的寡核苷酸探针,一种探针包含活性成熟序列,而另一种探针特异于miRNA的前体。阵列还可包含可用作杂交严格条件的对照的对照,例如与人直系同源物只相异于少数几个碱基的一个或多个小鼠序列。还可将来自两个物种的tRNA和其它RNA(例如,rRNA,mRNA)印制在微芯片上,从而为特异性杂交提供内部的、相对稳定的阳性对照。还可将用于非特异性杂交的一个或多个合适的对照包含在微芯片上。为了该目的,基于与任何已知的miRNA不存在任何同源性选择序列。
可使用本领域内已知的技术制备微阵列。例如,在位置C6上对合适长度例如40个核苷酸的探针寡核苷酸进行5’-胺修饰,并且使用可商购获得的微阵列系统例如GeneMachine OmniGridTM 100Microarrayer和Amersham CodeLinkTM活化的载玻片进行印制。通过用标记的引物逆转录靶RNA来制备相应于靶RNA的标记的cDNA寡聚物。在第一链合成后,使RNA/DNA杂交物变性以降解RNA模板。然后将所制备的标记的靶cDNA在杂交条件(例如在25℃下于6X SSPE/30%甲酰胺中进行18小时,然后在37℃下于0.75X TNT中清洗40分钟)下与微阵列芯片杂交。在阵列上的其中固定的探针DNA识别样品中的互补靶cDNA的位置上,发生杂交。标记的靶cDNA标记阵列上的其中发生结合的确切位置,从而允许自动检测和定量。输出信号由一列杂交事件组成,其标示了特定cDNA序列的相对丰度,从而标示了患者样品中相应的互补miR的相对丰度。根据一个实施方案,标记的cDNA寡聚物是从生物素标记的引物制备的生物素标记的cDNA。然后通过使用例如链霉抗生物素蛋白-Alexa647缀合物直接检测包含生物素的转录物来处理微阵列,和使用常规扫描方法扫描微阵列。阵列上的各点的图像强度与患者样品中相应的miR的丰度成比例。
使用阵列对于miRNA表达的检测具有几个有利方面。第一,可在一个时间点上鉴定相同样品中的数百个基因的整体表达。第二,通过寡核苷酸探针的仔细设计,可鉴定成熟分子和前体分子的表达。第三,与Northern印迹分析相比,芯片需要少量RNA,并且使用2.5μg总RNA可提供可重现的结果。数目相对有限的miRNA(每物种数百个)允许对数个物种构建共同的微阵列,其中对每一物种使用不同的寡核苷酸探针。这样的工具允许分析各已知的miR在不同条件下的跨物种表达。
除了用于特定miR的定量表达水平测定外,包含相应于miRNome的大部分(优选整个miRNome)的miRNA-特异性探针寡核苷酸的微芯片可用于进行miR基因表达谱分析,以分析miR的表达模式。可使不同的miR特征与已建立的疾病标记关联或直接与疾病状态关联。
按照本文中描述的表达谱分析法,对来自怀疑患有癌症(例如AML)的受试者的样品的总RNA进行定量逆转录以提供一组与样品中的RNA互补的标记的靶寡脱氧核苷酸。然后将靶寡脱氧核苷酸与包含miRNA-特异性探针寡核苷酸的微阵列杂交,从而提供样品的杂交谱。结果是显示样品中miRNA的表达模式的样品的杂交谱。杂交谱包括来自靶寡脱氧核苷酸(其来自样品)与微阵列中的miRNA-特异性探针寡核苷酸结合的信号。所述谱可记录为结合的存在或不存在(信号对0信号)。更优选地,记录的谱包括来自各杂交的信号的强度。将所述谱与从正常的(例如非癌的)对照样品产生的杂交谱相比较。信号的改变表示受试者中存在癌症或发展癌症的倾向。
用于测量miR基因表达的其它技术也在本领域技术人员的能力之内,其包括用于测量RNA转录和降解的速率的各种方法。
本发明也提供了测定具有AML癌的受试者的预后的方法,其包括,测量来自受试者的受试样品中至少一种miR基因产物的水平(其与AML的特定预后例如好的或积极的预后、差的或不利的预后相关)。根据这些方法,与对照样品中相应的miR基因产物的水平相比,受试样品中与特定预后相关的miR基因产物水平的改变,指示受试者患有具有特定预后的AML。在一个实施方案中,miR基因产物与不利(即,差)预后 相关。不利预后的实例包括、但不限于,低存活率和疾病快速进展。
在某些实施方案中,这样测量至少一种miR基因产物的水平,即通过逆转录获自受试者的受试样品的RNA以提供一组靶寡脱氧核苷酸,将该靶寡脱氧核苷酸与包含miRNA-特异性探针寡核苷酸的微阵列杂交,从而提供受试样品的杂交谱,然后将受试样品的杂交谱与从对照样品产生的杂交谱相比较来进行测量。
不希望受任何理论束缚,据信,细胞中一种或多种miR基因产物水平的改变可导致这些miR的一种或多种预期的靶失调,这可导致AML形成。因此,改变miR基因产物水平(例如,通过减少在AML癌细胞中上调的miR的水平,通过增加在AML癌细胞中下调的miR的水平)可成功地治疗AML癌。
因此,本发明包括治疗受试者的AML的方法,其中至少一种miR基因产物在受试者的细胞(例如,AML癌细胞)中失调(例如,下调、上调)。在一个实施方案中,受试样品(例如,AML癌样品)中的至少一种miR基因产物的水平大于对照样品中相应的miR基因产物的水平。在另一个实施方案中,受试样品(例如,AML癌样品)中的至少一种miR基因产物的水平小于对照样品中相应的miR基因产物的水平。当至少一种分离的miR基因产物在AML癌细胞中下调时,该方法包括施用有效量的该至少一种分离的miR基因产物或其分离的变体或生物学活性片段,从而抑制受试者中癌细胞的增殖。例如,当miR基因产物在受试者的癌细胞中下调时,对受试者施用有效量的分离的miR基因产物,可以抑制癌细胞的增殖。对受试者施用的分离的miR基因产物可以与在癌细胞中下调的内源野生型miR基因产物(例如,本文表中所示的miR基因产物)相同,或可以是其变体或生物学活性片段。
如本文定义的,miR基因产物的“变体”是指与对应的野生型miR基因产物具有小于100%同一性且具有对应的野生型miR基因产物的一种或多种生物学活性的miRNA。这样的生物学活性的实例包括、但不限于,抑制靶RNA分子的表达(例如,抑制靶RNA分子的翻译,调控靶RNA分子的稳定性,抑制靶RNA分子的加工)和抑制与AML有关的细胞 过程(例如,细胞分化,细胞生长,细胞死亡)。这些变体包括物种变体和由于miR基因中的一个或多个突变(例如,置换,缺失,插入)产生的变体。在某些实施方案中,变体与对应的野生型miR基因产物具有至少约70%、75%、80%、85%、90%、95%、98%、或99%同一性。
如本文定义的,miR基因产物的“生物学活性片段”是指具有对应的野生型miR基因产物的一种或多种生物学活性的miR基因产物的RNA片段。如上所述,这样的生物学活性的实例包括、但不限于,抑制靶RNA分子的表达和抑制与AML有关的细胞过程。在某些实施方案中,生物学活性片段的长度是至少约5,7,10,12,15,或17个核苷酸。在一个具体实施方案中,可以将分离的miR基因产物与一种或多种其它抗癌治疗组合地施用给受试者。合适的抗癌治疗包括、但不限于,化疗,放疗,和其组合(例如,放化疗(chemoradiation))。
当至少一种分离的miR基因产物在癌细胞中上调时,该方法包括给受试者施用有效量的抑制至少一种miR基因产物的表达的化合物,从而抑制AML癌细胞的增殖。这样的化合物在本文中称作抑制miR基因表达的化合物。合适的抑制miR基因表达的化合物的实例包括、但不限于,本文所述的那些(例如,双链RNA,反义核酸和酶促RNA分子)。在一个具体实施方案中,可以将抑制miR基因表达的化合物与一种或多种其它抗癌治疗组合地施用给受试者。合适的抗癌治疗包括、但不限于,化疗,放疗,和其组合(例如,放化疗)。
在一个特定实施方案中,在AML癌中失调的分离的miR基因产物选自:图5-6,8-18和21(表1-2,5-15和18)的任一个中所示的miRNA。
在一个具体实施方案中,至少一种miR基因产物选自:miR-20,miR-25,miR-191,miR-199a,和miR-199b和其组合。
如本文中所使用的,术语“治疗”、“医治”和“疗法”是指改善与疾病或病况例如AML癌相关的症状,包括预防或延迟疾病症状的发作,和/或减少疾病或病况的症状的严重度或频率。术语“受试者”和“个体”在本文中定义为包括动物例如哺乳动物,包括但不限于灵长类动物、牛、绵羊、山羊、马、狗、猫、兔子、豚鼠、大鼠、小鼠 或其它牛科、羊科、马科、犬科、猫科、啮齿目或鼠科物种。在优选实施方案中,动物是人。
如本文中所使用的,分离的miR基因产物的“有效量”是足以在患有AML癌的受试者中抑制癌细胞增殖的量。通过考虑因素例如受试者的大小和体重、疾病侵入的程度、受试者的年龄、健康和性别、施用的途径以及施用是局部的还是全身性的,本领域技术人员可容易地确定对给定的受试者施用的miR基因产物的有效量。
例如,分离的miR基因产物的有效量可基于待治疗的肿瘤块的近似重量。通过计算块的近似体积,可以确定肿瘤块的近似重量,其中1立方厘米的体积大致相对于1克。基于肿瘤块的重量的分离的miR基因产物的有效量可以在约10-500微克/g肿瘤块的范围内。在某些实施方案中,有效量可以是至少约10微克/g肿瘤块,至少约60微克/g肿瘤块或至少约100微克/g肿瘤块。
分离的miR基因产物的有效量也可基于待治疗的受试者的大致或估计的体重。优选,如本文中所描述的,胃肠外或肠内施用这样的有效量。例如,对受试者施用的分离的miR基因产物的有效量可在大约5-3000微克/kg体重、大约700-1000微克/kg体重的范围内或大于大约1000微克/kg体重。
本领域技术人员还可容易地确定用于对给定的受试者施用分离的miR基因产物的合适的给药方案。例如,可对受试者施用一次(例如,作为单次注射或沉积(deposition))miR基因产物。或者,可以每天1次或2次对受试者施用miR基因产物,进行大约3至大约28天,特别地大约7至大约10天的时期。在特定的给药方案中,每天1次施用miR基因产物,进行7天。当给药方案包括多次施用时,应理解,对受试者施用的miR基因产物的有效量可包括在整个给药方案中施用的基因产物的总量。
如本文中使用的,“分离的”miR基因产物是合成的或通过人工介入从天然状态改变或取出的miR基因产物。例如,合成的miR基因产物,或部分或完全从其天然状态的共存材料分离的miR基因产物被 认为是“分离的”。分离的miR基因产物可以以大体上纯化的形式存在,或可以存在于已将所述miR基因产物递送入其中的细胞中。因此,有意地被递送至细胞或在细胞中表达的miR基因产物被认为是“分离的”miR基因产物。在细胞内从miR前体分子产生的miR基因产物也被认为是“分离的”分子。根据本发明,本文所述的分离的miR基因产物可以用于制备用于治疗受试者(例如,人)的AML癌的药剂。
分离的miR基因产物可使用许多标准技术获得。例如,可使用本领域已知的方法化学合成或重组产生miR基因产物。在一个实施方案中,使用适当保护的核糖核苷亚磷酰胺和常规的DNA/RNA合成仪化学合成miR基因产物。合成的RNA分子或合成试剂的提供商包括例如Proligo(Hamburg,Germany)、Dharmacon Research(Lafayette,CO,U.S.A.)、Pierce Chemical(part of Perbio Science,Rockford,IL,U.S.A.)、Glen Research(Sterling,VA,U.S.A.)、ChemGenes(Ashland,MA,U.S.A.)和Cruachem(Glasgow,UK)。
或者,可使用任何合适的启动子从重组环形或线性DNA质粒表达miR基因产物。用于从质粒表达RNA的合适的启动子包括例如U6或H1RNA pol III启动子序列或巨细胞病毒启动子。其它合适启动子的选择在本领域技术人员的能力之内。本发明的重组质粒还可包括用于在癌细胞中表达miR基因产物的诱导型或可调控的启动子。
可通过标准技术从培养的细胞表达系统分离从重组质粒表达的miR基因产物。还可将从重组质粒表达的miR基因产物递送至癌细胞并且在其中直接表达。下面更详细地论述重组质粒将miR基因产物递送至癌细胞的用途。
miR基因产物可从分开的重组质粒表达,或它们可从相同的重组质粒表达。在一个实施方案中,miR基因产物从单个质粒表达为RNA前体分子,然后通过合适的加工系统(包括但不限于癌细胞中现有的加工系统)将该前体分子加工成功能性miR基因产物。其它合适的加工系统包括例如体外果蝇细胞裂解物系统(例如,如属于Tuschl等人的美国公开专利申请2002/0086356中所描述的,其全部公开内容通过 引用合并入本文)和大肠杆菌RNA酶III系统(例如,如属于Yang等人的美国公开专利申请2004/0014113中所描述的,其全部公开内容通过引用合并入本文)。
适合用于表达miR基因产物的质粒的选择、用于将核酸序列插入质粒以表达基因产物的方法以及将重组质粒递送至目的细胞的方法在本领域技术人员的能力之内。参见,例如,Zeng等人(2002),Molecular Cell 9:1327-1333;Tuschl(2002),Nat.Biotechnol,20:446-448;Brummelkamp等人(2002),Science 296:550-553;Miyagishi等人(2002),Nat.Biotechnol.20:497-500;Paddison等人(2002),Genes Dev.16:948-958;Lee等人(2002),Nat.Biotechnol.20:500-505;和Paul等人(2002),Nat.Biotechnol.20:505-508,其全部公开内容通过引用合并入本文。
在一个实施方案中,表达miR基因产物的质粒包含在CMV立即早期启动子(intermediate-early promoter)控制下编码miR前体RNA的序列。如本文中所使用的,“在启动子的控制下”是指编码miR基因产物的核酸序列位于启动子的3′端,以便启动子可起始miR基因产物编码序列的转录。
miR基因产物还可从重组病毒载体表达。预期miR基因产物可从两个分开的重组病毒载体或从相同的病毒载体表达。可通过标准技术从培养的细胞表达系统分离从重组病毒载体表达的RNA或所述RNA可在癌细胞中直接表达。下面更详细地论述重组病毒载体将miR基因产物递送至癌细胞的用途。
本发明的重组病毒载体包含编码miR基因产物的序列和用于表达RNA序列的任何合适的启动子。合适的启动子包括、但不限于U6或H1RNA pol III启动子序列,或巨细胞病毒启动子。其它合适的启动子的选择在本领域技术人员的能力之内。本发明的重组病毒载体还可包含用于在癌细胞中表达miR基因产物的诱导型或可调控的启动子。
可使用能够接受miR基因产物的编码序列的任何病毒载体;例如,来源于腺病毒(AV)、腺伴随病毒(AAV)、逆转录病毒(例如,慢病毒 (LV)、弹状病毒(Rhabdoviruses)、鼠白血病病毒)、疱疹病毒等的载体。可通过用来自其它病毒的包膜蛋白或其它表面抗原假型化载体或通过置换不同的病毒衣壳蛋白(如果合适)来改变病毒载体的趋向性。
例如,可用来自水泡性口膜炎病毒(VSV)、狂犬病病毒(rabies)、埃博拉病毒(Ebola)、莫科拉病毒(Mokola)等的表面蛋白假型化本发明的慢病毒载体。可通过对载体进行工程改造以表达不同的衣壳蛋白血清型来制备本发明的AAV载体,使之靶向不同的细胞。例如,表达血清型2型基因组上的血清型2型衣壳的AAV载体称为AAV 2/2。AAV 2/2载体中的该血清型2型衣壳基因可用血清型5型衣壳基因替换,从而产生AAV 2/5载体。用于构建表达不同衣壳蛋白血清型的AAV载体的技术在本领域技术人员的能力之内;参见,例如,Rabinowitz,J.E.,等人(2002),J.Virol.76:791-801,其全部公开内容通过引用合并入本文。
适合用于本发明的重组病毒载体的选择、用于将用于表达RNA的核酸序列插入载体的方法、将病毒载体递送至目的细胞的方法和表达的RNA产物的回收在本领域技术人员的能力之内。参见,例如,Dornburg(1995),Gene Therap.2:301-310;Eglitis(1988),Biotechniques 6:608-614;Miller(1990),Hum.Gene Therap.1:5-14;和Anderson(1998),Nature 392:25-30,其全部公开内容通过引用合并入本文。
特别合适的病毒载体是来源于AV和AAV的载体。用于表达miR基因产物的合适的AV载体、用于构建重组AV载体的方法以及用于将载体递送至靶细胞的方法描述于Xia等人(2002),Nat.Biotech.20:1006-1010,其全部公开内容通过引用合并入本文。用于表达miR基因产物的合适的AAV载体、用于构建重组AAV载体的方法以及用于将载体递送至靶细胞的方法描述于Samulski等人(1987),J.Virol.61:3096-3101;Fisher等人(1996),J.Virol,70:520-532;Samulski等人(1989),J.Virol.63:3822-3826;美国专利 5,252,479;美国专利5,139,941;国际专利申请WO 94/13788;和国际专利申请WO 93/24641,其全部公开内容通过引用合并入本文。在一个实施方案中,从包含CMV立即早期启动子的单个重组AAV载体表达miR基因产物。
在某些实施方案中,本发明的重组AAV病毒载体包含在人U6 RNA启动子控制下的与polyT终止序列有效连接的编码miR前体RNA的核酸序列。如本文中所使用的,“与polyT终止序列有效连接”是指编码有义或反义链的核酸序列以5′方向与polyT终止信号紧密邻接。在从载体转录miR序列的过程中,polyT终止信号用于终止转录。
在本发明的治疗方法的其它实施方案中,可对受试者施用有效量的至少一种抑制miR表达的化合物。如本文中所使用的,“抑制miR表达”是指治疗后miR基因产物的前体和/或有活性的成熟形式的产量低于治疗前产生的量。通过使用例如本文讨论的测定miR转录物水平的技术,本领域技术人员可容易地确定miR的表达在癌细胞中是否已被抑制。抑制可在基因表达的水平上(即,通过抑制编码miR基因产物的miR基因的转录)或在加工的水平上(例如,通过抑制miR前体至成熟的活性miR的加工)发生。
如本文中所使用的,抑制miR表达的化合物的“有效量”是足以在患有癌症(例如,AML癌)的受试者中抑制癌细胞的增殖的量。通过考虑因素,例如受试者的大小和体重、疾病侵入的程度、受试者的年龄、健康和性别、施用的途径以及施用是局部的还是全身性的,本领域技术人员可容易地确定对给定的受试者施用的抑制miR表达的化合物的有效量。
例如,抑制表达的化合物的有效量可基于待治疗的肿瘤块的近似重量,如本文所述。抑制miR表达的化合物的有效量也可基于待治疗的受试者的大致或估计的体重,如本文所述。
本领域技术人员还可容易地确定用于对给定的受试者施用抑制miR表达的化合物的合适的给药方案,如本文所述。
用于抑制miR基因表达的合适的化合物包括双链RNA(例如短的 或小干扰RNA或“siRNA”)、反义核酸和酶促RNA分子例如核酶。这些化合物中的每一种可被靶向给定的miR基因产物,并且干扰靶miR基因产物的表达(例如,通过抑制翻译,通过诱导切割和/或降解)。
例如,给定的miR基因的表达可通过用分离的双链RNA(“dsRNA”)分子诱导miR基因的RNA干扰来抑制,所述双链RNA分子与miR基因产物的至少一部分具有至少90%、例如至少95%、至少98%、至少99%或100%的序列同源性。在具体的实施方案中,dsRNA分子是“短的或小干扰RNA”或“siRNA”。
用于本方法的siRNA包括长度大约17个核苷酸至大约29个核苷酸、优选长度大约19至大约25个核苷酸的短双链RNA。siRNA包含通过标准Watson-Crick碱基配对相互作用(在下文中“碱基配对”)退火在一起的有义RNA链和互补反义RNA链。有义链包含与靶miR基因产物内包含的核酸序列大体上同一的核酸序列。
如本文中所使用的,si RNA中与靶mRNA内包含的靶序列“大体上同一”的核酸序列是与靶序列同一的核酸序列或与靶序列相异于1或2个核苷酸的核酸序列。siRNA的有义和反义链可包括两个互补的单链RNA分子或可包括其中两个互补部分碱基配对并且通过单链“发夹结构”区域共价连接的单个分子。
siRNA还可以是与天然存在的RNA相异于一个或多个核苷酸的添加、缺失、置换和/或改变的经改变的RNA。这样的改变可包括非核苷酸材料的添加,例如至siRNA的末端或至siRNA的一个或多个内部核苷酸的添加,或使siRNA抵抗核酸酶降解的修饰或用脱氧核糖核苷酸对siRNA中的一个或多个核苷酸的置换。
siRNA的一条或两条链还可包含3′突出端。如本文中所用的,“3′突出端”是指从双链RNA链的3′-末端延伸的至少一个未配对的核苷酸。因此,在某些实施方案中,siRNA包含至少一个长度为1至大约6个核苷酸(其包括核糖核苷酸或脱氧核糖核苷酸)、长度为1至大约5个核苷酸、长度为1至大约4个核苷酸或长度为大约2至大约4个核苷酸的3′突出端。在具体的实施方案中,3′突出端存在于siRNA的 两条链上,且其长度为2个核苷酸。例如,siRNA的各条链可包含二胸苷酸(“TT”)或二尿苷酸(“uu”)的3′突出端。
siRNA可通过化学或生物方法产生,或可从重组质粒或病毒载体表达,如上文对分离的miR基因产物所描述的。用于产生和检测dsRNA或siRNA分子的示例性方法描述于属于Gewirtz的美国公开专利申请2002/0173478和属于Reich等人的美国公开专利申请2004/0018176,二者的全部公开内容通过引用合并入本文。
给定的miR基因的表达还可通过反义核酸抑制。如本文中所使用的,“反义核酸”是指通过RNA-RNA或RNA-DNA或RNA-肽核酸相互作用与靶RNA结合的核酸分子,其改变靶RNA的活性。适合用于本方法的反义核酸是通常包含与miR基因产物中的连续核酸序列互补的核酸序列的单链核酸(例如,RNA、DNA、RNA-DNA嵌合物、肽核酸(PNA))。反义核酸可包含与miR基因产物中的连续核酸序列50-100%互补、75-100%互补或95-100%互补的核酸序列。本文表中提供了特定人miR基因产物的核酸序列。不希望受任何理论束缚,据信,反义核酸激活RNA酶H或降解miR基因产物/反义核酸双链体的另一种细胞核酸酶。
反义核酸还可包含对核酸主链或对糖和碱基部分(或它们的等价物)的修饰,从而增加靶特异性、核酸酶抗性、递送或与分子的功效相关的其它性质。此类修饰包括胆固醇部分、双链体插入剂例如吖啶或一种或多种抗核酸酶基团。
反义核酸可通过化学或生物方法产生,或可从重组质粒或病毒载体表达,如上文对分离的miR基因产物所描述的。用于产生和检测的示例性方法在本领域技术人员的能力之内;参见,例如,Stein和Cheng(1993),Science 261:1004以及属于Woolf等人的美国专利5,849,902,其全部公开内容通过引用合并入本文。
给定的miR基因的表达还可通过酶促核酸(enzymatic nucleicacid)抑制。如本文中所使用的“酶促核酸”是指包含与miR基因产物的连续核酸序列具有互补性的底物结合区并且能够特异性切割miR基因产物的核酸。酶促核酸底物结合区可以例如与miR基因产物中的 连续核酸序列50-100%互补、75-100%互补或95-100%互补。酶促核酸还可包括在碱基、糖和/或磷酸基团上的修饰。用于本方法的示例性酶促核酸是核酶。
酶促核酸可通过化学或生物方法产生,或可从重组质粒或病毒载体表达,如上文对分离的miR基因产物所描述的。用于产生和检测dsRNA或siRNA分子的示例性方法描述于Werner和Uhlenbeck(1995),Nucl.Acids Res.23:2092-96;Hammann等人(1999),Antisense andNucleic Acid Drug Dev.9:25-31;以及属于Cech等人的美国专利4,987,071,其全部公开内容通过引用合并入本文。
至少一种miR基因产物或至少一种用于抑制miR表达的化合物的施用将在患有癌症(例如,AML)的受试者中抑制癌细胞的增殖。如本文中所使用的,“抑制癌细胞的增殖”是指杀死细胞或永久性或暂时地阻止或减缓细胞的生长。如果受试者中癌细胞的数目在施用miR基因产物或抑制miR基因表达的化合物后保持恒定或减少,那么可推断癌细胞增殖被抑制。如果癌细胞的绝对数目增加但肿瘤生长的速度下降,则也可推断癌细胞增殖被抑制。
受试者体内的癌细胞数目可通过直接测量或通过对原发性或转移性肿瘤块的大小的估计来确定。例如,受试者中癌细胞的数目可通过免疫组织学方法、流式细胞术或经设计用于检测癌细胞的特征表面标记的其它技术来测量。
可通过适合用于将此类化合物递送至受试者的癌细胞的任何方法来对受试者施用miR基因产物或抑制miR基因表达的化合物。例如,可通过适合于用此类化合物或用包含编码此类化合物的序列的核酸转染受试者的细胞的方法来施用miR基因产物或抑制miR表达的化合物。在一个实施方案中,用包含编码至少一种miR基因产物或抑制miR基因表达的化合物的序列的质粒或病毒载体转染细胞。
用于真核细胞的转染方法在本领域内是熟知的,包括例如核酸至细胞的细胞核或前核(pronucleus)的直接注射、电穿孔、脂质体转移和由亲脂材料介导的转移、受体介导的核酸递送、基因枪或微粒加 速、磷酸钙沉淀以及由病毒载体介导的转染。
例如,细胞可用质脂体转移化合物例如DOTAP(N-[1-(2,3-二油酰氧基)丙基]-N,N,N-三甲基-甲基硫酸铵,Boehringer-Mannheim)或等价物例如LIPOFECTIN进行转染。使用的核酸的量对于实施本发明不是至关重要的;可接受的结果可用0.1-100微克核酸/105个细胞来获得。例如,可使用在3微克DOTAP中的大约0.5微克质粒载体/105个细胞的比例。
还可通过任何合适的肠内或胃肠外施用途径对受试者施用miR基因产物或抑制miR基因表达的化合物。用于本方法的合适的肠内施用途径包括例如口服、直肠或鼻内给药。合适的胃肠外施用途径包括例如血管内给药(例如,静脉内团注(bolus injection)、静脉内输注、动脉内团注、动脉内输注和至脉管系统内的导管滴注);组织外周(peri-tissue)和组织内注射(例如,肿瘤外周和肿瘤内注射,视网膜内注射或视网膜下注射);皮下注射或沉积,包括皮下输注(例如通过渗透泵);对目的组织的直接施用,例如通过导管或其它安置装置(例如,视网膜丸剂(retinal pellet)或栓剂或包含多孔的、无孔的或凝胶状材料的植入物);以及吸入。特别合适的施用途径是注射、输注和直接注射进肿瘤。
在本方法中,miR基因产物或抑制miR基因产物表达的化合物可以作为裸RNA、与递送试剂一起或作为包含表达miR基因产物或抑制miR基因表达的化合物的序列的核酸(例如,重组质粒或病毒载体)对受试者进行施用。合适的递送试剂包括例如Mirus Transit TKO亲脂试剂、LIPOFECTIN、lipofectamine、cellfectin、聚阳离子(例如,多聚赖氨酸)和脂质体。
本文中公开了和/或本领域熟知包含表达miR基因产物或抑制miR基因表达的化合物的序列的重组质粒和病毒载体、以及用于将此类质粒和载体递送至癌细胞的技术。
在具体的实施方案中,脂质体用于将miR基因产物或抑制miR基因表达的化合物(或包含编码它们的序列的核酸)递送至受试者。脂质 体还可增加基因产物或核酸的血液半衰期。可从标准的形成小囊泡的脂质形成用于本发明的合适的脂质体,所述脂质通常包括中性的或带负电荷的磷脂和固醇例如胆固醇。脂质的选择通常通过考虑因素例如期望的脂质体大小和脂质体在血流中的半衰期来进行指导。已知许多用于制备脂质体的方法,例如如Szoka等人(1980),Ann.Rev.Biophys.Bioeng.9:467;和美国专利4,235,871、4,501,728、4,837,028和5,019,369(其全部公开内容通过引用合并入本文)中所描述的方法。
用于本方法的脂质体可包含将脂质体靶向癌细胞的配体分子。结合癌细胞中普遍的受体的配体例如结合肿瘤细胞抗原的单克隆抗体是优选的。
用于本方法的脂质体还可进行修饰以避免被单核巨噬细胞系统(“MMS”)和网状内皮系统(“RES”)清除。此类经修饰的脂质体在表面具有调理作用-抑制部分或所述部分被整合入脂质体结构。在特别优选实施方案中,本发明的脂质体可包含调理作用-抑制部分和配体。
用于制备本发明的脂质体的调理作用-抑制部分通常是与脂质体膜结合的巨大的亲水聚合物。如本文中所使用的,调理作用-抑制部分,当其通过化学或物理方式(例如通过将脂溶性锚嵌入膜本身或通过与膜脂质的活性基团直接结合)附着至膜时,与脂质体膜“结合”。此类抑制调理作用的亲水聚合物形成了显著减少脂质体被MMS和RES吸收的保护性表面层;例如,如美国专利4,920,016中所描述的,其全部公开内容通过引用合并入本文。
适合于修饰脂质体的调理作用-抑制部分优选是具有大约500至大约40,000道尔顿,更优选大约2,000至大约20,000道尔顿的数量平均分子量的水溶性聚合物。此类聚合物包括聚乙二醇(PEG)或聚丙二醇(PPG)或其衍生物;例如甲氧基PEG或PPG以及PEG或PPG硬脂酸酯;合成的聚合物,例如聚丙烯酰胺或聚N-乙烯基吡咯烷酮;线性的、分支的或树枝状聚酰胺胺;聚丙烯酸;多元醇,例如与羧基或氨基化学连接的聚乙烯醇和聚木糖醇,以及神经节苷脂,例如神经节苷脂 GM1。PEG、甲氧基PEG或甲氧基PPG或其衍生物的共聚物也是合适的。此外,抑制调理作用的聚合物可以是PEG和多聚氨基酸、多糖、聚酰胺胺、聚乙烯胺或多聚核苷酸的嵌段共聚物。抑制调理作用的聚合物还可以是包含氨基酸或羧酸的天然多糖,例如半乳糖醛酸、葡糖醛酸、甘露糖醛酸、透明质酸、果胶酸、神经氨酸、褐藻酸、角叉菜胶(carrageenan);胺化的多糖或低聚糖(线性或分支的);或羧基化的多糖或低聚糖,例如与具有所得的羧基的连接的碳酸的衍生物反应的多糖或低聚糖。优选,调理作用-抑制部分是PEG、PPG或其衍生物。用PEG或PEG-衍生物修饰的脂质体有时称为“PEG化脂质体”。
可通过许多熟知的技术中的任一种将调理作用-抑制部分结合至脂质体膜。例如,可将PEG的N-羟基琥珀酰亚胺酯与磷脂酰乙醇胺脂质可溶性锚结合,然后再与膜结合。类似地,可使用Na(CN)BH3和溶剂混合物(例如以30∶12比例的四氢呋喃和水)在60℃下通过还原胺化作用,用硬脂酰胺脂质可溶性锚衍生葡聚糖(dextran)聚合物。
用调理作用-抑制部分修饰的脂质体在循环中比未修饰的脂质体保持更长时间。因此,此类脂质体有时称为“隐形(stealth)”脂质体。已知隐形脂质体在通过多孔或“渗漏”微脉管系统饲喂的组织中积累。因此,由此类微脉管系统缺陷表征的组织例如实体瘤(例如,AML癌)将有效地积累这些脂质体;参见Gabizon,等人(1988),Proc.Natl.Acad.Sci.,U.S.A.,18:6949-53。此外,减少的通过RES的吸收通过阻止脂质体在肝和脾中的大量积累来降低隐形脂质体的毒性。因此,用调理作用-抑制部分修饰的脂质体特别适合用于将miR基因产物或抑制miR基因表达的化合物(或包含编码它们的序列的核酸)递送至肿瘤细胞。
可在对受试者施用前,按照本领域已知的技术将miR基因产物或抑制miR基因表达的化合物配制为药物组合物,有时称为“药剂”。因此,本发明包括用于治疗AML癌的药物组合物。在一个实施方案中,药物组合物包含至少一种分离的miR基因产物、或分离的其变体或生物学活性片段和药学上可接受的载体。在具体的实施方案中,该至少 一种miR基因产物相应于与适合的对照细胞相比在AML癌细胞中具有减少的表达水平的miR基因产物。
在其它实施方案中,本发明的药物组合物包括至少一种抑制miR表达的化合物。在具体的实施方案中,至少一种抑制miR基因表达的化合物特异于其在AML癌细胞中的表达高于对照细胞的miR基因。
本发明的药物组合物表征为是至少无菌的和无热原的。如本文中所使用的,“药物组合物”包括用于人和兽医用途的制剂。用于制备本发明的药物组合物的方法在本领域技术人员的能力之内,例如在Remington′s Pharmaceutical Science,第17版,Mack PublishingCompany,Easton,PA.(1985)中所描述的,其全部分公开内容通过引用合并入本文。
本药物组合物包含与药学上可接受的载体混合的至少一种miR基因产物或抑制miR基因表达的化合物(或至少一种包含编码miR基因产物或抑制miR基因表达的化合物的序列的核酸)(例如,按重量计算0.1至90%)或其生理上可接受的盐。在某些实施方案中,本发明的药物组合物另外包含一种或多种抗癌剂(例如,化疗剂)。本发明的药物制剂还可包含由脂质体封装的至少一种miR基因产物或抑制miR基因表达的化合物(或至少一种包含编码miR基因产物或抑制miR基因表达的化合物的序列的核酸)和药学上可接受的载体。在一个实施方案中,所述药物组合物包含其不是miR-15,miR-16,miR-143和/或miR-145的miR基因或基因产物。
特别适合的药学上可接受的载体是水、缓冲水溶液、常用盐溶液、0.4%的盐溶液、0.3%的甘氨酸、透明质酸等。
在具体的实施方案中,本发明的药物组合物包含抗核酸酶降解的至少一种miR基因产物或抑制miR基因表达的化合物(或至少一种包含编码miR基因产物或抑制miR基因表达的化合物的序列的核酸)。本领域技术人员可以例如通过将一个或多个在2′-位置被修饰的核糖核苷酸掺入miR基因产物来容易地合成具有核酸酶抗性的核酸。合适的2′-修饰的核糖核苷酸包括在2′-位置用氟、氨基、烷基、烷氧基和 O-烯丙基修饰的核糖核苷酸。
本发明的药物组合物还可包含常规药物赋形剂和/或添加剂。合适的药物赋形剂包括稳定剂、抗氧化剂、重量摩尔渗透压浓度调节剂、缓冲剂和pH调节剂。合适的添加剂包括例如生理上生物相容性缓冲剂(例如,氨丁三醇盐酸盐)、螯合剂(例如,DTPA或DTPA-双酰胺)或钙螯合络合物(例如,钙DTPA、CaNaDTPA-双酰胺)的添加或任选地,钙或钠盐(例如,氯化钙、抗坏血酸钙、葡萄糖酸钙或乳酸钙)的添加。本发明的药物组合物可以以液体形式包装使用或可以进行冻干。
对于本发明的固体药物组合物,可使用常规无毒性的固体的药学上可接受的载体:例如药物级的甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、滑石、纤维素、葡萄糖、蔗糖、碳酸镁等。
例如,用于口服施用的固体药物组合物可包含上文所列的任何载体和赋形剂以及10-95%,优选25%-75%的至少一种miR基因产物或抑制miR基因表达的化合物(或至少一种包含编码它们的序列的核酸)。用于气雾剂(吸入)施用的药物组合物可包含按重量计算0.01-20%,优选1%-10%的封装在上文所述的脂质体中的至少一种miR基因产物或抑制miR基因表达的化合物(或至少一种包含编码miR基因产物或抑制miR基因表达的化合物的序列的核酸)和喷射剂。还可如所期望的包含载体例如卵磷脂以用于鼻内递送。
本发明的药物组合物还可以包含一种或多种抗癌剂。在一个具体实施方案中,所述组合物包含至少一种miR基因产物或抑制miR基因表达的化合物(或至少一种包含编码miR基因产物或抑制miR基因表达的化合物的序列的核酸)和至少一种化疗剂。适用于本发明方法的化疗剂包括、但不限于,DNA-烷化剂,抗肿瘤抗生素,抗代谢剂,微管蛋白稳定剂,微管蛋白去稳定剂,激素拮抗剂,拓扑异构酶抑制剂,蛋白激酶抑制剂,HMG-CoA抑制剂,CDK抑制剂,细胞周期蛋白抑制剂,胱天蛋白酶抑制剂,金属蛋白酶抑制剂,反义核酸,三螺旋DNA,核酸适配体,和分子上修饰的病毒、细菌和外毒素剂。适用于本发明组合物的试剂的实例包括、但不限于,胞苷阿拉伯糖苷,甲氨蝶呤,长春 新碱,依托泊苷(VP-16),多柔比星(阿霉素),顺铂(CDDP),地塞米松,arglabin,环磷酰胺,沙可来新,甲基亚硝脲,氟尿嘧啶,5-氟尿嘧啶(5FU),长春碱,喜树碱,放线菌素-D,丝裂霉素C,过氧化氢,奥沙利铂,伊立替康,托泊替康,亚叶酸,卡莫司汀,链佐星,CPT-11,紫杉酚,他莫昔芬,达卡巴嗪,利妥昔单抗,柔红霉素,1-β-D-阿糖呋喃糖胞嘧啶(1-β-D-arabinofuranosylcytosine),伊马替尼,氟达拉滨,多西他赛和FOLFOX4。
本发明还包括鉴定抗AML癌试剂的方法,该方法包括给细胞提供受试试剂和测量细胞中至少一种miR基因产物的水平。在一个实施方案中,该方法包括给细胞提供受试试剂和测量与AML癌细胞中减少的表达水平关联的至少一种miR基因产物的水平。与合适的对照(例如,对照细胞中miR基因产物的水平)相比,细胞中miR基因产物水平的增加指示受试试剂为抗AML癌试剂。
在一个具体实施方案中,与AML癌细胞中降低的表达水平有关的至少一种miR基因产物选自:图5-6,8-18和21(表1-2,5-15和18)的任一个中所示的miRNA和其组合。
在其它实施方案中,该方法包括给细胞提供受试试剂和测量与AML癌细胞中增加的表达水平关联的至少一种miR基因产物的水平。与合适的对照(例如,对照细胞中miR基因产物的水平)相比,细胞中miR基因产物水平的降低指示受试试剂为抗AML癌试剂。
在一个具体实施方案中,与AML癌细胞中增加的表达水平有关的至少一种miR基因产物选自:miR-20,miR-25,miR-191,miR-199a5和miR-199b和其组合。
合适的试剂包括但不限于药物(例如,小分子、肽)和生物大分子(例如,蛋白质、核酸)。试剂可通过重组、合成产生,或其可从天然来源分离(即,纯化)。用于给细胞提供此类试剂的各种方法(例如,转染)在本领域内是熟知的,并且在上文中描述了几种此类方法。用于检测至少一种miR基因产物的表达的方法(例如,RNA印迹、原位杂交、RT-PCR、表达谱分析)在本领域内也是熟知的。本文也描述了这些 方法中的几种。
现将通过下列非限定性实施例来说明本发明。
实施例
方法
患者和细胞样品。根据惯例指南(institutional guideline)签署知情同意书后,从在MD Anderson Cancer Center的Cell and TissueBank(n=202)和Thomas Jefferson University(n=10),得到158份来自新诊断的AML患者的白血病样品和54份来自处于复发(34)或患有难治病(20)的AML患者的样品(图4(表1))。
收集骨髓或外周血样品,通过Ficoll-Hypaque(Nygaard)梯度离心来制备,并冷藏保存。如前所述16,进行样品的细胞遗传分析。用于描述细胞遗传克隆和核型的标准遵循人细胞遗传命名法国际系统(International System for Human Cytogenetic Nomenclature)的推荐17。使用36位AML患者的独立组,使用qRT-PCR验证微阵列内的miRNA特征(图4(表1))。通过骨髓抽吸物中<5%的母细胞的存在、绝对外周嗜中性粒细胞数>1X109/l和血小板>100x109/l,定义完全缓解(CR)。
除了CD34+(10位供体)以外,从Allcells购买外周血成熟粒细胞和单核细胞、骨髓CD71+选择的红细胞前体和来自4位健康供体的CD34+细胞。如前所述18,得到体外分化的巨核细胞。
RNA提取和miRNA微阵列实验。
如别处详细描述的19,进行RNA提取和miRNA微芯片实验。简而言之,使来自176位AML患者的5ug总RNA一式四份地与对应于250个人成熟和前体miRNA的探针(如2005年11月miRBase(http://microrna.sanger.ac.uk)所述)20杂交。
微RNA的实时定量。
选择如前所述21的使用PCR 9700Thermocycler ABI Prism 7900HT和序列检测系统(Applied Biosystems)的单管TaqMan miRNA,因为它 在微阵列患者数据集合中具有最小的表达变异性。一式三份地进行对比实时PCR,包括无模板对照。使用比较Ct方法,计算相对表达。
数据分析。
使用GENEPIX PRO分析微阵列图像。当测得在至少10%样品中存在时,将每个miRNA的重复点的平均值减去背景,进行log2转化,标准化,并保持在表达表中。针对印制在芯片上的散布于miRNA探针中的一组持家基因(图7(表4))进行标准化。在两类的对比(即,CD34对AML)中,使用在微阵列显著性分析(SAM)内的检验程序22,鉴别出差异表达的miRNA。SAM在相对于所有测量的标准偏差的表达变化的基础上,计算每个基因的评分。由于这是多重检验,进行排列来计算假发现率(false discovery rate)(FDR)或q-值。将具有小于5%的FDR和超过2的变化倍数的MiRNA考虑用于进一步分析。使用MIAMExpress,将所有数据呈递给Array Express数据库(登记号未定)。
统计分析。
使用Fisher精确检验(Fisher’s exact test)、t检验和卡方检验(chi-square)来对比患者组之间的基线特征和平均miRNA表达。所有报道的P值是双侧的并且通过使用SPSS软件包(SPSS 10.0)得到。计算从诊断时直到最后一次随访时的总存活率,并计算从诊断时直到复发或死亡的无事件存活率(event-free survival)(EFS)。检查在最后一次随访时存活的患者的数据。为了进行存活和建立Kaplan-Meier(KM)图,通过将样品分成2类(高和低表达,根据整组样品中的中值(median)表达),将通过qRT-PCR和在芯片上测量的miRNA水平转化成离散变量。得到每个组的存活曲线,并通过使用时序检验进行对比。还报道了从KM方法得到的具有95%置信区间的危害比。
靶预测和微阵列验证
数据验证。为了验证微阵列数据,使用在10位患者中的42个miRNA测量,使用Pearson关联和线性回归分析(SPSS软件)。这些函数检查每对测量(一个来自芯片,另一个来自RT-PCR),以确定两个变量是否倾向于一起移动,即来自芯片的大r值(高表达)是否与来自qRT-PCR 的低值(δCt)相关。预期负相关,因为qRT-PCR值(δCt)反比于miRNA的表达水平。使用芯片和qRT-PCR miRNA测量值的Log值。
靶预测。使用TARGETSCAN32(www.genes.mit.edu/targetscan)和PICTAR33(www.pictar.bio.nyu.edu),在计算机上预测微RNA靶,所述两个数据库都预测保守的3′UTR miRNA靶。
结果
AML患者显示出与正常CD34+祖细胞相比不同的miRNA表达谱。
作为理解miRNA在AML发病机理中的可能作用的第一步,我们使用miRNA微阵列平台19,分析了122个新诊断的AML患者样品和来自10个不同供体的CD34+细胞中的miRNA表达(图4(表1)中的临床数据)。SAM仅鉴别出与CD34+细胞相比在AML样品中下调的miRNA(表S2,支持信息)。我们使用qRT-PCR证实了许多这些差异表达的miRNA(图1A)。另外,为了验证微阵列平台,我们对在芯片上高、中等和低表达的miRNA进行qRT-PCR。如图1B所示,通过微阵列或qRT-PCR测得的miRNA水平非常一致,2个平台的测量值之间存在非常显著的关联(r=0.88,p<0.001)。
miRNA特征与造血分化和FAB分类相关联
已经显示,miRNA表达提示肿瘤的造血发育谱系和分化阶段11。由于不同的谱表征AML患者中的正常和恶性细胞,我们通过qRT-PCR测定AML样品和人造血细胞组(包括成熟的粒细胞和单核细胞,以及红细胞和巨核细胞前体)中的CD34+细胞之间最差异表达的miRNA的表达模式。许多在AML中下调的miRNA也在成熟和前体造血细胞中下调(图1C和3A)。2个近期的研究已经描述了在CD34+细胞体外分化成几个谱系的过程中miRNA普遍下调18,23。这些结果暗示,白血病中miRNA的子集紧密遵循正常造血中miRNA表达的分化模式。如果miRNA反映白血病患者中的细胞分化阶段,那么它们也应与AML的法-美和英(FAB)分类相关24,所述分类基于细胞形态学和免疫表型,二者都与白血病的分化阶段密切相关。实际上,我们鉴别出与FAB分类有关的特征(图9-12,表6-9)。在FAB M0-M1内,我们鉴别出几个miR-181家族成员, 以及在CD34+细胞中高表达的其它miRNA,这暗示表达谱与干细胞的表达谱更接近(图9(表6))。miR-181b的表达实际上在来自所有谱系的成熟的和定向的前体造血细胞中下调(图3A),并且在最分化的白血病如FAB M6-M7中观察到类似的结果(图1D)。
MiRNA与白细胞和母细胞计数正相关
我们然后研究了miRNA是否与治疗前患者特征例如年龄、性别、白细胞(WBC)计数、骨髓或外周血母细胞百分比相关。我们检测到几种miRNA(包括miR-155,miR-30b,miR-30c,miR-25和miR-181b)与白细胞计数、外周血和骨髓母细胞百分比正相关(图13(表10))。
微RNA特征与定义的细胞遗传亚组相关。
为了鉴别与AML中的已知的细胞遗传异常情况相关的miRNA,我们使用SAM内的排列校正的t检验,研究了116个AML样品,所述样品具有至少20个中期(通过常规核型分析)。这些数据总结在图5(表2)中。
具有正常核型的AML。
我们鉴别出将具有正常核型的AML病例与具有异常核型的所有其它AML病例区分开的特征(图14(表11),图3B)。在上调的基因中,miR位于HOX基因簇内,已经证实其在具有正常核型6的AML中过表达(图1E,图5(表2))。更具体地,已经证实,Hox内含的miRNA如miR-10a和miR-196b靶向几个Hox基因,这揭示该转录因子家族的复杂调节层18,25。
2项以前的研究鉴别出正常核型AML样品中DNA甲基转移酶基因DNMT3A和3B的高水平表达,这暗示异常甲基化在该亚型的发病机理中的潜在作用5-6。有趣地,在正常核型组的下调的miRNA中,存在预测靶向DNMT3A的2种miRNA(miR-200c和miR-182)和miR-(推测其靶向DNMT3B)。因而,这些miRNA的下调可能促成两种DNMT3基因在正常核型AML细胞中的过表达。
11q23异常情况
在具有t(9;11)[5]和t(6;11)[4]的患者中下调的基因中(图 15(表12)),预测许多基因靶向已经描述成在该组患者中过表达且与预后不良有关的Hox基因,即HOXA9(let7f),HOSA10(iR-15a),PBX3(let07f,miR-15a和miR-196b)和MEISI(miR-331)6(图15(表12))。同样地,预测在该组中也下调的miR-29家族的成员靶向抗细胞凋亡的MCLI基因。
复杂的核型
具有3种或更多种细胞遗传学异常情况的样品共有一个共同的特征,其包括miR-126、miR-26a、miR-34b、miR-30c和miR-301作为该组的最具差别的基因(图16(表13))。同样地,在分离地缺失染色体7的患者中,miR-126被上调(表S11)。有趣地,该miRNA在CD34+干细胞中高表达,且在其它AML(具有复杂核型的那些除外)中下调。使用qRT-PCR,在具有复杂(N=6)和非复杂的细胞遗传异常情况(N=22)的AML患者独立组中证实了这些结果(图1F)。
三体性8
使用SAM得到的特征在具有分离的三体性8的患者样品中鉴别出许多上调的miRNA(图18(表15))。在上调的miRNA中,miR124a和miR-30d分别位于8p21和8q23,这表明基因剂量效应可能在这些miRNA的上调中起作用。
复发的AML患者中的微RNA表达
使用我们的miRNA平台,我们进一步研究了54位具有复发的急性髓细胞白血病的患者的miRNA表达谱(图19(表16))。我们在新的和治疗过的患者之间没有发现显著差异,正如非显著的统计评分和小于2的变化倍数所反映的(数据未显示)。但是,我们在这些患者中观察到,FAB和细胞遗传学特征非常类似于新患者(图8-17;表5-14),从而证实以前描述的发现。这些数据暗示,miRNA表达主要由细胞遗传学和白血病的分化阶段驱动。
与结果有关的微RNA
我们在122位新诊断的AML患者中鉴别出少数具有低于1%的假发现率和与总存活率有关的高于2的SAM存活评分(Cox消退)的miRNA。 所有鉴别出的基因:miR-17-5p,MIR-20,miR-miR-182,miR-191,miR-199a和miR-199b在过表达时,都不利地影响总存活率(图6(表3))。我们然后使用Kaplan-Meier方法和用于存活曲线对比的时序检验,估计了122位高或低表达上述miRNA的AML患者的存活概率(survival probability)。我们证实了miR-20(图2A)、miR-25(图2B)、miR-191、miR-199a和miR-199b的SAM结果,miR-17-5p和miR-182(p=0.06)除外[数据未显示]。为了进行评估,我们使用qRT-PCR在36位AML患者的独立样品中测量了miR-20和miR-25。
发现高表达miR-20或miR-25的患者具有比低表达的AML患者显著更短的总存活率(OS)(图2A和2B)和无事件存活率(miR-20p=0.012,HR=2.39CI 95%:1.3-5.2和miR-25p=0.018,HR=2.23CI 95%:1.7-4.9)。其它临床特征,包括性别、年龄、不利的细胞遗传学、白细胞和外周母细胞计数,都不与该36位AML患者的独立组的存活率显著相关(数据未显示)。
与用诱导治疗缓解失败有关的MiRNA
由于我们已经证实,AML患者中的生物学和遗传学发现与不同miRNA的表达相关,我们然后进一步研究了治疗响应和miRNA表达之间的关系。为了鉴别与诱导治疗响应有关的miRNA,我们分析了诊断出的24位AML患者的miRNA表达,他们都在第1至3天每天用伊达比星12mg/m.2治疗,并且用阿糖胞苷1500mg/m 2连续输注4天(图20(表17))。SAM在已经治疗失败的患者中鉴别出25个在诊断时下调的miRNA(图21(表18))。其中,预期miR-29b和miR-29c靶向MCLI,即与对许多化疗剂的抗性有关的基因26。为了证实这些结果,我们通过qRT-PCR在具有类似基线特征、但是用不同化疗方案治疗的AML患者的独立组中测量了miR-29b。我们发现,与实现完全缓解的患者相比,miR-29b在治疗诱导失败的患者中下调(图3C)。
讨论
在该研究中,我们使用微阵列平台进行AML样品和它们的祖细胞CD34+细胞的基因组范围的miRNome分析。尽管存在有些miRNA在AML 患者中与CD34+细胞相比上调的事实,但大多数miRNA下调。有些下调的miRNA包括白血病分化阶段的标志物,它们与AML的FAB分类密切相关。Lu等人报道,miRNA反映肿瘤的发育谱系和分化状态11。这里鉴别出的miRNA子集是否是分化阶段的唯一标志物,或这些miRNA中的一些是否具有致病作用,仍然有待阐述。
使用SAM,我们鉴别出与几个细胞遗传组有关的分子特征。其中,最强的特征是与11q23重排、正常核型和三体性8有关的那些。
miRNA子集作为致癌miRNA起作用。
跨miR-17和miR-20的上调簇靶向E2FI27,从而影响细胞周期调节。相反,预测在AML中下调且与缓解失败有关的miR-29家族的成员靶向MCLI(一种关键的细胞凋亡调节剂,发现它在抗许多化疗剂的细胞中上调26)。此外,已经在CLL患者28和AML癌29中的与短无事件存活率相关的特征中鉴别出该家族的其它成员,表明该miRNA可能是肿瘤抑制剂非编码基因。
我们描述了与总和无事件存活率(OS)有关的分子特征。几个发现加强了我们的结果。首先,我们鉴别出了与存活率有关的miRNA,尽管研究的患者具有总预后不良和短存活率(其中结果差异难以证实)。其次,与存活率有关的2个miRNA(miR-20和miR-25)也与高白细胞和母细胞计数有关,所有特征与存活率密切相关。第三,我们鉴别了几个上调的miRNA,它们与6个实体癌的共有特征相同(例如miR-17,miR-20和miR-191)10,它们中的一些(如miR-17和miR-20)在肿瘤发生中具有非常确定的作用27-30。
总之,我们证实了miRNA的子集是白血病分化阶段的标志物,且与FAB分类相关,而其它的miRNA在AML中明显失调,与细胞遗传组和结果有关。最后,我们显示miRNA可能参与白血病发生,作为癌基因和肿瘤抑制剂起作用。
前述实施方案和优点仅仅是示例性的,且不应理解为限制本发明。本发明的教导可以容易地应用于其它类型的装置。本发明的描述意在举例说明,而不是限制权利要求的范围。许多替代方案、改变和变型 是本领域技术人员显而易见的。在权利要求中,方式+功能的条款意在覆盖本文所述的结构以执行所述的功能,不仅是结构等同物,而且包括等效结构。
本文提及的所有科学和专利出版物都通过引用并入本文。本发明现在已经通过书面描述和实施例予以描述,本领域技术人员将认识到,本发明可以在多种实施方案中实现,前面的描述和实施例用于举例说明目的,而不限制下述权利要求。
未明确通过引用并入的本文引述的所有出版物的相关教导以其全部内容通过引用并入本文。尽管已通过优选实施方案明确地显示和描述了本发明,但本领域技术人员将理解其中可进行形式和细节上的各种变化,而不背离所附权利要求包括的本发明的范围。
参考文献
1.Lowenberg B,Downing J.R.,Burnett A.Acute Myeloid leukemia.NEnglJMed 1999;341:1051-1062.
2.Grimwade D,Haferlach T.Gene expression profiling in acute myeloidleukemia.NEnglJMed 2004;350:1676-7.
3.Burnett AK.Current controversies:which patients with acute myeloid leukemia should receive bone marrow transplantation?Anadult theater’s view.Br.JHaematol 2002;118:357-64.
4.Drobyski WR.The role of allogeneic transplantation in high-risk acutemyeloid leukemia.Leukemia 2004;10:1565-8.
5.Bullinger L,Dohner K,Bair E,et al.Use of gene-expression profiling toidentify prognostic subclasses in adult acute myeloid leukemia.NEngJMed 2004;350:1605-1616.
6.Valk PJM,Verhaak GW,Beijen MA.Prognostically useful gene-expressionprofiles in acute myeloid leukemia.NEngJMed 2004;350:1617-1628.
7.Pasquinelli AE,Hunter S,Bracht J.MicroRNAs:a developing story.CurrO,Genet Dev 2005;15:200-5.
8.Bartel D.MicroRNAs:genomics,Biogenesis,Mechanism,and Function.Cell 2004;116:281-297.
9.Chen CZ,Li L,Lodish H,Bartel D.MicroRNAs Modulate Hematopoieticlineage Differentiation.Science 2004;303:83-86.
10.Volinia S,Calin G,Liu CG,et al.A microRNA expression signature inhuman solid tumors defines cancer targets.Proc Nad Acad Sci USA 2006;103:2257-61.
11.Lu J,Getz G,Miska EA,et al.MicroRNA expression profiles classifyhuman cancers.Nature 2005;Jun 9;435:834-8.
12.Calin GA,Liu CG,Sevignani C,et al.MicroRNA profiling reveals distinctsignatures in B-Cell Chronic Lymphocytic leukemias.Proc Nad Acad Sci USA 2004;101:1175560.
13.Eis PS,Tam W,Sun,L.Accumulation of m iR-155 and BIC RNA in humanB cell lymphomas.Proc Nad Acad Sci USA 2005;102:3627-32.
14.Metzler M,Wilda M,Busch K,et al.High expression of miR-155/BICRNA in children with Burkitt lymphoma.Genes Chomosomes and Cancer 2004;39:167-9.
15.Costinean,S.et al.Pre B cell proliferation and lymphoblastic leukemia/highgrade lymphoma in EμmiR155 transgenic mice.Proc Nad Acad Sci USA 2006;103:7024-9.
16.Bloomfield CD.Prognostic factors for selecting curative therapy for adultacute myeloid leukemia.Leukemia 1992;6:65-67.21.
17.An International System for Human Cytogenetic Nomenclature(1985)ISCN 1985.Report of the Standing Committee on Human Cytogenetic Nomenclature.BiOrig Artic Ser 1985;21:1-117.
18.Garzon R,Pichiorri F,Palumbo T,et al.MicroRNAs fingerprints duringhuman megakaryocytopoiesis.Proc Nad Acad Sci USA 2006;103:5078-83.
19.Liu CG,Calin GA,Meloon B,et al.An oligonucleotide microchip forgenomic-wide microRNA profiling in human and mouse tissues.Proc Nad Acad Sci USA2004;101:11755-60.
20.Griffiths-Jones S.The microRNA registry.Nucleic Acids Res 2004;32,Database issue D109-D111.
21.Chen C,Ridzon DA,Broomer AJ,et al.Real-Time quantification ofmicroRNAs by stem-loop RT-PCR.Nucleic Acids Res 2005:33:e179.
22.Tusher VG,Tibshirani R,Chu G.Significant analysis of microarrays appliedto the ionizing radiation response.Proc Natl Acad Sci USA 2001;98:5116:21.
23.Felli N,Pelosi E,Beta R,et al.Lineage-Specific Expression and.functional Relevance of MicroRNA genes in Normal Hematopoiesis.Blood(ASH national meetingsabstract)2006;106:2263.
24.French-American-British(FAB)Cooperative Group.Proposed revisedcriteria for the classification of acute myeloid leukemia.Ann Intern Med.1985;103:620-685.
25.Yekta S,Shih IH,Bartel DP.Micro-RNA direct cleavage of HOXB8mRNA.Science 2004;304:594-6.
26.Zhou P,Qian L,Kozopas KM,Craig RW:Mcl-1:a Bcl-2family member,delays the death of hematopoietic cells under a variety of apoptosis-inducing conditions.Blood 1997;89:630.
27.O’Donnell KA,Wentzel EA,Zeller KI,Dang CV,Mendell JT.C-mycregulated microRNAs modulate E2F1 expression.Nature 2005;435:839-43.
28.Calin GA,Terracing M,Camino A,et al.A MicroRNA signature associatedwith prognosis and progression in chronic lymphocytic leukemia.NEngLJMed.2005;353:1793-801.
29.Yanaihara N,Caplen N,Bowman,E,et al.Unique microRNA molecularprofiles in AML cancer diagnosis and prognosis.Cancer Cell 2006;9:189-98.
30.He L,Thomson JM,Hemann MT.A microRNA polycistron as a potentialoncogene.re 2005;435:828-33.
31.Lewis BP,Shih IH,Jones-Rhoades MW,Bartel P,Burge CB.Prediction ofmammalian microRNA targets.Cell 2003;115:787-798.32.Krek A,Grün D,Poy M,et al.Combinatorial microRNA target Nature G 37:495-500.
32.Lewis BP,Burge CB,Bartel D.Conserved seed pairing often flanked byadenosines,indicates that thousands of human genes are microRNA targets.Cell 2005;120:15-20.
33.Krek A,Grun D,Poy MN,et al.Combinatorial microRNA targetpredictions.Nat.Genet.2005;37:495-500.
Claims (9)
1.miRNA-特异性探针寡核苷酸在制备诊断剂中的用途,所述诊断剂通过下列来诊断受试者是否患有急性髓细胞白血病或处于发展该疾病的风险中:测量来自所述受试者的受试样品中至少一种miR基因产物的水平,其中与对照样品中相应的miR基因产物水平相比,受试样品中miR基因产物水平的改变表示受试者患有AML或处于发展AML的风险中,其中所述至少一种miR基因产物选自图5、8-18和21的任一个中所示的miRNA,并且包括miR-20。
2.权利要求1的用途,其中所述至少一种miR基因产物还包括,选自miR-25,miR-191,miR-199a,和miR-199b及它们的组合的miRNA。
3.miRNA-特异性探针寡核苷酸在制备用于确定预后的试剂中的用途,所述试剂通过下列来确定患有急性髓细胞白血病的受试者的预后:测量来自所述受试者的受试样品中至少一种miR基因产物的水平,其中:
所述miR基因产物与AML中的不利预后有关;且
与对照样品中相应的miR基因产物水平相比,受试样品中所述至少一种miR基因产物水平的改变表示不利预后,其中所述miR基因产物包括miR-20。
4.权利要求3的用途,其中所述至少一种miR基因产物还包括下列中的一个或多个:miR-25,miR-17-5p,miR-182,miR-199a,miR-199b和miR-191。
5.miRNA-特异性探针寡核苷酸在制备微阵列中的用途,所述微阵列通过下列来诊断受试者是否患有AML或处于发展AML的风险中:
(1)逆转录获自受试者的受试样品的RNA,以提供一组靶寡脱氧核苷酸;
(2)将所述靶寡脱氧核苷酸与包含miRNA-特异性探针寡核苷酸的微阵列杂交,以提供受试样品的杂交谱;和,
(3)将受试样品杂交谱与从对照样品产生的杂交谱相比较,
其中至少一种miRNA的信号的改变表示受试者患有AML或处于发展AML的风险中,
其中所述至少一种miRNA选自图5、8-18和21的任一个中所示的miRNA,并且包括miR-20。
6.miRNA-特异性探针寡核苷酸在制备微阵列中的用途,所述微阵列通过下列来诊断受试者是否患有具有不利预后的AML或处于发展其的风险中:
(1)逆转录获自受试者的受试样品的RNA,以提供一组靶寡脱氧核苷酸;
(2)将所述靶寡脱氧核苷酸与包含miRNA-特异性探针寡核苷酸的微阵列杂交,以提供所述受试样品的杂交谱;和
(3)将受试样品杂交谱与从对照样品产生的杂交谱相比较,
其中至少一种miR基因产物的信号的改变表示受试者患有具有不利预后的AML或处于发展其的风险中,其中所述至少一种miR基因产物选自图5-6、8-18和21的任一个中所示的miRNA,并且包括miR-20。
7.权利要求6的用途,其中至少一种miR基因产物的信号的改变表示受试者患有具有不利预后的AML或处于发展其的风险中,其中所述miR基因产物还包括下列中的一个或多个:miR-25,miR-17-5p,miR-182,miR-199a,miR-199b和miR-191。
8.权利要求6的用途,其中所述微阵列包含针对miR-20的至少一种miRNA-特异性探针寡核苷酸。
9.权利要求8的用途,其中所述微阵列还包含针对选自miR-25、miR-191、miR-199a和miR-199b及其组合的miRNA的至少一种miRNA-特异性探针寡核苷酸。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201310439889.9A CN103555825B (zh) | 2007-01-31 | 2008-01-29 | 用于急性髓细胞白血病(aml)的诊断、预后和治疗的基于微rna的方法和组合物 |
| CN201510615615.XA CN105256004A (zh) | 2007-01-31 | 2008-01-29 | 用于急性髓细胞白血病(aml)的诊断、预后和治疗的基于微rna的方法和组合物 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US89857807P | 2007-01-31 | 2007-01-31 | |
| US60/898,578 | 2007-01-31 | ||
| PCT/US2008/001157 WO2008094545A2 (en) | 2007-01-31 | 2008-01-29 | Mic orna-based methods and compositions for the treatment of acute myeloid leukemia |
Related Child Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201510615615.XA Division CN105256004A (zh) | 2007-01-31 | 2008-01-29 | 用于急性髓细胞白血病(aml)的诊断、预后和治疗的基于微rna的方法和组合物 |
| CN201310439889.9A Division CN103555825B (zh) | 2007-01-31 | 2008-01-29 | 用于急性髓细胞白血病(aml)的诊断、预后和治疗的基于微rna的方法和组合物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN101627134A CN101627134A (zh) | 2010-01-13 |
| CN101627134B true CN101627134B (zh) | 2013-11-06 |
Family
ID=39674697
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201310439889.9A Expired - Fee Related CN103555825B (zh) | 2007-01-31 | 2008-01-29 | 用于急性髓细胞白血病(aml)的诊断、预后和治疗的基于微rna的方法和组合物 |
| CN201510615615.XA Pending CN105256004A (zh) | 2007-01-31 | 2008-01-29 | 用于急性髓细胞白血病(aml)的诊断、预后和治疗的基于微rna的方法和组合物 |
| CN2008800037367A Expired - Fee Related CN101627134B (zh) | 2007-01-31 | 2008-01-29 | 用于急性髓细胞白血病(aml)的诊断、预后和治疗的基于微rna的方法和组合物 |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201310439889.9A Expired - Fee Related CN103555825B (zh) | 2007-01-31 | 2008-01-29 | 用于急性髓细胞白血病(aml)的诊断、预后和治疗的基于微rna的方法和组合物 |
| CN201510615615.XA Pending CN105256004A (zh) | 2007-01-31 | 2008-01-29 | 用于急性髓细胞白血病(aml)的诊断、预后和治疗的基于微rna的方法和组合物 |
Country Status (7)
| Country | Link |
|---|---|
| US (4) | US8034560B2 (zh) |
| EP (1) | EP2109687B1 (zh) |
| JP (1) | JP2010516291A (zh) |
| CN (3) | CN103555825B (zh) |
| AU (1) | AU2008211142A1 (zh) |
| CA (1) | CA2674895A1 (zh) |
| WO (1) | WO2008094545A2 (zh) |
Families Citing this family (50)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103820562B (zh) | 2005-08-01 | 2015-05-13 | 俄亥俄州立大学研究基金会 | 用于乳腺癌的诊断、预后和治疗的基于MicroRNA的方法和组合物 |
| AU2006291165B2 (en) * | 2005-09-12 | 2013-03-14 | The Ohio State University Research Foundation | Compositions and methods for the diagnosis and therapy of BCL2-associated cancers |
| AU2006302496A1 (en) * | 2005-10-05 | 2007-04-19 | The Ohio State University Research Foundation | WWOX gene, vectors containing the same, and uses in treatment of cancer |
| CN103993082B (zh) | 2006-01-05 | 2017-01-11 | 俄亥俄州立大学研究基金会 | 用于肺癌的诊断、预后和治疗的基于微小rna 的方法和组合物 |
| EP2487252B1 (en) | 2006-01-05 | 2014-10-15 | The Ohio State University Research Foundation | MicroRNA-based methods for the diagnosis of colon cancer |
| JP5490413B2 (ja) | 2006-01-05 | 2014-05-14 | ジ・オハイオ・ステイト・ユニバーシティ・リサーチ・ファウンデイション | 膵内分泌腫瘍及び膵腺房腫瘍におけるマイクロrna発現異常 |
| EP2369012A1 (en) | 2006-03-20 | 2011-09-28 | The Ohio State University Research Foundation | Micro-RNA fingerprints during human megakaryocytopoiesis |
| EP2041317A4 (en) | 2006-07-13 | 2009-10-14 | Univ Ohio State Res Found | METHODS AND COMPOSITIONS BASED ON MICRO-RNA FOR THE DIAGNOSIS AND TREATMENT OF COLON CANCER RELATED DISEASES |
| EP2061907B1 (en) | 2006-09-19 | 2011-11-23 | The Ohio State University Research Foundation | Tcl1 expression in chronic lymphocytic leukemia (cll) regulated by mir-29 and mir-181 |
| EP2087135B8 (en) | 2006-11-01 | 2013-07-24 | The Ohio State University Research Foundation | Microrna expression signature for predicting survival and metastases in hepatocellular carcinoma |
| AU2008211142A1 (en) | 2007-01-31 | 2008-08-07 | The Ohio State University Research Foundation | Mic orna-based methods and compositions for the treatment of acute myeloid leukemia |
| JP5592251B2 (ja) * | 2007-04-30 | 2014-09-17 | ジ・オハイオ・ステイト・ユニバーシティ・リサーチ・ファウンデイション | 膵臓癌を正常な膵臓機能および/または慢性膵炎と識別する方法 |
| CN101711287B (zh) | 2007-06-08 | 2016-04-27 | 由卫生与公众服务部代表的美利坚合众国政府 | 确定肝细胞癌亚型和检测肝癌干细胞的方法 |
| EP2167521A4 (en) | 2007-06-15 | 2011-11-23 | Univ Ohio State Res Found | ALL-1 ONCOGEN FUSION PROTEINS TO TARGE TREATMENT OF MICRO-RNA REGULATED BY DROSHA |
| ES2496172T3 (es) * | 2007-07-31 | 2014-09-18 | The Ohio State University Research Foundation | Métodos para invertir la metilación por selección dirigida de DNMT3A y DNMT3B |
| US8465918B2 (en) * | 2007-08-03 | 2013-06-18 | The Ohio State University Research Foundation | Ultraconserved regions encoding ncRNAs |
| AU2008288806B2 (en) * | 2007-08-22 | 2014-11-27 | The Ohio State University Research Foundation | Methods and compositions for inducing deregulation of EphA7 and Erk phosphorylation in human acute leukemias |
| AU2008310704B2 (en) * | 2007-10-11 | 2014-03-20 | The Government Of The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Methods and compositions for the diagnosis and treatment of esphageal adenocarcinomas |
| CN102137927B (zh) | 2007-10-26 | 2014-03-12 | 俄亥俄州立大学研究基金会 | 鉴定脆性组氨酸三联体(Fhit)相互作用的方法及其用途 |
| EP2225396A4 (en) * | 2007-11-30 | 2011-03-02 | Univ Ohio State Res Found | PROFILING AND SCREENING OF MICRO-RNA EXPRESSION IN PERIPHERAL BLOOD IN LUNG CANCER |
| US20110054009A1 (en) * | 2008-02-28 | 2011-03-03 | The Ohio State University Research Foundation | MicroRNA-Based Methods and Compositions for the Diagnosis, Prognosis and Treatment of Prostate Related Disorders |
| WO2009108856A2 (en) * | 2008-02-28 | 2009-09-03 | The Ohio State University Research Foundation | Microrna signatures associated with human chronic lymphocytic leukemia (ccl) and uses thereof |
| CN102149827B (zh) | 2008-06-11 | 2014-08-20 | 由卫生与公众服务部代表的美利坚合众国政府 | MiR-26家族作为肝细胞癌和对治疗的应答性的预测性标志物的用途 |
| CA2742324A1 (en) * | 2008-10-30 | 2010-06-03 | Caris Life Sciences Luxembourg Holdings, S.A.R.L. | Methods for assessing rna patterns |
| WO2010051639A1 (en) * | 2008-11-10 | 2010-05-14 | University Health Network | Use of mir-126 for enhancing hematopoietic stem cell engraftment, for isolating hematopoietic stem cells, and for treating and monitoring the treatment of acute myeloid leukemia |
| JP2012508577A (ja) * | 2008-11-12 | 2012-04-12 | カリス ライフ サイエンシズ ルクセンブルク ホールディングス | 表現型を決定するためのエキソソームの使用方法およびそのシステム |
| IT1398768B1 (it) * | 2009-03-24 | 2013-03-18 | Zollo | Uso di microrna-199b-5p in campo medico e diagnostico. |
| WO2010119698A1 (ja) * | 2009-04-16 | 2010-10-21 | 学校法人 慶應義塾 | 頭頸部腫瘍増殖抑制剤 |
| WO2011063382A1 (en) | 2009-11-23 | 2011-05-26 | The Ohio State University | Materials and methods useful for affecting tumor cell growth, migration and invasion |
| EP2539357B1 (en) * | 2010-02-26 | 2017-06-14 | Memorial Sloan-Kettering Cancer Center | Methods and compositions for the detection and treatment of cancer involving mirnas and mirna inhibitors and targets |
| CA2791905A1 (en) | 2010-03-01 | 2011-09-09 | Caris Life Sciences Luxembourg Holdings, S.A.R.L. | Biomarkers for theranostics |
| EP2556172A4 (en) | 2010-04-06 | 2013-10-30 | Caris Life Sciences Luxembourg Holdings | CIRCULATING BIOMARKERS FOR DISEASES |
| US10246833B2 (en) * | 2017-02-23 | 2019-04-02 | Roadtec, Inc. | Asphalt paving machine operational reporting system |
| JP5931897B2 (ja) | 2010-11-12 | 2016-06-08 | ジ・オハイオ・ステイト・ユニバーシティ・リサーチ・ファウンデイションThe Ohio State University Research Foundation | マイクロrna−21、ミスマッチ修復および結腸直腸癌に関連する物質および方法 |
| WO2012068147A1 (en) | 2010-11-15 | 2012-05-24 | The Ohio State University Research Foundation | Controlled release mucoadhesive systems |
| WO2012122239A1 (en) | 2011-03-07 | 2012-09-13 | The Ohio State University | MUTATOR ACTIVITY INDUCED BY MICRORNA-155 (miR-155) LINKS INFLAMMATION AND CANCER |
| CN102178959B (zh) * | 2011-03-15 | 2013-10-23 | 清华大学深圳研究生院 | 抑制肺转移肿瘤生长的siRNA及其寡聚核酸组合与应用 |
| CN104364390B (zh) | 2011-10-14 | 2016-08-24 | 俄亥俄州立大学 | 与卵巢癌相关的方法和材料 |
| JP2015501843A (ja) | 2011-12-13 | 2015-01-19 | オハイオ・ステイト・イノベーション・ファウンデーション | miR−21およびmiR−29a、エキソソーム阻害、およびがん転移に関する方法および組成物 |
| WO2013110053A1 (en) | 2012-01-20 | 2013-07-25 | The Ohio State University | Breast cancer biomarker signatures for invasiveness and prognosis |
| CA2867662A1 (en) * | 2012-03-21 | 2013-09-26 | Erytech Pharma | Medicament for the treatment of acute myeloid leukemia (aml) |
| GB201400598D0 (en) | 2014-01-14 | 2014-03-05 | Univ Glasgow | Materials and methods for modulation of tendon healing |
| ES2910787T3 (es) * | 2016-05-12 | 2022-05-13 | Univ Michigan Regents | Inhibidores de ASH1L y métodos de tratamiento con los mismos |
| CN105838804A (zh) * | 2016-05-16 | 2016-08-10 | 苏州大学 | MiR-17-5p恶性血液病辅助诊断试剂及应用 |
| US10801025B2 (en) | 2016-07-26 | 2020-10-13 | Indiana University Research And Technology Corporation | MicroRNA therapy for pancreatic cancer |
| US20200054639A1 (en) * | 2016-10-31 | 2020-02-20 | Oregon Health & Science University | Combinations of agents to treat hematological malignancies |
| EP3706736A4 (en) | 2017-11-10 | 2021-08-11 | The Regents of the University of Michigan | ASH1L DEGRADATION AGENTS AND METHODS OF TREATMENT THROUGH THEM |
| US11410745B2 (en) * | 2018-06-18 | 2022-08-09 | International Business Machines Corporation | Determining potential cancer therapeutic targets by joint modeling of survival events |
| CN110151777B (zh) * | 2019-06-03 | 2022-04-26 | 暨南大学附属第一医院(广州华侨医院) | hsa-miR-12462在抗急性髓系白血病中的应用 |
| CN113584166B (zh) * | 2021-07-05 | 2024-03-26 | 暨南大学 | miR-31-5p在急性髓系白血病中的应用 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2877350A1 (fr) * | 2004-11-03 | 2006-05-05 | Centre Nat Rech Scient | IDENTIFICATION ET UTILISATION DE miRNAs IMPLIQUES DANS LA DIFFERENCIATION DE CELLULES ISSUES D'UNE LEUCEMIE MYELOIDE |
| WO2005118806A3 (en) * | 2004-05-28 | 2006-08-24 | Ambion Inc | METHODS AND COMPOSITIONS INVOLVING MicroRNA |
| CN1882702A (zh) * | 2003-09-22 | 2006-12-20 | 罗斯塔英法美蒂克斯有限责任公司 | 用rna干扰进行的协同致死筛选 |
Family Cites Families (157)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4196265A (en) | 1977-06-15 | 1980-04-01 | The Wistar Institute | Method of producing antibodies |
| US4172124A (en) | 1978-04-28 | 1979-10-23 | The Wistar Institute | Method of producing tumor antibodies |
| US4608337A (en) | 1980-11-07 | 1986-08-26 | The Wistar Institute | Human hybridomas and the production of human monoclonal antibodies by human hybridomas |
| US4701409A (en) | 1984-11-15 | 1987-10-20 | The Wistar Institute | Detection of B-cell neoplasms |
| US4693975A (en) | 1984-11-20 | 1987-09-15 | The Wistar Institute | Human hybridroma fusion partner for production of human monoclonal antibodies |
| US5015568A (en) | 1986-07-09 | 1991-05-14 | The Wistar Institute | Diagnostic methods for detecting lymphomas in humans |
| US5202429A (en) | 1986-07-09 | 1993-04-13 | The Wistar Institute | DNA molecules having human BCL-2 gene sequences |
| US5198338A (en) | 1989-05-31 | 1993-03-30 | Temple University | Molecular probing for human t-cell leukemia and lymphoma |
| US5149628A (en) | 1989-11-15 | 1992-09-22 | Temple University | Methods for detecting bcl-3 gene in human leukemias |
| WO1993012136A1 (en) | 1991-12-11 | 1993-06-24 | Thomas Jefferson University | Detection and treatment of acute leukemias resulting from chromosome abnormalities in the all-1 region |
| US6040140A (en) | 1991-12-11 | 2000-03-21 | Thomas Jefferson University | Methods for screening and treating leukemias resulting from all-1 region chromosome abnormalities |
| US5633135A (en) | 1991-12-11 | 1997-05-27 | Thomas Jefferson University | Chimeric nucleic acids and proteins resulting from ALL-1 region chromosome abnormalities |
| US5674682A (en) | 1992-10-29 | 1997-10-07 | Thomas Jefferson University | Nucleic acid primers for detecting micrometastasis of prostate cancer |
| DK0667920T3 (da) | 1992-10-29 | 2003-04-14 | Univ Jefferson | Fremgangsmåder til påvisning af prostatacancermetastase |
| US5985598A (en) | 1994-10-27 | 1999-11-16 | Thomas Jefferson University | TCL-1 gene and protein and related methods and compositions |
| US7175995B1 (en) | 1994-10-27 | 2007-02-13 | Thomas Jefferson University | TCL-1 protein and related methods |
| US5695944A (en) | 1995-05-05 | 1997-12-09 | Thomas Jefferson University | Modulation of bcl-2 phosphorylation |
| US5567586A (en) | 1995-05-18 | 1996-10-22 | Thomas Jefferson University | Methods of indentifying solid tumors with chromosome abnormalities in the ALL-1 region |
| US5928884A (en) | 1996-02-09 | 1999-07-27 | Croce; Carlo M. | FHIT proteins and nucleic acids and methods based thereon |
| US6242212B1 (en) | 1996-02-09 | 2001-06-05 | Thomas Jefferson University | Fragile histidine triad (FHIT) nucleic acids and methods of producing FHIT proteins |
| WO1998035707A1 (en) | 1997-02-18 | 1998-08-20 | Thomas Jefferson University | Compositions that bind to pancreatic cancer cells and methods of using the same |
| WO1998045480A1 (en) | 1997-04-04 | 1998-10-15 | The Texas A & M University System | Noninvasive detection of colonic biomarkers using fecal messenger rna |
| WO2000003685A2 (en) | 1998-07-20 | 2000-01-27 | Thomas Jefferson University | Nitrilase homologs |
| WO2000005419A1 (en) | 1998-07-24 | 2000-02-03 | Yeda Research And Development Company Ltd. | Prevention of metastasis with 5-aza-2'-deoxycytidine |
| US7141417B1 (en) | 1999-02-25 | 2006-11-28 | Thomas Jefferson University | Compositions, kits, and methods relating to the human FEZ1 gene, a novel tumor suppressor gene |
| EP1165586A4 (en) | 1999-03-15 | 2003-05-28 | Univ Jefferson | TCL-1B GENES AND PROTEINS AND RELATED METHODS AND METHODS |
| US6579857B1 (en) | 1999-06-11 | 2003-06-17 | Evanston Northwestern Healthcare Research Institute | Combination cancer therapy comprising adenosine and deaminase enzyme inhibitors |
| US7163801B2 (en) | 1999-09-01 | 2007-01-16 | The Burnham Institute | Methods for determining the prognosis for cancer patients using tucan |
| US6891031B2 (en) | 2000-02-18 | 2005-05-10 | The Regents Of The University Of California | Coordinate cytokine regulatory sequences |
| US20010026796A1 (en) | 2000-03-14 | 2001-10-04 | Croce Carlo M. | TCL1 enhances Akt kinase activity and mediates its nuclear translocation |
| JP2004516002A (ja) | 2000-04-11 | 2004-06-03 | トーマス・ジェファーソン・ユニバーシティー | Fhit欠損マウスにおけるミュア−トール様症候群 |
| WO2001087958A2 (en) | 2000-05-16 | 2001-11-22 | Thomas Jefferson University | CRYSTAL STRUCTURE OF WORM NitFhit REVEALS THAT A Nit TETRAMER BINDS TWO Fhit DIMERS |
| US7060811B2 (en) | 2000-10-13 | 2006-06-13 | Board Of Regents, The University Of Texas System | WWOX: a tumor suppressor gene mutated in multiple cancers |
| US20040033502A1 (en) | 2001-03-28 | 2004-02-19 | Amanda Williams | Gene expression profiles in esophageal tissue |
| US20050176025A1 (en) | 2001-05-18 | 2005-08-11 | Sirna Therapeutics, Inc. | RNA interference mediated inhibition of B-cell CLL/Lymphoma-2 (BCL-2) gene expression using short interfering nucleic acid (siNA) |
| EP2390330B1 (en) | 2001-09-28 | 2018-04-25 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | MicroRNA molecules |
| US7371736B2 (en) | 2001-11-07 | 2008-05-13 | The Board Of Trustees Of The University Of Arkansas | Gene expression profiling based identification of DKK1 as a potential therapeutic targets for controlling bone loss |
| GB0128898D0 (en) | 2001-12-03 | 2002-01-23 | Biotech Res Ventures Pte Ltd | Materials and methods relating to the stabilization and activation of a tumour suppressor protein |
| AU2003224672B2 (en) | 2002-03-08 | 2010-02-04 | Eisai R&D Management Co., Ltd. | Macrocyclic compounds useful as pharmaceuticals |
| US20060084059A1 (en) | 2002-04-08 | 2006-04-20 | Tai-Tung Yip | Serum biomarkers in hepatocellular carcinoma |
| AU2003241325A1 (en) | 2002-04-29 | 2003-11-17 | Thomas Jefferson University | Human chronic lymphocytic leukemia modeled in mouse by targeted tcl1 expression |
| JP2005528115A (ja) | 2002-05-31 | 2005-09-22 | ザ ボード オブ トラスティーズ オブ ザ リーランド スタンフォード ジュニア ユニバーシティ | 幹細胞および癌幹細胞を同定および単離する方法 |
| US20050260639A1 (en) | 2002-09-30 | 2005-11-24 | Oncotherapy Science, Inc. | Method for diagnosing pancreatic cancer |
| JP2006512908A (ja) | 2002-10-11 | 2006-04-20 | トーマス ジェファーソン ユニバーシティー | 腫瘍抑制遺伝子および組成物ならびにその作製法および使用法 |
| US20050266443A1 (en) | 2002-10-11 | 2005-12-01 | Thomas Jefferson University | Novel tumor suppressor gene and compositions and methods for making and using the same |
| US20040152112A1 (en) | 2002-11-13 | 2004-08-05 | Thomas Jefferson University | Compositions and methods for cancer diagnosis and therapy |
| US7250496B2 (en) | 2002-11-14 | 2007-07-31 | Rosetta Genomics Ltd. | Bioinformatically detectable group of novel regulatory genes and uses thereof |
| WO2004071464A2 (en) | 2003-02-12 | 2004-08-26 | Johns Hopkins University School Of Medicine | Diagnostic application of differentially-expressed genes in lympho-hematopoietic stem cells |
| WO2004079013A1 (en) | 2003-03-03 | 2004-09-16 | Arizona Board Of Regents On Behalf Of The University Of Arizona | Ecto-5’-nucleotidase (cd73) used in the diagnosis and the treatment of pancreatic cancer |
| US7183384B2 (en) | 2003-03-06 | 2007-02-27 | A & G Pharmaceutical, Inc. | Monoclonal antibody 7H11 reactive with human cancer |
| AU2003286741A1 (en) | 2003-05-02 | 2004-11-26 | Thomas Jefferson University | Methods and compositions for diagnosis and therapy of parkin-associated disorders |
| US20050069918A1 (en) | 2003-05-29 | 2005-03-31 | Francois Claret | JAB1 as a prognostic marker and a therapeutic target for human cancer |
| AU2004289953B2 (en) | 2003-06-18 | 2008-09-25 | Genelux Corporation | Modified recombinant vaccina viruses and other microorganisms, uses thereof |
| CA2533701A1 (en) | 2003-07-31 | 2005-02-17 | Isis Pharmaceuticals, Inc. | Oligomeric compounds and compositions for use in modulation of small non-coding rnas |
| US8106180B2 (en) | 2003-08-07 | 2012-01-31 | Whitehead Institute For Biomedical Research | Methods and products for expression of micro RNAs |
| US20050037362A1 (en) | 2003-08-11 | 2005-02-17 | Eppendorf Array Technologies, S.A. | Detection and quantification of siRNA on microarrays |
| US8412541B2 (en) | 2003-08-14 | 2013-04-02 | Edda Technology, Inc. | Method and system for intelligent qualitative and quantitative analysis for medical diagnosis |
| US20050084883A1 (en) | 2003-08-25 | 2005-04-21 | The Johns Hopkins University School Of Medicine | Method of diagnosis and treatment of pancreatic endocrine neoplasms based on differential gene expression analysis |
| EP1670955A2 (en) | 2003-09-22 | 2006-06-21 | Rosetta Inpharmatics LLC. | Synthetic lethal screen using rna interference |
| WO2005028675A2 (en) | 2003-09-24 | 2005-03-31 | Oncotherapy Science, Inc. | Methods for detecting, diagnosing and treating hepatocellular carcinomas (hcc) |
| WO2005047477A2 (en) | 2003-11-07 | 2005-05-26 | University Of Massachusetts | Interspersed repetitive element rnas as substrates, inhibitors and delivery vehicles for rnai |
| US20050164252A1 (en) | 2003-12-04 | 2005-07-28 | Yeung Wah Hin A. | Methods using non-genic sequences for the detection, modification and treatment of any disease or improvement of functions of a cell |
| WO2005060661A2 (en) | 2003-12-19 | 2005-07-07 | The Regents Of The University Of California | Methods and materials for assessing prostate cancer therapies |
| JP4120002B2 (ja) * | 2004-01-07 | 2008-07-16 | 愛知県 | miRNAを用いた癌の予後判定方法、癌の遺伝子治療ベクター及び癌治療用医薬組成物 |
| EP2295604B1 (en) | 2004-02-09 | 2015-04-08 | Thomas Jefferson University | Diagnosis and treatment of cancers with microRNA located in or near cancer-associated chromosomal features |
| US20050256072A1 (en) | 2004-02-09 | 2005-11-17 | University Of Massachusetts | Dual functional oligonucleotides for use in repressing mutant gene expression |
| AU2005214904B2 (en) | 2004-02-13 | 2011-07-21 | Rockefeller University | Anti-microRNA oligonucleotide molecules |
| SG155968A1 (en) | 2004-02-23 | 2009-10-29 | Univ Erasmus Medical Ct | Classification, diagnosis and prognosis of acute myeloid leukemia by gene expression profiling |
| US7365058B2 (en) | 2004-04-13 | 2008-04-29 | The Rockefeller University | MicroRNA and methods for inhibiting same |
| CA2585525A1 (en) | 2004-04-20 | 2005-11-03 | Genaco Biomedical Products, Inc. | Method for detecting ncrna |
| EP2322650A1 (en) | 2004-05-14 | 2011-05-18 | Rosetta Genomics Ltd | MicroRNAs and uses thereof |
| US7635563B2 (en) | 2004-06-30 | 2009-12-22 | Massachusetts Institute Of Technology | High throughput methods relating to microRNA expression analysis |
| US20060037088A1 (en) | 2004-08-13 | 2006-02-16 | Shulin Li | Gene expression levels as predictors of chemoradiation response of cancer |
| EP2338994B1 (en) | 2004-09-02 | 2014-03-19 | Yale University | Regulation of oncogenes by microRNAs |
| US7592441B2 (en) | 2004-10-04 | 2009-09-22 | Rosetta Genomics Ltd | Liver cancer-related nucleic acids |
| US7642348B2 (en) | 2004-10-04 | 2010-01-05 | Rosetta Genomics Ltd | Prostate cancer-related nucleic acids |
| EP2281887A1 (en) | 2004-11-12 | 2011-02-09 | Asuragen, Inc. | Methods and compositions involving miRNA and miRNA inhibitor molecules |
| AU2005316384B2 (en) | 2004-12-14 | 2012-02-09 | Alnylam Pharmaceuticals, Inc. | RNAi modulation of MLL-AF4 and uses thereof |
| CA2589055A1 (en) * | 2004-12-17 | 2006-06-22 | Veridex Llc | Methods for assessing patients with acute myeloid leukemia |
| US20060185027A1 (en) | 2004-12-23 | 2006-08-17 | David Bartel | Systems and methods for identifying miRNA targets and for altering miRNA and target expression |
| EP1959012A3 (en) | 2004-12-29 | 2009-12-30 | Exiqon A/S | Novel oligonucleotide compositions and probe sequences useful for detection and analysis of microRNAs and their target mRNAs |
| DE602006016739D1 (de) | 2005-01-25 | 2010-10-21 | Rosetta Inpharmatics Llc | Verfahren zur quantifizierung kleiner rna-moleküle |
| US8071306B2 (en) | 2005-01-25 | 2011-12-06 | Merck Sharp & Dohme Corp. | Methods for quantitating small RNA molecules |
| US20070065840A1 (en) | 2005-03-23 | 2007-03-22 | Irena Naguibneva | Novel oligonucleotide compositions and probe sequences useful for detection and analysis of microRNAS and their target mRNAS |
| GB2425311A (en) | 2005-04-15 | 2006-10-25 | Ist Superiore Sanita | Micro RNA against kit protein |
| CA2605701C (en) | 2005-04-29 | 2015-12-08 | Rockefeller University | Human micrornas and methods for inhibiting same |
| EP1904111A4 (en) | 2005-06-03 | 2009-08-19 | Univ Johns Hopkins | COMPOSITIONS AND METHODS FOR DECREASING MICROARN EXPRESSION FOR THE TREATMENT OF NEOPLASIA |
| US20070065844A1 (en) | 2005-06-08 | 2007-03-22 | Massachusetts Institute Of Technology | Solution-based methods for RNA expression profiling |
| US20060292616A1 (en) | 2005-06-23 | 2006-12-28 | U.S. Genomics, Inc. | Single molecule miRNA-based disease diagnostic methods |
| CN103820562B (zh) | 2005-08-01 | 2015-05-13 | 俄亥俄州立大学研究基金会 | 用于乳腺癌的诊断、预后和治疗的基于MicroRNA的方法和组合物 |
| US20070213292A1 (en) | 2005-08-10 | 2007-09-13 | The Rockefeller University | Chemically modified oligonucleotides for use in modulating micro RNA and uses thereof |
| WO2007021896A2 (en) | 2005-08-10 | 2007-02-22 | Alnylam Pharmaceuticals, Inc. | Chemically modified oligonucleotides for use in modulating micro rna and uses thereof |
| AU2006291165B2 (en) | 2005-09-12 | 2013-03-14 | The Ohio State University Research Foundation | Compositions and methods for the diagnosis and therapy of BCL2-associated cancers |
| AU2006302496A1 (en) | 2005-10-05 | 2007-04-19 | The Ohio State University Research Foundation | WWOX gene, vectors containing the same, and uses in treatment of cancer |
| US7390792B2 (en) | 2005-12-15 | 2008-06-24 | Board Of Regents, The University Of Texas System | MicroRNA1 therapies |
| EP2487252B1 (en) | 2006-01-05 | 2014-10-15 | The Ohio State University Research Foundation | MicroRNA-based methods for the diagnosis of colon cancer |
| JP5490413B2 (ja) | 2006-01-05 | 2014-05-14 | ジ・オハイオ・ステイト・ユニバーシティ・リサーチ・ファウンデイション | 膵内分泌腫瘍及び膵腺房腫瘍におけるマイクロrna発現異常 |
| CN103993082B (zh) | 2006-01-05 | 2017-01-11 | 俄亥俄州立大学研究基金会 | 用于肺癌的诊断、预后和治疗的基于微小rna 的方法和组合物 |
| WO2008051260A1 (en) | 2006-01-13 | 2008-05-02 | Battelle Memorial Institute | Methods for assessing copd-retlated diseases |
| EP2369012A1 (en) | 2006-03-20 | 2011-09-28 | The Ohio State University Research Foundation | Micro-RNA fingerprints during human megakaryocytopoiesis |
| WO2007112097A2 (en) | 2006-03-24 | 2007-10-04 | Children's Medical Center Corporation | Novel signature self renewal gene expression programs |
| EP2194129A3 (en) | 2006-04-03 | 2012-12-26 | Santaris Pharma A/S | Pharmaceutical composition comprising anti-miRNA antisense oligonucleotides |
| CA2650026C (en) | 2006-04-24 | 2013-01-22 | The Ohio State University Research Foundation | Pre-b cell proliferation and lymphoblastic leukemia/high-grade lymphoma in mir155 transgenic mice |
| EP2041317A4 (en) | 2006-07-13 | 2009-10-14 | Univ Ohio State Res Found | METHODS AND COMPOSITIONS BASED ON MICRO-RNA FOR THE DIAGNOSIS AND TREATMENT OF COLON CANCER RELATED DISEASES |
| NZ575193A (en) | 2006-08-30 | 2011-12-22 | Unversity Of Michigan | Small molecule inhibitors of MDM2 comprising a spiropyrrolidine |
| US20080193943A1 (en) | 2006-09-05 | 2008-08-14 | Abbott Laboratories | Companion diagnostic assays for cancer therapy |
| EP2061907B1 (en) | 2006-09-19 | 2011-11-23 | The Ohio State University Research Foundation | Tcl1 expression in chronic lymphocytic leukemia (cll) regulated by mir-29 and mir-181 |
| WO2008036741A2 (en) | 2006-09-19 | 2008-03-27 | Asuragen, Inc. | Mir-200 regulated genes and pathways as targets for therapeutic intervention |
| AU2007299828C1 (en) | 2006-09-19 | 2014-07-17 | Interpace Diagnostics, Llc | MicroRNAs differentially expressed in pancreatic diseases and uses thereof |
| JP2010510964A (ja) | 2006-09-19 | 2010-04-08 | アシュラジェン インコーポレイテッド | 治療的介入の標的としての、miR−15、miR−26、miR−31、miR−145、miR−147、miR−188、miR−215、miR−216、miR−331、mmu−miR−292−3pによって調節される遺伝子および経路 |
| EP2087135B8 (en) | 2006-11-01 | 2013-07-24 | The Ohio State University Research Foundation | Microrna expression signature for predicting survival and metastases in hepatocellular carcinoma |
| US8293684B2 (en) | 2006-11-29 | 2012-10-23 | Exiqon | Locked nucleic acid reagents for labelling nucleic acids |
| WO2008070082A2 (en) | 2006-12-04 | 2008-06-12 | The Johns Hopkins University | Stem-progenitor cell specific micro-ribonucleic acids and uses thereof |
| CA2671194A1 (en) | 2006-12-08 | 2008-06-19 | Asuragen, Inc. | Mir-20 regulated genes and pathways as targets for therapeutic intervention |
| CA2671294A1 (en) | 2006-12-08 | 2008-06-19 | Asuragen, Inc. | Mir-21 regulated genes and pathways as targets for therapeutic intervention |
| CN101622349A (zh) | 2006-12-08 | 2010-01-06 | 奥斯瑞根公司 | 作为治疗性干预靶标的miR-21调节的基因和途径 |
| AU2007333109A1 (en) | 2006-12-08 | 2008-06-19 | Asuragen, Inc. | Functions and targets of let-7 micro RNAs |
| US20090175827A1 (en) | 2006-12-29 | 2009-07-09 | Byrom Mike W | miR-16 REGULATED GENES AND PATHWAYS AS TARGETS FOR THERAPEUTIC INTERVENTION |
| AU2008211142A1 (en) | 2007-01-31 | 2008-08-07 | The Ohio State University Research Foundation | Mic orna-based methods and compositions for the treatment of acute myeloid leukemia |
| AU2008220438A1 (en) | 2007-02-27 | 2008-09-04 | Rosetta Genomics Ltd. | Composition and methods for modulating cell proliferation and cell death |
| EP2126584B1 (en) | 2007-03-16 | 2012-12-19 | CovalX AG | Direct mass spectrometric analysis of drug candidates targeting protein complexes |
| CA2695868A1 (en) | 2007-04-10 | 2008-10-16 | Dcb-Usa Llc | Predicting post-treatment survival in cancer patients with micrornas |
| JP5592251B2 (ja) | 2007-04-30 | 2014-09-17 | ジ・オハイオ・ステイト・ユニバーシティ・リサーチ・ファウンデイション | 膵臓癌を正常な膵臓機能および/または慢性膵炎と識別する方法 |
| US20090005336A1 (en) | 2007-05-08 | 2009-01-01 | Zhiguo Wang | Use of the microRNA miR-1 for the treatment, prevention, and diagnosis of cardiac conditions |
| US20090232893A1 (en) | 2007-05-22 | 2009-09-17 | Bader Andreas G | miR-143 REGULATED GENES AND PATHWAYS AS TARGETS FOR THERAPEUTIC INTERVENTION |
| US20090131354A1 (en) | 2007-05-22 | 2009-05-21 | Bader Andreas G | miR-126 REGULATED GENES AND PATHWAYS AS TARGETS FOR THERAPEUTIC INTERVENTION |
| US20090099034A1 (en) | 2007-06-07 | 2009-04-16 | Wisconsin Alumni Research Foundation | Reagents and Methods for miRNA Expression Analysis and Identification of Cancer Biomarkers |
| WO2008154333A2 (en) | 2007-06-08 | 2008-12-18 | Asuragen, Inc. | Mir-34 regulated genes and pathways as targets for therapeutic intervention |
| CN101711287B (zh) | 2007-06-08 | 2016-04-27 | 由卫生与公众服务部代表的美利坚合众国政府 | 确定肝细胞癌亚型和检测肝癌干细胞的方法 |
| EP2167521A4 (en) | 2007-06-15 | 2011-11-23 | Univ Ohio State Res Found | ALL-1 ONCOGEN FUSION PROTEINS TO TARGE TREATMENT OF MICRO-RNA REGULATED BY DROSHA |
| ES2496172T3 (es) | 2007-07-31 | 2014-09-18 | The Ohio State University Research Foundation | Métodos para invertir la metilación por selección dirigida de DNMT3A y DNMT3B |
| US8465918B2 (en) | 2007-08-03 | 2013-06-18 | The Ohio State University Research Foundation | Ultraconserved regions encoding ncRNAs |
| AU2008288806B2 (en) | 2007-08-22 | 2014-11-27 | The Ohio State University Research Foundation | Methods and compositions for inducing deregulation of EphA7 and Erk phosphorylation in human acute leukemias |
| US20090061424A1 (en) | 2007-08-30 | 2009-03-05 | Sigma-Aldrich Company | Universal ligation array for analyzing gene expression or genomic variations |
| CN101939446B (zh) | 2007-09-06 | 2015-02-11 | 俄亥俄州立大学研究基金会 | 人类卵巢癌中的微小rna特征 |
| AU2008310704B2 (en) | 2007-10-11 | 2014-03-20 | The Government Of The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Methods and compositions for the diagnosis and treatment of esphageal adenocarcinomas |
| CN102137927B (zh) | 2007-10-26 | 2014-03-12 | 俄亥俄州立大学研究基金会 | 鉴定脆性组氨酸三联体(Fhit)相互作用的方法及其用途 |
| US8575121B2 (en) | 2007-11-12 | 2013-11-05 | The United States of America as represented by the Secetary of the Department of Health and Human Services | Therapeutic applications of p53 isoforms in regenerative medicine, aging and cancer |
| US20090123933A1 (en) | 2007-11-12 | 2009-05-14 | Wake Forest University Health Sciences | Microrna biomarkers in lupus |
| EP2225396A4 (en) | 2007-11-30 | 2011-03-02 | Univ Ohio State Res Found | PROFILING AND SCREENING OF MICRO-RNA EXPRESSION IN PERIPHERAL BLOOD IN LUNG CANCER |
| WO2009070805A2 (en) | 2007-12-01 | 2009-06-04 | Asuragen, Inc. | Mir-124 regulated genes and pathways as targets for therapeutic intervention |
| WO2009086156A2 (en) | 2007-12-21 | 2009-07-09 | Asuragen, Inc. | Mir-10 regulated genes and pathways as targets for therapeutic intervention |
| SG10201609507TA (en) | 2008-02-01 | 2017-01-27 | Gen Hospital Corp | Use of microvesicles in diagnosis, prognosis and treatment of medical diseases and conditions |
| EP2260110B1 (en) | 2008-02-08 | 2014-11-12 | Asuragen, INC. | miRNAs DIFFERENTIALLY EXPRESSED IN LYMPH NODES FROM CANCER PATIENTS |
| US20110054009A1 (en) | 2008-02-28 | 2011-03-03 | The Ohio State University Research Foundation | MicroRNA-Based Methods and Compositions for the Diagnosis, Prognosis and Treatment of Prostate Related Disorders |
| JP5662166B2 (ja) | 2008-02-28 | 2015-01-28 | ジ・オハイオ・ステイト・ユニバーシティ・リサーチ・ファウンデイションThe Ohio State University Research Foundation | 胃癌の診断、予後診断及び治療のためのマイクロrnaに基づいた方法及び組成物 |
| WO2009108856A2 (en) | 2008-02-28 | 2009-09-03 | The Ohio State University Research Foundation | Microrna signatures associated with human chronic lymphocytic leukemia (ccl) and uses thereof |
| AU2009219203B2 (en) | 2008-02-28 | 2014-04-03 | The Ohio State University Research Foundation | MicroRNA signatures associated with cytogenetics and prognosis in acute myeloid leukemia (AML) and uses thereof |
| WO2009111643A2 (en) | 2008-03-06 | 2009-09-11 | Asuragen, Inc. | Microrna markers for recurrence of colorectal cancer |
| WO2009154835A2 (en) | 2008-03-26 | 2009-12-23 | Asuragen, Inc. | Compositions and methods related to mir-16 and therapy of prostate cancer |
| US8258111B2 (en) | 2008-05-08 | 2012-09-04 | The Johns Hopkins University | Compositions and methods related to miRNA modulation of neovascularization or angiogenesis |
| WO2009149418A2 (en) | 2008-06-06 | 2009-12-10 | Asuragen, Inc. | Novel compositions for the in vivo delivery of rnai agents |
| CN102149827B (zh) | 2008-06-11 | 2014-08-20 | 由卫生与公众服务部代表的美利坚合众国政府 | MiR-26家族作为肝细胞癌和对治疗的应答性的预测性标志物的用途 |
| JP2012500389A (ja) | 2008-08-12 | 2012-01-05 | ジ・オハイオ・ステイト・ユニバーシティ・リサーチ・ファウンデイション | 多発性脊髄腫の診断、予後および治療のためのマイクロrnaに基づく組成物および方法 |
| CN102271706A (zh) | 2008-11-21 | 2011-12-07 | 俄亥俄州立大学研究基金会 | 作为转录调节剂的Tcl1 |
| EP2373815A4 (en) | 2008-12-05 | 2012-09-26 | Univ Ohio State Res Found | MICRO-RNA-RNA BASED METHODS AND COMPOSITIONS FOR DIAGNOSIS AND TREATMENT OF OVARIAN CARCINOMA |
| CA2753562A1 (en) | 2009-02-26 | 2010-09-02 | The Ohio State University Research Foundation | Micrornas in never-smokers and related materials and methods |
-
2008
- 2008-01-29 AU AU2008211142A patent/AU2008211142A1/en not_active Abandoned
- 2008-01-29 EP EP20080713330 patent/EP2109687B1/en not_active Not-in-force
- 2008-01-29 US US12/523,915 patent/US8034560B2/en active Active
- 2008-01-29 CN CN201310439889.9A patent/CN103555825B/zh not_active Expired - Fee Related
- 2008-01-29 CA CA 2674895 patent/CA2674895A1/en not_active Abandoned
- 2008-01-29 WO PCT/US2008/001157 patent/WO2008094545A2/en active Application Filing
- 2008-01-29 CN CN201510615615.XA patent/CN105256004A/zh active Pending
- 2008-01-29 CN CN2008800037367A patent/CN101627134B/zh not_active Expired - Fee Related
- 2008-01-29 JP JP2009548281A patent/JP2010516291A/ja active Pending
-
2011
- 2011-10-07 US US13/269,410 patent/US8354229B2/en not_active Expired - Fee Related
- 2011-10-07 US US13/269,407 patent/US8431342B2/en not_active Expired - Fee Related
- 2011-10-07 US US13/269,404 patent/US8530159B2/en not_active Expired - Fee Related
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1882702A (zh) * | 2003-09-22 | 2006-12-20 | 罗斯塔英法美蒂克斯有限责任公司 | 用rna干扰进行的协同致死筛选 |
| WO2005118806A3 (en) * | 2004-05-28 | 2006-08-24 | Ambion Inc | METHODS AND COMPOSITIONS INVOLVING MicroRNA |
| FR2877350A1 (fr) * | 2004-11-03 | 2006-05-05 | Centre Nat Rech Scient | IDENTIFICATION ET UTILISATION DE miRNAs IMPLIQUES DANS LA DIFFERENCIATION DE CELLULES ISSUES D'UNE LEUCEMIE MYELOIDE |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2008094545A2 (en) | 2008-08-07 |
| US20100048681A1 (en) | 2010-02-25 |
| US20120028831A1 (en) | 2012-02-02 |
| US8431342B2 (en) | 2013-04-30 |
| EP2109687A4 (en) | 2011-08-24 |
| CN101627134A (zh) | 2010-01-13 |
| US20120028832A1 (en) | 2012-02-02 |
| JP2010516291A (ja) | 2010-05-20 |
| US8034560B2 (en) | 2011-10-11 |
| WO2008094545A3 (en) | 2008-12-04 |
| CN105256004A (zh) | 2016-01-20 |
| CA2674895A1 (en) | 2008-08-07 |
| CN103555825B (zh) | 2015-09-30 |
| US20120028833A1 (en) | 2012-02-02 |
| EP2109687A2 (en) | 2009-10-21 |
| EP2109687B1 (en) | 2014-06-04 |
| US8354229B2 (en) | 2013-01-15 |
| CN103555825A (zh) | 2014-02-05 |
| US8530159B2 (en) | 2013-09-10 |
| AU2008211142A1 (en) | 2008-08-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN101627134B (zh) | 用于急性髓细胞白血病(aml)的诊断、预后和治疗的基于微rna的方法和组合物 | |
| CN102943108B (zh) | 用于肺癌的诊断、预后和治疗的基于微小rna的方法和组合物 | |
| CN101809169B (zh) | 通过靶向dnmt3a和dnmt3b恢复甲基化的方法 | |
| AU2007346101B2 (en) | TCL1 expression in chronic lymphocytic leukemia (CLL) regulated by miR-29 and miR-181 | |
| CN101861401B (zh) | 用于诊断和治疗食管腺癌的方法和组合物 | |
| CN102533966B (zh) | 用于乳腺癌的诊断、预后和治疗的基于MicroRNA的方法和组合物 | |
| CN103361424A (zh) | 胰腺内分泌和腺泡肿瘤中的微小rna表达异常 | |
| CN103642900A (zh) | 用于诊断和治疗实体癌的基于微小rna的方法和组合物 | |
| AU2016203848B2 (en) | MicroRNA-based methods and compositions for the diagnosis, prognosis and treatment of lung cancer |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20131106 Termination date: 20180129 |
|
| CF01 | Termination of patent right due to non-payment of annual fee |